Заняття з фізики та астрономії для 10 класу на тему «Внутрішня енергія тіл. Кількість теплоти. Робота термодинамічного процесу. Перший закон термодинаміки. Адіабатний процес»
РОЗРОБКА ЗАНЯТТЯ
З ПРЕДМЕТУ «ФІЗИКА ТА АСТРОНОМІЯ» (10 клас)
Юлія Василенко
викладач фізики та астрономії, інформатики
Індустріального коледжу ДВНЗ КНУ
спеціаліст першої категорії
Геніальні відкриття – це 99% праці та 1 % таланту
(Томас Едісон)
Тема «Внутрішня енергія тіл. Кількість теплоти. Робота термодинамічного процесу. Перший закон термодинаміки. Адіабатний процес»
Мета заняття:
освітня: формувати поняття про внутрішню енергію з позицій молекулярної теорії; досягти усвідомлення універсальності закону збереження і перетворення енергії; надати термодинамічну трактову поняття роботи; встановити зв'язок між зміною внутрішньої енергії системи, роботою і кількістю теплоти, що передана системі; систематизувати та поглибити знання студентів щодо І закону термодинаміки при застосуванні його до ізопроцесів; формувати навички розв'язування задач з теми;
розвиваюча: розвиток навичок аналізу та порівняння, логічного мислення;
виховна: виховувати вміння взаємодії під час вивчення навчального матеріалу.
Тип заняття: вивчення нового матеріалу.
Обладнання заняття: ноутбук, мультимедійний проектор, екран, ментальні карти, папки із завданням.
ПЛАН ЗАНЯТТЯ
І. Організаційний момент.
ІІ. Повідомлення теми, мети, девізу та структури заняття.
ІІІ. Актуалізація опорних знань.
ІV. Вивчення нового матеріалу та формування фізичних понять.
- Внутрішня енергія тіл.
- Кількість теплоти.
- Робота термодинамічного процесу.
- Перший закон термодинаміки.
- Адіабатний процес.
V. Закріплення нового матеріалу.
VІ. Рефлексія.
VІІ. Домашнє завдання.
ХІД ЗАНЯТТЯ
I. Організаційна частина. (2 хв.)
Привітання. Перевірити присутність студентів на занятті. Готовність аудиторії до заняття.
II. Повідомлення теми, мети, девізу та структури заняття.(3хв.)
ІІІ. Актуалізація опорних знань. (10 хв.)
1. З яких частинок складаються всі речовини? Як можна охарактеризувати їх рух?
2. Чому рух частинок називають тепловим? Як рух частинок речовини пов'язаний з температурою?
3. Що таке енергія? В яких одиницях вона вимірюється?
4. Що таке потенціальна енергія? Кінетична енергія?
5. Ізопроцеси – це…
6. Ізотермічним називається процес…
7. Ізобарним називається процес…
8. Ізохорним називається процес…
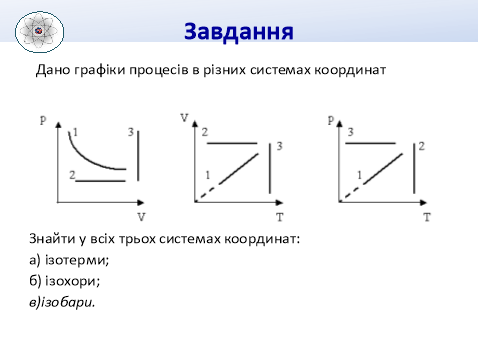
ІV. Вивчення нового матеріалу та формування фізичних понять. (35хв.)
- Внутрішня енергія тіл.
- Кількість теплоти.
- Робота термодинамічного процесу.
- Перший закон термодинаміки.
- Адіабатний процес.
МОТИВАЦІЯ НАВЧАЛЬНОЇ ДІЯЛЬНОСТІ
Створення проблемної ситуації.
На стіл з певної висоти падає пластилінова кулька.
Дайте відповіді на запитання:
- Яку енергію мала кулька на початку руху?
- Чи відбувся перехід під час падіння? Який саме?
- Яку енергію мала кулька безпосередньо перед ударом? Куди поділася ця енергія?
- Що сталося з кулькою та столом?
Під час вивчення нового матеріалу будемо використовувати ментальну карту. Вона може містити текст, схеми, рисунки, графіки, таблиці, формули. Зручна у використанні, тому що містить головні відомості по темі у цікавому оформлені. Окрім того, на карті будемо робити необхідні для нас дописи.
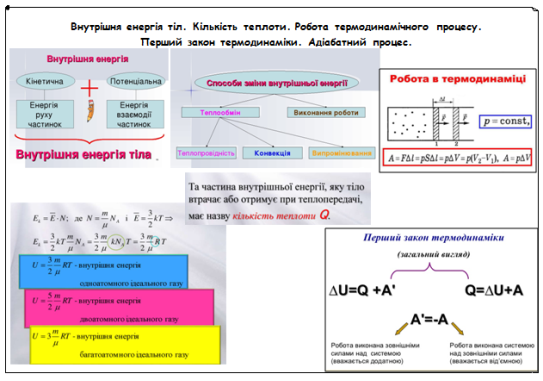

- Внутрішня енергія тіл.
Викладач пропонує студентам пригадати, що називають внутрішньою енергією.
Внутрішня енергія макроскопічного тіла дорівнює сумі кінетичних енергій безладного руху всіх молекул (або атомів) та потенціальних енергій взаємодії молекул (або атомів) між собою.
Якщо йдеться про ідеальний газ, то для нього не розглядається взаємодія молекул між собою. Отже, внутрішня енергія ідеального газу дорівнює тільки сумі кінетичних енергій безладного руху всіх молекул (або атомів), з яких він складається.
Для ідеального газу внутрішня енергія визначається формулою
![]()
де ![]() — внутрішня енергія,
— внутрішня енергія, ![]() — маса газу,
— маса газу, ![]() — число ступенів свободи молекул. Число ступенів свободи — це число незалежних величин, за допомогою яких може бути задано положення тіла або частинки. Для одноатомного газу
— число ступенів свободи молекул. Число ступенів свободи — це число незалежних величин, за допомогою яких може бути задано положення тіла або частинки. Для одноатомного газу![]() , двохатомного
, двохатомного ![]() , трьохатомного
, трьохатомного ![]() і т. д.
і т. д.
Способи зміни внутрішньої енергії: 1) теплопередача; 2) здійснення роботи над тілом чи самим тілом.
Теплопередача, її види.
Теплопередачею або теплообміном називається процес передачі енергії від одного тіла до іншого без здійснення роботи.
Способи теплопередачі: 1) теплопровідність, 2) конвекція, 3) випромінювання.
Теплопровідність — вид теплопередачі, під час якої передавання внутрішньої енергії від одних тіл до інших відбувається при їх безпосередньому контакті і зумовлена взаємодією атомів і молекул.
Конвекція — вид теплопередачі, при якій внутрішня енергія від одних тіл до інших передається рухомими струменями рідини чи газу.
Випромінювання — це передача тепла за допомогою електромагнітних хвиль (світлового потоку).
Запитання до аудиторії:
1. Наведіть приклади передачі енергії способом теплопровідності.
2. Які тіла мають найбільшу теплопровідність? Чому?
3. Наведіть приклади передачі енергії способом конвекції.
4. Як утворюються конвекційні струмені? Як вони завжди напрямлені?
5. Наведіть приклади передачі енергії способом променевого теплообміну.
6. Які тіла — темні чи світлі — краще випромінюють тепло? Які краще поглинають?
- Кількість теплоти.
В процесі теплообміну одні тіла віддають, а інші отримують деяку кількість теплоти. Кількість теплоти позначається символом
Кількість теплоти — це та частина внутрішньої енергії, яку тіло втрачає чи отримує при теплопередачі. Це скалярна величина. В СІ вимірюється в джоулях (Дж).
У ході теплообміну не відбувається перетворення енергії з однієї форми в іншу: частина внутрішньої енергії гарячого тіла передається холодному; теплообмін припиняється як тільки їхні температури зрівняються.
Теплообмін у замкненій системі описується рівнянням теплового балансу:
Q1=Q2
де Q1 — сумарна кількість теплоти, одержана тілом при теплообміні; Q2— сумарна кількість теплоти, віддана тілом при теплообміні.
- Робота термодинамічного процесу.
Уявимо собі, що газ знаходиться у вертикальному циліндрі, який закрито нерухомим поршнем площею S. Нехай під дією прикладеної зовнішньої сили F поршень опустився на відстань ∆x , та стиснув при цьому газ. Газ буде стискатися до тих пір, доки сила F не врівноважиться силою, що діє на поршень зі сторони газу і дорівнює pS, де р – тиск газу (якщо переміщення маленьке, то тиск газу можна вважати сталим). Робота газу (А ) при цьому визначається так
F∆x = pS∆x
A = p∆V
Якщо газ стискався, то ∆V <0 - робота газу від’ємна; якщо газ розширювався, то ∆V > 0 - додатна.
- Перший закон термодинаміки.
Енергія в природі не виникає з нічого та не зникає нікуди, вона лише переходить із однієї форми до іншої. Цей фундаментальний закон природи в термодинаміці сформульовано у такій формі: перехід термодинамічної системи з одного стану в інший характеризується зміною її внутрішньої енергії, що дорівнює сумі роботи зовнішніх сил і кількості теплоти, що надана системі:
∆U = А + Q
Це і є перший закон термодинаміки. Але на практиці перший закон термодинаміки записують в іншому вигляді, тому що основний інтерес представляє не робота зовнішніх сил, що скоєна над газом, а робота, що скоєна газом над зовнішніми тілами. Крім того величиною, що шукають буває кількість теплоти. Якщо газ сам виконує роботу внаслідок теплопередачі, то перший закон термодинаміки має вигляд: кількість теплоти, що передано системі, йде на зміну внутрішньої енергії та виконання роботи системою над зовнішніми тілами:
Q = ∆U + A
Питання студентам: який знак може мати кожна із величин, що входять до першого закону термодинаміки? Наведіть приклади, що підтверджують вашу відповідь.
Відповідь: величини, що входять до першого закону термодинаміки можуть мати знаки „+” та „ –” . наприклад, Q>0, якщо система отримує енергію шляхом теплообміну; Q<0, якщо система віддає енергію таким же шляхом. Знак роботи А залежить від знаку ∆\/.
- Адіабатний процес.
Адіабатний процес – процес зміни стану системи без теплообміну з навколишнім середовищем. При адіабатному процесі:
Q = 0 → ΔU + A = 0 або А = - ΔU.
Якщо газ адіабатно розширюється, тобто здійснює додатну роботу, то внутрішня енергія його зменшується, газ охолоджується. Якщо газ адіабатно стискається, тобто здійснює від'ємну роботу, то внутрішня енергія його збільшується, газ нагрівається.
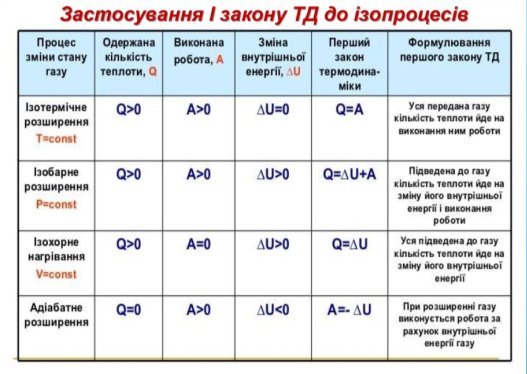
V. Закріплення нового матеріалу. (25 хв.)
Розв’язок задач.
ЗАДАЧА 1
Вважаючи, що внутрішня енергія ідеального газу складається з кінетичної енергії всіх його молекул, обчисліть , яку внутрішню енергію має 500г гелію при температурі Т= 300К.
Дано: Розв'язання:
m = 500г 0,5кг Гелій - одноатомний газ. Вважатимемо
М = 4*10-3 кг/моль його ідеальним. Тоді Е = 3kT/2 - середня
Т = 300К кінетична енергія одного атома;
R = 8,31 Дж/моль*К k – стала Больцмана.
N = m Nа/М – кількість атомів, де Nа -
U - ? число Авогадро.
Отже, U = E*N = (3kT/2)*( m Nа/М) = 3mRT/2M
[ U ] = (кг*Дж *К*моль)/ (кг*моль*К) = Дж
U = (3*0,5*8,31*300)/(2*4*10-3) = 4,67*105 (Дж)
Відповідь: 4,67*105 Дж
ЗАДАЧА 2
Визначити роботу розширення 20л газу при ізобарному нагріві від 270С до 1200С. Тиск газу 80 кПа.
Дано: Розв'язання:
V1 = 20л 20*10-3 м3 Для визначення роботи необхідно визначити
Т1 = 270С 300К зміну об'єму газу, так як невідомо V2
Т2 = 1200С 397К A = Р(V2 – V1)
Р = 80 кПа 80*103 Па При постійному тиску маємо
співвідношення V1/V2 = T1/T2
А - ? V2 = V1*T2 /T1
А = Р ( (V1*T2 /T1) - V1 )
[ А ] = Па м3 = (Н/м2) *м3 = Н*м = Дж
А = 80*103 ( (20*10-3*397 / 300) - 20*10-3) = 500 Дж
Відповідь: 500 Дж
ЗАДАЧА 3
На скільки змінилась внутрішня енергія газу, який виконав роботу 50 кДж, коли отримав кількість теплоти 85 кДж?
Дано: Розв'язання:
А = 50 кДж 50*103 Дж В цьому випадку запишемо формулу
Q = 85 кДж 85*103 Дж І закону термодинаміки так
Q = ∆U + A
∆U - ? ∆U = Q – А
[ U ] = Дж – Дж = Дж
∆U = 85*103 - 50*103 = 35*103 (Дж)
Відповідь: збільшиться на 35*103 Дж.
ЗАДАЧА 4
Над газом була виконана робота 75 кДж, при цьому його внутрішня енергія збільшилась на 25 кДж. Одержав чи віддав тепло газ у цьому процесі? Яку саме кількість теплоти?
Дано: Розв'язання:
А’ = 75 кДж 75*103 Дж В цьому випадку запишемо формулу
∆U = 25 кДж 25*103 Дж І закону термодинаміки так
∆U = Q + А’
Q - ? Q = ∆U - А’
[ Q] = Дж – Дж = Дж
Q = 25*103 - 75*103 = -50*103 (Дж)
Відповідь: газ віддав 50*103 Дж теплоти.
ЗАДАЧА 5
Одноатомному газу, кількістю речовини 2 моля, передано кількість теплоти 1,2 кДж. При цьому газ виконав роботу 600 Дж. На скільки змінилась температура газу?
Дано: Розв'язання:
ν = 2 моль І закон термодинаміки для цього
Q = 1,2 кДж 1,2*103 Дж випадку має вигляд
А = 600 Дж Q = ∆U + A
Зміна внутрішньої енергії одноатомного
∆Т - ? газу ∆U = 3mR∆T/2M
а кількість речовини визначимо ν = m/М ∆U = 3 ν R∆T/2
Рівняння І закону термодинаміки стане
Q = (3 ν R∆T/2) + А 3 ν R∆T/2 = Q – А
∆Т = (Q – А)*2/3 ν R
[∆Т] = Дж*моль*К/моль*Дж = К
∆Т = (1200 – 600)*2/3*2*8,31= 24 (К)
Відповідь: збільшилась на 24 К.
ЗАДАЧА 6
На скільки змінилась внутрішня енергія газу, якщо йому надали кількість теплоти 20 кДж і виконали над ним роботу 30 кДж?
Дано: Розв'язання:
А’ = 30 кДж 30*103 Дж В цьому випадку запишемо формулу
Q = 20 кДж 20*103 Дж І закону термодинаміки так
∆U = Q + А’
∆U - ? [∆U] = Дж – Дж = Дж
∆U = 20*103 + 30*103 = 50*103 (Дж)
Відповідь: збільшиться на 50*103 Дж.
VІ. Рефлексія. (3 хв.)
- Які питання викликали у вас найбільші труднощі?
- Розв’язання якої задачі для вас залишилось не зрозумілим?
- Чи зручно було вам працювати з картою при вивчені нового матеріалу?
VІІ. Домашнє завдання. (2хв.)
- Вивчити теоретичний матеріал.
- Задача 1. Яку кількість теплоти потрібно передати газу, щоб його внутрішня енергія збільшилась на 45 кДж і при цьому газ виконав роботу 65 кДж?
Задача 2. В циліндрі під поршнем знаходиться кисень. Визначте масу кисню, якщо відомо, що робота, яка виконується під час нагріву газу від 273 К до 473 К, дорівнює 16 кДж. Тертя не враховувати.
- Заповнити таблицю, користуючись підручником та довідниковою літературою.
Таблиця
Кількість теплоти, яку тіло отримує або втрачає при теплопередачі або внаслідок зміни агрегатного стану речовини
|
Кількість теплоти |
Формула |
Коментар |
|
Отримана або втрачена тілом при нагріванні чи охолодженні |
|
|
|
Виділена при згорянні палива |
|
|
|
Поглинена при плавленні або виділена при кристалізації |
|
|
|
Поглинена при пароутворенні або виділена при конденсації |
|
|
Література:
- „Фізика і астрономія (профільний рівень, за навчальною програмою авторського колективу під керівництвом Ляшенко О.І.)” підручник для 10 класу закладів загальної середньої освіти (авт. Засєкіна Т.М., Засєкін Д.О.), 2018р.
- „Фізика (рівень стандарту, за навчальною програмою авторського колективу під керівництвом Ляшенко О.І.)” підручник для 10 класу закладів загальної середньої освіти (авт. Засєкіна Т.М., Засєкін Д.О.), 2018р.
- „Фізика (рівень стандарту, за навчальною програмою авторського колективу під керівництвом Ляшенко О.І.)” підручник для 10 класу закладів загальної середньої освіти (авт. Головко М.В., Мельник Ю.С., Непорожня Л.В., Сіпій В.В.), 2018р.
1


про публікацію авторської розробки
Додати розробку
