Застосування електролізу у практичній діяльності людини
Олеярник Олександр Вікторович – вчитель фізики та астрономії загальноосвітньої школи № 33, Краматорської міської ради, Донецької області
Мета роботи: розширити кругозір учнів щодо фізико-хімічного процесу, під назвою електроліз, його основними сферами застосування, практичною значимістю, показати процес проведення гальванопластики в домашніх умовах та розрахунок вартості використовуваного обладнання та готового виробу (вкритий міддю невеликий кленовий лист). Дана розробка має актуальність, розвиває винахідливі та підприємницькі якості, виховує бережливе ставлення до природних матеріалів
Застосування електролізу у практичній діяльності людини
Актуальність обраної теми: життя людини у сучасному світі неможливе без використання досягнень науки та техніки. Досягнення у сфері фізики та хімії робить життя людини не тільки комфортним, але й створює безліч необхідних речей. Процес електролізу допомагає людині проводити очищення матеріалів та створювати нові матеріали. Тому моя учениця 8 класу Бородієнко Єлизавета під моїм керівництвом підготувала такий навчальний проект, який на мою думку є дуже актуальним.
Мета: розширити знання про електроліз, його властивості, вплив на наше життя та роль у побуті; дізнатися історію виникнення гальваніки.
Завдання: розглянути на практиці процес гальваніки, обчислити вартість обладнання.
Хід роботи
Електроліз - розклад речовин (наприклад, води, розчинів кислот, лугів, розчинених або розплавлених солей тощо) постійним електричним струмом.
Електроліз полягає в електрохімічних процесах окиснення та відновлення на електродах. При електролізі позитивно заряджені йони (катіони) рухаються до катода, на якому електрохімічно відновлюються. Негативно заряджені йони (аніони) рухаються до анода, де електрохімічно окиснюються[1].
Електроліз є одним з найважливіших напрямків в електрохімії. Електроліз протікає тільки в тих середовищах, які проводять електричний струм. Здатністю проводити струм мають також водяні розчини солей. Безводні кислоти – дуже погані провідники, але водяні розчини кислот добре проводять струм. Розчини кислот, солей в інших рідинах у більшості випадків струм не проводять, але й осмотичний тиск таких розчинів виявляється нормальним, точно так само не проводять струм водяні розчини цукру, спирту, гліцерину й інші розчини з нормальним осмотичним тиском.
Закон Фарадея для електролізу
Маса речовини, що виділився на електроді при проходженні по розчину електроліту електричного струму, прямо пропорційна кількості електрики. Δm=kQ де Δm – кількість речовини; Q – кількість електрики; k – коефіцієнт пропорційності, що показує, скільки речовини прореагувало при проходженні одиниці кількості електрики. Величина, k називається електрохімічним еквівалентом. k=M/(Naz│e│) де z – валентність іона; M – молярна маса речовини, що виділився на електроді; NA-постійна Авогадро. │e│= 1,6• 10-19Кл.
Ще на початку позаминулого сторіччя було встановлено, що при проходженні електричного струму через водяні розчини солей відбуваються хімічні перетворення, що приводять до створення нових речовин. У результаті цього, на початку минулого століття виник науковий напрямок по вивченню електрохімічних процесів у розчинах і розплавах речовин – електрохімія. Хімічні перетворення, що відбуваються при впливі електричного струму на речовини, називаються електролітичними [2].
В результаті електролізу на електродах виділяються речовини в кількостях, пропорційних кількості пропущеного струму. Електроліз застосовується для одержання багатьох речовин (металів, водню, хлору та ін.), при гальваностегії (нанесенні металічних покриттів), гальванопластиці (відтворенні форми предметів), а також у хімічному аналізі (полярографія).
Відкриття електролізу стало можливим тільки лише після створення Вольтом батареї гальванічних елементів (1799).
У 1800 англійські дослідники Нікольсон і Карлейль відкрили електроліз: вони встановили, що під час проходження постійного струму у воді чи водних розчинах вода розкладається на водень і кисень. Результати пізніших досліджень, завершених Майклом Фарадеєм 1833р, були сформульовані у вигляді законів.
Електрохімічні процеси широко застосовуються в різних галузях сучасної техніки, в аналітичній хімії, біохімії і т. д. У хімічній промисловості електролізом одержують хлор і фтор, луги, хлорат і перхлорат, надсірчану кислоту і персульфати, хімічно чисті водень і кисень і т. д. При цьому одні речовини одержують шляхом відновлення на катоді, інші — електроокисненням на аноді.
Електроліз в гідрометалургії є однією з стадій переробки металомісткої сировини, що забезпечує отримання товарних металів. У кольоровій металургії електроліз використовується для добування металів з руд та їх очищення. Електролізом з розплавлених середовищ отримують алюміній, магній, титан, цирконій, уран, берилій та ін. Для рафінування (очищення) металу електролізом з нього відливають пластини і поміщають їх як анод в електролізер. При пропущенні струму метал, що підлягає очищенню, піддається анодному розчиненню, тобто переходить у розчин у вигляді катіонів. Потім ці катіони металу розряджаються на катоді, завдяки чому утворюється компактний осад вже чистого металу. Домішки, що знаходяться в аноді, або залишаються нерозчинними, або переходять в електроліт і видаляються.
Гальванотехніка — сфера прикладної електрохімії, що займається процесами нанесення металевих покриттів на поверхню як металевих, так і неметалевих виробів при проходженні постійного електричного струму через розчини їх солей. Гальванотехніка ділиться на гальваностегію і гальванопластику.
Гальваностегія — це електроосадження на поверхню металу іншого металу, який міцно зв'язується (зчіплюється) з покриваючим металом (предметом), що служить катодом електролізера.
Перед покриттям вироби необхідно ретельно очистити, в іншому випадку метал буде осідати нерівномірно, і зв'язок металу з поверхнею виробу буде нестійким. Способом гальваностегії можна покрити деталь тонким шаром золота або срібла, хрому або нікелю. За допомогою електролізу можна наносити найтонші металеві покриття на різні металеві поверхні. При такому способі нанесення покриттів, деталь використовують як катод, який міститься у розчину солі того металу, покриття з якого необхідно отримати. Як анод використовується пластинка з того ж металу.
Гальванопластика — одержання шляхом електролізу точних, легко відокремлюваних металевих копій щодо значної товщини з різних як неметалічних, так і металевих предметів, які називаються матрицями. За допомогою гальванопластики виготовляють бюсти, статуї і т. д.
Гальванопластика використовується для нанесення порівняно товстих металевих покриттів на інші метали (наприклад, утворення «накладного» отримання оксидних захисних плівок на металах (анодування). Також використовуэться у таких напрямках:
- електрохімічна обробка поверхні металевого виробу (поліровка);
- електрохімічне фарбування металів (наприклад, міді, латуні, цинку, хрому та ін.);
- очищення води — видалення з неї розчинних домішок. В результаті виходить так звана м'яка вода (за своїми властивостями наближається до дистильованої);
- електрохімічна заточка ріжучих інструментів (наприклад, хірургічних ножів(скальпелів), бритв і т. д.) [1].
Процес гальванопластики був розроблений в 1836 р. російським академіком Борисом Семеновичем Якобі (1801- 1874). Борис Семенович Якобі відомий своїми численними роботами в сферы електротехніки. Він є винахідником першого електродвигуна з безпосереднім обертанням валу, колектора для випрямлення струму, телеграфних апаратів, що пишуть, а також першого у світі букводрукувального телеграфного апарату; ним уперше (у 1838 р.) здійснений рух човна за допомогою електричної енергії. Якобі створив прилади для виміру електричного опору, виготовив еталон опору, сконструював вольтметр.
Аналіз наукової й науково-популярної літератури свідчить про те, що процеси електролізу розчинів і розплавів цікавлять учених і технологів у цей час, тобто дана тема не втратила своєї актуальності й практичної значимості. Очищення міді, нікелю, свинцю проводять цілком електрохімічним методом. Виробництво фтору засноване на електролізі розплавленої суміші фторида калію й фтороводородной кислоти, хлору – при електролізі водних розчинів або розплавів хлоридів. Водень і кисень високому ступеня чистоти одержують електролізом водяних розчинів лугів. Таким чином, за допомогою електролізу вдається здійснювати реакції окиснення й відновлення з більшим виходом і високої селективності, які у звичайних хімічних процесах важко досяжні. Важливою галуззю застосування електролізу є захист металів від корозії: при цьому електрохімічним методом на поверхню металевих виробів наноситься тонкий шар іншого металу (хрому, срібла, міді, нікелю, золота) стійкого до корозії [2].
Гальванопластика в домашніх умовах
Обладнання яке необхідне для проведення даного досліду:
-джерело струму;
-мідний купорос (електроліт);
-мідні пластини;
-графітовий лак;
-дроти;
Хід роботи
Вкриваємо графітовим лаком невеликий кленовий лист, черенок листа кріпимо за допомогою дроту до мідного тримача та занурюємо у електролітичну ванну з електролітом. Напругу ставимо не більше 1 В, слідкуємо за силою струму та спостерігаємо процес, схема установки надана на рисунку 1 ( 1 –електроди, 2 – виріб, 3- електролітична ванна, 4 – розчин мідного купоросу) [3].
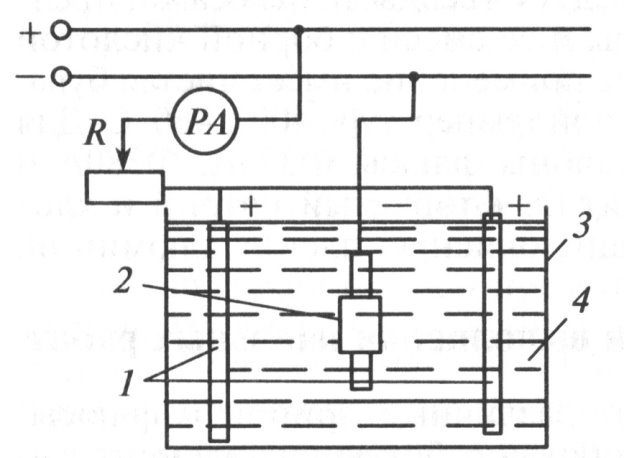
Рисунок 1 – Схема установки для гальванопластики
Прорахуємо грошові затрати для нашої установки
1 варіант
Ми придбаємо все самостійно
Графітовий лак – 510 грн
Джерело змінного струму – 1900 грн
Електролітична ванна – 50 грн
Мідні електроди – 100 грн
Мідний купорос – 71 грн/кг
Загалом отримуємо суму 2550 грн. За рахунок економного використання графітового лаку його вистачить приблизно на 100 листків. І хоч вартість джерела струму велика, цю установку можна використовувати протягом багатьох років.
2 варіант
Якщо ми обмежені у грошах, установку для електролізу позичимо в кабінеті хімії, а у кабінеті фізики під’єднаємо її до джерела змінного струму. І тоді наші витрати становитимуть 793 грн (вартість графітового лаку і 3 кг мідного купоросу).
Промислова вартість готового виробу - від 300 грн [4]. Використовуючи 4 мл графітового лаку на 1 лист, ми підготуємо 50 листочків. Якщо нам вдасться продати листи за ціною 100 грн за кожний – отримаємо приблизно 5000 грн. Ми зможемо окупити витрати на придбання обладнання (вартість – 2833 грн за рахунок повного придбання).
Заключення
В цілому була досягнута мета розглянути явище електролізу, його вплив на наше життя та роль у побуті, розширити знання про гальванопластику.
Висновок: ознайомилися з технологією гальванопластики, дізналися історію електролізу, його практичне використання.
Використана література
1.https://uk.wikipedia.org/wiki
2.http://www.zhu.edu.ua/mk_school/pluginfile.php/10046/mod_resource/content/2
3. https://kraska.guru/specmaterialy/drugie-pokrytiya/galvanoplastika-v-domashnix-usloviyax.html
4. https://namitli.com.ua/p651667468-brosh-listok-shelkovitsy.html


про публікацію авторської розробки
Додати розробку
