Завдання підсумкової контрольної роботи з хімії за І семестр 9 класу
Підсумкова КР з хімії №1 за темами : « Розчини. Розчинність. Хімічні реакції.»
В. – 1
Завдання 1. Користуючись таблицею розчинності ( форзац підручника), випишіть окремо у рядок по чотири катіони та по чотири аніони. Вкажіть назву кожного записаного йона. З вибраних вами катіонів та аніонів складіть формули чотирьох електролітів. Запишіть рівняння дисоціації кожної з цих чотирьох сполук. Вкажіть кількісний та якісний склад кожного електроліта, його хімічну назву.
Завдання 2. Наведені рівняння хімічних реакцій перепишіть у зошит, біля кожної реакції зазначте її тип ( сполучення, розкладу, заміщення, обміну). За потреби допишіть коефіцієнти. Відмітьте чи є серед наведених реакцій окисно-відновні реакції. Назвіть сполуки, що беруть участь у наведених реакціях.
K2CO3 + NaOH → KOH + Na2СO3 Al +Cl2 → AlCl3
AlCl3 + NaOH → Al(OH)3↓ + NaCl NH4NO3 ![]() N2О + 2Н2О
N2О + 2Н2О
Fe2O3 + H2 → Fe + Н2О СaSO4 → ? + ?
2* ( високий рівень) здійсніть ланцюжки перетворень.
А) ZnO → ZnCl2 → Zn(ОН)2→ ZnІ2 Б) ... + НСl → АlСl3 + ...
Завдання 3.
Випари ртуті дуже небезпечні для здоров'я. Для хімічної демеркуризації використовують розбавлений водний розчин калій перманганату, підкислений хлоридною кислотою:
KMnO4+HCl+Hg→HgCl2+MnO2+KCl+H2O.
Використовуючи метод електронного балансу, складіть хімічне рівняння окисно-відновної реакції, що відповідає цій схемі. Вкажіть відновник та окисник, їхні коефіцієнти.
Завдання 3* ( високий рівень)
Укажіть хімічну формулу речовини, у реакції з якою сірка є відновником з наведенням відповідних рівнянь реакцій.
А)H2 Б) Fe В) Na Г) O2
Завдання 4. Розв’яжіть одну із запропонованих задач.
4.1 Приготували 300 г розчину, де масова частка солі становить 15%. Визначити масу солі і води в розчині.
4.2 Для засолювання огірків застосовують розчин з масовою часткою кухонної солі 0.06. Яку масу солі та води треба взяти, щоб приготувати такий розчин масою 2 кг?
Завдання 5. ( з вибором правильної відповіді )
Проаналізуйте твердження й укажіть правильні.
І. Розчинність газів у воді зростає внаслідок підвищення тиску.
ІІ. Розчинність газів у воді зменшується внаслідок підвищення температури.
А)правильне лише І Б)правильне лише ІІ
В)обидва правильні Г)обидва неправильні
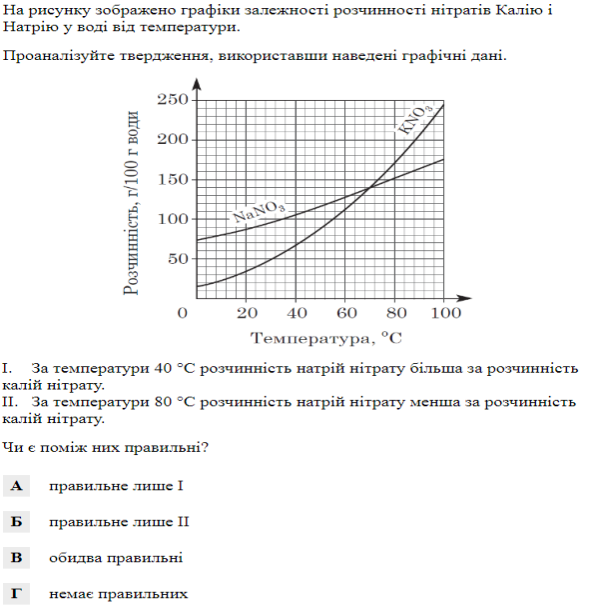
Завдання 6. ( з вибором правильної відповіді )
Задача 7*
На суміш масою 15 г, що складається з барію та його оксиду подіяли соляною кислотою. При цьому виділилося 2, 24 л газу (н. у.) . Визначити маси компонентів суміші.
Підсумкова КР з хімії №1 за темами : « Розчини. Розчинність. Хімічні реакції.»
В. – 2
Завдання 1. Користуючись таблицею розчинності ( форзац підручника), випишіть окремо у рядок по чотири катіони та по чотири аніони. Вкажіть назву кожного записаного йона. З вибраних вами катіонів та аніонів складіть формули чотирьох електролітів. Запишіть рівняння дисоціації кожної з цих чотирьох сполук. Вкажіть кількісний та якісний склад кожного електроліта, його хімічну назву.
Завдання 2. Наведені рівняння хімічних реакцій перепишіть у зошит, біля кожної реакції зазначте її тип ( сполучення, розкладу, заміщення, обміну). За потреби допишіть коефіцієнти. Відмітьте чи є серед наведених реакцій окисно-відновні реакції. Назвіть сполуки, що беруть участь у наведених реакціях.
Mg + О2 → MgO MgO + Н2SO4→ MgSO4 + Н2О
MgO + SO3 → MgSO4 2H2S + 3О2 → 2SO2 + 2Н2О
Мn + НСl → МnСl2 + Н2↑ Fe(OH)3 → ? + ?
2* ( високий рівень) здійсніть ланцюжки перетворень.
А) P → P2O5 → H3PO4 → Na3PO4 Б) СаО + ... → Ca(NO3)2 + ...
Завдання 3.
Знешкодження отруйної дії білого фосфору купрум(ІІ) сульфатом відбувається за рівнянням хімічної реакції:
P+CuSO4+H2O=H3PO4+Cu+H2SO4
Складіть електронний баланс окисно-відновного процесу. . Вкажіть відновник та окисник, їхні коефіцієнти.
Завдання 3* ( високий рівень)
Визначте напівсхему хімічної реакції, у якій Ферум є відновником. Перетворіть напівсхеми реакцій у повні хімічні рівняння.
А)Fe2O3+ H2→ Fe + … Б) FeO+CO→ Fe + СО2 В) Fe+Cl2→
Г) Fe(OH)2+HCl→
Завдання 4. Розв’яжіть одну із запропонованих задач.
4.1 Приготували 700 г розчину, де масова частка солі становить 8%. Визначити масу солі і води в розчині.
4.2 У медицині застосовують розчин кухонної солі з масовою часткою 0.009 відомий під назвою фізіологічний розчин. Які маси солі та води потрібно взяти, щоб добути такий розчин масою 500 г ?
Завдання 5. ( з вибором правильної відповіді)

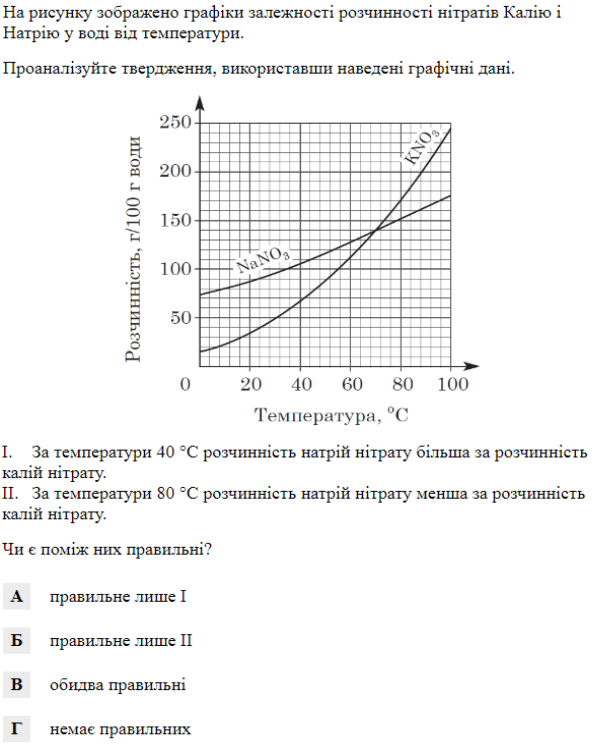
Завдання 6. (з вибором правильної відповіді)
Задача 7* Який об’єм вуглекислого газу (н. у.) можна добути з 500г вугілля, масова частка негорючих домішок в якому складає 4% ?


про публікацію авторської розробки
Додати розробку
