Презентація. 11 клас. Практична робота "Генетичні зв’язки між неорганічними речовинами"
Про матеріал
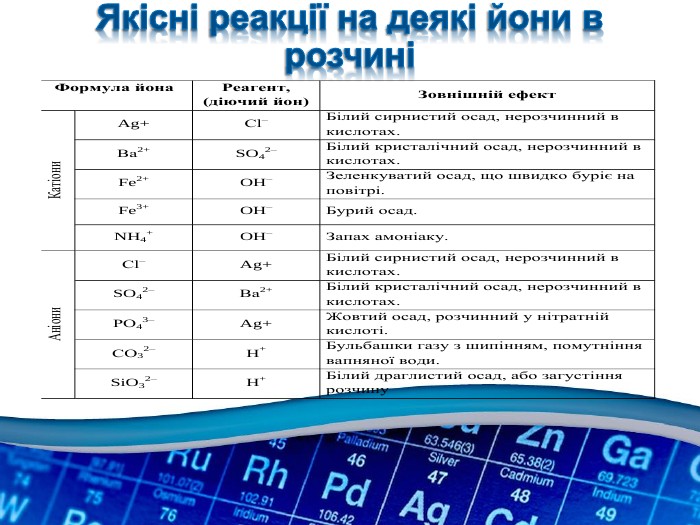
Презентація. 11 клас. Практична робота "Генетичні зв'язки між неорганічними речовинами". Пояснювати взаємозв'язки між простими та складними речовинами, класами органічних сполук; досліджувати властивості речовин та їхні взаємоперетворення; складати план досліджень і рівняння реакцій, що підтверджують їхні перетворення; робити висновки про внутрішньопредметні зв'язки на основі взаємоперетворень між простими та складними речовинами.
Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку