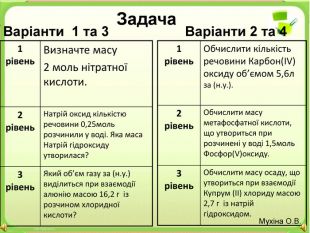
8 клас Узагальнюючий урок "Основні класи неорганічних сполук"
Про матеріал
8 клас, презентація до узагальнюючого уроку "Основні класи неорганічних сполук" Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку