Алгоритм розв'язування розрахункових задач з хімії
Даний алгоритм розв'язування розрахункових задач з хімії дасть можливість поетапно з'ясувати хід аналізу та розв'язку задач на масові частки( елемента у складі речовини, речовини у складі суміші, домішок у технічній речовині).























![1. Основне завдання обчислити масову частку домішок: w% (домішок) = [mтехн. (Ba) - m (Ba)] / m техн. (Ba)∙ 100%2. Невідомою величиною для визначення частки домішок є маса чистого (без домішок) барію. Масу барію можна визначити за формулою: m (Ba) = n(Ва) ∙ М (Ва)3. На цьому етапі невідомою величиною є кількість речовини барію, який розчинився у воді. Але використовуючи співвідношення вихідних речовин та продуктів реакції з'ясовуємо: n (Ва) = n (Н2) 4. Кількість речовини водню можна обчислити за відомою з умови задачі масою: n(Н2) = m (Н2) / М (Н2) На цьому перша частина 4 етапу завершена. Етап 4 ( І частина) 1. Основне завдання обчислити масову частку домішок: w% (домішок) = [mтехн. (Ba) - m (Ba)] / m техн. (Ba)∙ 100%2. Невідомою величиною для визначення частки домішок є маса чистого (без домішок) барію. Масу барію можна визначити за формулою: m (Ba) = n(Ва) ∙ М (Ва)3. На цьому етапі невідомою величиною є кількість речовини барію, який розчинився у воді. Але використовуючи співвідношення вихідних речовин та продуктів реакції з'ясовуємо: n (Ва) = n (Н2) 4. Кількість речовини водню можна обчислити за відомою з умови задачі масою: n(Н2) = m (Н2) / М (Н2) На цьому перша частина 4 етапу завершена. Етап 4 ( І частина)](/uploads/files/227353/68136/72636_images/24.jpg)
![Формули визначені, шлях з'ясований, підставимо відомі значення величин:1. n(Н2) = m (Н2) / М (Н2) n (Н2) = 0,2 г / 2 г/моль = 0,1 моль2. n (Ва) = n (Н2) ν (Ва) = 0,1 моль3. m (Ba) = n (Ва) ∙ М (Ва) m (Ba) = 0,1 моль ∙ 137 г/моль = 13,7 г4. w% (домішок) = [mтехн. (Ba) – mч.р. (Ba)] / mтехн.(Ba)w% (домішок) = [15,4 г - 13,7 г ] / 15,4 г ∙ 100% = 11%Етап 4 ( ІІ частина) Формули визначені, шлях з'ясований, підставимо відомі значення величин:1. n(Н2) = m (Н2) / М (Н2) n (Н2) = 0,2 г / 2 г/моль = 0,1 моль2. n (Ва) = n (Н2) ν (Ва) = 0,1 моль3. m (Ba) = n (Ва) ∙ М (Ва) m (Ba) = 0,1 моль ∙ 137 г/моль = 13,7 г4. w% (домішок) = [mтехн. (Ba) – mч.р. (Ba)] / mтехн.(Ba)w% (домішок) = [15,4 г - 13,7 г ] / 15,4 г ∙ 100% = 11%Етап 4 ( ІІ частина)](/uploads/files/227353/68136/72636_images/25.jpg)














Процес прочитання й осмислення задачі, під час якого потрібно визначити: з якого розділу, до якої теми належить, про що запитується в умові; чи достатньо даних задачі для знаходження невідомої величини? Можна спробувати сформулювати умову задачі інакше або встановити зв’язок даної задачі з іншими з цього розділу, які розв'язувались раніше.1. Аналіз задачі
Для хімічних задач можливе існування декількох способів розв'язування. Тому важливо обрати раціональний спосіб. Більшість задач можна розв'язати математичним шляхом, проте необхідно враховувати хімічні властивості речовин та особливості перебігу хімічних процесів.3. Пошук способу розв'язування задачі
Розв'язуйте задачу поетапно, коротко формулюйте ключові запитання кожного етапу. Ретельно перевіряйте результати розрахунків – помилка на проміжному етапі призведе до неправильної кінцевої відповіді. Починати необхідно з основного завдання задачі, з'ясовуючи на кожному етапі величини, значення яких треба визначити. 4. Процес розв'язування задачі.
Задача на визначення масових часток елементів у речовині. Важливим моментом є знання формули для знаходження цієї фізичної величини. Задача потребує вміння: За періодичною системою знаходити символи хімічних елементів і записувати заокруглені значення їх відносних атомних мас. Визначати відносну молекулярну (формульну) масу. Етап 1
2. За хімічною формулою встановлюємо:n (Na) = 1n(H) = 1n (C) = 1n (О) = 33. За періодичною системою знаходимо символи хімічних елементів і записуємо заокруглені значення їх відносних атомних мас: Ar(Na) = 23 Ar(H) = 1 Ar (C) = 12 Ar (О) = 164. Визначаємо відносну молекулярну масу речовини: Мr(Na. HCO3)= Ar(Na)+ Ar(H)+ Ar (C)+3∙ Ar (О);Мr(Na. HCO3)= 23+1+12+3 ∙16 =84 Етап 4 ( І частина)
Формули визначені, шлях з'ясований, підставимо відомі значення величин:1. W(Na) = n(Na) ∙ Ar(Na) ∙ 100% /Mr(Na. HCO3) W(Na) = 1∙ 23 ∙ 100% / 84 ≈ 27,4 %2. W(H) = n(H) ∙ Ar(H) ∙ 100% /Mr(Na. HCO3)W(H) = 1∙ 1 ∙ 100% / 84 ≈ 1,2 %3. W(С) = n(С) ∙ Ar(С) ∙ 100% /Mr(Na. HCO3)W(С) = 1∙ 12 ∙ 100% / 84 ≈ 14,3 %4. W(О) = n(О) ∙ Ar(О) ∙ 100% /Mr(Na. HCO3) або. W(О) = 100% - (W(Na) + W(H) + W(С) ) W(О) = 100% - (27,4 % + 1,2%+14,3 %) = 57,1%Етап 4 ( ІІ частина)
Задача на визначення хімічної формули речовини за масовими частками елементів у ній. Задача потребує вміння: За періодичною системою знаходити символи хімічних елементів і записувати заокруглені значення їх відносних атомних мас. Визначати емпіричну(найпростішу, елементарну) формулу речовини, знаходячи кількість речовини елементів у довільній кількості речовини і виражати їх відношення у вигляді цілих чисел,які не мають спільного дільника. Знаходити молекулярну формулу, у якій індекси в ціле число разів більші,ніж відповідні індекси в емпіричній формулі. Етап 1
І спосіб Із формули: n Ar W= ∙ 100% (1)Mr. Виводимо формулу (2) і знаходимо n : W ∙Mr n = (2) 100% ∙ Arде W- масова частка елемента в речовині, n – кількість атомів даного елемента в молекулі речовини, Ar – відносна атомна маса елемента, Mr – відносна молекулярна маса речовини. Визначимо емпіричну(найпростішу, елементарну) формулу речовини Нх. Оу х : у = n(Н) : n(О) або W (Н) W (О) х : у = : Ar(Н) Ar(О) Знайдемо молекулярну формулу (Нx. Оу)n Mr n = , Mr (Нx. Оу)де n – число,яке показує, у скільки разів збільшуються індекси в емпіричній формулі, Mr – відносна молекулярна маса речовини,формулу якої визначаємо, Mr (Нx. Оу) – відносна молекулярна маса емпіричної формули Етап 3 З 'ясовуємо, що задачу можна розв'язати двома способами:ІІ спосіб
І спосіб1)n(Н)=W(Н)∙Mr/100% ∙Ar(Н);n(Н)=5,88%∙34/100% ∙1 ≈ 22)n(О)=W(О)∙Mr/100%∙Ar(О);n(О)=94,12%∙34/100%∙16 ≈ 23) Н2 О2 –молекулярна формула. Mr(Н2 О2)=2 Ar(Н) + 2 Ar(О);Mr(Н2 О2)=2 ∙ 1 +2 ∙ 16=341)Нх. Оучисло атомів у речовині прямо пропорційне масовій частці елемента і обернено пропорційне його відносній атомній масі,тобто W (Н) W (О) 5,88 94,12х : у = : = : ; Ar(Н) Ar(О) 1 16х : у = 5,88 : 5,88 =1 : 12)НО – емпірична формула. Mr(НО)= Ar(Н) + Ar(О);Mr(НО)= 1 + 16=173) Знайдемо молекулярну формулу (НО)n Mr n = = 34/17 =2 Mr (НО)Н2 О2 –молекулярна формула. Етап 4 ІІ спосіб
1. Основне завдання обчислити масову частку домішок: w% (домішок) = [mтехн. (Ba) - m (Ba)] / m техн. (Ba)∙ 100%2. Невідомою величиною для визначення частки домішок є маса чистого (без домішок) барію. Масу барію можна визначити за формулою: m (Ba) = n(Ва) ∙ М (Ва)3. На цьому етапі невідомою величиною є кількість речовини барію, який розчинився у воді. Але використовуючи співвідношення вихідних речовин та продуктів реакції з'ясовуємо: n (Ва) = n (Н2) 4. Кількість речовини водню можна обчислити за відомою з умови задачі масою: n(Н2) = m (Н2) / М (Н2) На цьому перша частина 4 етапу завершена. Етап 4 ( І частина)
Формули визначені, шлях з'ясований, підставимо відомі значення величин:1. n(Н2) = m (Н2) / М (Н2) n (Н2) = 0,2 г / 2 г/моль = 0,1 моль2. n (Ва) = n (Н2) ν (Ва) = 0,1 моль3. m (Ba) = n (Ва) ∙ М (Ва) m (Ba) = 0,1 моль ∙ 137 г/моль = 13,7 г4. w% (домішок) = [mтехн. (Ba) – mч.р. (Ba)] / mтехн.(Ba)w% (домішок) = [15,4 г - 13,7 г ] / 15,4 г ∙ 100% = 11%Етап 4 ( ІІ частина)
Етап 4 Формули визначені, шлях з'ясований, підставимо відомі значення величин:m(Mg. CO3)= w (Mg. CO3) ∙ mc / 100%; m(Mg. CO3)= 69,23% ∙ 20 г / 100%=13,846 гm(Mg(OH)2) = w (Mg(OH)2) ∙ mc / 100%; m(Mg(OH)2) = 15,93% ∙ 20 г / 100%=3,186 гm(Н2 О) = w(Н2 О) ∙ mc / 100%; m(Н2 О) = 14,84% ∙ 20 г / 100%=2,968 г
Етап 41. Визначаємо масу куприту:mе = W ∙ mр/ 100%;m(Cu2 O)=0,03∙10000кг =300кг2. Визначаємо відносну атомну масу міді та відносну молекулярну масу куприту: Ar (Cu) = 64 Mr (Cu2 O) =2 ∙ Ar (Cu) + Ar (О); Mr (Cu2 O) = 2 ∙ 64+ 16 = 1443. Визначаємо масову частку міді у куприті: W (Cu) = n (Cu) ∙ Ar (Cu) /Mr (Cu2 O) W (Cu) = 2 ∙ 64 / 144 ≈ 0,894. Визначаємо масу міді:m(Cu ) = 300кг ∙ 0,89 = 267 кг =0,267 т
{073 A0 DAA-6 AF3-43 AB-8588-CEC1 D06 C72 B9}Дано:v(розчину)=200мл=0,2лm(KOH)=11.2г. Розв’язання: Обчислимо кількість речовини калій гідроксиду: M(KOH)=56 г/мольn(KOH)=11,2 г / 56 г/моль = 0,2 моль. Обчислимо молярну концентрацію одержаного розчину: C(KOH)= v(KOH) / V(розчину) = = 0,2 моль / 0,2 л = 1 моль /л. С(KOH)-?Задача. У воді розчинили калій гідроксид масою 11,2 г, об’єм розчину довели до 200 мл. Обчисліть молярну концентрацію одержаного розчину. Відповідь: 1 моль /л
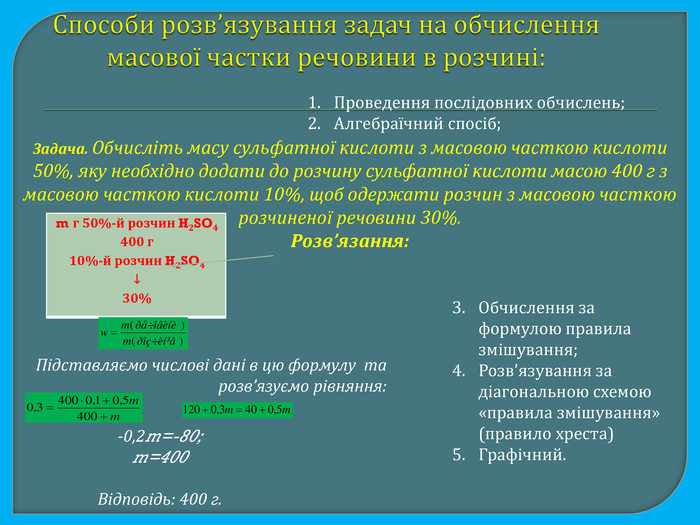
Способи розв’язування задач на обчислення масової частки речовини в розчині: Проведення послідовних обчислень;Алгебраїчний спосіб;Задача. Обчисліть масу сульфатної кислоти з масовою часткою кислоти 50%, яку необхідно додати до розчину сульфатної кислоти масою 400 г з масовою часткою кислоти 10%, щоб одержати розчин з масовою часткою розчиненої речовини 30%. Розв’язання:{073 A0 DAA-6 AF3-43 AB-8588-CEC1 D06 C72 B9}m г 50%-й розчин H2 SO4400 г10%-й розчин H2 SO4↓30%Підставляємо числові дані в цю формулу та розв’язуємо рівняння:-0,2m=-80;m=400 Відповідь: 400 г. Обчислення за формулою правила змішування;Розв’язування за діагональною схемою «правила змішування» (правило хреста)Графічний.
-
 Na Sledovatel 08.11.2021 в 10:07Загальна:1.0Структурованість1.0Оригінальність викладу1.0Відповідність темі1.0
Na Sledovatel 08.11.2021 в 10:07Загальна:1.0Структурованість1.0Оригінальність викладу1.0Відповідність темі1.0 -
 Веселова Тетяна Борисівна 16.12.2020 в 13:55Загальна:5.0Структурованість5.0Оригінальність викладу5.0Відповідність темі5.0
Веселова Тетяна Борисівна 16.12.2020 в 13:55Загальна:5.0Структурованість5.0Оригінальність викладу5.0Відповідність темі5.0


про публікацію авторської розробки
Додати розробку








































