Алкани.Насичені вуглеводні. Презентація.



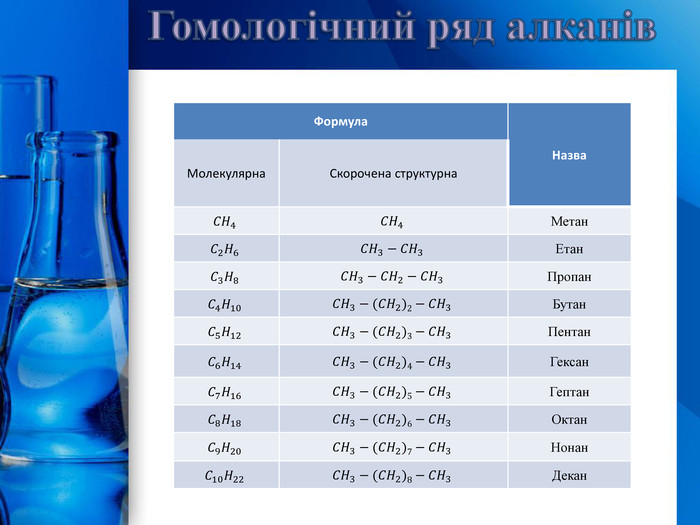




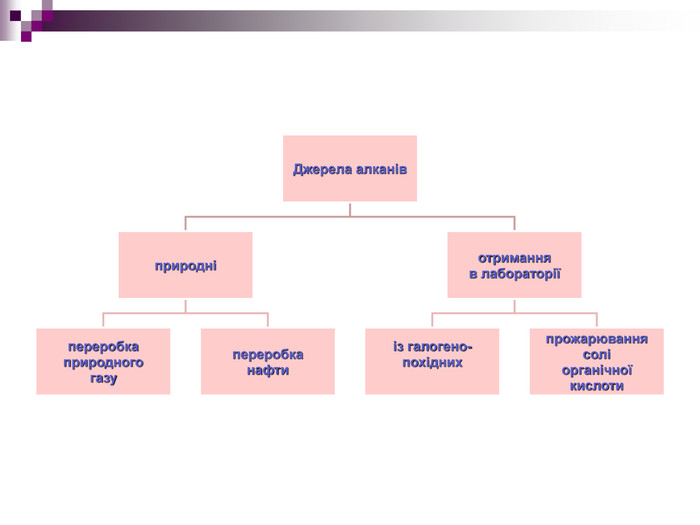
































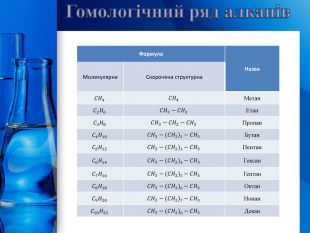
Гомологічний ряд алканів{5 C22544 A-7 EE6-4342-B048-85 BDC9 FD1 C3 A}Формула. Назва. Молекулярна. Скорочена структурна𝐶𝐻4𝐶𝐻4 Метан𝐶2𝐻6𝐶𝐻3−𝐶𝐻3 Етан𝐶3𝐻8𝐶𝐻3−𝐶𝐻2−𝐶𝐻3 Пропан𝐶4𝐻10𝐶𝐻3−(𝐶𝐻2)2−𝐶𝐻3 Бутан𝐶5𝐻12𝐶𝐻3−(𝐶𝐻2)3−𝐶𝐻3 Пентан𝐶6𝐻14𝐶𝐻3−(𝐶𝐻2)4−𝐶𝐻3 Гексан𝐶7𝐻16𝐶𝐻3−(𝐶𝐻2)5−𝐶𝐻3 Гептан𝐶8𝐻18𝐶𝐻3−(𝐶𝐻2)6−𝐶𝐻3 Октан𝐶9𝐻20𝐶𝐻3−(𝐶𝐻2)7−𝐶𝐻3 Нонан𝐶10𝐻22𝐶𝐻3−(𝐶𝐻2)8−𝐶𝐻3 Декан{5 C22544 A-7 EE6-4342-B048-85 BDC9 FD1 C3 A}Формула. Назва. Молекулярна. Скорочена структурна. Метан. Етан. Пропан. Бутан. Пентан. Гексан. Гептан. Октан. Нонан. Декан
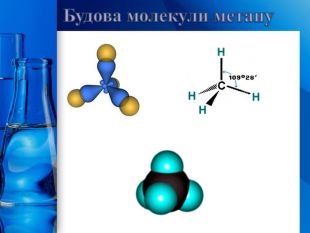
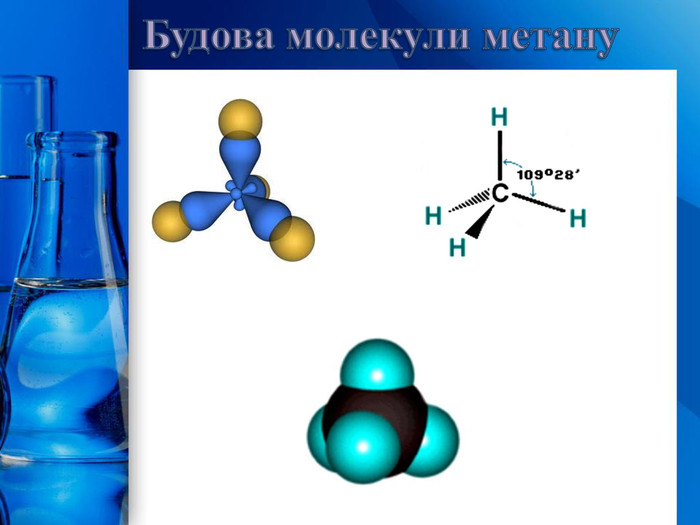
Усі атоми Карбону в молекулах алканів знаходяться у стані 𝑠𝑝3- гібридизації. Молекула метану має форму тетраедра. Кути між осями симетрії σ-зв’язків, які утворює атом Карбону в стані 𝑠𝑝3- гібридизації, дорівнюють 109о28′. Молекули алканів нерозгалуженої будови мають нелінійну, а зигзагоподібну форму: Будова молекул алканів
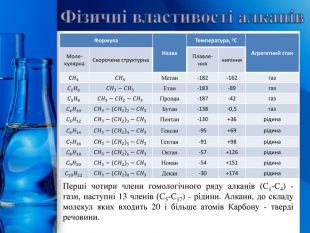
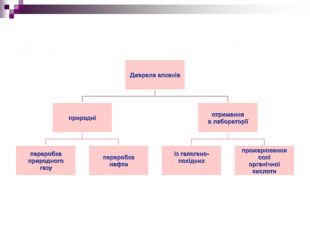
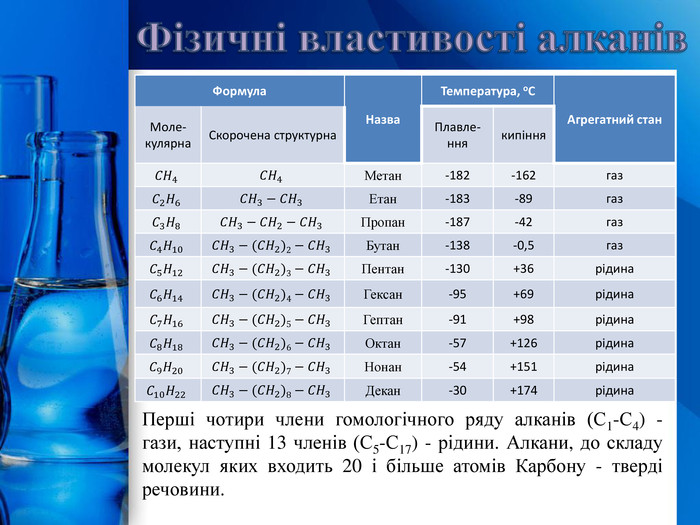
{5 C22544 A-7 EE6-4342-B048-85 BDC9 FD1 C3 A}Формула. Назва. Температура, о. САгрегатний стан. Моле-кулярна. Скорочена структурна. Плавле-ннякипіння𝐶𝐻4𝐶𝐻4 Метан-182-162газ𝐶2𝐻6𝐶𝐻3−𝐶𝐻3 Етан-183-89газ𝐶3𝐻8𝐶𝐻3−𝐶𝐻2−𝐶𝐻3 Пропан-187-42газ𝐶4𝐻10𝐶𝐻3−(𝐶𝐻2)2−𝐶𝐻3 Бутан-138-0,5газ𝐶5𝐻12𝐶𝐻3−(𝐶𝐻2)3−𝐶𝐻3 Пентан-130+36рідина𝐶6𝐻14𝐶𝐻3−(𝐶𝐻2)4−𝐶𝐻3 Гексан-95+69рідина𝐶7𝐻16𝐶𝐻3−(𝐶𝐻2)5−𝐶𝐻3 Гептан-91+98рідина𝐶8𝐻18𝐶𝐻3−(𝐶𝐻2)6−𝐶𝐻3 Октан-57+126рідина𝐶9𝐻20𝐶𝐻3−(𝐶𝐻2)7−𝐶𝐻3 Нонан-54+151рідина𝐶10𝐻22𝐶𝐻3−(𝐶𝐻2)8−𝐶𝐻3 Декан-30+174рідина{5 C22544 A-7 EE6-4342-B048-85 BDC9 FD1 C3 A}Формула. Назва. Температура, о. САгрегатний стан. Моле-кулярна. Скорочена структурна. Плавле-ннякипіння. Метан-182-162газ. Етан-183-89газ. Пропан-187-42газ. Бутан-138-0,5газ. Пентан-130+36рідина. Гексан-95+69рідина. Гептан-91+98рідина. Октан-57+126рідина. Нонан-54+151рідина. Декан-30+174рідина. Фізичні властивості алканів. Перші чотири члени гомологічного ряду алканів (С1-С4) - гази, наступні 13 членів (С5-С17) - рідини. Алкани, до складу молекул яких входить 20 і більше атомів Карбону - тверді речовини.
Горіння вищих алканів. Алкани з високим числом атомів Карбону при горінні можуть утворювати вуглець. Побутові свічки, що складаються із суміші твердих алканів, при горінні утворюють полум'я, що утворює кіптяву. Кіптява – це частинки сажі (вуглецю), які не встигають згоріти:2 С20 Н42 + 21 О2 → 40 C + 42 H2 O
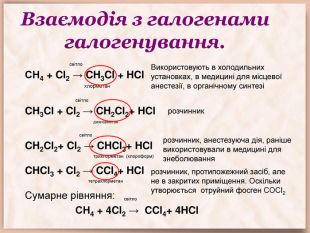
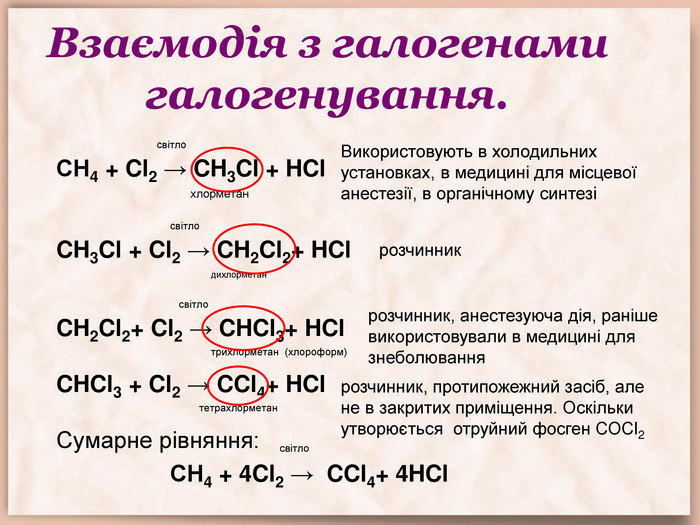
Взаємодія з галогенами галогенування. світло. СН4 + Cl2 → CH3 Cl + HCl хлорметан світло. CH3 Cl + Cl2 → CH2 Cl2+ HCl дихлорметан світло. CH2 Cl2+ Cl2 → CHCl3+ HCl трихлорметан (хлороформ) CHCl3 + Cl2 → CCl4+ HCl тетрахлорметан Сумарне рівняння: світло СН4 + 4 Cl2 → CCl4+ 4 HCl Використовують в холодильних установках, в медицині для місцевої анестезії, в органічному синтезі розчинник розчинник, анестезуюча дія, раніше використовували в медицині для знеболюваннярозчинник, протипожежний засіб, але не в закритих приміщення. Оскільки утворюється отруйний фосген СОСl2
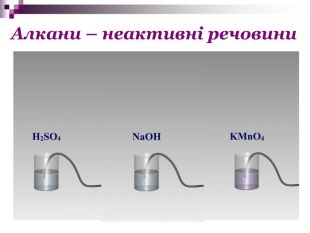
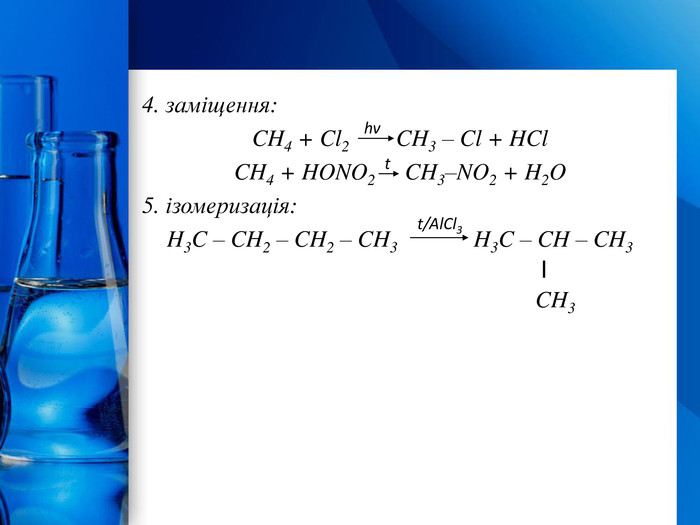
У молекулах алканів є лише неполярні й доволі міцні σ-зв’язки C – C і C – H. Тому сполуки малоактивні в хімічних реакціях. Однак за жорстких умов (висока температура, підвищений тиск, ультрафіолетове опромінення тощо) ці сполуки можуть вступати в деякі реакції:повне окиснення (горіння):2 H3 C–CH3 + 7 O2 4 CO2 + 6 H2 O2. часткове окиснення (каталітичне окиснення): H3 C–(CH2)n–CH3 суміш оксигеновмісних сполук3. розкладання: H3 C – CH3 2 C + 3 H2 Хімічні властивості алканівt
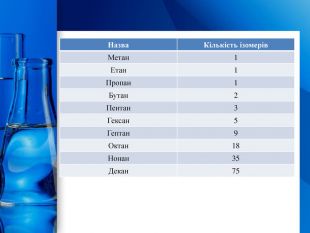
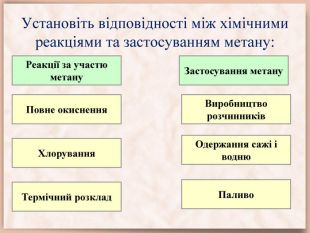
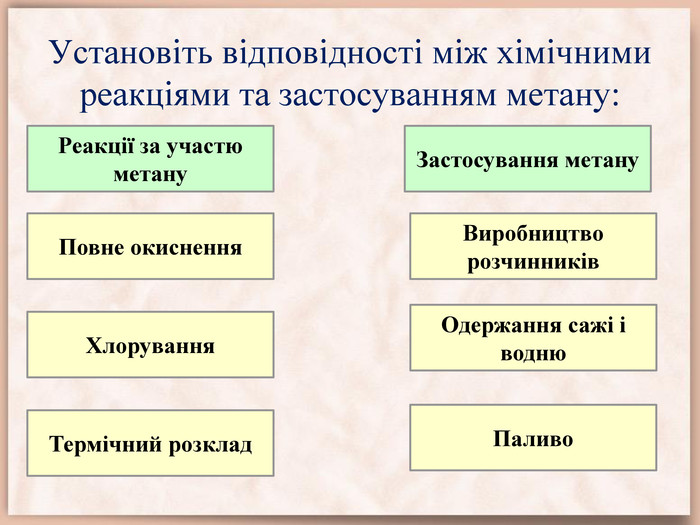
Експрес-контроль. Найпростіша органічна речовина – це…Загальна формула алканів – …Гомологи – це речовини, які …Ізомери – це речовини, які …Гомологічна різниця – це група атомів …За кімнатної температури газуватими є тільки алкани з числом атомів Карбону …Молекула метану має форму …Третім членом гомологічного ряду алканів є …
-
 Олена Мироненко 30.09.2024 в 21:01Дякую !Загальна:5.0Структурованість5.0Оригінальність викладу5.0Відповідність темі5.0
Олена Мироненко 30.09.2024 в 21:01Дякую !Загальна:5.0Структурованість5.0Оригінальність викладу5.0Відповідність темі5.0 -
 Оксана Проценко Григорівна 09.10.2022 в 15:46спасибочки огромноеЗагальна:5.0Структурованість5.0Оригінальність викладу5.0Відповідність темі5.0
Оксана Проценко Григорівна 09.10.2022 в 15:46спасибочки огромноеЗагальна:5.0Структурованість5.0Оригінальність викладу5.0Відповідність темі5.0 -
 Товстолес Лариса 27.09.2021 в 19:44дякую.Загальна:5.0Структурованість5.0Оригінальність викладу5.0Відповідність темі5.0
Товстолес Лариса 27.09.2021 в 19:44дякую.Загальна:5.0Структурованість5.0Оригінальність викладу5.0Відповідність темі5.0


про публікацію авторської розробки
Додати розробку