Амінокислоти-цеглинки життя
1
МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ
Відокремлений структурний підрозділ
«СЛОВ`ЯНСЬКИЙ ФАХОВИЙ КОЛЕДЖ НАЦІОНАЛЬНОГО АВІАЦІЙНОГО УНІВЕРСИТЕТУ»
Методична розробка
відкритого заняття
з дисципліни «Хімія»
на тему: «Нітрогеновмісні органічні сполуки. Амінокислоти. Білки»
Слов’янськ 2022
Методична розробка заняття з дисципліни «Хімія». Підготувала Челов’ян Н.М. – викладач Відокремленого структурного підрозділу «Слов’янський фаховий коледж Національного авіаційного університету», спеціаліст першої кваліфікаційної категорії – 2022р.
Дана методична розробка вміщує у собі основні питання щодо структури, властивостей та біологічної ролі білків. Вона може бути використана викладачами при вивченні теми «Нітрогеновмісні органічні сполуки. Амінокислоти. Білки». В ній поєднуються як традиційні так і інноваційні методи навчання.
Для викладачів природничо-наукових дисциплін закладів фахової передвищої освіти.
Рецензенти:
- Лисак Т.К. – викладач Відокремленого структурного підрозділу Національного авіаційного університету Слов’янського коледжу Національного авіаційного університету, спеціаліст вищої категорії, викладач-методист.
- Солод Л.С. – викладач Відокремленого підрозділу «Слов'янський технікум Луганського національного аграрного університету», спеціаліст вищої категорії.
Розглянуто та схвалено на засіданні циклової комісії фундаментальних дисциплін протокол №3 від 18 жовтня 2022р.
ЗМІСТ
с.
Передмова…………………………………………………………………………...4
- План заняття………………………………………………………………….6
-
Хід заняття…………………………………………………………………....7
- Організаційний момент……………………………………………….7
- Ознайомлення студентів з темою та навчальними
цілями заняття………………………………………………………....7
- Мотивація навчання…………………………………………………...7
- Актуалізація опорних знань…………………………………………..8
- Коментар відповіді студентів………………………………………....9
- Викладання та вивчення нового матеріалу …………………………...9
- Закріплення знань студентів…………………………………………..17
- Підсумок заняття…………………………………………………….....18
- Коментар відповіді студентів ………………………………………….18
- Домашнє завдання………………………………………………………18
Критерії оцінювання роботи студентів на занятті…………………………………. 19
Висновки………………………………………………………………………….........21
Передмова
Сучасна педагогіка відмовляється від «авторитарного керування» і переходить до системи організації підтримки і стимулювання самостійної пізнавальної діяльності здобувача освіти, створення умов для творчості, до навчання творчістю, до педагогіки співробітництва. Одним із способів створення таких умов є застосування викладачем методів активного навчання, як складової частини сучасних інноваційних технологій. Саме активні методи навчання дають змогу студентові розкритися як особистості.
Інтерактивна технологія кооперативного навчання може бути використана як на заняттях засвоєння нових знань, так і на заняттях застосування знань, умінь і навичок. Групова робота дуже ефективна на всіх етапах навчання. Вона дає можливість студентам поміркувати, обмінятися ідеями й лише потім висловити свої ідеї групі. Це сприяє розвиткові критичного мислення, навичок спілкування, вміння висловлювати свої думки, ідеї, переконувати й обстоювати свою думку.
Різновидом інтерактивної технології кооперативного навчання може бути також груповий пошук інформації. Ця технологія дає можливість пожвавити вивчення іноді не дуже цікавого матеріалу.
Для активізації роботи групи можливо використати такі форми навчання як використання прийомів «Мозковий штурм», «Спіймай помилку», «Асоціативний кущ», «Рефлексія». Для кращого розуміння теми доцільно підійти до вивчення матеріалу через предметні зв’язки, а саме при вивченні даної теми, об’єднати знання з біології, основ здоров’я, інформатики.
Здобувачам освіти, які мають творчі здібності, навчальний матеріал легше засвоїти саме з творчим підходом, а саме підготовка презентації, підбір відео демонстраційного матеріалу.
Навчальна мета заняття полягає у тому, щоб вивчити склад, будову, властивості амінокислот та білків; знати, що таке денатурація, кольорові реакції на білки, біологічну роль амінокислот і білків, пояснити сутність біохімічних процесів на прикладі конкретних хімічних реакцій; продовжити формувати навички визначення речовин за допомогою якісних реакцій.
Виховна мета – виховувати у здобувачів фахової передвищої освіти допитливість та працездатність, вміння виділяти головне, аналізувати, конспектувати, порівнювати, зіставляти.
Розвиваюча мета – розвивати логічне мислення, увагу, пам’ять, хімічну мову, екологічне мислення, виховувати інтерес до вивчення хімії.
Очікувані результати навчання
Студент:
Знаннєвий компонент: називає загальні формули та функціональні групи амінокислот; пояснює амфотерність амінокислот; зміст понять: пептидна група, поліпептид.
Діяльнісний компонент: складає структурні формули амінокислот за назвами; рівняння реакцій, які описують хімічні властивості аміноетанової кислоти; білків; установлює причинно-наслідкові зв’язки між складом, будовою, властивостями нітрогеновмісних органічних сполук; класифікує нітрогеновмісні органічні сполуки за функціональними групами; прогнозує та характеризує хімічні властивості амінокислот, зумовлені особливостями будови їхніх молекул.
Ціннісний компонент: висловлює судження про вплив окремих нітрогеновмісних органічних сполук на організм людини; оцінює біологічне значення амінокислот і білків; робить висновки про властивості амінокислот і білків, виходячи з будови молекул речовин, і про будову речовин, виходячи з їхніх властивостей; розв’язує проблему власного раціонального харчування на основі знань про білки.
ПЛАН ЗАНЯТТЯ
Група: 1Ф-КД-БО22
Тема заняття: Нітрогеновмісні органічні сполуки. Амінокислоти. Білки
Мета заняття:
Методична – удосконалити методику проведення лекції з використанням інтерактивних методів навчання.
Навчальна – вивчити склад, будову, властивості амінокислот та білків; знати, що таке денатурація, кольорові реакції на білки, біологічну роль амінокислот і білків, пояснити сутність біохімічних процесів на прикладі конкретних хімічних реакцій; продовжити формувати навички визначення речовин за допомогою якісних реакцій.
Виховна – виховувати у здобувачів фахової передвищої освіти допитливість та працездатність, вміння виділяти головне, аналізувати, конспектувати, порівнювати, зіставляти.
Розвиваюча – розвивати логічне мислення, увагу, пам’ять, хімічну мову, екологічне мислення, виховувати інтерес до вивчення хімії.
Вид заняття: Лекція.
Тип заняття: Лекція - формування нових знань і вмінь.
Форма проведення заняття: групова, фронтальна, індивідуальна робота, евристична бесіда, захист навчальних проектів, використання прийомів «Мозковий штурм», «Спіймай помилку», «Асоціативний кущ», «Рефлексія», проведення лабораторних дослідів: «Біуретова реакція», «Ксантопротеїнова реакція».
Міжпредметні зв’язки:
Забезпечуючі: історія, українська мова, біологія.
Забезпечувані: прикладна хімія, спеціальні дисципліни.
Методичне забезпечення: ноутбук, платформа Googl-meet, презентація, хімічні реактиви (розчин натрій гідроксиду, купрум(ІІ) сульфату, нітратної кислоти, етиловий спирт, розчин яєчного білка), спиртівка, пробіркотримач, штатив з пробірками, сірники, скляна паличка.
Література:
- Савчин М.М. Хімія 10 кл (рівень стандарту). Київ «Грамота», 2018.
- Русакова К.О. Хімія 10 кл. Мій конспект. Харків «Основа», 2018.
- Стеценко В.І., Овчаренко І.Ю. Усі уроки хімії 10 кл. Харків «Основа», 2018.
- Басов В.П., Радіонов В.М. Хімія. Навчальний посібник. Київ «Каравела», 2019.
ХІД ЗАНЯТТЯ
1.Організаційний момент 2 хв.
1.1 Привітання студентів.
1.2 Перевірка присутніх. Налаштування студентів на роботу. Викладач ознайомлює студентів з критеріями оцінювання їх роботи на занятті.
2. Ознайомлення студентів з темою та навчальними цілями заняття 1 хв.
Тема заняття: Нітрогеновмісні органічні сполуки. Амінокислоти. Білки
Мета заняття:
Методична – удосконалити методику проведення лекції з використанням інтерактивних методів навчання.
Навчальна – вивчити склад, будову, властивості амінокислот та білків; знати, що таке денатурація, кольорові реакції на білки, біологічну роль амінокислот і білків, пояснити сутність біохімічних процесів на прикладі конкретних хімічних реакцій; продовжити формувати навички визначення речовин за допомогою якісних реакцій.
Виховна – виховувати у здобувачів фахової передвищої освіти допитливість та працездатність, вміння виділяти головне, аналізувати, конспектувати, порівнювати, зіставляти.
Розвиваюча – розвивати логічне мислення, увагу, пам’ять, хімічну мову, екологічне мислення, виховувати інтерес до вивчення хімії.
3. Мотивація навчання 3 хв.
Прийом «Асоціативний кущ».
Викладач пропонує студентам назвати асоціативні поняття до слова «амінокислота», використавши свої знання з біології. Поняття висвічуються на екрані після бесіди зі студентами.
- Аміногрупа
- Карбоксильна група
- Амфотерність
- Пептидний зв’язок
- Білок
- Первинна структура білка
- Вторинна структура білка
- Третинна структура білка
- Четвертинна структура білка
- Життя
- Денатурація
- Якісна реакція на білок
- Замінні та незамінні амінокислоти
Вважають, що життя на землі зародилось тоді, коли виникли білки. На сьогодні лише в людському організмі виявлено 5 млн. білків. Проте всі ці білки побудовані лише з 20 амінокислот. Як таке можливо? Окрім білків фрагменти їхніх молекул входять до складу молекул таких речовин, як ферменти і гормони.
Сьогодні ми з’ясуємо будову молекул амінокислот, їх властивості, біологічну роль.
4. Актуалізація опорних знань 3 хв.
Актуалізація опорних знань студентів проводиться формі перевірки домашнього завдання.
Метод «Мозковий штурм». Студентам ставляться питання, які потребують від них короткої, швидкої, точної відповіді, без обговорення, але при потребі з обґрунтовуванням.
- Які речовини називають амінами? (Аміни-похідні амоніаку, що утворюються в результаті заміщення атомів гідрогену на карбонові радикали.)
- Основні чи кислотні властивості виявляють аміни? (Основні).
- Порівняйте анілін з амінами та бензеном: що подібного, а в чому відмінність? (Анілін схожий за властивостями з бензеном тим, що взаємодіє з бромною водою з утворенням білого осаду. Реакція відбувається за механізмом заміщення 3-х атомів Гідрогену в бензеновому кільці. Анілін як і насичені аміни взаємодіє з кислотами за участю аміногрупи.)
- Як впливає будова аніліну на його властивості? (Радикал феніл C6H5-притягує до себе неподілену електронну пару Нітрогену аміногрупи, яка спряжена із 6-π-електронною хмарою радикалу фенілу. Внаслідок цього основні властивості аніліну слабкіші, ніж у амінів.)
- Сформулюйте правила безпечного поводження з аніліном.
- Який вплив амінів на організм людини? (Анілін-отруйна речовина, яка подразнює слизові оболонки, пригнічує дихання, негативно діє на кров, внутрішні органи, нервову систему людини.)
- Де застосовуються аміни? (У виробництві барвників; полімерів, синтетичних волокон; лікарських препаратів.)
Прийом «Спіймай помилку». Студентам пропонуються твердження, у яких потрібно знайти помилки та виправити їх.
- Анілін належить до ароматичних амінів, його молекула складається з бензенового кільця і нітрогрупи. (Анілін належить до ароматичних амінів, його молекула складається з бензенового кільця і аміногрупи).
- В аніліні проявляється взаємний вплив атомів та груп атомів у молекулі. (В аніліні проявляється взаємний вплив бензенового кільця та аміногрупи у молекулі).
- Наявність бензенового кільця посилює основні властивості аніліну, а присутність аміногрупи збільшує рухливість атомів Гідрогену у мета-положенні. (Наявність бензенового кільця послаблює основні властивості аніліну, а присутність аміногрупи збільшує рухливість атомів Гідрогену в орто- і пара-положенні).
- Для аніліну характерні сильні основні властивості, тому він взаємодіє навіть із слабкими кислотами. (Для аніліну характерні слабкі основні властивості, тому він взаємодіє лише з сильними кислотами).
- Перевагою реакції Зініна є те, що в ній використовується молекулярний водень. (Перевагою реакції Зініна є те, що в ній використовується атомарний водень).
Розташувати речовини за посиленням основних властивостей: метиламін, анілін, амоніак, диметиламін, триметиламін. Відповідь обґрунтуйте. (Анілін, амоніак, метиламін, диметиламін, триметиламін. Сила основних властивостей зростає в ряду: анілін < амоніак < первинні аміни < вторинні аміни < третинні аміни залежно від будови молекули.)
5. Коментар відповіді студентів 1 хв.
6. Викладання та вивчення нового матеріалу 40 хв.
План лекції
1.Амінокислоти (загальна характеристика).
2.Класифікація амінокислот.
3. Функції амінокислот.
4.Фізичні і хімічні властивості амінокислот.
5. Будова молекул білків. Їх класифікація.
6. Біосинтез та життєвий цикл білків.
7. Властивості білків.
8. Функції білків.
9. Сучасні методи синтезу, виділення, очищення, а також дослідження функцій та механізмів роботи білків.
Амінокислоти-органічні сполуки, до складу яких входять карбоксильна (-СООН) та аміногрупа (-NН2), які пов’язані з вуглеводневим радикалом.
Поширення в природі
Амінокислоти в природі існують у вільному стані та в складі інших сполук. Подібно до того, як із молекул глюкози побудовані високомолекулярні природні вуглеводи – крохмаль та целюлоза, із молекул амінокислот утворені всі рослинні та тваринні білки. Відмінність полягає лише в тому, що у крохмалю та целюлози мономером є одна речовина – глюкоза, а до складу кожного білка входять різні амінокислоти.
Загальна формула: R-СН(NН2)-СООН.
Найпростіша амінокислота-аміноетанова (гліцин): NН2-СН2-СООН.
Класифікація амінокислот
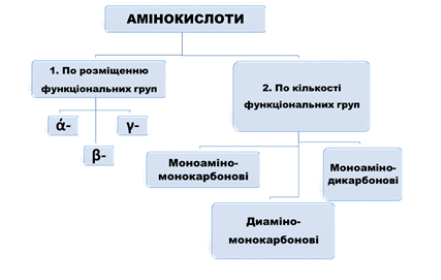
- За положенням аміногрупи щодо карбоксильної: α, β, γ, δ, ε.
α
NH2 - CH2 – COOH- α-амінооцтова кислота
β
NH2 - CH2 - CH2 – COOH - β-амінопропанова кислота
- Викладач. Поясніть, чому α-атом Карбону не перший, а другий?
Найпоширеніші у природі: ɑ-Ак.
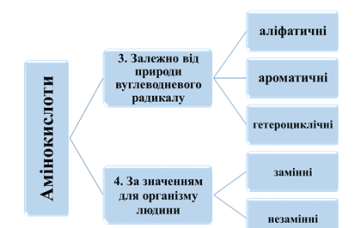
3. Залежно від природи вуглеводневого радикалу:
- аліфатичні (насичені) - гліцин (NH2-CH-COOH)
- ароматичні – фенілаланін (С6Н5-CH2-CH(NH2)-COOH).
- гетероциклічні - містять різні функціональні групи-триптофан, гістидин.
4. За значенням для організму людини:
- Незамінні-надходять з їжею (валін, метіонін, лізин, ізолейцин, лейцин, треонін, фенілаланін, триптофан);
- Замінні-синтезуються в організмі людини з цілого ряду органічних сполук, у тому числі з деяких амінокислот.
Будова молекули
Молекули амінокислот містять дві функціональні групи з протилежними хімічними властивостями-аміногрупу-з основними та карбоксильну-з кислотними. Ці дві групи, знаходячись в одній молекулі, взаємодіють між собою з утворенням внутрішньої солі:
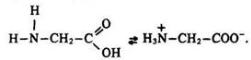
Молекула амінокислоти є біполярним іоном. Цим пояснюються фізичні та хімічні властивості амінокислот.
Фізичні властивості
- безбарвні нелеткі кристалічні речовини.
- мають високі температури плавлення (понад 250°С).
- добре розчиняються у воді і нерозчинні в органічних розчинниках, чим подібні до неорганічних сполук.
- мають різний смак: солодкий, гіркий або зовсім без смаку.
- Прийом «Мозковий штурм». Студенти дають відповідь на поставлене питання.
- З якими речовинами реагує оцтова кислота?
У результаті бесіди з’ясовується перелік речовин, з якими реагує оцтова кислота. Свої відповіді студенти аргументують. Паралельно в зошитах складають схему.

- Викладач. А тепер розглянемо хімічні властивості амінокислот на прикладі амінооцтової (аміноетанової) і порівняємо їх із властивостями карбонових кислот, результатом чого буде завершення нашої схеми.
Хімічні властивості
- Амінокислоти дисоціюють:
Н2N-СН2-СООН → Н2N-СН2-СООН- + Н+
- Основні властивості - взаємодіють з кислотами з утворенням солей:
Н2N-СН2-СООН + НСl → (Н3N-СН2-СООН)⁺СІ¯
- Кислотні властивості-взаємодіють з лугами з утворенням солі і води:
Н2N-СН2-СООН + NaОН → Н2N-СН2-СООNa + H2O
- Взаємодіють з металами та основними оксидами з утвореннями солей.
2Н2N-СН2-СООН + 2Na → 2Н2N-СН2-СООNa + H2
2Н2N-СН2-СООН + СaО → (Н2N-СН2-СОО)2Сa + H2O
- Із спиртами при нагріванні та присутності конц. сульфатної кислоти утворюють естери подібно до неорганічних кислот-.
NН2-СН2-СООН + С2Н5ОН → NН2-СН2-СООС2Н5+ H2O
- Викладач. Назовіть естер, який утворився за правилами номенклатури цих речовин.
- Очікувана відповідь: етиловий естер амінооцтової кислоти.
- Особливі властивості. Вступають в реакції полікондесації:
NH2-CH2-CO-OH + Н-NH-CH2-COOH → NH2-CH2-CO – NH-CH2-COOH +Н2О,
де (-CO –NH-) - пептидний зв’язок.
Цікаво! Учений-біохімік О.Я. Данилевський на основі своїх досліджень у 1888 році вперше висловив гіпотезу про пептидний зв’язок між залишками амінокислот у білковій молекулі. Пізніше на початку ХХ століття німецький учений Е. Фішер експериментально підтвердив існування такого зв’язку. Йому вдалося синтезувати поліпептид, який складався з 19 залишків амінокислот.
- Студенти завершують заповнення схеми і порівнюють властивості карбонових кислот і амінокислот.

- Студенти формулюють висновок про здатність амінокислот вступати в хімічні реакції та пояснюють чим це обумовлено.
Одержання
- У промисловості: – гідролізом білків.
- У лабораторії поетапно:
оцтова кислота → хлороцтова кислота → амінооцтова кислота
СН3-СООН + Сl2 → СН2Сl-СООН + НСl
СН2Сl-СООН + 2NН3 → NН2-СН2-СООН + NН4Сl
Значення
- Із амінокислот (20 α-амінокислот) в організмі синтезуються білки органів й тканин, гормони, ферменти та інші біологічно важливі речовини.
- Це цікаво! Доведено що не менше 14 захворювань виникають через порушення амінокислотного обміну, з яких 12 виражаються у психічних розладах. Більшість з них лікують за допомогою амінокислотних дієт й вітамінотерапії. Наприклад, при спадковому порушенні обміну фенілаланіну й терозину у 60% дітей відмічають ідіотію, а у 10% – слабо виражену олігофренію. З цим порушенням зв’язане й явище альбінізму (лат. albus – «білий»).
- Амінокислоти використовують як лікувальні засоби при деяких захворюваннях: метіонін – при цирозі печінки, після операції на серці, при інфаркті; лізин – для харчування недоношених дітей, глютамінова кислота – при епілепсії;
- Синтетичними амінокислотами підгодовують сільськогосподарських тварин.
- Для виробництва синтетичних волокон, наприклад, капрону й енанту.
- Викладач. Коли вчені з’ясовують чи є життя на невідомій планеті, вони насамперед перевіряють, чи є на планеті білки. Як вигадаєте, чому?
Виявляється, білки - це і є саме життя. Без білків не може існувати жоден живий організм. Про ці речовини ми сьогодні детально поговоримо.
- Повідомлення студента на тему: «Історія вивчення білків».
Білки
це природні біополімери складної будови, макромолекули яких, складаються із залишків Ак, сполучених між собою пептидним зв'язком -CO-NH- з молекулярною масою більше 1000.
Білки-це вища форма розвитку органічних речовин, основна складова частина клітин, вони входять до складу всіх живих організмів. Білки тіла людини складають 40-50% з розрахунку на суху вагу. В організмі є тисячі білкових речовин, причому кожний білок виконує строго визначену функцію.
У живому організмі не існує ділянки, де б не було білків. Вони є у крові, м’язах, мозку, навіть входять до складу емалі зубів.
Вивчення елементного складу білків свідчить, що вони складаються з таких хімічних елементів, а саме:
Середній вміст хімічних елементів у білках:
- Карбон (С) – 50-55%;
- Оксиген (О) – 19-24%;
- Нітроген (N) – 15-18%;
- Гідроген (Н) – 6-8%;
- Сульфур (S) – 0,3-2,5%;
- Фосфор (Р) – до 0,5%;
- мікроелементи (Cl, F, I, Zn, Mg, Fe, Cu) – до 0,2
Наприклад, емпірична формула гемоглобіну – білка крові ![]()
Класифікація білків
- За складом:
|
Протеїни, прості білки |
Протеїди, складні білки |
|
складаються лише із залишків амінокислот |
крім залишків амінокислот містять залишки речовин небілкової природи. |
|
приклади |
|
|
Приклади складних білків є міоглобін та гемоглобін.
|
2. За будовою:
а) глобулярні – молекули шаровидної форми (наприклад, у яйцях, ікрі, злаках, картоплі, капусті та ін.);
б) фібрилярні – ниткоподібні, волокнисті (кератин шерсті, колаген й еластин сполучних тканин м’яса).
3. За вмістом амінокислот:
а) повноцінні – містять усі незамінні амінокислоти;
б) неповноцінні – відсутня хоча б одна незамінна амінокислота.
Структури білка
Окремі амінокислоти з’єднуються між собою й утворюють ланцюг, який набуває певної просторової структури.
- Первинна структура - це послідовність амінокислот у лінійному поліпептидному ланцюзі. Зв’язок пептидний. Визначає специфіку білків.
- Вторинна структура - утворення поліпептидним ланцюгом - спіралі або – шару, закріплена безліччю водневих зв’язків.
- Третинна структура - просторова укладка поліпептидного ланцюга, утворена головним чином за рахунок дисульфідних містків, водневих зв’язків, гідрофобних та йонних узаємодій.
- Четвертинна структура - об’єднання декількох поліпептидних ланцюгів з третинною структурою, за рахунок узаємодії різних поліпептидних ланцюгів.
Фізичні властивості
- утворюють колоїдні розчини;
- мають різний смак, колір і запах;
- температури, за яких відбувається руйнування білка, специфічні для кожного з них;
- відрізняються за ступенем розчинності у воді, але більшість із них у ній розчиняються.
Хімічні властивості білків
- Денатурація білків під дією температури, спирту, кислоти, лугу.
- Демонстрація «Денатурація білків під дією температури, спирту, кислоти, лугу».
2. Гідроліз білка:
Н2N-СН2-СО-NН-СН2-СООН + Н2О → Н2N-СН2-СООН + NН2-СН2-СООН
Кольорові реакції на білки
1. Біуретова реакція:
Білок + NaOH + Cu(OH)2 → сполука червоно-фіолетового кольору
2. Ксантопротеїнова реакція (при нагріванні):
Білок + НNO3 → сполука жовтого кольору
- Лабораторні досліди: «Біуретова реакція», «Ксантопротеїнова реакція».
Біологічна роль
В організмах тварин чи людини під час травлення білкові молекули гідролізуються до амінокислот, які розчиняючись у водному середовищі проникають у кров й надходять до всіх органів та тканин. Тут найбільше амінокислот витрачається на синтез білків органів й тканин, частина йде на синтез гормонів, ферментів, а частина розкладається до кінцевих продуктів з виділенням енергії.
- Структурна (будівельна): утворення клітин, тканин, гормонів (колаген сполучної тканини, кератин волосся, нігтів, шкіри, еластин стінок судин);
- Каталітична (ферменти);
- Транспортна-перенесення білковими тілами речовин в організмі (гемоглобін, міоглобін);
- Енергетична (забезпечення організму енергією (12% енергії, 1г білка – 17,6 кДж, тільки в разі нестачі жирів та вуглеводів);
- Захисна (здатність антитіл знищувати хвороботворні мікроорганізми, здатність крові до згортання);
- Регуляторна (гормони);
- Беруть участь у передачі генетичної інформації;
- Рухову– рух м’язів, війок, джгутиків;
- Рецепторну– передача імпульсів в центральну нервову систему.
- Підтримання кислотно-лужної рівноваги організму.
Це цікаво!
- Якщо в організмі не було б ферментів, невдовзі ми померли б з голоду, адже тоді звичайний процес перетравлення обіду тривав би 50 років;
- Старіння людини викликається зміною у білках. Тривалість життя запрограмовано в ядрі клітини (до 110-115 років). За 60-70 років організм людини близько 200 разів поновлює свої білки із амінокислот білків їжі. Очевидно, чим кращий «будівельний матеріал», тим старіння наступить пізніше. Довготривале харчування одноманітною їжею призводить до захворювань. При порушенні обміну білка виникають такі захворювання як порфінурія (утворення темно-червоних пігментів в шкірі), подагра (відкладання солей в сухожиллях дрібних суглобів рук, ніг).
Презентація навчальних проектів
1. «Синтез білків».
2. «Збалансоване харчування - запорука здорового життя».
7.Закріплення знань студентів 10 хв.
- «Фронтальне опитування»
1. З чого побудовані молекули білків?
2. Як називається зв’язок між амінокислотами?
3. Що таке первинна структура білка?
4. Що таке вторинна структура білка?
5. Що таке третинна структура білка?
6. Що таке «денатурація»?
7. За допомогою яких реактивів можна довести наявність білка?
8. Яка якісна реакція на білок?
- Дати відповіді на питання:
- Чому зі зварених яєць ніколи не з'явиться курча?
- Подумайте, чому, для того щоб отримати смачний бульйон, м’ясо кладуть у холодну воду, а для смачного м'яса його опускають в окріп?
- Чому молоко згортається природним чином у разі тривалого зберігання в теплому місці?
- Чому лікарі рекомендують збивати температуру у хворого, якщо вона перевищує 38?
- З чим пов'язане відторгнення пересаджених органів?
- Про що свідчить утворення пластівців або помутніння бульйону під час варіння м'яса?
- Чому свіжі плями крові на одязі не можна відпирати в гарячій воді?
- Написати формули речовин:
- 2- аміно-3-етилпентанова кислота.
- β-аміно-2, 3, 4-триметилгексанова кислота.
- Скласти формули всіх ізомерів α-амінопентанової кислоти, назвіть їх.
8.Підсумок заняття 3 хв.
- Прийом «Рефлексія»
- Сьогодні я переконався, що…
- Сьогодні я вперше побачив, що…
- Сьогодні мене здивувало те, що…
- Сьогодні мені було важко…
- Сьогодні для мене не становило труднощів …
9.Коментар відповіді студентів 1 хв.
Викладач коментує відповіді студентів, виставляє оцінки.
10. Домашнє завдання 1 хв.
- Опрацювати конспект лекції.
- Хімія: підруч. для 11 кл. загальноосвіт. навч. закл.(академічний рівень) / П.П. Попель, Л.С. Крикля. – К: ВЦ «Академія», 2021.
- Підготуватися до узагальнюючого повторення з теми.
Критерії оцінювання роботи студентів на занятті
При оцінюванні рівня навчальних досягнень на занятті враховується:
- Рівень засвоєння теоретичних знань;
- Оволодіння хімічною мовою як засобом відображення знань про речовини і хімічні явища;
- Сформованість експериментальних умінь, необхідних для виконання хімічних дослідів;
- Здатність студентів застосовувати набуті знання на практиці;
За відмінностями між обсягом і глибиною досягнутих результатів, ступенем самостійності у виконанні завдань, здатністю використовувати знання у нових ситуаціях виокремлено рівні навчальних досягнень студентів, що оцінюються за 12-бальною шкалою. Кожний наступний рівень вбирає в себе вимоги до попереднього, а також додає нові характеристики.
|
Рівні навчальних досягнень студентів |
Бали |
Орієнтовні вимоги оцінювання навчальних досягнень студентів |
|
1 |
|
|
2 |
|
|
|
3 |
|
|
|
II. Середній |
4 |
|
|
5 |
|
|
|
6 |
|
|
|
III. Достатній |
7 |
|
|
8 |
|
|
|
9 |
|
|
|
IV. Високий |
10 |
|
|
11 |
|
|
|
12 |
|
ВИСНОВОК
В даній методичній розробці наводиться досвід методичного опрацювання і проведення лекційного заняття на тему: «Нітрогеновмісні органічні сполуки. Амінокислоти. Білки». Особливості сучасного етапу становлення освіти в Україні потребують упровадження нових форм та методів навчання і виховання, що забезпечують розвиток особистості здобувача освіти. Сьогодні існує багато інноваційних технологій, які орієнтовані на краще засвоєння студентами матеріалу, підвищення якості їх умінь і навичок. Але для досягнення цієї мети, заняття необхідно будувати таким чином, щоб він був не лише цікавим, але й не перевантаженим для студента. Ефективність його зростає, коли поряд із класичними методами широко використовуються активні форми навчання. Практика свідчить про те, що застосування в навчальному процесі інноваційних технологій дозволяє сформувати основні життєві компетентності, уміння оперувати науковими знаннями та фактичним матеріалом, орієнтуватись в інформаційному просторі, приймати зважені рішення і прагнути в розумінні власних почуттів і вимог, сприяє вихованню творчої, креативної особистості.
На життя сучасного здобувача освіти активно впливають нові інформаційні технології. Вони істотно підсилюють мотивацію вивчення хімії та біології, підвищують рівень індивідуалізації навчання. Комп'ютерна грамотність та комунікативна освіченість студентів є компетенціями, що формуються тільки в умовах застосування інформаційно-комунікаційних технологій і забезпечують успішний результат у широкому спектрі освітньої діяльності.
Вдале використання інноваційних технологій у поєднанні з традиційними методами навчання підвищує інтерес студентів до вивчення хімії, зростає їх активність, посилює у них прагнення здобувати знання самостійно. На занятті створюється атмосфера співробітництва, розуміння і доброзичливості.


про публікацію авторської розробки
Додати розробку
