Методична розробка урока"Алотропія"
ІУДЕЙСЬКА РЕЛІГІЙНА ГРОМАДА У м. КАМ’ЯНСЬКЕ
СЕРЕДНІЙ ЗАГАЛЬНООСВІТНІЙ НАВЧАЛЬНО-ВИХОВНИЙ КОМПЛЕКС
«ОР-АВНЕР»
Циклова комісія природничо - математичних дисциплін
РОЗРОБКА УРОКА З ХІМІЇ
ТЕМА: «Алотропія»
ДЛЯ УЧНІВ
11класів
2022-2023н.р.
Укладач: Гінтер М.В., викладач хімії та біології, спеціаліст вищої категорії,
викладач-методист
МЕТА уроку: ознайомити учнів з явищем алотропії;
з’ясувати причини відмінностей властивостей алотропних модифікацій на прикладі алотропних видозмін Оксигену, Сульфуру, Карбону;
формувати в учнів уявлення про залежність якісних і кількісних характеристик речовин на прикладі кисню й озону;
навчити наводити приклади алотропних модифікацій Оксигену, Сульфуру, Карбону, Фосфору; сполук неметалічних елементів з Гідрогеном (гідроген хлорид, гідроген сульфід, амоніак);
Тип уроку: засвоєння нових знань.
Форми роботи: фронтальна бесіда, лекція, робота з підручником.
Обладнання: періодична система хімічних елементів, таблиця розчинності, моделі кристалічних ґраток алмаза, графіту, схема будови моноклінної та ромбічної сірки, фулеренів, таблиця порівняння властивостей алотропних модифікацій.
ХІД УРОКУ
I. Організація класу
II. Перевірка домашнього завдання.
Заслуховуємо повідомлення учнів про природні сполуки Оксигену, Сульфуру, Карбону, Силіцію. Особливу увагу звертаємо на природні сполуки — прості речовини: кисень і озон, алмаз, графіт, вугілля; складні речовини: кварц, пісок, агат тощо.
ІІІ. Мотивація навчальної діяльності

Як можна пояснити відмінності в зовнішньому вигляді й фізичних властивостях цих речовин?
Далі дізнаємося, що вони відрізняються й хімічними властивостями. Ці відмінності пояснюються різною будовою речовини.
Порівняймо фізичні властивості кисню й озону (з допомогою підручника або інших довідкових матеріалів).
|
|
Кисень |
Озон |
|
Хімічна формула |
О2 |
О3 |
|
Молярна маса |
32 |
48 |
|
Будова |
|
|
|
Агрегатний стан |
Газ |
Газ |
|
Колір |
Відсутній |
Синій |
|
Запах |
Відсутній |
Різкий |
|
Температура кипіння, °С |
-183,0 |
-111,9 |
|
Температура плавлення, °С |
-218,7 |
-192,7 |
Явище, за якого той самий хімічний елемент утворює кілька простих речовин, називається алотропією (від грецьк. «мінливість»).
ІІІ. Вивчення нового матеріалу
Явище алотропії (розповідь учителя)
Прості речовини, утворені тим самим елементом, називаються алотропними видозмінами цього елемента.
Алотропія спостерігається в багатьох елементів. Вона пояснюється наявністю двох і більше молекул, що містять різну кількість атомів або наявністю двох і більше кристалічних форм, що характеризуються різним розташуванням атомів у кристалічних ґратках.
- Алотропія Оксигену
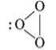
Для Оксигену існує дві прості речовини — кисень О2 і озон О3.
Кисень — безбарвний газ, без запаху. молекула — O2. Будова: ![]()
Озон O3- парамагнітний (притягується магнітом, має два неспарені електрони). Має запах, є отруйним; його температури плавлення і кипіння вищі, ніж кисню. Він виявляє значно більшу хімічну активність

У природі озон утворюється з кисню під час грозових розрядів, а на висоті 10-30 км — під дією ультрафіолетового випромінювання. Він затримує шкідливе для людини ультрафіолетове випромінювання Сонця, поглинає інфрачервоні промені Землі, перешкоджаючи її остиганню.
Утворення O3 — ланцюгова реакція:
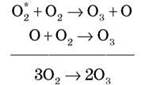
- Алотропія Сульфуру (заповнення опорної схеми)

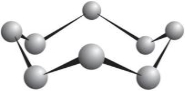
Природна сірка — порошок жовтого кольору. Цей елемент утворює дві дуже схожі кристалічні прості речовини — моноклінну і ромбічну сірку. У них містяться однакові молекули S8, але порядок їх розташування у кристалах речовин різний. Як правило, з усіх алотропних видозмін хімічного елемента за певних умов стійкою є лише одна.
Для Сульфуру за нормального тиску й t° < 95,6 °С, стійкою є ромбічна модифікація. За кімнатної температури на неї перетворюються решта форм. У процесі кристалізації з розплаву сірки спочатку утворюються голчасті кристали моноклінної сірки, які за температури нижче 95,6 °С переходять у ромбічні.
За температури вище 95,6 °С стійкою є моноклінна сірка, за температури плавлення сірка — рухлива жовта рідина. У результаті подальшого нагрівання вона буріє, втрачаючи рухливість. Якщо вилити її в холодну воду (швидке охолодження), утвориться еластична, схожа на гуму коричнева маса — пластична сірка.
Sкр ![]() Sпласт - Q (кДж)
Sпласт - Q (кДж)
У нерозтягнутій сірці ланцюжки переплутані, скручені, унаслідок розтягування вони розправляються паралельно один одному. Пластична сірка нестійка, поступово переходить у ромбічну, жовтіє.
За значного нагрівання сірка переходить у пару бурого кольору (S2, S4, S8), за температури понад 1 760 °С сірка одноатомна.
Висновок: Якщо сірку розплавити, нагріти майже до кипіння, а потім вилити рідину в холодну воду, то вона застигне в масу, що нагадує пластилін. Це — пластична сірка, яка складається із ланцюгових молекул S4, S6 та ін. Із часом такі молекули руйнуються, формуються циклічні молекули S8, і пластична сірка поступово перетворюється на тверду й крихку ромбічну сірку.
- Алотропія Фосфору
Елемент Фосфор утворює кілька простих речовин. Найважливішими є білий і червоний фосфор. Білий фосфор складається з молекул Р4, а червоний —
зі сполучених між собою атомів.
Білий фосфор, на відміну від червоного, має часниковий запах, дуже отруйний і хімічно активніший. При нагріванні на повітрі до 50 °С він займається, а за звичайних умов окислюється з виділенням енергії у вигляді
світла (тому його зберігають під водою). Кристалічна ґратка — молекулярна. Надзвичайно отруйний! Розчиняється в багатьох органічних розчинниках. У разі зберігання на світлі, за незначного нагрівання без доступу повітря переходить у порошок червоного кольору:
Практично червоний фосфор одержують шляхом тривалого нагрівання білого фосфору до температури 280-340 °С. Це порошок, ρ = 2,3 г/см3, не розчинний у воді. Не леткий, не отруйний. Використовується в сірниковому виробництві. Запалюється під час горіння. Пара червоного фосфору, конденсуючись, перетворюється на білий фосфор.
Чорний фосфор має шарувату структуру й за зовнішнім виглядом схожий на графіт, напівпровідник, а за хімічними властивостями подібний до червоного фосфору. Під тиском 18 тис. атм плавиться за температури близько 400 °С, а під тиском своєї пари переходить у фіолетовий. За тиску понад 111 тис. атм — металева фаза фосфору.
- Алотропні модифікації Карбону
Загальна назва простих речовин Карбону — вуглець. Серед них є речовини атомної будови — алмаз і графіт, а також молекулярна речовина фулерен. Молекула фулерену складається із 60 атомів.
Характеристика основних алотропних модифікацій Карбону
Алмаз, ρ = 3,5 г/см3, найтвердіший з усіх мінералів. Чисті алмази — безбарвні та прозорі. (Розглядаємо модель кристалічної ґратки алмаза)
Утворення природних алмазів відбувалося шляхом кристалізації С у глибинних шарах Землі (200-300 км від поверхні), t° = 3 000 °С, Р = 200 тис. атм., їх родовища пов’язані з рідкісними виходами на поверхню особливої гірської породи — кімберліту. Промислові розробки містять близько 0,5 г алмаза на 1 т породи (Якутія, Південна Африка).
Кожен атом Карбону в алмазі з’єднаний з чотирма іншими ковалентним неполярним зв’язком, причому відстані від його центра до центра інших атомів однакові (1,54 А). Відносно кожного атома Карбону чотири сусідні перебувають у кутах правильного тетраедра. Ґратка алмаза — атомна.
(демонстрація кристалічної ґратки)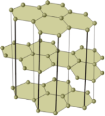
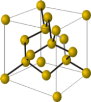
Алмаз крихкий і розколюється від удару. Проводить тепло, але не проводить електричного струму. Не діють на алмаз кислоти й луги. На повітрі горить за температури 900 °С, а за t° ≥ 1 200 °С за відсутності повітря графітується.
Графіт. Сіра, жирна на дотик, з металевим блиском маса, ρ = 2,2 г/см3, м’який, легко дряпається нігтем і після тертя ним об папір залишає сірі смуги. Кристал графіту побудований із плоских сіток атомів Карбону, що розташовуються один над одним. (Розглядаємо модель кристалічної ґратки графіту) Кожен атом Карбону з’єднаний трьома ковалентними зв’язками з трьома іншими атомами (1,42 А — міцний зв’язок). Відстань між шарами — 3,35 А (зв’язок слабший), тому розщеплюється на лусочки в разі механічного впливу (tпл = 4 492 °С за Р = 10 атм). Добре проводить тепло, має близьку до металів електропровідність. Перехід «алмаз ![]() графіт
графіт ![]() алмаз» можна здійснити лише за високих тисків, високих температур і наявності каталізатора.
алмаз» можна здійснити лише за високих тисків, високих температур і наявності каталізатора.
Аморфні модифікації Карбону
Деревне вугілля утворюється в результаті нагрівання деревини без доступу повітря. Рихлий чорний продукт, зберігає структуру деревини.Тваринне вугілля утворюється в результаті обвуглювання тваринних тканин.
Сажа — продукт неповного згоряння органічних сполук.
IV. Підбиття підсумків уроку
1) У чому полягають відмінності між алотропними модифікаціями Оксигену? Карбону?
2) Як пояснити різку відмінність фізичних і хімічних властивостей алотропних модифікацій Оксигену? Карбону?
3) Чим відрізняються алотропні модифікації й аморфні речовини, утворені тим самим хімічним елементом?
4) Одержання штучних алмазів із графіту — це явище фізичне чи хімічне? Чому?
V. Домашнє завдання
Опрацювати матеріал параграфа, відповісти на запитання до нього.
Розв’язати задачу. Обчисліть масову частку Сульфуру в таких сполуках: CuS, Na2SO4, SO2.
! Готуємось до захисту проекту на тему: «Штучні алмази у техніці»


про публікацію авторської розробки
Додати розробку