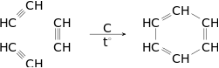Арени. Бензен: молекулярна і структурна формули, фізичні властивості. Хімічні властивості бензену.
Методична розробка уроку
з предмета «Хімія»
Тема програми. Вуглеводні (13 год.)
Тема уроку. Арени. Бензен: молекулярна і структурна формули, фізичні властивості. Хімічні властивості бензену. (1 год.)

|
|
|
Урок №
Дата __________ Час проведення _______
Місце проведення: Група:
Предмет: Хімія
Тема програми. Вуглеводні (13 год.)
Тема уроку. Арени. Бензен: молекулярна і структурна формули, фізичні властивості. Хімічні властивості бензену. (1 год.).
Цілі уроку:
– навчальна – ознайомити учнів з особливостями будови молекули бензену як представника ароматичних вуглеводнів; розглянути фізичні та хімічні властивості бензену; з’ясувати основні методи добування та застосування бензену та його похідних.
– розвивальна – розвивати творчу активність та пізнавальні інтереси учнів; продовжувати формувати вміння порівнювати, узагальнювати, робити висновки, сприяти розвитку інтересу до вивчення хімії;
– виховна – виховувати пізнавальний інтерес, наполегливість у здобутті знань, сприяти формуванню інтересу до вивчення предмету.
Очікуванні результати:
|
учні знають: молекулярну та структурну формулу бензену; особливості будови молекули бензену; фізичні та хімічні властивості бензену; добування та застосування бензену та сполук на його основі; |
учні вміють: характеризувати будову молекули бензену складати схеми рівнянь хімічних реакції бензену як представника ароматичних вуглеводнів – аренів. здійснювати обчислення на знаходження молекулярної формули речовини за відомими масовими частками хімічних елементів та відносною густиною парів. |
Тип уроку: комбінований.
Форми, методи, прийоми: випереджувальне завдання, фронтальне опитування, бліц-опитування, виконання вправ, демонстраційний хімічний експеримент, рефлексія.
Дидактичне та матеріально-технічне забезпечення: портрети М. Фарадея та
Ф.А. Кекуле, мультимедійна презентація, роздатковий матеріал до теми, мультимедійний проектор, колонки, проекційний екран, хімічні реактиви (бензен, розчин калій перманганату), лабораторний посуд (чаша випарювальна, пробірка, штатив), сірники, покривне скло, паперовий екран, лабораторний халат.
Методична мета: продемонструвати методику використання випереджувальних завдань в умовах особистісно-орієнтованого навчання як засобу активізації навчально-пізнавальної діяльності учнівської молоді.
Базові поняття і терміни: арени, ароматичність, кратні карбон-карбонові ковалентні хімічні зв’язки.
Міжпредметні зв’язки: інформатика, математика, фізика, біологія.
Епіграф уроку:
Жодна з наук не потребує експериментів до такої міри як хімія
М. Фарадей
Інформаційні джерела:
Ярошенко О.Г. Хімія: підручник для загальноосвітніх навчальних закладів: (рівень стандарту) 10 кл./ О.В. Ярошенко. – К.: УОВЦ: «Оріон», 2018. – 208 с. іл.
ПЛАН УРОКУ
1. Організаційна частина (1 хв.).
1.1. Перевірка наявності учнів.
1.2. Перевірка готовності учнів до уроку.
2. Актуалізація опорних знань (5 хв.).
Методичний коментар. Актуалізація опорних знань у формі фронтального опитування дає можливість виділити та акцентувати увагу на опорних знаннях, включити учнів в активну навчальну діяльність. Доцільним на даному етапі уроку є виконання письмового завдання.
2.1. Фронтальне опитування
Перелік питань
- Які речовини називають вуглеводнями?
- Що таке алкани? Алкени? Алкіни?
- Яка валентність атома Карбону в органічних сполуках? Чи є винятки?
- Скільки неспарених електронів має атом Карбону в основному та збудженому стані?
Очікувані відповіді
- Вуглеводні – це органічні сполуки, молекули яких складаються з атомів Карбону та Гідрогену).
- Алкани – це насичені вуглеводні, у яких атоми Карбону сполучені між собою простими (одинарними) С–С ковалентними зв’язками. Алкени – це ненасичені вуглеводні, у яких атоми Карбону сполучені між собою подвійними С=С ковалентними зв’язками. Алкіни – це ненасичені вуглеводні, у яких атоми Карбону сполучені між собою потрійними С≡С ковалентними зв’язками.
- В органічних сполуках усі (без винятку) атоми Карбону є чотиривалентні.
- О основному стані атом карбону містить на зовнішньому енергетичному рівні два неспарених електрони, а в збудженому – чотири.
2.2. Розв’язування задачі.
Виведіть формулу речовини, яка містить Карбон масова частка якого складає 92,3%, та Гідроген, масова частка якого становить 7,7%. Відносна густина парів речовини за воднем – 39.
3. Мотивація навчальної діяльності учнів (5 хв.).
Методичний коментар. Метод розповіді дозволяє кожному учневі, незалежно від ступені його готовності до уроку виявляти ініціативу, самостійність і винахідливість у способах роботи. Викладач повідомляє тему уроку, яку учні записують в зошит. Викладач озвучує навчальну мету, акцентуючи увагу на очікуваних результатах
3.1. Розповідь викладача.
3.2. Повідомлення теми уроку, навчальної мети уроку, епіграфу.
|
4. Формування нових знань. (23 хв.). Методичний коментар. Випереджувальні завдання допомагають учням проявити активність, наполегливість, опрацювати інформаційні джерела, виділити найбільш суттєвий матеріал. Демонстрація дослідів сприяє активізації пізнавального інтересу до навчання і показу прикладного характеру знань. Під час виконання демонстраційних хімічних дослідів викладач акцентує увагу на необхідності дотримання правил техніки безпеки при роботі з хімічними реактивами. Після виступів учнів з презентацією, викладач узагальнює інформацію, після чого інші учні групи, користуючись роздатковим матеріалом записують до конспектів основні відомості про бензен. Це дає змогу структурувати та узагальнити навчальний матеріал навчальний матеріал.
– повне окиснення (горіння) (демонстраційний дослід) – реакції приєднання: – взаємодія з воднем; – взаємодія з галогенами; – реакції заміщення: – взаємодія з нітратною кислотою. – окиснення сильними окисниками: – взаємодія з розчином калій перманганату (демонстраційний дослід)
|
|
5. Узагальнення і систематизація знань (6 хв.). Методичний коментар. Учні групи повинні швидко відповісти на запропоновані запитання, що дає змогу викладачеві швидко та оперативно перевірити та закріпити знання учнів отримані на уроці. Самостійне розв’язування задачі сприяє закріпленню отриманих на уроці знань та перевірці рівня засвоювання навчального матеріалу. 5.1. Бліц-опитування. Перелік питань
5.2. Розв’язування задачі. 6. Рефлексія (2 хв.) (інтерактивна вправа «Незакінчене речення») Методичний коментар. У фронтальному порядку учням пропонується відповісти на три запитання. Вправа «Незакінчене речення» дає учням можливість самостійно оцінити рівень зацікавленості на уроці. – на уроці я вивчив … – мене зацікавило … – мені сподобалося… |
7. Підведення підсумків. (1 хв.)
Методичний коментар. Підведення підсумків є логічним завершенням на уроці як для учнів так і для викладача. Важливим моментом є оцінка діяльності на уроці як окремих учнів та і всієї групи, обґрунтувати виставлені оцінки.
7.1. Аналіз діяльності учнів у процесі всього уроку.
7.2. Повідомлення та обґрунтування оцінок.
8. Домашнє завдання (1 хв.)
Методичний коментар. Диференціація домашнього завдання в умовах особистісно-орієнтованого навчання, дає можливість кожному учню в міру своїх можливостей краще підготуватися до уроку, що є мотивацією до навчання учнів різних рівнів навченості.
Завдання для всіх: 1. Прочитати § 8 стор. 58-62., § 9 стор. 62-66.
2. Виконати вправу № 6 стор. 62
Індивідуальне завдання: 1. Підготувати повідомлення: «Застосування ароматичних сполук у сільському господарстві».
ХІД УРОКУ
- Організаційний етап.
1.1. Перевірка наявності учнів.
1.2. Перевірка готовності учнів до уроку.
Пропоную об’єднати наші зусилля та налаштуватися плідну роботу та співпрацю для кращого опанування нового матеріалу.
Я розраховую на вашу активну роботу і сподіваюся, що дух партнерства допоможе нам у цьому.
ІІ. Актуалізація опорних знань.
2.1. Фронтальне опитування
Перелік питань
- Які речовини називають вуглеводнями?
- Що таке алкани? алкени? алкіни?
- Яка валентність атома Карбону в органічних сполуках? Чи є винятки?
- Скільки неспарених електронів має атом Карбону в основному та збудженому стані?
2.2. Розв’язування задачі.
Виведіть формулу речовини, яка містить Карбон масова частка якого складає 92,3%, та Гідроген, масова частка якого становить 7,7%. Відносна густина парів речовини за воднем – 39.
Розв’язування
Дано: 1) Визначаємо відносну молекулярну масу невідомої речовини
w (C) = 92,3,% М (CxHy) = М(H2) • DH2 = 2 • 39 = 78 г/моль
w (H) = 7,7% 2) Визначаємо кількість атомів Карбону:
DH2 = 39 n (E) =![]()
СхНу ‒ ? n (C) =![]() = 6
= 6
3) Визначаємо кількість атомів Гідрогену:
n (Н) =![]() = 6
= 6
Формула невідомої речовини ‒ С6Н6 ‒ бензен.
Перевірка: М (С6Н6) = (12 ![]() ) + (1
) + (1 ![]() ) = 78
) = 78
Відповідь: Істинна формула речовини ‒ С6Н6 ‒ бензкн.
IІІ. Мотивація навчальної діяльності учнів.
Протягом майже 30 років хіміки намагалися розгадати будову сполуки складу С6Н6. Моменти творчого прозріння іноді приходять уві сні. Фрідріх Кекуле під час роботи над підручником (1861) несподівано задрімав. Йому наснилися ланцюжки атомів вуглецю, що переплітаються і згортаються, як змійки. Раптово голова однієї змії схопила свій власний хвіст і утворила замкнуте кільце. Згодом Кекуле висловив (1865) ідею про циклічний будову молекули. У своїй імпровізованій мови на святкуванні 25-ї річниці, присвяченій роботі по циклічної структурі бензолу, він вперше повідомив про своє сновидінні і підсумував: «Давайте вчитися спати, і, можливо, тоді ми дізнаємося правду. Але при цьому давайте остерігатися опубліковувати наші сновидіння, поки вони не будуть перевірені розбудженим розумом».
Отже, тема нашого уроку «Арени. Бензен: молекулярна і структурна формули, фізичні властивості. Хімічні властивості бензену.»
Тому, метою нашого уроку є:
з’ясувати особливості будови молекули бензену.
розглянути фізичні та хімічні властивості бензену, як представника ароматичних вуглеводнів:
з’ясувати способи добування бензену та галузі його застосування.
Епіграфом нашого сьогоднішнього уроку я обрав слова академіка видатного фізико-хіміка М. Фарадея: «Жодна з наук не потребує експериментів до такої міри як хімія».
ІV. Формування нових знань, умінь і навичок.
4.1. Арени. Бензен:
4.1.1. Молекулярна та структурна формули. Будова молекули (виступ викладача)
У структурній формулі бензену, запропонованій німецьким ученим Фрідріхом Августом Кекуле, шість атомів Карбону утворюють правильний шестикутник. Ще одним хімічним зв’язком кожний атом Карбону сполучений з атомом Гідрогену. Усі атоми розташовані в одній площині:

На перший погляд може видатись, що в молекулі бензену між атомами Карбону існують три подвійні і три одинарні ковалентні хімічні зв’язки. Але це не так, тому що бензен не знебарвлює ані бромну воду, ані розчин калій перманганату. Тобто не виявляє властивостей ненасичених вуглеводнів – алкенів чи алкінів. Пояснюється це тим, що в молекулі бензену існує особливий вид хімічного зв’язку – ароматичний зв’язок. Під час його утворення одна р-орбіталь кожного атома Карбону перекривається з такими самими двома р-орбіталями (по одній від кожного сусіднього
атома Карбону). Тому всі зв’язки С – С у бензені однакові й мають довжину 0,140 нм. Ця відстань менша від відстані між атомами Карбону в алканів, але більша, ніж в алкенів. Тому точнішим є запис структурної формули бензену у вигляді правильного шестикутника з колом усередині нього (так зване бензенове кільце):

Формула Фрідріха Кекуле також досить часто використовується, але при цьому зважають, що вона лише умовно передає будову молекули бензену.
4.1.2. Фізичні властивості бензену (виступ учня з повідомленням).
Бензен – безбарвна рідина з характерним запахом, нерозчинна у воді й легша за неї. Він добре розчиняється в різних органічних розчинниках, і сам є розчинником багатьох органічних речовин. Бензен – дуже токсична речовина, вдихання навіть незна
чної кількості парів якої викликає запаморочення й головний біль. За більш високої концентрації бензену в повітрі людина може втратити свідомість. Бензен здатний проникати через шкіру. Так само небезпечні для довкілля викиди підприємств і смог, до складу яких входить бензен. У роботі з бензеном необхідно неухильно дотримуватися правил безпеки, усі досліди проводити під витяжкою, уникати потрапляння на відкриті ділянки шкіри.
4.1.3. Хімічні властивості бензену (виступ викладача)
повне окиснення (горіння) (демонстраційний дослід)
2С6Н6 + 15О2 → 12СО2 + 6Н2О
реакції приєднання:
Бензен вступає також у реакції приєднання, але важче, ніж алкени чи алкіни. У цих реакціях ароматичний зв’язок руйнується, внаслідок чого в молекулі з’являється шість (по одному біля кожного атома Карбону) неспарених електронів. Вони беруть участь в
утворенні шести одинарних ковалентних хімічних зв’язків з атомами реагенту (водню чи галогену). Розглянемо це на прикладах.
– взаємодія з воднем:
Приєднання водню до бензену відбувається за підвищеної температури в присутності каталізаторів:

– взаємодія з галогенами:
Ця реакція відбувається в присутності каталізаторів:

або
![]()
реакції заміщення:
– взаємодія з галогенами:
Як і приєднання водню, ця реакція відбувається за участю всіх атомів Карбону бензенового кільця завдяки розриву ароматичного зв’язку. Для її проведення реагенти опромінюють ультрафіолетом і нагрівають.


або
С6Н6 + 3Сl2 → С6Н6Сl6
– взаємодія з нітратною кислотою:
С6Н6 + НNO3 → С6Н5NO2 + Н2O
окиснення сильними окисниками:
– взаємодія з розчином калій перманганатом (демонстраційний дослід)
С6Н6 + KMnO4 → реакція не відбувається
На сьогодні існує кілька принципово різних способів виробництва бензолу.
Коксування кам'яного вугілля. Цей процес історично був першим та служив основним джерелом бензолу до Другої світової війни. Останнім часом частка бензолу, одержуваного цим способом, становить менше 10 %. Слід додати, що бензол, одержуваний з кам'яновугільної смоли, містить значну кількість тіофену, що робить такий бензол сировиною, непридатним для ряду технологічних процесів.
Каталітичний риформінг бензинових фракцій нафти. Цей процес є основним джерелом бензолу в США. У Західній Європі, Росії та Японії цим способом отримують 40 - 60 % від загальної кількості сполуки. У цьому процесі крім бензолу утворюються толуол та ксилоли. З огляду на те, що толуол утворюється в кількостях, що перевищують попит на нього, його також частково переробляють в: бензол – методом гідродеалкілірування; суміш бензолу та ксилолів – методом диспропорціонування;
Піроліз бензинових та більш важких нафтових фракцій. До 50 % бензолу виробляється цим методом. Поряд з бензолом утворюються толуол та ксилоли. У деяких випадках всю цю фракцію направляють на стадію деалкілування, де і толуол, і ксилоли перетворюються на бензол.
Тримеризація ацетилену.
При пропусканні ацетилену при 600 °C над активованим вугіллям з хорошим виходом утворюється бензен та інші ароматичні вуглеводні (реакція М. Д. Зелінського):
3С2Н2 → С6H6
або
Бензен є важливою сировиною для хімічної промисловості. Великі кількості його йдуть для одержання нітробензену, який за реакцією М. М. Зініна відновлюють в анілін:
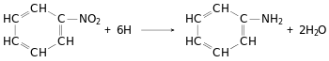
У техніці цю реакцію проводять при дії на бензен хлоридної кислоти в присутності залізних стружок. Залізо, реагуючи з кислотою, утворює водень, який у момент виділення відновлює нітробензен. З аніліну синтезують найрізноманітніші органічні барвники і фармацевтичні препарати. Значні кількості бензену використовують для синтезу фенолу, який йде на виробництво фенолформальдегідних смол. Гексахлороциклогексан, який одержують з бензену (реакція наведена вище), під назвою гексахлоран застосовується в сільському господарстві як один з найефективніших засобів для знищення комах. Крім того, бензен використовують для синтезу багатьох інших органічних сполук і як розчинник.
|
5. Узагальнення і систематизація знань (6 хв.). 5.1. Бліц-опитування. Перелік питань
Який об’єм вуглекислого газу і яка маса води утворяться при спалюванні 50 г бензену, що містить 15% негорючих домішок?
– на уроці я вивчив … – мене зацікавило … – мені сподобалося… |
7. Підведення підсумків. (1 хв.)
7.1. Аналіз діяльності учнів у процесі всього уроку.
7.2. Повідомлення та обґрунтування оцінок.
8. Домашнє завдання (1 хв.)
Завдання для всіх: 1. Прочитати § 8 стор. 58-62., § 9 стор. 62-66.
2. Виконати вправу № 6 стор. 62
Індивідуальне завдання: 1. Прочитати § 9 стор. 62-66.
2. Здійснити перетворення:
СН4 → С2Н2 → С2Н4 → С2Н5ОН
↓
С6Н6Сl6 ← С6Н6 → С6Н5Сl
↓
CO2


про публікацію авторської розробки
Додати розробку