" Білки і нуклеїнові кислоти"
1
Міністерство освіти і науки України
Прилуцький агротехнічний коледж
«ЗАТВЕРДЖУЮ»
Заступник директора з
навчальної роботи
В.ДРОНЬ
Викладач: Н.МУЛЯР
Дата проведення 8жовтня 2019
Група 1 курсу відділення « Монтаж,обслуговування і ремонт систем газопостачання»
Аудиторія 22
ПЛАН
Проведення відкритого заняття
з предмета « Біологія» на тему:
«Білки, нуклеїнові кислоти: огляд будови й біологічної ролі»
«Погоджено»
Завідувач методичним кабінетом
Н.КАЇКА
Розглянуто та схвалено на засіданні
циклової комісії математичної
та природничо-наукової підготовки,
фізичного виховання
Протокол № 1 від 02.10.2019р
Голова циклової комісії
В.ЖИГУН
Прилуки 2019
Тема:Білки, нуклеїнові кислоти: огляд будови й біологічної ролі
Цілі заняття:
Освітня: розширити знання про різноманіття й функції білків і нуклеїнових кислот, встановити зв'язок між будовою молекул і виконуваними ними функціями; з’ясувати значення білків та нуклеїнових кислот для живих організмів;
Розвивальна: розвивати вміння логічно мислити та знаходити зв’язки між особливостями будови та функціями біологічних структур.
Виховна: виховувати розуміння єдності всього живого і бережливе ставлення до природи.
Обладнання і матеріали: ілюстрації білків,нуклеїнових кислот, презентація.
Базові поняття і терміни: амінокислоти, білки, нуклеотиди, ДНК,РНК.
Тип заняття: засвоєння нових знань.
Ключові компетентності: спілкування державною мовою; наукове розуміння природи; уміння аналізувати, формулювати висновки;значення та розуміння фундаментальних принципів біології.
«Наука лише штучно розділена на дисципліни, насправді ж це єдина система знань і бачення світу» М. Реймерс
ХІД ЗАНЯТТЯ
І. ОРГАНІЗАЦІЙНИЙ ЕТАП
ІІ. АКТУАЛІЗАЦІЯ ОПОРНИХ ЗНАНЬ І МОТИВАЦІЯ НАВЧАЛЬНОЇ ДІЯЛЬНОСТІ СТУДЕНТІВ
Питання для бесіди
- Які групи органічних речовин, що містяться в живих організмах ви знаєте?
- Які речовини належать до білків? У чому особливості їхньої будови?
- Які речовини відносяться до нуклеїнових кислот? Як побудовані їхні молекули?
ІІІ. ВИВЧЕННЯ НОВОГО МАТЕРІАЛУ
Розповідь з елементами бесіди

Нобелівську премію 2017 року за дослідження в сфері фізіології і медицини присудили групі науковців зі США – Майклу Янґу, Джеффрі Голлу і Майклу Росбашу за «відкриття молекулярних механізмів, які контролюють добовий ритм. Вчені виділили ген, який контролює нормальний щоденний біологічний ритм. Цей ген кодує білок, який накопичується в клітині протягом ночі, а потім руйнується за день.«Вони змогли проникнути всередину біологічного годинника організму людини і пояснити його роботу», – повідомили в Нобелівському комітеті.
Скільки часу необхідно вченим, щоб досягти такого результату і отримати Нобелівську премію?
Звичайно багато. Але крім часу, необхідні ще й знання. Знання – це наша сила, наш успіх, наш інтелект, наш скарб. Навчаючись ви збагачуєтеся знаннями кожного заняття і сьогоднішнє заняття не є виключенням.
Тож вперед до нових знань.
Сьогодні ми вивчимо і перевіримо ваші знання з теми.
Вміст хімічних сполук у клітині
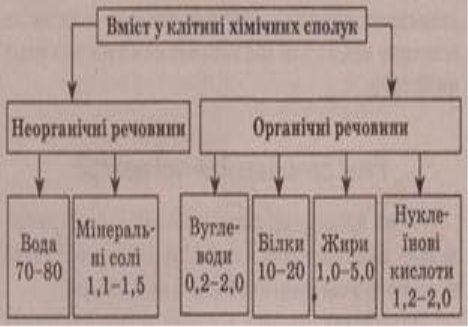
Символом початку життя завжди було яйце. Ось чому білок пташиних яєць дав назву всьому класові білків. Серед усіх речовин органічної природи білки займають особливе місце – вони становлять основу структури живих систем і виконують ряд важливих функцій.
Білкові речовини були відомі людині з давніх- давен. Лише на початку ХІІІст. було встановлено, що речовини, які містяться в соках рослин,екстрактах тваринних тканин, мають однакову природу. Вперше почав вивчати хімію білкових речовин Я.Бекаррі. У 1728 р він виділив із пшеничного борошна білок – клейковину і дослідив властивості. Французький вчений А.Фуркруа дослідив сироватку крові і назвав її компоненти: желатин,альбумін,фібрин. Пізніше, у 1839 році голландський хімік Г.Мульдер назвав білки протеїнами( гр. – перший) . Вміст білків в організмі людини: у м’язах 80%,в шкірі 63%, в печінці 57%,в кістках 28%. До складу тваринних організмів входить 5 млн білків.
Пеніцилін – С16Н18О4N2
Молоко – C1684H3021O576N466S21
Гемоглобін – C3052H4876O872N780S6Fe4
Й.Гете сказав « Щоб освоїти безконечне треба спочатку його роз’єднати, а потім сполучити».
Білки – високомолекулярне органічне з’єднання, побудоване із залишків 20 амінокислот і відіграє значну роль в процесах життєдіяльності організмів . Кожна людина, особливо якщо говорити про жінок, хоч раз чув про колаген і кератин - це протеїни, які відповідають за зовнішній вигляд нігтів, шкіри і волосся.
Амі́нокисло́ти — органічні сполуки, які одночасно містять у своєму складі аміно- (- NH2) та карбоксильну (- СООН) групи. Амінокислоти є мономерними одиницями білків, у складі яких залишки амінокислот з'єднані пептидними зв'язками.
Кожна із двадцяти стандартних, і багато нестандартних, амінокислот мають тривіальні назви. Частина цих назв пов'язана із джерелами, з яких вперше було виділено сполуку: наприклад, аспарагін виділений зі спаржі (лат. Asparagus), глутамін — з глютену пшениці, тирозин — із сиру (сир грецькою tyros). Для скороченого запису протеїногенні амінокислоти позначають трибуквеним кодом, використовуючи перші три літери тривіальної назви (за винятком аспарагіну (Асн), глутаміну (Глн), ізолейцину (Іле) і триптофану (Трп), для останнього використовують також скорочення Три). Інколи також використовують позначення Asx і Glx, що означають «аспарагінова кислота або аспарагін» і «глутамінова кислота або глутамін».
З їжею людина отримує 8 незамінних амінокислот. Незамінні вони тому,що не можуть бути синтезовані організмом людини.
У 1880 р російський вчений О.Данилевський встановив, яким чином сполучаються амінокислоти у білках.
Білкові молекули мають чотири рівні структурної організації:
Первинна ( послідовність амінокислот, з’єднаних між собою поліпептидним зв’язком);
Вторинна ( впорядковане розташування окремих ділянок поліпептидного ланцюга у вигляді спіралей або складок);
Третинна ( скручування молекули вторинної структури у клубок
« глобулу»);
Четвертинна (формується кількома молекулами третинної структури, утворюючи стійкий комплекс).
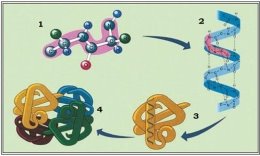
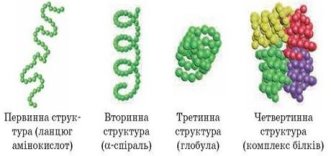
Біологічними функціями білків є:
1. Структурна – білки входять до складу клітинних мембран, а також є основою цитоскелета, міжклітинного матриксу та деяких спеціалізованих тканин ( колаген, кератин,еластин).
2. Каталітична,або ферментативна – усі ферменти за своєю хімічною природою є білками або комплексами білків з низькомолекулярними небілковими сполуками, які прискорюють біохімічні процеси, що відбуваються в живих організмах ( амілази, каталаза, трипсин). Термін «фермент» був запропонований у ХІІ ст. хіміком Яном ван Гельмонтом для опису механізмів травлення. Власне «ферментами» (від лат. fermentum — «закваска») називали «організовані ферменти» (тобто саме живі мікроорганізми), а термін «ензим» (від грец. ἐν- — «в-» і ζύμη — «дріжджі», «закваска»), запропонований 1876 року В. Кюне для «неорганізованих ферментів», що секретуються клітинами, наприклад, до шлунку (пепсин) або кишечника (трипсин, амілаза). Через два роки по смерті Пастера (1897) Едуард Бюхнер опублікував роботу «Спиртове бродіння без дріжджових клітин», в якій експериментально показав, що екстракт клітин дріжджів здійснює спиртове бродіння так само, як і незруйновані дріжджові клітини. 1907 року за цю роботу він був удостоєний Нобелівської премії.
За висловлюванням вченого Ф.Мішера фермент має підходити субстрату як ключ до замка.
Ферменти чутливі до зміни температури. Не діють при температурі більшій 70-80 С.При Т меншій за О ферменти втрачають активність, але не руйнуються. Оптимальна Т дії ферментів – в межах від 35 до 45С. Є термостійкі,наприклад трипсин.
3. Транспортна – білки зв’язують та здійснюють внутрішньоклітинний і міжклітинний транспорт молекул (гемоглобін, альбумін сироватки крові).
Гемоглобін міститься в еритроцитах вищих тварин і людини, і становить 90% їхнього вмісту. У деяких молюсків, ракоподібних – еритроцити відсутні і гемоглобін розчинений у цитоплазмі. У кальмарів, головоногих молюсків транспорт кисню забезпечується мідьвмісним білком – гемоціаніном,що зумовлює голубий колір крові цих тварин.
4. Захисна – виконують функції імунного захисту завдяки здатності зв’язувати бактерії,токсини та віруси, протидіють кровотечі та тромбоутворенню, а також є захисним механічним бар’єром ( тромбін).
5. Скорочувальна – білки беруть участь у скороченні й розслабленні м’язів , роботі серця, легенів, шлунка та інших внутрішніх органів ( актин, міозин).
6. Рецепторна –мембранні рецептори клітин, що відповідають за функції вибіркового впізнання та приєднання окремих речовин, мають білкову природу ( принцип роботи нервової системи).
7 Регуляторна – гормони, медіатори та модулятори ендокринної системи, імунної та нервової систем є білками ( інсулін, соматропін – гормон росту).
8. Запасна та травна – білки є найважливішими компонентами їжі, а також резервними, запасними речовинами ( казеїн молока, яєчний альбумін).
9. Енергетична – при розщепленні 1 гр білків виділяється 17,2 кДЖ енергії.
Приклади білків за виконуваними функціями
1.Рецепторна - адренорецептор повідомляє клітині про приєднання адреналіну.
2.Каталітична – амілаза розщеплює крохмаль до мальтози; каталаза розщеплює гідроген пероксид до води та кисню;
3.Структурна – колаген надає пружності сполучній тканині, кісткам,сухожиллям,хрящам;
4.Скорочувальна – актин та міозин входить до складу міофібрил;
5.Транспортна – гемоглобін переносить кисень у крові хребетних тварин;альбумін сироватки крові транспортує жирні кислоти і ліпіди у крові;
6.Захисна – антитіла ( імуноглобуліни) приєднуються до антигенів, зменшуючи їхню активність.
7.Регуляторна – інсулін та глюкагон регулюють обмін глюкози;
Гормон росту соматропін прискорює ріст організму.
8.Запасна – казеїн – білок молока; яєчний альбумін – білок курячого яйця.
Властивості білків ( студент демонструє дослід)
Розчиність
За здатністю розчинятися білки діляться на розчинні і нерозчинні. До розчинних відноситься білок курячого яйця. Не можуть розчинятися білки вовни, пір'я, нігтів.
Гідроліз
При дії води в присутності кислоти або ферментів білки піддаються гідролізу. В результаті розщеплення білкових молекул водою утворюється суміш амінокислот. Такий процес відбувається в органах травлення при перетравленні білкової їжі. Утворені амінокислоти всмоктуються в кров і використовуються організмом для синтезу власних білків.
Денатурація — руйнування просторової структури білка.
Вона відбувається при нагріванні білків, під дією радіоактивного випромінювання, деяких хімічних речовин (кислот, лугів, солей важких металів). При денатурації білки змінюють свої властивості і втрачають біологічну активність, незважаючи на те, що їх первинна структура зберігається.
Прикладом денатурації служить зміна яєчного білка при нагріванні.
Здебільшого денатурація необоротна. Але якщо на початкових стадіях денатурації припиняється дія чинників, що призвели до неї, білок може відновити свій початковий стан. Це явище називають ренатурацією. У живих організмів оборотна денатурація часто пов'язана з виконанням певних функцій білковими молекулами: забезпеченням рухів, передачею до клітини сигналів з навколишнього середовища, прискоренням біохімічних реакцій тощо. Необоротний процес руйнування первинної структури білків називають деструкцією.
Розклад при нагріванні
При сильному нагріванні білки горять. При цьому утворюються речовини зі своєрідним запахом паленого пір'я. По запаху можна легко відрізнити вовняні або шовкові волокна від синтетичних.
Кольорові реакції
Присутність білка у розчині можна виявити за допомогою якісних реакцій, в результаті яких утворюються забарвлені продукти.
Після демонстрації викладач пропонує студентам зробити перевірку
нового матеріалу використовуючи мультимедійний комплекс ( слайд )

Мойри були трьома сестрами, охоронницями ладу у Всесвіті та в стосунках між людьми. Зображували мойр статечними жінками з кужелем, терезами, ножицями або сувоєм папірусу, на якому записані слова долі. Клото наосліп брала жереб, визначаючи ще до народження людини якою буде її доля. Вона ж подавала пряжу, в якій містилися всі події життя. Лахесіс згідно з жеребом робила нитку гладкою чи грубою, відповідно життя людини ставало щасливим чи нещасливим, людина легко жила свій вік або повсюди зазнавала нещасть. Антропа записувала все життя на сувій і перерізала нитку, в цю мить життя людини обривалося. Навіть боги не могли урятуватися від смерті, якщо це суперечить долі, і сам Зевс мав у мойр свою нитку.Який зміст має розповідь? Які органічні сполуки ми будемо вивчати далі? Так, нуклеїнові кислоти.

Наймолодша в Україні доктор наук, Ольга Броварець ( 1986р.н.) зробила відкриття, якому пророкують Нобелівську премію, обчисливши закономірність за якою відбуваються мутації в ДНК, що призводять до раку і безліч інших хвороб. Це відкриття дає надію на повне одужання від раку і інших хвороб, що викликають мутації.
Нуклеїнові кислоти — складні високомолекулярні біополімери, мономерами яких є нуклеотиди. Вперше їх виявлено в ядрі клітини, звідки й походить назва цих сполук (від лат. nucleus — ядро).
Нуклеїнові кислоти були виділені у 1869 році з ядер лейкоцитів ран людини в результаті досліджень Фрідріха Мішера. Мішер працював у Тюбінгенському університеті та намагався дослідити хімію найпростіших, з його точки зору клітин людського організму. Спочатку він намагався виділяти лейкоцити з лімфатичних вузлів, проте не зміг отримати необхідної для аналізу кількості. Тоді він став збирати матеріал з використаних для бинтування ран пов'язок у сусідній лікарні - й домігся успіху.
![]() Природні нуклеїнові кислоти — ДНК і РНК — виконують у всіх живих організмах роль передачі і експресії генетичної інформації. Цей термін був введений Рихардом Альтманом. Молекула нуклеотиду складається із залишків нітрогеновмісного гетероциклу (азотистої основи), п'ятивуглецевого моносахариду (пентози) і фосфатної кислоти. Розрізняють два типи нуклеїнових кислот: дезоксирибонуклеїнову (ДНК) і рибонуклеїнову (РНК). До складу ДНК входить залишок пентози дезоксирибози, до складу РНК — рибози.
Природні нуклеїнові кислоти — ДНК і РНК — виконують у всіх живих організмах роль передачі і експресії генетичної інформації. Цей термін був введений Рихардом Альтманом. Молекула нуклеотиду складається із залишків нітрогеновмісного гетероциклу (азотистої основи), п'ятивуглецевого моносахариду (пентози) і фосфатної кислоти. Розрізняють два типи нуклеїнових кислот: дезоксирибонуклеїнову (ДНК) і рибонуклеїнову (РНК). До складу ДНК входить залишок пентози дезоксирибози, до складу РНК — рибози.
Нуклеїновим кислотам, як і білкам, притаманна первинна структура — певна послідовність розташування нуклеотидів, а також складніша вторинна і третинна структури, які формуються за допомогою водневих зв'язків, електростатичним та іншим взаємодіям.
Відстань між нуклеотидами в складі полінуклеотиду становить 0,34 нм.
- ДНК — дезоксирибонуклеїнова кислота. Цукор — дезоксирибоза,азотисті основи: пуринові — гуанін (G), аденін (A), піримідинові — тимін (T) і цитозин (C). ДНК часто складається з двох полінуклеотидних ланцюжків, направлених антипаралельно.
- РНК — рибонуклеїнова кислота. Цукор — рибоза, азотисті основи: пуринові — гуанін (G), аденін (A), піримідинові урацил (U) і цитозин (C). Структура полінуклеотидного ланцюжка аналогічна ДНК, дволанцюжкові РНК зустрічаються тільки у вірусів. Через особливість рибози, молекули РНК часто мають різні вторинні і третинні структури, утворюючи дволанцюгові ділянки через комплементарні взаємодії всередині молекули.
Пра́вила Ча́ргаффа — система емпірично встановлених правил, що описують кількісні співвідношення між різними типами азотистих основ у ДНК. Правила були сформульовані в результаті роботи групи біохіміка Ервіна Чаргаффа в 1949—1951 роках.
- Вміст аденіну рівний вмісту тиміну, а вміст гуаніну — кількості цитозину: А=Т, Г=Ц.
- Кількість пуринів дорівнює кількості піримідинів: А+Г=Т+Ц.
Структура подвійної спіралі ДНК була запропонована Френсісом Криком і Джеймсом Уотсоном - 21 лютого 1953 року на підставі рентгеноструктурних даних, отриманих Морісом Вілкінсом і Розалінд Франклін, а також правил Чаргаффа. Пізніше запропонована Уотсоном і Криком модель будови ДНК була доведена, а їх робота відзначена Нобелівською премією з фізіології та медицини 1962 р. Серед лауреатів не було померлої на той час від раку Розалінд Франклін, так як премія посмертно не присуджується.
Висновок
Біологічна роль нуклеїнових кислот надзвичайно важлива. Адже одна з головних їхніх функцій - участь у синтезі білків. У процесі життєдіяльності білки постійно витрачаються і тому вони мають регулярно відтворюватися за участю нуклеїнових кислот. Увесь синтез білкової молекули, що містить сотні амінокислотних залишків, триває в живому організмі близько однієї хвилини.
Дотепер галузь науки, пов'язана з дослідженням нуклеїнових кислот, стрімко розвивається задля забезпечення потреб людства у новітніх матеріалах і технологіях. Варто пам'ятати про етичні проблеми, які виникають під час проведення таких досліджень й використання їхніх результатів.
ІУ. УЗАГАЛЬНЕННЯ,СИСТЕМАТИЗАЦІЯ Й КОНТРОЛЬ ЗНАНЬ І ВМІНЬ СТУДЕНТІВ
1.Порівняйте хімічний склад білків, нуклеїнових кислот та неорганічних речовин.
2.Яку структуру мають білкові молекули?
3.Перелічіть функції білків у живих організмах і обґрунтуйте свою відповідь конкретними прикладами?
4.охарактеризуйте біологічну роль нуклеїнових кислот.
5.Які різновиди нуклеїнових кислот вам відомі?
У. ДОМАШНЄ ЗАВДАННЯ ( Вивчити конспект )
Література
- Барна М.М. Навчальні заняття з біології : можливі варіанти / М. М. Барна, Л. С. Барна, Г. Ф. Яцук. – Тернопіль : Астон, 2005. – 140 с.
- Богданова О.К. Сучасні форми і методи викладання біології в школі / О. К. Богданова. – Х. : Основа, 2003. – 80 с.
- Верзилін М. М. Загальна методика викладання біології : підручник для студентів біол. фак. пед. ін-тів / М. М. Верзилін, В. М. Корсунська; [пер. з рос.]. – К. : Вища школа, 1980. – 352 с.
- Грицай Н.Б. Методика навчання біології : навчальний посібник. – Рівне : РДГУ, 2016. – 272 с.
- Загальна методика навчання біології : навч. посібник / [І. В. Мороз, А. В. Степанюк, О. Д. Гончар та ін.] ; за ред. І. В. Мороза. – К. : Либідь, 2006. – 592 с.

про публікацію авторської розробки
Додати розробку
