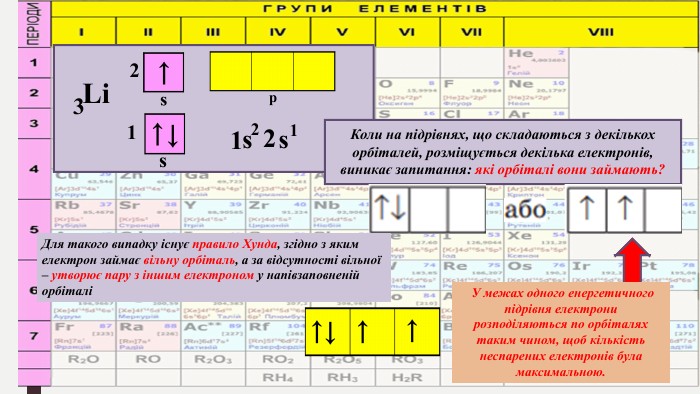
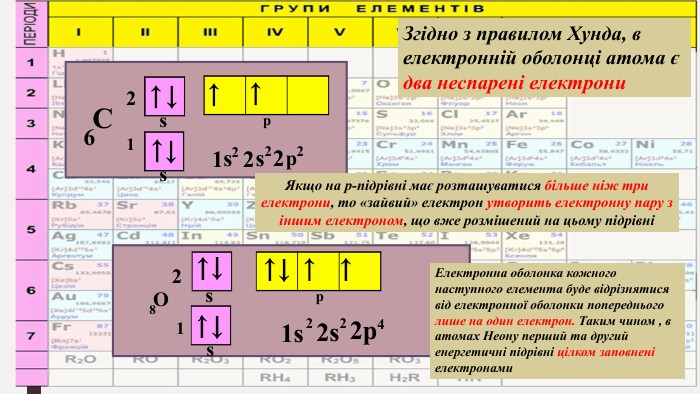
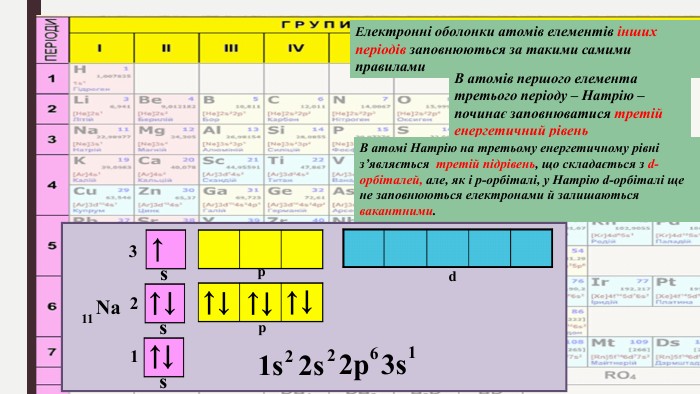
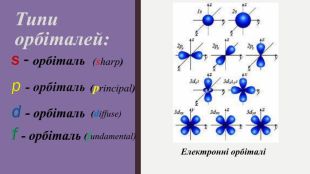
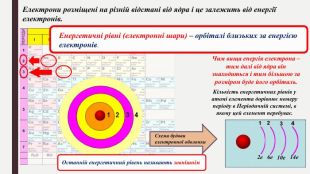
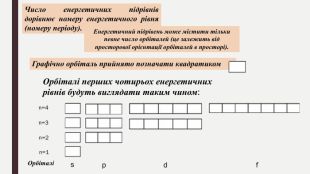
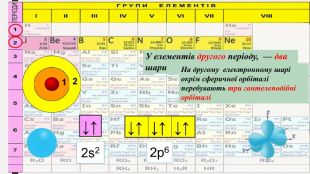
«Будова електронних оболонок атомів хімічних елементів № 1-20. Стан електронів у атомі. Електронні орбіталі»
Про матеріал
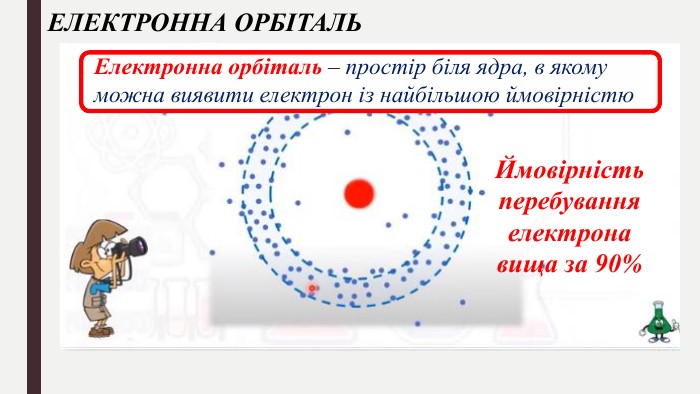
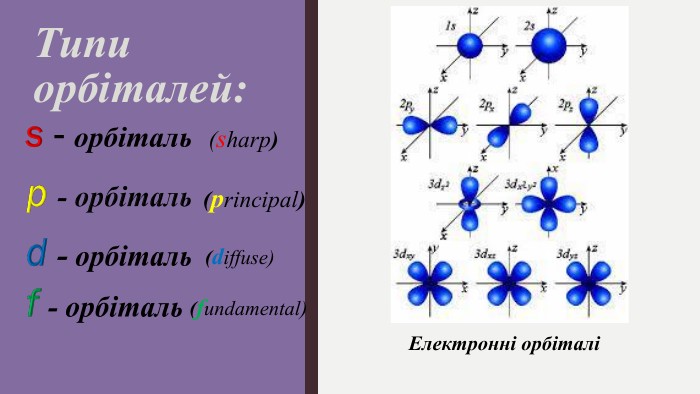
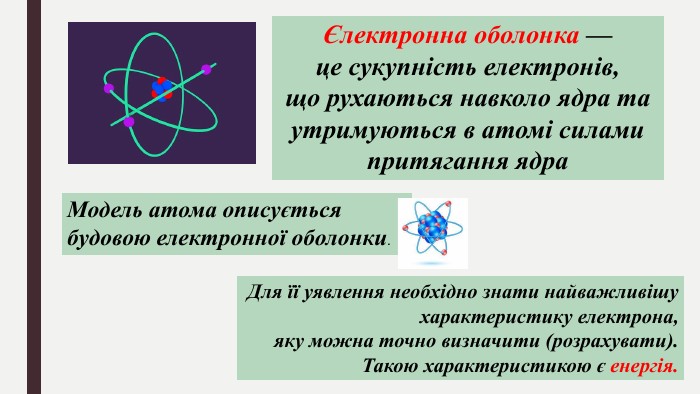
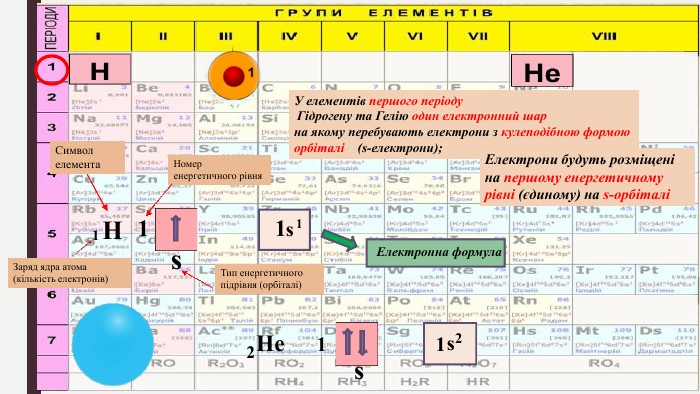
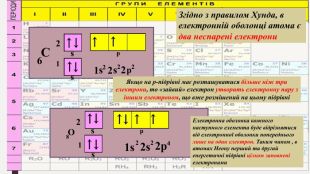
Мета: ознайомити учнів з особливостями електрона як мікрочастинки, розглянути хвильовий характер руху електрона; ввести поняття «орбіталь», «енергетичний рівень», «енергетичний підрівень»; сформувати уявлення про види орбіталей та структуру їх розміщення в атомі; поглибити уявлення про складну будову атома; розвивати творчі здібності учнів; виховувати наполегливість, акуратність, увагу. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
Дякую!


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку