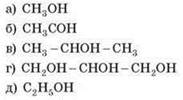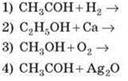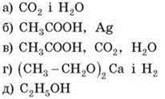Практична робота №3 "Обчислення за хімічними рівняннями кількості речовини, маси, об"єму за кількість речовини, масою, об"ємом реагенту, що містить певну частку домішок
Суміш — система, що складається з кількох компонентів. Компонентами суміші речовин є окремі речовини, до яких ще застосовують терміни основна речовина і домішки.
Практично чистих речовин у природі не існує. Речовини дуже часто містять домішки. Під час розрахунків маси, кількості речовини та об'єму продукту реакції необхідно відкинути кількість домішок у вихідних речовинах та розв'язувати задачі за чистими речовинами
Домішками називають речовини, які відмінні за складом і властивостями від основної речовини, з якою вони входять до складу суміші.
Домішки — своєрідний баласт, що не бере участі в реакції, яка відбувається з основною речовиною
Практична робота № 3
Тема: Обчислення за хімічними рівняннями кількості речовини, маси або об'єму за
кількістюречовини, масою або об'ємом реагенту, що містить певну частку домішок.
Теоретична частина
Практично чистих речовин у природі не існує. Речовини дуже часто містять домішки. Під час розрахунків маси, кількості речовини та об’єму продукту реакції необхідно відкинути кількість домішок у вихідних речовинах та розв’язувати задачі за чистими речовинами. Під час проведення хімічних реакцій у лабораторіях і на виробництві здебільшого використовують речовини, які містять домішки, - так звані технічні продукти або природні матеріали (сировина). Уміст домішок у них може бути різним. Зазвичай передбачають, а іноді прямо вказують в умові задачі, що домішки не взаємодіють із тими реагентами , з якими взаємодіє основна речовина, або під час їх взаємодії не виходять продукти, утворені основними компонентами. Масову ( або об’ємну ) частку основної речовини або домішок указують в умові задачі або її можна визначити за умови задачі.
Суміш — система, що складається з кількох компонентів. Компонентами суміші речовин є окремі речовини, до яких ще застосовують терміни основна речовина і домішки.
Між структурними частинками компонентів суміші відсутні хімічні зв’язки, тому індивідуальні властивості речовин у складі суміші за конкретних умов зберігаються протягом тривалого часу.
Із суміші компоненти можна виділити фізичними методами.
Під основною речовиною суміші розуміють деяку чисту речовину. Чиста речовина не містить інших структурних частинок, окрім тих, з яких вона складається. Проте у природі, техніці, побуті чистих речовин не знайти, бо завжди присутній певний відсоток домішок.
Домішками називають речовини, які відмінні за складом і властивостями від основної речовини, з якою вони входять до складу суміші.
Домішки — своєрідний баласт, що не бере участі в реакції, яка відбувається з основною речовиною. Через це вихід продукту реакції залежить лише від умісту основної речовини. тому, розв’язуючи задачі, за умовами яких реагент містить домішки, виконують математичні дії в такій послідовності:
- за відомою масовою часткою домішок обчислюють їх масу чи об’єм (для газоподібних сумішей);
- обчислену масу чи об’єм домішок віднімають від загальної маси чи об’єму суміші;
- обчислюють кількість речовини, масу або об’єм основної речовини (реагенту).
- після цього здійснюють обчислення за хімічними рівняннями кількості речовини, маси або об’єму продуктів реакції за кількістю речовини, масою або об’ємом основної речовини.
Розрахункові формули
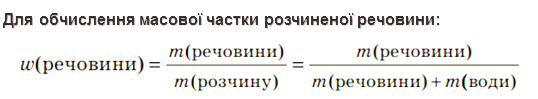


Алгоритм розв'язування задач
1. Записати (дано) скорочену умову задачі.
2. Скласти рівняння реакції, дібрати коефіцієнти.
3. Розрахувати масу домішок або масу чистої речовини.
4. Знайти кількість речовини чистої речовини і підставити в рівняння.
5. Розрахувати за рівнянням реакції кількість речовини тієї речовини, яку потрібно знайти.
6. Розрахувати масу чи об’єм тієї речовини, яку потрібно знайти.
Задача 1. У результаті реакції 13,5 г алюмінію, що містить домішки, з достатньою кількістю етанової кислоти утворилося 13,44 л водню. Обчисліть масову частку домішок у металі
|
Дано: |
|
|
|
||||||||||||||
|
m(Al(техніч.)) = 13,5г |
|
ω(дом) = 100% - ω(чист.реч.) |
|
Vm = 22,4л/моль |
|||||||||||||
|
V(H2) = 13,44л |
|
|
|
М(Al) = 27г/моль |
|||||||||||||
|
|
|
ω(чист.реч.) |
= |
m(чист. реч.) |
|
|
|
||||||||||
|
ω(дом) - ? |
|
m(техніч.реч.) |
|
|
|
||||||||||||
|
|
|
|
|||||||||||||||
|
Розв’язання |
|||||||||||||||||
|
|
|||||||||||||||||
|
хг 13,44л |
|||||||||||||||||
|
|||||||||||||||||
|
2 моль 3 моль |
|||||||||||||||||
|
27г/моль 22,4л/моль |
|||||||||||||||||
|
54г 67,2л |
|||||||||||||||||
|
|
|||||||||||||||||
|
|
хг |
= |
13,44л |
|
|||||||||||||
|
|
54г |
67,2л |
|
||||||||||||||
|
|
|||||||||||||||||
|
|
m(Al чист.) |
= |
54 •13,44 |
|
|||||||||||||
|
|
67,2 |
|
|||||||||||||||
|
|
|||||||||||||||||
|
m(Al чист.) = 10,8г |
|||||||||||||||||
|
|
|||||||||||||||||
|
|
ω(Al чист.) |
= |
10,8г |
|
|||||||||||||
|
|
13,5г |
|
|||||||||||||||
|
|
|||||||||||||||||
|
ω(Al чист.) = 0,8 або 80% |
|||||||||||||||||
|
|
|||||||||||||||||
|
|||||||||||||||||
|
|
|||||||||||||||||
|
Відповідь: масова частка домішок в технічному алюмінію 20% |
|||||||||||||||||
Задача 2. Який об’єм водню утвориться (н. у.) під час взаємодії 23,5 г технічного фенолу, який містить 20 % домішок, з достатньою кількістю натрію?
|
Дано: |
|
|
|
|||||
|
m(С6Н5ОН(техніч.)) = 23,5г |
ω(чист.реч.) = 100% - ω(дом) |
|
М(С6Н5ОН) = 94г/моль |
|||||
|
ω(дом) = 20% |
|
|
Vm = 22,4л/моль |
|||||
|
|
m (чист.реч.) = m (тех.реч.) • ω(чист.реч.) |
|
|
|||||
|
V(H2) -? |
|
|
|
|||||
|
|
||||||||
|
|
||||||||
|
Розв’язання |
||||||||
|
|
||||||||
|
||||||||
|
|
||||||||
|
||||||||
|
|
||||||||
|
18,8г хл |
||||||||
|
||||||||
|
2 моль 1 моль |
||||||||
|
94г/моль 22,4л/моль |
||||||||
|
188г 22,4л |
||||||||
|
|
||||||||
|
|
V(H2) |
= |
18,8 • 22,4 |
|
||||
|
|
188 |
|
||||||
|
|
||||||||
|
V(H2) = 2,24 л |
||||||||
|
|
||||||||
|
Відповідь: об’єм водню який утворився під час взаємодії 2,24л |
||||||||
Задача 3. Яку масу натрію з масовою часткою домішок 20 % потрібно взяти, щоб під час його взаємодії з етанолом виділилося 4,48 л водню?
|
Дано: |
|
|
|||||||||||||
|
ω(дом) = 20% |
|
ω(чист.реч.) = 100% - ω(дом) |
|
Vm = 22,4л/моль |
|||||||||||
|
V(H2) = 4,48л |
|
|
|
М(Na) = 23г/моль |
|||||||||||
|
|
|
m (тех.реч.) |
= |
m (чист.реч.) |
|
|
|
||||||||
|
m(Na (техніч.)) - ? |
|
ω(чист.реч.) |
|
|
|
||||||||||
|
|
|
|
|||||||||||||
|
|
|||||||||||||||
|
Розв’язання |
|||||||||||||||
|
|
|||||||||||||||
|
|||||||||||||||
|
|
|||||||||||||||
|
хг 4,48л |
|||||||||||||||
|
|||||||||||||||
|
2 моль 1 моль |
|||||||||||||||
|
23г/моль 22,4л/моль |
|||||||||||||||
|
46г 22,4л |
|||||||||||||||
|
|
|||||||||||||||
|
m(Na (чист.)) |
= |
46 • 4,48 |
|
||||||||||||
|
22,4 |
|
||||||||||||||
|
|
|||||||||||||||
|
m(Na (чист.)) = 9,2г |
|||||||||||||||
|
|
|||||||||||||||
|
m(Na (техніч.)) |
= |
9,2 |
= |
11,5г |
|
||||||||||
|
0,8 |
|
||||||||||||||
|
|
|||||||||||||||
|
|
|||||||||||||||
|
Відповідь: маса технічного натрію 11,5г |
|||||||||||||||
Задача 4. Спалили метан об’ємом 52,7л з масовою часткою домішок 15%. Який об’єм повітря витратився? Який об’єм карбон (IV) оксиду утворився?
Завдання вхідного контролю
1. Естери вищих карбонових кислот і гліцеролу — це:
а) вуглеводи; б) білки; в) жири; г) мило.
2. До складу рідких жирів входять залишки:
а) нижчих насичених карбонових кислот;
б) вищих насичених карбонових кислот;
в) нижчих ненасичених карбонових кислот;
г) вищих ненасичених карбонових кислот.
3. Спільна властивість жирів та естерів — це реакція:
а) гідрування; б) гідролізу в) приєднання; г) заміщення.
4. До рослинних жирів належить:
а) яловичий; б) свинячий; в) оливкова; г) баранячий.
5. Вкажіть формулу вищих жирних кислот:
а) C6H13COOH; б) C12H25COOH; в) C17H35COOH; г) C15H31COOH.
6. Вкажіть речовину, яка дає реакцію омилення жирів:
а) C2H5OH; б) KOH; в) C6H12O6; г) C17H35COOH.
7. Вкажіть реакцію, яка лежить в основі виробництва маргарину:
а) гідроліз; б) етерифікація; в) гідрування; г) обміну.
8. Вкажіть формулу рідкого мила:
а) С17Н35СООН; б) C17H35COOK; в) C15H31COONa; г) C2H5OH.
9. До фізичних властивостей жирів належить:
а) розчинні у воді; б) легші за воду;в) розчинні в органічних розчинниках; г) гази.
10. Вкажіть речовину, з якою реагують і гліцерол, і оцтова кислота:
а) CuO; б) CuSO4; в) KOH; г) CO2.
11. Вкажіть функціональну групу спиртів:
а) -COH; б) -COOH; в) -OH; г) -NH2.
12. Вкажіть метал, який заміщує Гідроген у гідроксогрупі кислот:
а) Cu; б) Ag; в) Na; г) Pb.
13. Вкажіть формулу етанової кислоти:
а) C2H5OH; б) CH3OH; в) CH3COOH; г) C3H7OH.
14. Вкажіть формулу пальмітинової кислоти:
а) C2H5OH; б) C17H35COOH; в) CH3COOH; г) C15H31COOH.
15. Вкажіть як називається реакція між спиртами і карбоновими кислотами:
а) нейтралізації; б) обміну; в) заміщення; г) етерифікації.
16) Закінчіть рівняння реакцій:
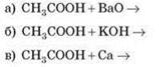
17) Закінчіть рівняння реакцій:
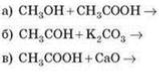
18. Вкажіть загальну формулу одноатомних насичених спиртів:
а) CnH2n-1OH; б) CnH2n+1OH; в) CnH2nO; г) CnH2nO2.
19. Вкажіть суфікс, за допомогою якого утворюється назва спирту:
а) -ол-; б) -ен-; в) -он-; г) -аль-.
20. Вкажіть формулу етилового спирту:
а) CH3 - OH; б) C2H5 - OH; в) C2H5 - COOH; г) C3H7 - OH.
21. Вкажіть речовину, за допомогою якої можна розпізнати гліцерол:
а) свіжовиготовлений купрум(ІІ) гідроксид;
б) амоніаковий розчин Ag2O;
в) натрій гідроксид;
г) ферум(ІІІ) хлорид.
22. Вкажіть правильне твердження: Ал ьдегіди можна розпізнати за допомогою:
а) свіжовиготовленого розчину купрум(ІІ) гідроксиду;
б) амоніакового розчину Ag2O;
в) натрій гідроксиду;
г) ферум(ІІІ) хлориду.
23. Вкажіть речовину, яка реагує і зі спиртами, і з фенолами:
а) калій гідроксид; б) арґентум(І) оксид; в) натрій; г) фенолфталеїн.
24. Вкажіть формулу етаналю:
а) CH3- COH; б) CH3- OH; в) CH3 - COOH; г) C3H7 - OH.
25. Вкажіть, до яких спиртів належить гліцерол:
а) одноатомні; б) двохатомні; в) ароматичні; г) трьохатомні.
26. Встановіть відповідність між назвою речовини і формулою.
|
Назва |
Формула |
|
1) Оцтовий альдегід 2) Метанол 3) Етанол 4) Гліцерол |
|
27. Встановіть відповідність.
|
Реагенти |
Продукти реакції |
|
|
|
28. Встановіть послідовність збільшення відносних молекулярних мас речовин:
а) гліцерол; б) етаналь; в) фенол; г) метанол.
ХІД РОБОТИ
ВАРІАНТ 1
- Яка маса солі утвориться під час взаємодії 4,8 г магнію, який містить 15% домішок з оцтовою кислотою?
- Який об’єм вуглекислого газу утвориться при спалюванні природного газу масою 40 г, що містить 98% метану?
- Яка маса оцтової кислоти витрачається на синтез 20 г етилового естеру оцтової кислоти
(етилетаноату), якщо масова частка домішок в кислоті 15%.
ВАРІАНТ 2
- Який об’єм водню (н. у.) утвориться під час взаємодії 18,4 г натрію, якій містить 20% домішок з етановою кислотою?
- Який об’єм кисню необхідний на спалювання природного газу об’ємом 20 л, що містить 97,55% метану?
- Обчисліть масу етанолу, необхідну для добування етилового естеру оцтової кислоти (етилетаноату) масою 35,2 г, якщо масова частка домішок в спирті 20%.
ВАРІАНТ 3
- Яка маса алкоголята натрію утвориться під час взаємодії 25,5 г натрію, який містить 10% домішок з етанолом?
- Який об’єм вуглекислого газу утвориться при спалюванні природного газу об’ємом 25 л, що містить 96,54% метану?
- Яка маса оцтової кислоти витрачається на синтез 25,5 г етилового естеру оцтової кислоти
(етилетаноату), якщо масова частка домішок в кислоті 10%.
ВАРІАНТ 4
- Який об’єм водню (н. у.) утвориться під час взаємодії 10,5 г натрію, якій містить 20% домішок з етанолом?
- Який об’єм кисню необхідний на спалювання природного газу масою 35 г, що містить 98,25% метану?
- Обчисліть масу етанолу, необхідну для добування етилового естеру оцтової кислоти (етилетаноату) масою 17,5 г, якщо масова частка домішок в спирті 12,5%.
Практична робота № 3
Обчислення за хімічними рівняннями кількості речовини, маси або об'єму за кількістю речовини, масою або об'ємом реагенту, що містить певну частку домішок
ВАРІАНТ 1
- Яка маса солі утвориться під час взаємодії 4,8 г магнію, який містить 15% домішок з оцтовою кислотою?
- Який об’єм вуглекислого газу утвориться при спалюванні природного газу масою 40 г, що містить 98% метану?
- Яка маса оцтової кислоти витрачається на синтез 20 г етилового естеру оцтової кислоти
(етилетаноату), якщо масова частка домішок в кислоті 15%.
Практична робота № 3
Обчислення за хімічними рівняннями кількості речовини, маси або об'єму за кількістю речовини, масою або об'ємом реагенту, що містить певну частку домішок
ВАРІАНТ 2
- Який об’єм водню (н. у.) утвориться під час взаємодії 18,4 г натрію, якій містить 20% домішок з етановою кислотою?
- Який об’єм кисню необхідний на спалювання природного газу об’ємом 20 л, що містить 97,55% метану?
- Обчисліть масу етанолу, необхідну для добування етилового естеру оцтової кислоти (етилетаноату) масою 35,2 г, якщо масова частка домішок в спирті 20%.
Практична робота № 3
Обчислення за хімічними рівняннями кількості речовини, маси або об'єму за кількістю речовини, масою або об'ємом реагенту, що містить певну частку домішок
ВАРІАНТ 3
- Яка маса алкоголята натрію утвориться під час взаємодії 25,5 г натрію, який містить 10% домішок з етанолом?
- Який об’єм вуглекислого газу утвориться при спалюванні природного газу об’ємом 25 л, що містить 96,54% метану?
- Яка маса оцтової кислоти витрачається на синтез 25,5 г етилового естеру оцтової кислоти
(етилетаноату), якщо масова частка домішок в кислоті 10%.
Практична робота № 3
Обчислення за хімічними рівняннями кількості речовини, маси або об'єму за кількістю речовини, масою або об'ємом реагенту, що містить певну частку домішок
ВАРІАНТ 4
- Який об’єм водню (н. у.) утвориться під час взаємодії 10,5 г натрію, якій містить 20% домішок з етанолом?
- Який об’єм кисню необхідний на спалювання природного газу масою 35 г, що містить 98,25% метану?
- Обчисліть масу етанолу, необхідну для добування етилового естеру оцтової кислоти (етилетаноату) масою 17,5 г, якщо масова частка домішок в спирті 12,5%.


про публікацію авторської розробки
Додати розробку