Презентація на тему "Спирти"
Презентація розроблена для вищої школи. Матеріал базується на підручнику "Органічна хімія" Ластухін Ю.О та Воронов С.А.





















![Гліцерол. Гліцери́н (гліцеро́л) — триатомний спирт. Це означає, що в молекулі цього спирту три гідроксильні групи приєднані до трьох атомів вуглецю. Хімічна формула — C3 H8 O3, або C3 H5(OH)3. Гліцерин відкрив у 1783 році шведський хімік Карл Вільгельм Шеєле, який показав, що фрагменти цієї сполуки складають основу всіх природних жирів, і назвав його «солодкою речовиною із жиру», позаяк продукт має солодкий смак. Шеєлє кип'ятив оливкову олію з окисом свинцю (свинцевий гліт).[3] Визначити точний склад і будову цих фрагментів Вільгельм Шеєле не зміг — органічна хімія лише починала розвиватися. У 1813 (1823) році французький хімік Мішель Ежен Шеврель встановив, що під дією води (каталізатори: кислота і луг) відбувається розщеплення жирів з утворенням гліцерину і вищих карбонових кислот. Він уперше дав назву «гліцерин» одному з продуктів, який утворюється в даному процесі («гліцерос» — солодкий). Французові Т. Петлузові в 1836 році вдалося встановити елементний склад цього тріолу. Синтез гліцерину вперше провів у 1873 році французький хімік і мінеролог Ш. Фрідель. Гліцерол. Гліцери́н (гліцеро́л) — триатомний спирт. Це означає, що в молекулі цього спирту три гідроксильні групи приєднані до трьох атомів вуглецю. Хімічна формула — C3 H8 O3, або C3 H5(OH)3. Гліцерин відкрив у 1783 році шведський хімік Карл Вільгельм Шеєле, який показав, що фрагменти цієї сполуки складають основу всіх природних жирів, і назвав його «солодкою речовиною із жиру», позаяк продукт має солодкий смак. Шеєлє кип'ятив оливкову олію з окисом свинцю (свинцевий гліт).[3] Визначити точний склад і будову цих фрагментів Вільгельм Шеєле не зміг — органічна хімія лише починала розвиватися. У 1813 (1823) році французький хімік Мішель Ежен Шеврель встановив, що під дією води (каталізатори: кислота і луг) відбувається розщеплення жирів з утворенням гліцерину і вищих карбонових кислот. Він уперше дав назву «гліцерин» одному з продуктів, який утворюється в даному процесі («гліцерос» — солодкий). Французові Т. Петлузові в 1836 році вдалося встановити елементний склад цього тріолу. Синтез гліцерину вперше провів у 1873 році французький хімік і мінеролог Ш. Фрідель.](/uploads/files/2261867/339196/391804_images/26.jpg)








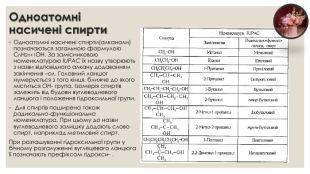
Спирти – це похідні вуглеводнів, у молекулах яких один або декілька атомів водню заміщені гідроксильною групою –ОН. Кількість гідроксильних груп визначає атомність спиртів. Одноатомні спирти містять у молекулі одну гідроксильну групу, наприклад CH3-OH, двоатомні-дві, наприклад CH2-OH-CHOH-CH2 OH тощо. Наявність або відсутність ненасичених зв’язків визначає поділ аліфатичних спиртів на насичені і ненасичені.
Одноатомні насичені спирти. Одноатомні насичені спирти(алканоли) позначаються загальною формулою Cn. H2n+1 OH. За замісниковою номенклатурою IUPAC їх назву утворюють з назви відповідного алкану додаванням закінчення –ол. Головний ланцюг нумерується з того кінця, ближче до якого міститься ОН- група. Ізомерія спиртів залежить від будови вуглеводневого ланцюга і положення гідроксильної групи. Для спиртів поширена також радикально-функціональна номенклатура. При цьому до назви вуглеводневого залишку додають слово спирт, наприклад метиловий спирт. При розташуванні гідроксильної групи у бічному розгалуженні вуглецевого ланцюга її позначають префіксом гідрокси- .
Ненасичені одноатомні спирти. Ненасиченими називаються такі спирти, в яких гідроксильна група сполучена з ненасиченим вуглеводневим залишком. До цих спиртів відносяться всі сполуки, в молекулах яких існує подвійний або потрійний зв’язок, а такаж їх комбінування. Назви спиртів даного типу за замісниковою номенклатурою IUPAC складають з назви вуглеводневої частини і закінчення –ол. Для одержання одноатомних ненасичених спиртів застосовують ті самі методи, що і для насичених, додаючи метод добування з ацетилену. За хімічними властивостями вони нагадують як спирти, так і ненасичені вуглеводні
трет-Бутиловий спирттрет-Бутанол (трет-бутиловий спирт) — найпростіший третинний спирт. Його хімічна формула (CH3)3 COH (інколи записується t-Bu. OH). трет-Бутил є одним з чотирьох ізомерних бутанолів. Це — безбарвна рідина з камфороподібним запахом, що замерзає при температурі, близькій до кімнатної. Вона змішується з водою, етанолом та більшістю органічних розчинниках в будь-яких співвідношеннях. Зображення кристалічної структури
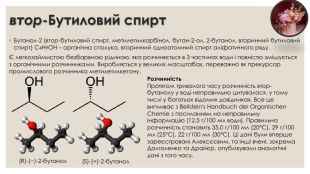
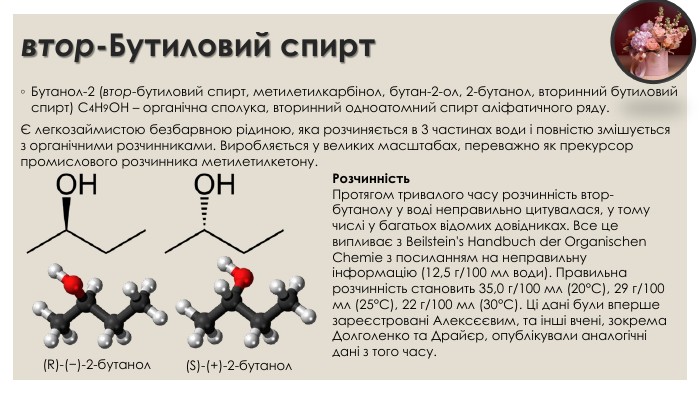
втор-Бутиловий спирт. Бутанол-2 (втор-бутиловий спирт, метилетилкарбінол, бутан-2-ол, 2-бутанол, вторинний бутиловий спирт) C4 H9 OH – органічна сполука, вторинний одноатомний спирт аліфатичного ряду.Є легкозаймистою безбарвною рідиною, яка розчиняється в 3 частинах води і повністю змішується з органічними розчинниками. Виробляється у великих масштабах, переважно як прекурсор промислового розчинника метилетилкетону.(R)-(−)-2-бутанол(S)-(+)-2-бутанол. Розчинність. Протягом тривалого часу розчинність втор-бутанолу у воді неправильно цитувалася, у тому числі у багатьох відомих довідниках. Все це випливає з Beilstein's Handbuch der Organischen Chemie з посиланням на неправильну інформацію (12,5 г/100 мл води). Правильна розчинність становить 35,0 г/100 мл (20°С), 29 г/100 мл (25°С), 22 г/100 мл (30°С). Ці дані були вперше зареєстровані Алексєєвим, та інші вчені, зокрема Долголенко та Драйєр, опублікували аналогічні дані з того часу.
Хімічні властивостіРеакція з розщепленням О-Н зв’язку. Кислотно-основні реакції. Для спиртів характерна іонізація О-Н зв’язку з утворенням протона внаслідок його полярності: Однак кислотність спиртів нижча, ніж води, і в ряду наведених сполук зменшується: Алкоголяти(алканоляти), що при цьому утворюються, легко гідролізуються, оскільки вода є сильнішою кислотою, ніж спирти, за винятком метанолу. Тому добути алкоголяти при взаємодії спиртів навіть з концентрованими водними розчинами лугів . Кислотні властивості спиртів залежать від положення ОН- групи і зменшується в ряду: первинні > вторинні > третинні. Це пояснюється проявленням +І- ефекту алкільних груп, унаслідок якого збільшується електронна густина на атомі кисню. Надлишок електронної густини знижує стійкість аніона
Реакція з розщепленням С-О- зв’язку. Заміщення гідроксильної групи галогеном. Заміщення ОН- групи може відбуватися при дії на спирти як газоподібних галогеноводнів або їх водних розчинів, так і галогенангідридів неорганічних кислот PCI5, PBr3, SOCI2 тощо. При взаємодії спиртів з ННаІ утворюються галогеноалкани, за здатністю взаємодіяти із спиртами вони розташовуються в ряді HI > HBr > HCI.
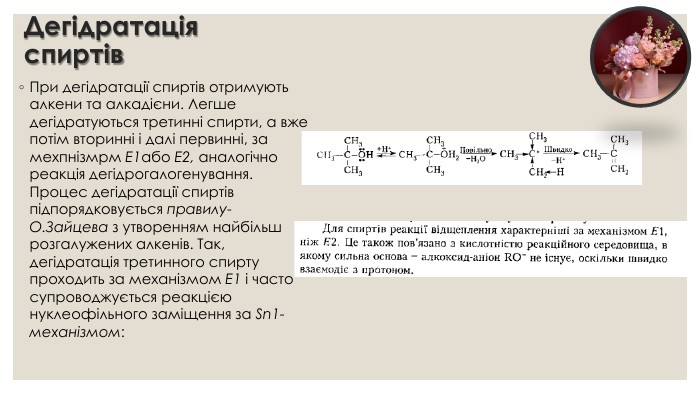
Дегідратація спиртів. При дегідратації спиртів отримують алкени та алкадієни. Легше дегідратуються третинні спирти, а вже потім вторинні і далі первинні, за мехпнізмрм E1або E2, аналогічно реакція дегідрогалогенування. Процес дегідратації спиртів підпорядковується правилу- О. Зайцева з утворенням найбільш розгалужених алкенів. Так, дегідратація третинного спирту проходить за механізмом E1 і часто супроводжується реакцією нуклеофільного заміщення за Sn1- механізмом:
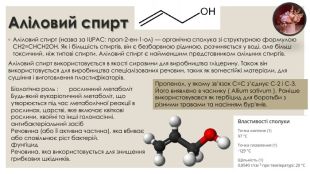
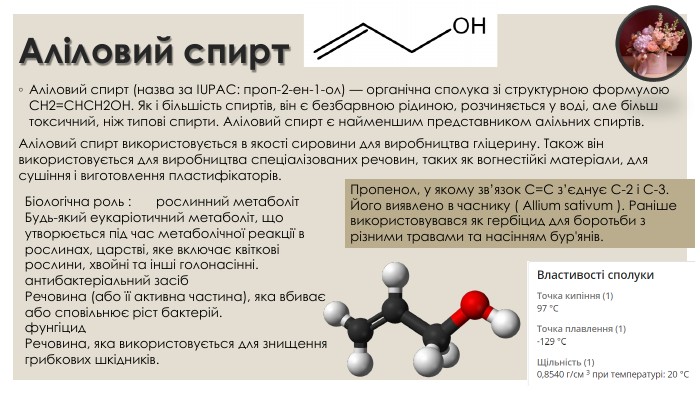
Аліловий спирт. Аліловий спирт (назва за IUPAC: проп-2-ен-1-ол) — органічна сполука зі структурною формулою CH2=CHCH2 OH. Як і більшість спиртів, він є безбарвною рідиною, розчиняється у воді, але більш токсичний, ніж типові спирти. Аліловий спирт є найменшим представником алільних спиртів. Аліловий спирт використовується в якості сировини для виробництва гліцерину. Також він використовується для виробництва спеціалізованих речовин, таких як вогнестійкі матеріали, для сушіння і виготовлення пластифікаторів. Пропенол, у якому зв’язок C=C з’єднує C-2 і C-3. Його виявлено в часнику ( Allium sativum ). Раніше використовувався як гербіцид для боротьби з різними травами та насінням бур'янів. Біологічна роль : рослинний метаболіт. Будь-який еукаріотичний метаболіт, що утворюється під час метаболічної реакції в рослинах, царстві, яке включає квіткові рослини, хвойні та інші голонасінні.антибактеріальний засіб. Речовина (або її активна частина), яка вбиває або сповільнює ріст бактерій.фунгіцид. Речовина, яка використовується для знищення грибкових шкідників.
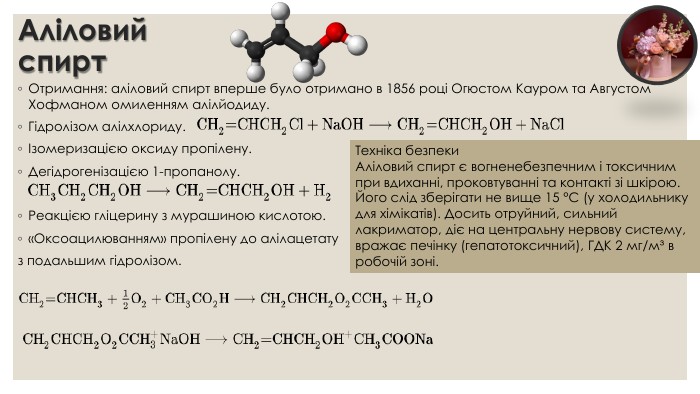
Аліловий спирт. Отримання: аліловий спирт вперше було отримано в 1856 році Огюстом Кауром та Августом Хофманом омиленням алілйодиду. Гідролізом алілхлориду.Ізомеризацією оксиду пропілену. Дегідрогенізацією 1-пропанолу. Реакцією гліцерину з мурашиною кислотою.«Оксоацилюванням» пропілену до алілацетатуз подальшим гідролізом. Техніка безпеки. Аліловий спирт є вогненебезпечним і токсичним при вдиханні, проковтуванні та контакті зі шкірою. Його слід зберігати не вище 15 °C (у холодильнику для хімікатів). Досить отруйний, сильний лакриматор, діє на центральну нервову систему, вражає печінку (гепатотоксичний), ГДК 2 мг/м³ в робочій зоні.
Аліловий спирт. Аліловий спирт виглядає як прозора безбарвна рідина з гірчичним запахом. Температура спалаху 70 °F. Дуже токсичний при вдиханні та проковтуванні. Менш густий, ніж вода (7,1 фунт/гал). Пари важчі за повітря. Тривалий вплив низьких концентрацій або короткий вплив високих концентрацій може мати негативний вплив на здоров'я через вдихання. Нескінченно розчинний у воді при 20 °CЗмішується зі спиртом, хлороформом , ефіром, петролейним ефіром. При зберіганні протягом декількох років аліловий спирт полімеризується і утворюється густий сироп (інсоль у воді , золь в хлороформі ), який при обробці ефіром дає крихку резиноїдну масу. Стійкий в ультрафіолетіЕнергія розкладання (в діапазоні 360-500 °C) вимірюється як 0,69 к. Дж/г. При нагріванні до розкладання він виділяє їдкий дим і пари. Константи дисоціації - p. Ka = 15,5 при 25 °CАгрохімічна категорія - гербіцид
Аліловий спирт Одна пероральна інтубація 120 мг/кг аллілового спирту самцям щурів Long-Evans призвела до концентрації в крові від 9 до 15 мкг/мл через 15-120 хвилин після впливу. Пікові концентрації в крові досягалися через 30-60 хвилин. Після внутрішньовенної ін’єкції 30 мг/кг маси тіла щурам вихідний алкоголь швидко виводився з кровообігу, так що протягом 60 хвилин його більше не можна було виявити в крові. Було зроблено висновок, що метаболізм аллілового спирту у щурів був набагато повільнішим, ніж метаболізм етанолу . Алліловий спирт, мабуть, легко окислюється, оскільки протягом кількох хвилин після внутрішньовенної ін'єкції щурам у дозі 30 мг/кг середня концентрація в крові порожнистої вени становила близько 24 мкг/мл; протягом 15 хвилин концентрація становила приблизно 4 мкг/мл, і протягом 1 години алкоголь майже зник з крові. Під час постійної внутрішньовенної інфузії алліловий спирт зникав зі швидкістю приблизно 23 мг/год. Протягом 15-120 хвилин після введення одноразової пероральної дози алілового спирту (120 мг/кг) щурам середня концентрація цього спирту в ворітній вені становила від 9 до 15 мкг/мл. Дихання восьми чоловіків-добровольців було проаналізовано, щоб визначити рівні слідів органічних сполук у вдихуваному повітрі. 2-Пропен-1-ол був виявлений у 0,52 і 9,5 мкг/год у видихуваному повітрі в одного суб’єкта, який був курцем, і в одного суб’єкта, який не курив, відповідно. 2-пропен-1-ол не було виявлено в диханні інших 6 суб'єктів. 2-Пропен-1-ол був класифікований як хімічна речовина, яка, як вважають, є результатом або пов’язана з нормальним метаболізмом людини. Фармакологія та біохімія
Аліловий спирт. Аліловий спирт метаболізується алкогольдегідрогеназою до акролеїну ; він також перетворюється на малоновий діальдегід . ... Характерному перипортальному некрозу печінки, спричиненому впливом алілового спирту, передує швидке виснаження внутрішньоклітинного глутатіону . Це виснаження глутатіону є передумовою для виникнення токсичності, спричиненої алліловим спиртом, про що свідчить введення N-ацетилцистеїну та інших метаболічних попередників глутатіону , що містять сірку , які запобігають гепатотоксичності, спричиненій алліловим спиртом і акролеїном , у культивованих клітинах і в інтактних тваринах. Швидкість метаболізму алілового спирту в перипортальному та перицентральному регіонах часточки печінки вимірювали, щоб визначити, чи є зональна токсичність алілового спирту результатом його селективного метаболізму в перипортальному регіоні. Вливання алілового спирту в перфузовану печінку щурів, які отримували фенобарбітал , викликало збільшення флуоресценції нікотинамідаденіндинуклеотиду ( NADH ) (366 призводить до 450 нм), виміряної за допомогою світловода з великим наконечником (2 мм), розміщеного на поверхні печінки. Лінійне збільшення флуоресценції NADH спостерігалося при введенні 25-150 мк. М аллілового спирту; однак, коли алліловий спирт перевищує 200 мк. М, кисеньпоглинання печінкою було пригнічено на 30-40%, і відбулося значне збільшення флуоресценції NADH . / 4-Метилпіразол (80 мкмоль), інгібітор алкогольдегідрогенази, запобігав збільшенню флуоресценції через алліловий спирт в обох областях, вказуючи на те, що зміни були повністю зумовлені НАДН , утвореним залежним від алкогольдегідрогенази метаболізмом алілового спирту. Метаболізм/Метаболіти
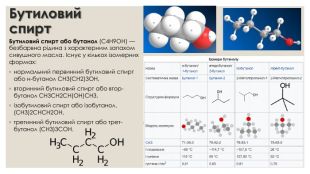
Бутиловий спирт. Бутиловий спирт або бутанол (C4 H9 OH) — безбарвна рідина з характерним запахом сивушного масла. Існує у кількох ізомерних формах:нормальний первинний бутиловий спирт або н-бутанол СН3(СН2)3 ОН,вторинний бутиловий спирт або втор-бутанол СН3 СН2 СН(ОН)СН3,ізобутиловий спирт або ізобутанол, (СН3)2 СНСН2 ОН,третинний бутиловий спирт або трет-бутанол (СН3)3 СОН.
Бутиловий спирт. Як і решта парних спиртів, всі ізомери отруйні для людини. Бутанол використовується як розчинник для виробництва фарб, смол і пластифікаторів, в промисловому синтезі багатьох органічних сполук та як паливо. Бутанол виробляють з нафти гідролізом галогеналканів чи гідролізом і гідратацією алкенів. Бутанол, що виробляється з біомаси, називають біобутанолом, хоча він має абсолютно ті ж характеристики, що й бутанол, отриманий з нафти. Бутанол почали виробляти починаючи з 20-х років XX століття з використанням бактерії Clostridia acetobutylicum. Світове виробництво бутилового спирту в 2004 р. становило 4,5 млн т. при ціні 3 долари за галон. N-бутиловий спирт — безбарвна рідина. Використовується в органічному хімічному синтезі, пластифікаторах, миючих засобах тощо. Змішується з багатьма органічними розчинниками. Дуже добре розчинний в ацетоні ; змішується з етанолом і етиловим ефіром. Константи дисоціації – p. Ka 16,1 (при 25 °C)Класи харчових добавок - ароматизатори. Смаковий профіль FEMA - фрукти
Бутиловий сприт. Дванадцять суб'єктів піддалися впливу 300 або 600 мг/куб.моль н-бутилового спирту у вдихуваному повітрі під час відпочинку та під час вправ на велоергометрі. Експозиція тривала 2 години. Результати викликали здивування з огляду на високий коефіцієнт розподілу кров/повітря для бутилового спирту. Концентрація в артеріальній крові мала. Концентрація в останній частині видихуваного повітря, тобто «альвеолярна», була низькою. Коефіцієнт «альвеолярної» концентрації X 100/концентрації при вдиху був низьким у порівнянні з низьким відсотком поглинання. Однак висока розчинність бутилового спирту у воді може пояснити результати. Ймовірно, бутиловий спирт був частково поглинений водоюмертвого простору слизових оболонок під час вдиху. Потім він частково вивільнився з мембран. Тому концентрація бутилового спирту в останній частині видиху, ймовірно, не була такою ж, як концентрація в альвеолярному повітрі. У щурів н-бутанол інтенсивно метаболізується; протягом 24 годин після одноразової пероральної дози 83% перетворювалося на вуглекислий газ , 4% виводилося з сечею і 12% залишалося в організмі. Фармакологія та біохімія. Бутанол всмоктується через легені, шлунково-кишковий тракт і шкіру.
Бутиловий спиртн-Бутанол був запропонований як біопаливо, альтернативне етанолу , і кілька промислово використовуваних мікробів, включаючи Escherichia coli, були створені для його виробництва. На жаль, н-бутанол більш токсичний, ніж етанолдо цих організмів. Щоб зрозуміти основу його токсичності, були проведені загальноклітинні дослідження на рівнях транскрипту, білка та метаболіту, щоб отримати загальне уявлення про реакцію стресу н-бутанолу. Аналіз даних показує, що стрес на н-бутанол має компоненти, загальні для інших реакцій на стрес, включаючи порушення дихальних функцій (оперони nuo і cyo), окислювальний стрес (sod. A, sod. C і yqh. D), тепловий шок і стрес клітинної оболонки (rpo. E, clp. B, htp. G, cpx. R і cpx. P), а також транспорт і біосинтез метаболітів (mal. E і opp оперон). Аналізи з використанням флуоресцентних барвників вказали на значне збільшення активних форм кисню під час стресу н-бутанолу, підтверджуючи спостереження за допомогою мікрочіпів і протеомних вимірювань. Мутантні штами з мутаціями в кількох генах, чиї продукти змінювалися найбільш драматично під час стресу н-бутанолу, досліджували на підвищену чутливість до н-бутанолу. Результати цих аналізів дозволили ідентифікувати ключові гени, які були використані для послаблення окислювального стресу, неправильного згортання білків та інших причин дефектів росту. Клітинна інженерія, заснована на цих сигналах, може допомогти в розробці господаря з високим титром, що виробляє n-бутанол. Механізм дії
використовується як розчинник для фарб, лаків і лаків, природних і синтетичних смол, камеді, рослинних олій, барвників і алкалоїдів. Він використовується як проміжний продукт у виробництві фармацевтичних препаратів і хімікатів, а також використовується в галузях виробництва штучної шкіри, текстилю, безпечного скла, гумового цементу, шелаку , плащів, фотоплівок і парфумів. Як органічний розчинник для жирів, воску, смол, шелаку , лакової гуми тощо; виробництво лаків, віскози , мийних засобів, інших бутилових сполук; в мікроскопії для приготування парафінопоглинаючих матеріалів.н-бутиловий спирт є основним аліфатичним спиртом, який історично використовувався як розчинник у косметичних продуктах для догляду за нігтями, але нові дані про концентрацію використання вказують на те, що він також використовується в низьких концентраціях у косметичних засобах для макіяжу очей, засобів особистої гігієни та гоління. n-Бутиловий спирт був загальновизнаний безпечним для використання в якості смакової речовини в харчових продуктах і внесений до списку неактивних інгредієнтів Управління з контролю за продуктами і ліками (FDA) 1982 року для схвалених лікарських засобів, що відпускаються за рецептом. Використання та виготовлення. Харчові добавки -> Ароматизатори. Класи та категорії небезпеки -> Займисті - 3-й ступінь
Класифікація небезпеки NFPAНебезпека для здоров'я. Анестезія, нудота, головний біль, запаморочення, подразнення дихальних шляхів. Легко подразнює шкіру та очі. (USCG, 1999)Легкозаймиста рідина. Помірно вибухонебезпечний при дії полум'я. Потенційними симптомами надмірного впливу є подразнення очей, носа та горла. Пари можуть вибухнути, якщо їх запалити в закритому приміщенні.
ВПЛИВ НА ЛЮДИНУ ТА ТОКСИЧНІСТЬВплив n-бутилового спирту на людину може відбуватися на робочому місці під час виробництва та промислового/комерційного використання, а також під час споживчого використання продуктів, що містять n-бутиловий спирт. Працівники скаржилися на подразнення очей, неприємний запах, легкий головний біль і запаморочення, легке подразнення носа і горла, а також дерматит пальців і рук, коли концентрація n-бутилового спирту в повітрі була більше 50 частин на мільйон. Короткочасне вдихання н-бутанолу також викликає різноманітні ефекти з боку ЦНС, включаючи запаморочення, атаксію, сплутаність свідомості, марення та можливу кому. У високій концентрації в повітрі може спричинити транзиторний легкий набряк кон’юнктиви ока та дещо зменшити кількість еритроцитів. Дослідження інгаляційної токсичності у людей демонструють сенсорне подразнення верхніх дихальних шляхів, але лише при рівнях вище 3000 мг/куб. Вживання n-бутилового спирту може призвести до блювоти, болю в животі, головного болю, сонливості та втрати свідомості. Нігтьова емаль, що містить 3% n-бутилового спирту, не викликала ніяких реакцій. Шкірні симптоми - Почервоніння. Біль. Суха шкіра. Очні симптоми - Почервоніння. Біль. LC50 (щур) = 8000 ppm/4 HLD50 кролики 4,2 г/кг дермально. LD50 щури від 0,79 до 4,36 г/кг (одноразова пероральна доза)
Гліцерол. Гліцери́н (гліцеро́л) — триатомний спирт. Це означає, що в молекулі цього спирту три гідроксильні групи приєднані до трьох атомів вуглецю. Хімічна формула — C3 H8 O3, або C3 H5(OH)3. Гліцерин відкрив у 1783 році шведський хімік Карл Вільгельм Шеєле, який показав, що фрагменти цієї сполуки складають основу всіх природних жирів, і назвав його «солодкою речовиною із жиру», позаяк продукт має солодкий смак. Шеєлє кип'ятив оливкову олію з окисом свинцю (свинцевий гліт).[3] Визначити точний склад і будову цих фрагментів Вільгельм Шеєле не зміг — органічна хімія лише починала розвиватися. У 1813 (1823) році французький хімік Мішель Ежен Шеврель встановив, що під дією води (каталізатори: кислота і луг) відбувається розщеплення жирів з утворенням гліцерину і вищих карбонових кислот. Він уперше дав назву «гліцерин» одному з продуктів, який утворюється в даному процесі («гліцерос» — солодкий). Французові Т. Петлузові в 1836 році вдалося встановити елементний склад цього тріолу. Синтез гліцерину вперше провів у 1873 році французький хімік і мінеролог Ш. Фрідель.
Гліцерол. Чистий гліцерин являє собою прозору, безбарвну, дуже густу, в'язку, сиропоподібну, без запаху, важчу за воду і неотруйну солодкувату на смак рідину. Гліцерин має здатність поглинати вологу з повітря та утримувати її. На повітрі може увібрати до 40% води від своєї маси. Таку властивість речовини називають гігроскопічністю. Через це гліцеринова крапля на руці дає враження легкого нагріву. Питома вага хімічно чистого гліцерину при 15о. С становить 1,26469. Молекулярна маса 92,09 г/моль. При звичайному атмосферному тиску гліцерин кипить при 290 °C і частково розкладається; під розрідженим тиском його можна перегнати, не розклавши. Змішується з водою в будь-якій пропорції. Як і при утворенні спирто-водних розчинів, при змішуванні гліцерину і води сумарний об'єм стає меншим, ніж об'єм вихідних компонентів. Температура спалаху гліцерину становить 150 °C, температура самозаймання — 362 °C. Як і винний спирт він горить не яскравим синім полум'ям. При нагріванні гліцерин швидко випаровується, а у звичайних умовах — гліцерин не леткий.
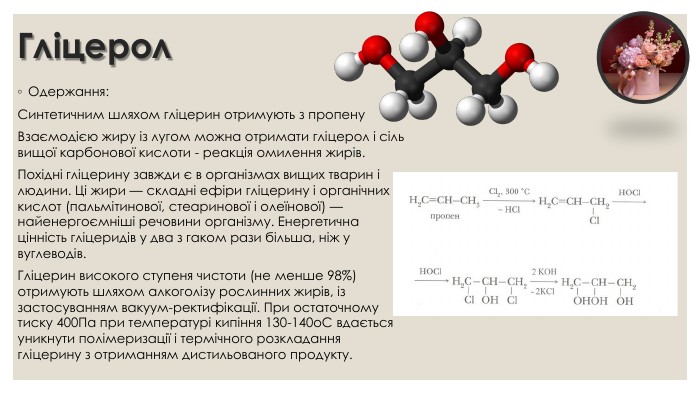
Гліцерол. Одержання: Синтетичним шляхом гліцерин отримують з пропену Взаємодією жиру із лугом можна отримати гліцерол і сіль вищої карбонової кислоти - реакція омилення жирів. Похідні гліцерину завжди є в організмах вищих тварин і людини. Ці жири — складні ефіри гліцерину і органічних кислот (пальмітинової, стеаринової і олеїнової) — найенергоємніші речовини організму. Енергетична цінність гліцеридів у два з гаком рази більша, ніж у вуглеводів. Гліцерин високого ступеня чистоти (не менше 98%) отримують шляхом алкоголізу рослинних жирів, із застосуванням вакуум-ректифікації. При остаточному тиску 400 Па при температурі кипіння 130-140о. С вдається уникнути полімеризації і термічного розкладання гліцерину з отриманням дистильованого продукту.
Гліцерол. До розробки синтетичних методів гліцерин отримували лужним омиленням жирів. При цьому утворюються мила з водним розчином гліцерину. Мило відокремлюють шляхом висолювання за допомогою хлориду натрію, а гліцерин отримують шляхом повторного згущення і кристалізації осадженого хлориду натрію. Отриманий 80% гліцерин темного кольору очищується перегонкою і обробкою активованим вугіллям.Існує ферментативний метод отримання гліцерину. Гліцерин присутній в натуральних винах, але у долях відсотка. Близько трьох відсотків цукру, який міститься у винограді, у кінцевому результаті перетворюються в гліцерин. В процесі дозрівання вина гліцерин частково перетворюється в інші органічні продукти.Інший метод оснований на гідролітичному розщепленні вуглеводів (крохмалю, деревного борошна і цукру, особливо тростинного), призводить до утворення суміші гліцерину з іншими гліколями. Також гліцерин утворюється при виробництві біодизеля.
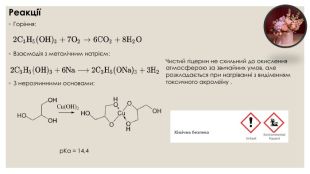
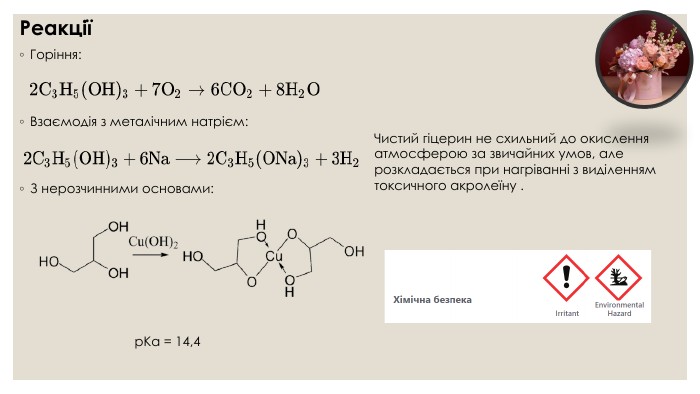
Гліцерол. Хімічні властивостіЗ водою гліцерин змішується в усіх пропорціях, причому об'єм такого розчину буде трохи менший від суми первинних об'ємів води й гліцерину. В усіх пропорціях змішується з етанолом. Не розчиняється в жирах, олії, бензині, хлороформі. Наявність гідроксильних груп зумовлює подібність гліцерину до одноатомних спиртів, він вступає в ті самі реакції, але за участю трьох гідроксильних груп. Реакції повного окиснення (горіння) відбувається, як і в інших органічних речовин, з утворенням вуглекислого газу і води. Гліцерин вступає в реакцію заміщення з металічним натрієм, яка супроводжується виділенням водню. Реакція з гідроксидами металів. На відміну від одноатомних спиртів, багатоатомні взаємодіють із гідроксидами лужних і металічних елементів.
Офтальмологічний розчин гліцерину можна використовувати місцево для зменшення поверхневого набряку рогівки внаслідок захворювання, щоб полегшити офтальмоскопічне та гоніоскопічне дослідження. Побічні ефекти виникають рідко після ректального введення гліцерину або сорбіту . Гліцерин може викликати дискомфорт у прямій кишці, подразнення, печіння або стискання, судомний біль і тенезми. Також можлива гіперемія слизової оболонки прямої кишки з мінімальною кількістю крововиливів і виділенням слизу. Ці побічні ефекти виникають рідше після ректального введення сорбітолу . Статус харчової добавки FDAГліцерин - MISC, GRAS/FS, GMP, Частина 169, Харчові ароматизатори, 182.1320; Частина 582 - Корми для тварин. Фармакологія та біохімія. Гліцерин зазвичай класифікують як осмотичний проносний засіб, але він може діяти додатково або альтернативно через місцеву подразнювальну дію; він також може мати змащувальні дії та пом’якшення фекалій. Зазвичай гліцеринові супозиторії діють протягом 15-30 хвилин. Всмоктування, розподіл і виведення
Метаболізм/Метаболіти. Гліцерин є субстратом для синтезу триацилгліцеринів і фосфоліпідів у печінці та жировій тканині. Коли жир метаболізується як джерело енергії, гліцерин і жирні кислоти вивільняються в кров. Циркулюючий гліцерин не глікує білки та не призводить до утворення прогресуючих кінцевих продуктів глікації (AGE). У деяких організмах гліцериновий компонент може безпосередньо входити в шлях гліколізу, щоб забезпечити субстрат для виробництва енергії або глюкози . Перед використанням у гліколізі чи глюконеогенезі гліцерин необхідно перетворити на проміжний гліцеральдегід-3-фосфат . Метаболізм гліцерину регулюється ферментами гліцеринкіназа, (цитозольна) NAD+ -залежна G3 P-дегідрогеназа та (мітохондріальна) FAD-пов’язана G3 P-дегідрогеназа. Ефіри гліцерину гідролізуються до гліцерину та відповідних карбонових кислот. Гідроліз каталізується кишковою ліпазою, яка атакує складноефірні зв’язки при атомах вуглецю 1 і 3. Складноефірний зв’язок при атомі вуглецю 2 більш стійкий до гідролізу, можливо, через його стереохімію та стеричних перешкод. Проте бета-моногліцерид може спонтанно ізомеризуватися до альфа-форми (3-ацилгліцерину), дозволяючи подальший гідроліз з утворенням гліцерину.
Використання та виготовлення. Гліцерин фосфорилюється до альфа-гліцерофосфату гліцеринкіназою переважно в печінці (80-90%) і нирках (10-20%) і включається в стандартні метаболічні шляхи з утворенням глюкози та глікогену . Гліцеролкіназа також міститься в слизовій оболонці кишечника, бурій жировій тканині, лімфатичній тканині, легенях і підшлунковій залозі. Гліцерин також може поєднуватися з вільними жирними кислотами в печінці з утворенням тригліцеридів (ліпогенез), які розподіляються в жировій тканині. Швидкість обміну прямо пропорційна рівням гліцерину в плазмі. Гліцерин, піровиноградна кислота та молочна кислота є ендогенними для людини. Гліцерин і піровиноградна кислота метаболізуються повністю і не виводяться. ... Гліцерин метаболізується через гліколітичний шлях після того, як він перетворюється в печінці на гліцерин-3-фосфат . Гліцерин має повсюдне використання, його можна знайти в промислових, професійних і споживчих товарах. Гліцерин використовується як компонент у багатьох продуктах і як проміжний продукт у промисловому застосуванні для виробництва таких продуктів, як мило/миючі засоби та ефіри гліцерину. Він міститься в споживчих товарах, таких як фармацевтичні препарати, косметика, тютюн, продукти харчування та напої, а також присутній у багатьох інших продуктах, таких як фарби, смоли та папір. Наприклад, він використовується як мастило для свердловин на нафтових і газових родовищах і як змочувальний агент у складах пестицидів. Немає жодного використання, яке домінувало б у моделі використання.
Моделі споживання23% у лікарських засобах як носій, для гладкості, для підтримки вологи, а також як зволожувач, розчинник і мастило в косметиці та туалетних засобах; 21% у виробництві покриттів з алкідних смол; 15% як зволожувач тютюну; 12% як розчинник ароматизаторів і харчових барвників, згладжувач і зволожувач у харчових продуктах, а також при приготуванні швидкозаморожених продуктів; 11% як пом'якшувач або пластифікатор у целофані; 7% у виробництві поліефірних поліолів для пінополіуретану ; 5% як хімічний проміжний продукт для вибухової речовини, нітрогліцерин ; 6% у численних різних програмах (1974)ХІМІЧНИЙ ПРОФІЛЬ: Гліцерин. Ліки та зубна паста, 20%; тютюн 19%; косметика 15%; харчові продукти, 13%; алкідні смоли 12%; поліефірні поліоли для уретанів, 8%; целофан 4%; вибухові речовини, 1%; різне, включаючи сільське господарство, клеї, шкіру, фотографію, текстиль, чорнило, гуму, деревину та інші, 8%. Зелене коло - на основі експериментальних і змодельованих даних підтверджено, що хімічна речовина не викликає занепокоєння.


про публікацію авторської розробки
Додати розробку