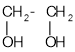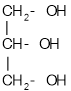Цикл уроків 11 класу з хімії
Пояснювальна записка
Зміни, що відбуваються сьогодні в суспільному житті, вимагають розвитку нових педагогічних технологій, що орієнтуються на індивідуальний розвиток особистості, навичок самостійного навчання, формування вміння чітко вирішувати поставлені завдання. Такий підхід спонукає до впровадження в освітній процес альтернативних форм і способів освітньої діяльності. Серед них є технологія «переверненого» навчання. Впровадження вказаної технології в навчальний процес досліджували Д. Бергман, О Єльникова, М. Курвітс, Е. Попов, А. Самс та інші.
Ідея «перевернутого навчання» полягає в попередньому ознайомленні учнів удома з новим навчальним матеріалом за допомогою відеоматеріалів та підручника, а на уроці — короткий розбір проблемних моментів, закріплення теоретичних знань і вироблення практичних навичок. Оцінювання засвоєння нового матеріалу проводиться в кінці того ж самого уроку за допомогою виконання завдань у робочому зошиті, комп’ютерного тестування тощо.
Пропоноване «перевернуте навчання» передбачає запровадження елементів педагогіки співробітництва: учитель виступає скоріше в ролі колеги й консультанта. Учні опановують навчальний матеріал, значною мірою за допомогою самонавчання, що сприяє розвитку пізнавальної активності та самостійності.
«Перевернене навчання» – це форма активного навчання, яка дозволяє «перевернути» звичний процес навчання таким чином: домашнім завданням для учнів є перегляд відповідних відеофрагментів із навчальним матеріалом наступного уроку, учні самостійно опановують теоретичний матеріал, а в класі час використовують на виконання практичних завдань: учні виконують вправи, створюють проекти, обговорюють проблемні питання, дискутують.
Відеолекції розглядають як ключовий компонент в «переверненому» підході, їх готує вчитель і розміщує в Інтернеті
Перевагами «переверненого» навчання є такі: зростання активності, розвиток співробітництва, персоналізація навчання, доступність інформаційно-комунікаційних технологій.
Перевернена модель покладає більшу відповідальність за навчання на учнів, дає їм стимул для дослідження, експерименту.
При «перевернутому навчанні» вчитель бачить рівень успішності кожного в процесі виконання практичних завдань і може вчасно допомогти.
Мета брошури полягає в розкритті особливостей застосування технології «переверненого» навчання у загальноосвітньому навчальному закладі, зокрема у процесі викладання хімії.
В брошурі представлені конспекти уроків хімії в 11 класі по темі:
«Природні джерела органічних речовин» на основі методики перевернутого навчання.
Календарно-тематичне планування з хімії
11клас Стандартний рівень
Програма: МОН України. Хімія 10-11 класи. Програми для профільного навчання учнів ЗНЗ. . Програма призначена для навчання хімії на рівні стандарту
(зі змінами, затвердженими наказом МОН України № 826 від14.07.2016)
Зміст курсу хімії 11 класу розроблено з урахуванням відомостей про органічні сполуки, одержаних учнями в основній школі. У ньому посилено дедуктивний підхід і практичне спрямування навчального матеріалу.
Річний план
11-й клас
(1 година на тиждень, усього 35 годин із них 5 годин — резервних)
Тема 1. Органічні сполуки (30 годин + 5 годин резервних)
Підтеми:
1.Теорія хімічної будови органічних сполук О. Бутлерова. Органічні речовини в живій природі -7 годин
2.Природні джерела органічних речовин- 8 годин
3.Органічні речовини як основа сучасних матеріалів –
4 години
4.Органічні сполуки і здоров’я людини –8 годин
5.Органічні сполуки в побуті -8 годин
КАЛЕНДАРНИЙ ПЛАН ТЕМИ: Природні джерела органічних речовин.
Урок№8 Природні джерела органічних речовин Природний і супутній нафтові гази, їх склад. Використання.
Урок№9 Нафта, її склад і властивості. Продукти перегонки нафти, їх застосування. Детонаційна стійкість бензину
Урок№10 Вивчення складу, властивостей, застосування природного, супутнього нафтового газів і нафти
Урок№11 Кам’яне вугілля, продукти його переробки. Основні види палива та їх значення в енергетиці країни
Урок№12 Синтез органічних сполук різних класів на основі вуглеводневої сировини
Урок№13 Охорона навколишнього середовища від забруднень під час переробки вуглеводневої сировини та використання продуктів її переробки
Урок№14 Узагальнення та систематизація знань з теми
Урок№15 Контрольна робота №1.
КОНСПЕКТИ УРОКІВ ХІМІЇ ДЛЯ УЧНІВ 11 КЛАСУ З ТЕМИ
« ОРГАНІЧНІ СПОЛУКИ»
Урок№9 Нафта, її склад і властивості. Продукти перегонки нафти, їх застосування. Детонаційна стійкість бензину
Урок№10 Вивчення складу, властивостей, застосування природного, супутнього нафтового газів і нафти
Урок№11 Кам’яне вугілля, продукти його переробки. Основні види палива та їх значення в енергетиці країни
Урок№12 Синтез органічних сполук різних класів на основі вуглеводневої сировини
Урок№13 Охорона навколишнього середовища від забруднень під час переробки вуглеводневої сировини та використання продуктів її переробки
Урок№14 Узагальнення та систематизація знань з теми
|
Клас: 11 |
||||||||
|
Урок: 9 |
||||||||
|
Тема: Нафта, її склад і властивості. Продукти перегонки нафти, їх застосування. Детонаційна стійкість бензину |
Мета: розглянути склад та фізичні властивості нафти, ознайомити учнів з процесами переробки й продуктами перегонки нафти, їх застосуванням, з характеристикою бензину — детонаційною стійкістю. |
|||||||
|
|
Дома |
На уроці |
||||||
|
Діяльність учня |
Переглядають відео (Науково-популярний фільм та відеоінструкції учителя). Відповідають на питання для самоконтролю |
Сідають групами.Слухають учителя. За необхідністю ставлять питання вчителю |
Опрацьовують питання семінару (завд 9.1) |
У групах обговорюють прочитане, відповідають на контрольні запитання (завд 9.2) |
Групи обмінюються інформацією,представляють свої роботи, задають питання один одному Демонструють модель нафтопереробної установки. |
У групах проводять Лабораторний дослід № 2 Ознайомлення зі зразками нафтопродуктів.(завд.9.3) |
Знайомляться з роботами інших груп |
|
|
Час |
|
2хв |
7хв |
12хв |
17хв |
5хв |
2хв |
|
|
Діяльність учителя |
Готує навчальне відео, питання для самоконтролю |
Знайомить учнів з особливістю проведення уроку- семінару,вимогами до кожної групи і кожного учня, моделлю організації роботи |
Організовує роботу учнів та допомагає групам при необхідності |
Організовує та координує роботу учнів, відповідає на запитання |
Доповнює, уточнює, коментує |
Організує роботу |
||
Завдання 9.1
Група №1
Склад і фізичні властивості нафти.
Група №2
Перегонка пафти.
Група №3
Нафтопродукти та їх застосування.
Група №4
Крекінг та його види.
Група №5
Детонаційна стійкість бензину.
Завдання 9.2
Група №1
-Що таке нафта?
-Який склад нафти?
-Описати фізичні властивості нафти.
-Назовіть основні види нафти.
Група №2
-Чому нафту називають «чорним золотом»?
- На яких властивостях нафти заснована первинна перегонка нафти?
- Які продукти одержують при прямій перегонці нафти?
-Які продукти одержують при перегонці мазуту?
-Опишіть трубчату установку перегонки нафти (з допомогою моделі нафтопереробної установки.)
Група №3
Де використовують продукти перегонки нафти?
Де використовують продукти перегонки мазуту?
Як використовують продукти перегонки нафти у паливно-енергетичній галузі?
Як використовують продукти перегонки нафти у хімічній промисловості?
Як використовують продукти перегонки нафти у сільському господарстві?
Як використовують продукти перегонки нафти у харчовій промисловості?
Як використовують продукти перегонки нафти у фармацевтичній і парфумерній промисловості
Група №4
-Що таке крекінг?
-Які умови проведення крекінгу?
-Які є види крекінгу?
-Що є сировиною для крекінгу?
-Які продукти утворюються в результаті крекінгу (навести приклади)
Група №5
-Що таке детонаційна стійкість?
-Дати визначення октановому числу.
-Як визначається октанове число?
-Що характеризує октанове число?
-Як можна підвищити октанове число бензину?
Завдання 9.3
Метод рецензій (критичний погляд на виступи інших груп)
Проаналізувати виступи інших груп за схемою:
1.Що сподобалось у виступі, про що сказано найбільш удачно.
2.Як побудований виступ, логіка викладу
3.Чи повністю розкрита тема.
4.Помічені неточності, помилки,протиріччя.Заперечення виступаючому.
5.Доповнення до виступу.
6.Побажання виступаючому і групі.
7.Загальна оцінка виступу.
Завдання 9.4
6.1. Лабораторний дослід № 2
Тема. Ознайомлення зі зразками нафтопродуктів.
Мета: дослідити фізичні властивості нафтопродуктів, та взаємозв’язок між хімічним складом та властивостями.
Досліджувані об’єкти: колекція нафтопродуктів.
Хід роботи
1. Розгляньте запропоновані зразки продуктів нафтопереробки. Складіть порівняльну таблицю, в якій слід зазначити фізичні властивості (агрегатний стан, колір, наявність запаху тощо) та вказати галузі переважного застосування.
2. Зробіть висновки (поясніть залежність між фізичними властивостями нафтопродуктів та галуззю застосування).
Додатки до завдання 9.1
1.Склад і фізичні властивості нафти
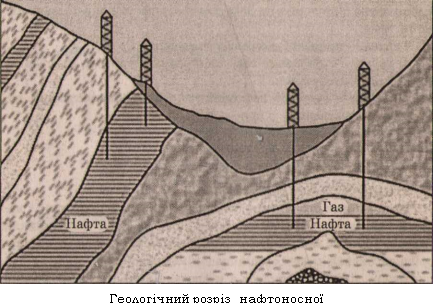
Нафта — масляниста рідина темно-бурого або майже чорного кольору з характерним запахом. Вопа легша за воду (густина 0,73-0,97 г/см3), у воді практично нерозчинна.
За складом нафта — складна суміш вуглеводнів різної молекулярної маси, головним чином рідких (у них розчинені тверді й газоподібні вуглеводні). Зазвичай це вуглеводні парафінові, ароматичні, циклоалкани, співвідношення яких у нафтах різних родовищ змінюється в широких межах. Крім вуглеводнів, нафта містить оксигено-, сульфуро- і нітрогеповмісні органічні сполуки.
Залежно від переважного вмісту вуглеводнів того чи іншого класу розрізняють такі осповні види нафти:
-метанова нафта, яка складається переважпо з нерозгалужених алканів;
-нафтенова нафта, яка складається, в основному, з циклічних неароматичних вуглеводнів циклоалканів або нафтенів;
-змішала нафта, яка включає суміш алканів, нафтенів і ароматичних вуглеводнів. Змішана нафта трапляється найчастіше.
Іноді нафту класифікують за фізичпими властивостями, наприклад на легку нафту густиною менше 0,9 г/мл і більш важку нафту. Усі види нафти мають домішки нітрогено- й сульфуровмісних органічних сполук.
Сира нафта зазвичай не застосовується. Для одержання з нафти технічно цінних продуктів її піддають переробці.
2. Перегонка нафти
Первинна переробка нафти полягає в її перегонці. Перегонку здійснюють на нафтопереробних заводах після відділенпя з нафти супутніх газів. У процесі перегонки нафти одержують світлі нафтопродукти:
-бензин (tкип. — від 40 до 150-200 °С);
-лігроїн (tкип. — 120-240 °С);
-гас (tкип. --150-300°С);
-газойль — солярове масло (tкип. вища від 300°С).
У залишку — в'язка чорна рідина — мазут.
Мазут піддають подальшій переробці. Його переганяють під зменшеним тиском (щоби попередити розкладання) і виділяють мастила:
-веретенне;
-машинне;
-циліндрове та ін.
З мазуту деяких сортів нафти виділяють вазелін і парафін. Залишок мазуту після відгону називають нафтовим пеком, або гудроном.
3. Нафтопродукти та їх застосування
Продукти первинної перегонки нафти мають різне застосування.
Бензин у великих кількостях використовують як авіаційне й автомобільне пальне. Він складається зазвичай з вуглеводнів, що містять у молекулах у середньому від п'яти до дев'яти атомів Карбону.
Лігроїн є пальним для дизельних двигунів, а також розчинником у лакофарбовій промисловості. Велику-кількість його переробляють на бензин.
Гас застосовують як пальне для реактивних і тракторних двигунів, а також для побутових потреб. Він складається з вуглеводнів, що містять у молекулах у середньому від 9 до 16 атомів Карбону.
Газойль — використовують як моторне нальне.
Мазут, крім переробки на мастила й бензин, використовують як котельне рідке пальне.
Застосування продуктів переробки мазуту
Вазелін використовують у медицині. Він складається із суміші рідких і твердих вуглеводнів.
Парафін застосовують для одержання вищих карбонових кислот, для просочення деревини у виробництві сірників і олівців, для виготовлення свічок, гуталіну і т. д. Він складається із суміші твердих вуглеводнів.
Мастила, які виділяються під час перегонки мазуту, називають мінеральними (нафтовими) маслами, на відміну від синтетичних масел, які одержують штучно (хоча всі масла є сумішами органічних сполук).
Гудрон — нелетка темна маса, після часткового окиснення його застосовують для одержання асфальту.
Крекінг та його види
Крекінг нафтопродуктів полягає в розщепленні довгих молекул вуглеводнів, що входять у висококиплячі фракції, на більш короткі молекули легких низькокиплячих продуктів.
Первинна пряма перегонка нафти дає порівняно мало бензину — 4-25% з різних нафт. Збільшення виходу бензину досягається застосуванням вторинної переробки більш важких нафтових фракцій, а також мазуту з допомогою методів деструкції, що дозволяє підвищити вихід бензину в кілька разів.
Залежно від виду сировини й необхідної якості одержуваної продукції в нафтопереробній промисловості застосовують різні технологічні способи переробки сировини.
Без застосування каталізаторів: термічний крекінг у рідкій і паровій фазах, піроліз, коксування, окисний крекінг і окисний піроліз.
Із застосуванням каталізаторів: каталітичний крекінг, гідрогенізаційний крекінг (деструктивна гідрогенізація), каталітична ароматизація (дегідрогенізаційний крекінг).
Термічний крекінг — проводять за t = 450-600 °С і тиску 2-7 МІІа
Каталітичний крекінг — проводять за t = 450 °С, атмосферного тиску й каталізатора (алюмосилікати)
У його основі лежать процеси перетворення вуглеводнів, що входять до складу нафти чи нафтопродуктів, під впливом нагрівання до температур 400-700 °С і вище й за різного тиску. У результаті одержують газоподібні, рідкі та тверді продукти.
Термічний крекінг здійснюється у двох основних варіантах: у рідкій (тиск 2-7 МІІа, температура 450 -500 °С) і в паровій (тиск 0,2-0,5 МІІа, температура 550-600 °С) фазах. У разі рідкофазного крекінгу більший вихід бензину й менше газу, ніж під час паро-фазного.
Сировиною для крекінгу є різні фракції: газойль, солярка, гас, мазут, гудрон, а також бензин прямої перегонки нафти. Різні види сировини доцільно піддавати крекінгу окремо, підбираючи для кожного процесу відповідні умови. Алкани крекуються легше за все й дають бензин з низькими октановими числами (55-60), за тієї ж глибини крекінгу нафтенів октанові числа бензину вище (60-70). Наприклад:
С16Н34→ С8Н18 + С8Н16
гексадекан октан октен
Утворилася суміш насичепих і непасичепих вуглеводнів, яка відповідає бензину. Речовини, що утворилися, частково можуть розкладатися далі:
С8Н18→С4Н10 + С4Н8
С4Н10->С2Н6 + С2Н4
С4ІІ10->С3Н6+СН4
За глибоких форм крекінгу одержувані продукти сильно ароматизовані. Вихід крекінг-бензинів, залежпо від виду сировини й режиму роботи установок, змінюється від 25 до 70%.
Каталітичний крекінг на алюмосилікатних каталізаторах — один із найбільш багатотоннажних процесів у нафтопереробній промисловості. Метою процесу є одержання високооктанового бензину з вакуумних дистилятів різних нафт, що википають у межах 300-500 °С.
Каталітичний крекінг проводять за температури 450-530 °С під тиском, близьким до атмосферного (0,07-0,3 МПа). Реактори мають забезпечувати можливість постійного відводу каталізатора на регенерацію, тому використовують реактори з рухомим чи киплячим шаром каталізатора.
Крім високооктанового бензину на установках каталітичного крекінгу отримують також вуглеводневий газ, легкі й важкі газойлі. Кількість та якість продуктів залежить від характеристики переробної сировини, каталізатора, а також режиму процесу.
Детонаційна стійкість бензину. Октанове число
Основною експлуатаційною властивістю бензинів є детонаційна стійкість. Детонаційна стійкість — здатність бензину згоряти без вибуху у двигуні з іскровим запалюванням. Чим вище октанове число, тим більш стійкий бензин перед детонацією й тим кращі експлуатаційні якості він має.
Детонація — це процес дуже швидкого, вибухового згоряння робочої суміші. Детонація приводить до прогоряння поршнів і випускних клапанів. Зовнішні ознаки детонації - характерний металевий стукіт і вібрація, чорний колір відпрацьованих газів (дим), нерівна робота двигуна.
Детонація пального в моторах пояснюється нерівномірністю процесу його згоряння й залежить від якості бензину. Мірою детонаційної стійкості пального с октанове число (ОЧ).
Октанове число дорівнює вмісту (в об'ємних %) ізооктану (ОЧ = 100) в його еталонній суміші з н-гептаном (ОЧ = 0), за якого ця суміш має однакові антидетонаційні властивості з пальним, що випробовують. Отже, октанове число (ОЧ) умовний показник, що характеризує здатність палива забезпечити бездотонаційну роботу двигунів із примусовим запаленням. Октанове число бензину підвищується шляхом додавання до бензину високооктанових компонентів або ирисадок-аптидетонаторів.
Додатковий матеріал до завдання 9.1
1. Походження та історичні етапи дослідження нафти
Нафта відома людству з давніх часів. Перші згадки про нафту є у давньоперських письмових джерелах («нефт» з перської перекладається як «витікати»). Адже саме на території Персії (нині Ірану) нафта просочувалась на поверхню Землі із надр.
За теорією органічного походження, нафта — це органічна речовина, що утворилася із залишків вимерлих рослин і організмів у давні геологічні ери. Упродовж тривалого часу у товщі Землі під дією високої температури й тиску утворилися значні родовища нафти.
За теорією мінерального походження, нафта утворилася з карбідів і води під впливом високих температур, випромінювання та каталізаторів. Це відбувалося на ранніх етапах формування літосфери Землі.
Головні родовища нафти розташовані в країнах Перської затоки та Росії. В Україні запаси нафти розташовані у Полтавській, Сумській, Львівській та Чернігівській областях.
Пріоритет у вивченні нафти належить російським ученим.
Велике значення у вивченні складу нафти мали роботи В. В. Марковнікова (80-ті рр. XIX ст.). Він відкрив у нафті новий клас вуглеводнів, названий нафтенами, і вивчив будову багатьох вуглеводнів. Л. Г. Гурвич на підставі своїх досліджень розробив фізико-хімічну основу очищення нафти й нафтопродуктів і значно вдосконалив методи їх переробки. Продовжуючи роботи Марковнікова, М. Д. Зелинський розробив у 1918 році каталітичний спосіб одержання бензину з важких залишків нафти. Багато років у галузі хімії нафти працював С. С. Наметкин. Він розробив методи визначення вмісту в нафті вуглеводнів різних класів (визначення групового складу) і визначені способи підвищення виходу нафтопродуктів. В. Г. Шухов створив першу в світі промислову установку термічного крекінгу нафти (1891 р.), був автором проекту й головним інженером будівництва першого російського нафтопроводу (1878 р.), заклав основи конструювання нафтопроводів, нафтосховищ і устаткування необхідного для нафтопереробки.
2.Склад нафти
Елементний склад (%): Карбон 80–88, Гідроген 11,0–14,5, Сульфур 0,01–6 (рідко до 8), Оксиген 0,005–0,7 (рідко до 1,2), Нітроген 0,001–1,8.
Основу технологічної класифікації нафти складає вміст Сульфуру: I клас — малосульфурні, що містять до 0,5 % S; II клас — сульфурні з 0,5–2 % S; III клас — високосульфурні, що містять понад 2 % S.
Усього в нафті виявлено понад 50 хімічних елементів. Так, поряд із згаданими, у нафті присутні V (10-5—10-2), Ni (10-4—10-3), Cl (від слідів до 2.10-2 %) тощо.
Нафта — це суміш, що містить близько 1000 речовин, з яких велика частина — рідкі вуглеводні (понад 500) і гетероатомні органічні сполуки, переважно сірчасті (близько 250), азотисті (понад 30) і кисневі (близько 85); інші компоненти — розчинені вуглеводневі гази, вода, мінеральні солі, механічні домішки (частинки глини, піску, вапняку).
Вуглеводневий склад
У хімічному відношенні нафта — найскладніша суміш вуглеводнів, що підрозділяється на дві групи — важку і легку нафту. Легка нафта містить приблизно на два відсотки менше Карбону, ніж важка, і відповідно, більшу кількість Гідрогену і Оксигену. Головну частину нафти складають три групи вуглеводнів — алкани, нафтени й арени.
Алкани (насичені вуглеводні, парафіни) хімічно найбільш стійкі. Якщо число атомів Карбону в молекулі не більше чотирьох, то за атмосферного тиску алкани будуть газоподібними. При 5–16 атомах Карбону — це рідини, а понад — уже тверді речовини, парафіни.
До нафтенів належать алициклічні вуглеводні. У нафті міститься переважно циклопентан C5H10, циклогексан C6H12 та їхні гомологи.
Арени (ароматичні вуглеводні) містять значно менше атомів Гідрогену, проте співвідношення Карбон/Гідроген в аренах найвище, набагато вище, ніж у нафті в цілому.
Крім карбонової частини, у нафті міститься асфальто-смолиста складова, порфірини, Сульфур і зольна частина.
Асфальто-смолиста частина — темна щільна речовина, що частково розчиняється в бензині. Частину, що розчиняється, називають асфальтеном, а ту, що не розчиняється — смолою.
Порфірини — особливі органічні сполуки, що містять у своєму складі Нітроген. Багато вчених упевнені, що колись вони утворилися з хлорофілу рослин і гемоглобіну тварин.
Сульфуру в нафті досить багато — до 5 %, і він заподіює чимало турбот нафтовикам, спричинюючи корозію металів. Зольна частина — це те, що залишається після спалювання нафти. У золі зазвичай утримуються сполуки Феруму, Ніколу, Ванадію та деяких інших речовин.
3.Первинна перегонка нафти, фракції нафти, їхнє застосування
Сиру нафту зазвичай не використовують. Щоб одержати з видобутої нафти потрібні речовини, її слід піддати переробці після видалення механічних домішок.
Перегонка — це фізичний метод розподілу нафти на її складові, що заснований на різних температурах кипіння фракції.
Перегонку нафти здійснюють в установці, що складається із трубчастої печі й ректифікаційної колони. По трубопроводу подається нафта, де вона нагрівається до температури 320–350 °C і у вигляді суміші рідини й випарів надходить у колону. Усередині колона має горизонтальні перегородки з отворами (так звані тарілки). Випари нафти подаються в колону через отвори і піднімаються нагору. При цьому вони поступово охолоджуються й скраплюються. Менш леткі виходять на перших тарілках, більш леткі піднімаються вище. При цьому виділяють такі фракції (заповнити таблицю разом з учнями):
|
Фракції |
Склад фракції |
t кипіння, °C |
Застосування |
|
Газова |
|
— |
Паливо |
|
Бензин |
|
40–200 |
Пальне для автомобільних і авіаційних двигунів |
|
Лігроїн |
|
120–240 |
Пальне для дизельних двигунів, розчинник лаків та фарб |
|
Гас |
|
150–310 |
Пальне для реактивних двигунів, побутове пальне |
|
Газойль |
C18 і вище |
250–275 |
Дизельне паливо |
|
Мазут |
Залишок після перегонки |
Сировина для одержання мастил рідке котельне паливо |
|
Залишок після перегонки (мазут) також піддають вакуумній перегонці (при зниженому тиску) і одержують: солярні масла (дизельне паливо), мастила (машинні, циліндрові), частина, що залишилася — гудрон.
Недолік процесу первинної перегонки нафти — малий вихід бензину (20 %).
4.Теорії походження нафти
Дуже ймовірно, що нафта утворилася із залишків морських організмів і рослин, що осідали протягом мільйонів років на морське дно. Неорганічні речовини були каталізаторами гниття, що було викликано анаеробними бактеріями (бактеріями, що живуть без доступу повітря). При тектонічних порушеннях донні органічні шари опинялися в товщі Землі, де на них впливали тиск земної кори й високі температури внутрішніх шарів Землі. У такий спосіб донні шари перетворювалися на суміш вуглеводнів. Рідка нафта накопичувалася у вигляді нафтоносних шарів, які утримувалися під поверхнею Землі верхніми шарами літосфери.
Окрім цієї — органічної теорії — можна назвати неорганічну теорію походження нафти, автором якої є Д. І. Менделєєв. Відповідно до цієї теорії, нафта могла утворитися з карбідів металів, що знаходяться у надрах Землі, і прониклої туди води. Існує також космічна теорія, за якої нафта могла утворитися з Гідрогену й Карбону одночасно з формуванням нашої планети.
5. «Нафтова чума»
«Нафтова чума» з’явилася не сьогодні й не раптово. Ще в 1922 році у Великобританії була прийнята постанова, що забороняла злив нафти в її територіальні води. Надалі укладалися міжнародні угоди, проводилися міжнародні наради, створювалися ради й комітети з боротьби з нафтовим забрудненням морів. Але остаточного рішення проблеми поки ще немає.
Щорічно у Світовий океан із тих або інших причин скидається від 2 до 10 млн т нафти. Супутниками зафіксовано, що вже майже 30 % поверхні океану вкрито нафтовою плівкою. Особливо забруднені води Середземного моря, Атлантичного океану та їхні береги.
Джерел надходження нафти в моря й океани багато: це скидання очисних вод, принесення забруднюючих компонентів річками. У наш час із кожних 10 т нафти, що видобувають у морі, 7–8 тонн транспортується до місця споживання морським шляхами. Майже щороку трапляються великі катастрофи. В 1967 р. сталася аварія супертанкера «Торуй Каньйон» біля берегів Західної Європи. У море потрапило 120 тис. т нафти. Величезна нафтова пляма спотворила води й береги Франції та Англії. Загинуло 50 тис. водоплавних птахів, тобто 90 % морських птахів цих районів.
Якщо перераховувати всі аварії, що відбулися за останні роки, вийде величезний список. Лише 1 літр нафти, що потрапила у воду, позбавляє кисню 40 тис. літрів морської води.
1 т нафти забруднює 12 км2 поверхні океану. Ікринки багатьох риб розвиваються в приповерхньому шарі води. Небезпека нафти тут є особливо великою. На 1 гектарі морської поверхні може загинути більше 100 млн риб, якщо її вкриває нафтова плівка. Молюски накопичують канцерогенні речовини, що одержують з нафти. Важко перелічити всі лиха, які заподіює «нафтова чума» океану.
6.Продукти переробки нафти, їхнє застосування
Сьогодні з нафти одержують тисячі різних продуктів: рідке паливо, газоподібне паливо, тверде паливо (нафтовий кокс), змащувальні та спеціальні мастила, парафіни і церезини, бітуми, ароматичні сполуки, сажу, ацетилен, етилен, нафтові кислоти та їхні солі, вищі спирти тощо.
Найбільше застосування продукти переробки нафти здобули в паливно-енергетичній галузі. Наприклад, мазут має майже в півтора рази вищу теплоту згоряння у порівнянні з найкращим вугіллям. Він займає мало місця при згоранні і не дає твердих залишків при горінні.
Заміна твердих видів палива мазутом на ТЕС, заводах, на залізничному та водному транспорті дає величезну економію коштів, сприяє швидкому розвитку основних галузей промисловості та транспорту.
Енергетичний напрям використання нафти донині залишається головним у всіх країн світу. Частка нафти в світовому енергобалансі становить понад 46 %.
Проте останнім часом продукти переробки нафти все ширше використовуються як сировина для хімічної промисловості. Близько 8 % нафти, що видобувається, стає сировиною для сучасної хімії. Наприклад, етанол використовується у понад 150 галузях виробництва.
У хімічній промисловості застосовуються формальдегід, пластмаси, синтетичні волокна, синтетичний каучук, амоніак, етанол тощо.
Продукти переробки нафти використовуються і в сільському господарстві. Це стимулятори росту, отрутохімікати, азотні добрива, сечовина, плівки для парників тощо. У машинобудуванні та металургії застосовуються універсальні клеї, деталі й частини апаратів із пластмас, змащувальні мастила тощо.
У харчовій промисловості застосовуються поліетиленові упаковки, харчові кислоти як консерванти, парафін, білково-вітамінні концентрати, сировиною для яких є метанол, етанол і метан. Хімізація нафти дозволила скоротити витрати харчових продуктів на технічні цілі.
У фармацевтичній і парфумерній промисловості з похідних переробки нафти виготовляють нашатирний спирт, хлороформ, формалін, аспірин, вазелін тощо. Похідні нафтосинтезу широко застосовуються і в деревообробній, текстильній, шкіряно-взуттєвій і будівельній промисловостях.
7.Риформінг
Риформінг — каталітична переробка бензинових фракцій первинної перегонки нафти за допомогою водню під тиском із використанням каталізаторів та під дією високих температур. Під час риформінгу насичені вуглеводні перетворюються на ароматичні. Застосовується переважно для одержання високооктанового моторного пального. Крім того, за допомогою риформінгу виділяють бензол та інші арени.
8. Детонаційна стійкість бензину
Швидкість згоряння пального визначається його хімічним складом (вмістом вуглеводнів). Якщо у бензині переважають такі вуглеводні як гексан, гептан та октан, то швидкість згоряння буде дуже високою і може статися вибух — детонація. Отже, детонація палива в моторах пояснюється нерівномірністю процесу його згоряння й залежить від якості бензину. Мірою детонаційної стійкості палива є октанове число (ОЧ). Воно чисельно дорівнює вмісту (в об’ємних %) ізооктану (ОЧ = 100) у його еталонній суміші з н-гептаном (ОЧ = 0), за якого ця суміш має однакові з випробуваним паливом антидетонаційні властивості.
Найменше октанове число мають нормальні алкани. ОЧ зростає при переході від алканів до алкенів, циклоалканів та ізоалканів. Найбільшими значеннями ОЧ характеризуються арени.
|
Речовина |
Октанове число |
|
|
0 |
|
|
26 |
|
|
63 |
|
C6H12 (циклогексан) |
77 |
|
|
90 |
|
|
110 |
|
C6H6 (бензол) |
108 |
Бензини, одержані первинною перегонкою нафти, мають октанові числа
від 30 до 45.Так, із бензинової фракції нафти з ОЧ = 30–45 у результаті
аталітичного риформінгу одержують бензин з ОЧ = 85–95.
|
Клас:11 |
||||||||||
|
Урок: 10 |
||||||||||
|
Тема: Вивчення складу, властивостей, застосування природного, супутнього нафтового газів і нафти |
Мета: розглянути склад, властивості, застосування природного й супутнього нафтового газів, нафти й продуктів їх переробки; закріпити знання про природні джерела органічних речовин. |
|||||||||
|
|
Дома |
На уроці |
||||||||
|
діяльність учня |
Переглядають відео. Відповідають на питання для самоконтролю |
Слухають учителя За необхідністю ставлять питання вчителю |
Працюють з ключовими поняттями, теми (завд 10.1 |
"Дерево рішень" групи вирощують розгалуджене дерево предтвляючи свої роботи, задають питання один одному й учителю |
"Творча лабораторія"виконання завдань в групах (завд. 10.2) |
Взаємоперевірка "Замкнене коло",виставлення балів кожною групою за кожну роботу |
гра між групами "Хто швидше і ліпше"Дають відповіді на питання (екранзавд 10.3) |
робота в групах "Незакінчені речення" (завд. 10.4) |
взаємоперевірка в "мікрофон" |
|
|
Час |
|
2хв |
5 хв |
10 хв |
10 хв |
9 хв |
4 хв |
3 хв |
2 хв |
|
|
Діяльність учителя |
Готує навчальне відео, питання для самоконтролю |
Знайомить учнів з особливістю проведення уроку, вимогами, моделлю організації роботи |
Організовує роботу учнів та допомагає |
координує роботу учнів, дає відповіді на запитання |
координує роботу учнів |
Доповнює, уточнює, коментує,пояснює наявні помилки на дошці |
В ролі ведучого, координатора, коректора |
координує роботу учнів |
Організовує роботу учнів |
|
Завдання 10.1
Завдання для всіх груп
Знайти на економічній карті України місця розташування родовищ природних джерел вуглеводнів і виробництв із їх переробки.
З допомогою підручника та додаткової літератури опрацювати питання теми.
1 група
-Природні джерела вуглеводнів
11 група
-Природний газ, поширення у природі, утворення, добування, застосування
111 група
Супутній нафтовий газ, поширення у природі, добування, застосування
1У група - експертна
Завдання 10.2
Група№1
1.Напишіть структурні формули вуглеводнів, які можуть входити до складу природного й супутнього газів.
Група№2
2.Запишить рівняння реакцій добування з природного газу (метану):
а) водню; б) сажі;
в) ацетилену; г) хлорпохідних алканів.
Група№3
3. Напишіть рівняння реакцій, з допомогою яких можна здійснити перетворення:
![]() С -> СН4 --> С2Н2 ->С2Н4 -> С2Н5ОН
С -> СН4 --> С2Н2 ->С2Н4 -> С2Н5ОН
СН3С1-> СН2С12 -> СНС13 -> СС14
Група№4
4.Яку масу ацетилену можна отримати зі 100 л (н.у.) природного газу, який містить 95% метану?
Додаткове завдання для всіх груп
Природний газ одного з родовищ містить 80 % метану, 5 % етану, 5 % пропану, 4 % азоту й 6 % карбон(IV) оксиду. (Сполуки подані в об’ємних частках.) Обчисліть об’єм повітря (м3), необхідний для спалювання цього газу об’ємом 2 м3 (н. у.). Об’ємну частку кисню в повітрі слід прийняти такою, що становить 21 %.
Завдання 10.3
-Який склад має природний газ?
-Назвіть переваги застосування природного газу.
-Що таке супутній нафтовий газ?
-У чому відмінність складу супутнього газу від природного?
-На які суміші розділяють супутній газ і де їх застосовують?
-Які неорганічні й органічні речовини можна добувати з природного та супутнього газів?
Завдання 10.4
Закінчити речення
Група №1
1)Нафта — це_________________ рідина,________________ кольору, _________ за воду, у воді практично______________________ .
Група №2
2) Крекінг — це_____ вуглеводнів на більш______________ вуглеводні.
Група №3
3)Детонаційна стійкість_____________цс здатність бензину згоряти без ___________________ у двигуні з іскровим запалюванням.
Група №4
4) Чим вище октанове число, тим більше________________бензин перед ________________ і тим кращі експлуатаційні якості він має.
Розв'язуємо задачу (всі групи).
Бак автомобіля заповнений бензином, масова частка гептанових ізомерів у якому становить 20% і октапових — 80%. Який об'єм кисню потрібний для спалювання бензину масою ЗО кг (н. у.)?
Додатки до завдання 10.1
Природні джерела вуглеводнів
Природними джерелами вуглеводнів є горючі копалини - нафта й газ, вугілля й торф. Поклади сирої нафти й газу виникли близько 100-200 мільйонів років тому. Найпоширенішими є дві теорії походження нафти: органічна й мінеральна. Відповідно до першої теорії, пафта утворилася з мікроскопічних морських рослин і тварин, які виявилися включеними в осадові породи, що утворилися на дні моря. Теорію мінерального походження нафти вперше висловив Д. І. Менделєєв. На початку XX ст. французький учений П. Сабатьє змоделював описаний Д. І. Менделєєвим процес у лабораторії й одержав суміш вуглеводнів, подібну до нафти. На відміну від нафти й газу вугілля й торф почали утворюватися близько 340 мільйонів років тому з рослин, які зростали на суші. Природний газ і сира нафта зазвичай виявляються разом з водою в нафтоносних шарах, розташованих між шарами гірських порід. Термін «природний газ» застосовується також до газів, які утворюються в природних умовах у результаті розкладання вугілля. Природний газ і сира нафта розробляються па всіх континентах, за винятком Антарктиди. Найбільшими виробниками природного газу у світі є Росія, Алжир, Іран і Сполучені Штати. Найбільшими виробниками сирої нафти с Венесуела, Саудівська Аравія, Кувейт та Іран.
2. Нафта і вугілля
 Сира нафта являє собою маслянисту рідину, колір якої може бути найрізноманітнішим — від темно-коричневого або зеленого до майже безбарвного. У ній міститься велика кількість алканів. Серед них є перозгалужені алкани, розгалужені алкапи й цикло-алкани з числом атомів карбону від 5 до 40.
Сира нафта являє собою маслянисту рідину, колір якої може бути найрізноманітнішим — від темно-коричневого або зеленого до майже безбарвного. У ній міститься велика кількість алканів. Серед них є перозгалужені алкани, розгалужені алкапи й цикло-алкани з числом атомів карбону від 5 до 40.
У сирій нафті, крім того, міститься приблизно 10% ароматичних вуглеводнів, а також певелика кількість інших сполук, що містять сірку, кисень і азот.
Вугілля є найдавнішим джерелом енергії, відомим людству. Воно являє собою мінерал, який утворився з рослинної речовини в процесі метаморфізму. Метаморфічними називаються гірські породи, склад яких зазнав змін в умовах високого тиску, а також високих температур. Продуктом першої стадії в процесі утворення вугілля є торф, що являє собою продукт розкладу органічної речовини. Вугілля утворюється з торфу після того, як він покривається осадовими породами. Ці породи зменшують уміст вологи в торфі.
3. Природний газ
Дещо про природний газ ми вже знаємо, тому що вивчали метан, який є його складовою частиною. Крім метану в природному газі містяться його найближчі гомологи. Чим вище молекулярна маса вуглеводню, тим його менше міститься у складі природного газу.
Склад природного газу
|
Компоненти |
Формула |
Вміст, % |
|
Метан |
СН„ |
88-95 |
|
Етан |
с2н6 |
3 8 |
|
Пропан |
с3н8 |
0,7-2,0 |
|
Бутан |
с4н10 |
0,2-0,7 |
|
Пентан |
с6н12 |
0,03 0,5 |
|
Карбоп(ІУ) оксид |
со2 |
0,6 2,0 |
|
Азот |
N.. |
0,3 3,0 |
|
Гелій |
Не |
0,01-0,5 |
Природний газ, в основному, застосовують як пальне. Він має декілька переваг неред твердим і рідким паливом.
Переваги природного газу
Вища теплота згоряння
Не залишає золи
Продукти згоряння екологічно чистіші
Застосування природного газу:
-Теплові електростанції.
-Заводські котельні
-Промислові печі: доменні, мартенівські, скловарні тощо. У результаті: скорочення використання коксу, зниження вмісту сірки в чавуні, підвищення виробничої потужності печі.
-Для побутових потреб.
-Автотранспорт. У результаті: економія бензину, менше забруднення навколишнього середовища.
-Сировина для хімічної промисловості: добування багатьох органічних і неорганічних речовин.
4. Супутній нафтовий газ
Супутній пафтовий газ за своїм походженням також є природним газом. Існують поклади природного газу, що залягає разом із нафтою: він розчинився в ній та знаходиться над нею, утворюючи «нафтову шапку», і разом із нею виходить на поверхню зі свердловини. Це і є так звані супутні нафтові гази. Вони є сумішшію летких вуглеводнів, хоча, на відміну від природного газу, в них менший вміст метану — до 40 %, а більше його гомологів та інших газів. Суміш газів розділяють і використовують як паливо і як хімічну сировину. Суміш пропану й бутану зріджують і зберігають під тиском у балонах. Це дає змогу транспортувати газ у місця, не підключені до мережі газопроводів.
Раніше супутній нафтовий газ не використовувався, а спалювався на місці. Можливості використання супутнього газу значно ширші, ніж природного, тому що в ньому вміст гомологів метану більший і шляхом його переробки можна отримати більше хімічних речовин. Щоб застосування супутнього газу було раціональним, його розділяють па суміші більш вузького складу:
-по-перше, це суміш пентапу, гексану та інших рідких вуглеводнів, що утворює так званий газовий бензин;
-по-друге, суміш пропану з бутаном;
-по-третє, сухий газ, який складається з метану й етапу.
Газовий бензин застосовується як добавка до бензину для кращого згоряння під час запуску двигунів.
Пропан і бутан у зрідженому стані використовуються в побуті й автотранспорті.
Сухий газ, за складом схожий на природний, використовується для органічного синтезу і як паливо.
Додатковий матеріал до завдання 10.1
Огляд основних джерел вуглеводнів
Джерела енергії
|
Джерела енергії |
Запаси енергії, млрд кВт/г |
|
Торф |
480 103 |
|
Вугілля буре й кам’яне |
358 106 |
|
Сланці горючі |
7105 |
|
Природний газ |
8104 |
|
Нафта |
223 103 |
|
Деревина |
2105 |
|
Енергія Сонця |
15 107 |
|
Енергія вітру |
15 104 |
|
Енергія річок |
23 103 |
|
Енергія припливів і відливів |
7107 |
|
Енергія ядерного пального |
практично безмежна |
Значну частку необхідної енергії людство одержує з вуглеводнів: нафти, природного газу, кам’яного вугілля. Це зумовлюється наявністю відповідних технологій та достатньо легким способом добування. Щоб опанувати інші джерела енергії потрібні наукові розробки технологій добування і використання.
Окрім використання вуглеводнів як джерел енергії, вони використовуються як сировина для подальшої переробки й одержання важливих речовин шляхом органічного синтезу.
Основні джерела вуглеводнів — нафта, кам’яне вугілля, природний газ — сформувалися на Землі в давні часи і належать до невідновлюваних природних ресурсів. Неконтрольоване й нераціональне використання існуючих запасів вуглеводнів може призвести до повного виснаження родовищ.
Перед людством постає складне завдання: відшукати більш ефективні шляхи переробки нафти, газів, вугілля, сланців; удосконалити вже існуючі (перегонка, крекінг, піроліз, коксування); розробити технології одержання рідкого палива з вугілля та сланців; одержання й використання водню як моторного палива; одержання синтетичного рідкого палива з водню.
2. Природний і супутній гази
Найбільші родовища природного газу розташовані на території Росії. Склад газу з різних родовищ може відрізнятися за відсотковим вмістом основних складових. Запаси природного газу є і в Україні (Шебелінське, Дашевське, Семенівське, Абазівське родовища тощо).
У родовищах газ перебуває у стислому стані у товщі земної кори. Для його добування роблять свердловини, а для транспортування на великі відстані — будують газопроводи.
Супутній газ є різновидом природного газу. Він залягає разом із нафтою і виділяється на поверхню під час її добування.
Склад природного й супутнього газів
|
Складова газу |
Природний газ |
Супутній нафтовий газ |
|
Метан |
95,6 % |
63,4 % |
|
Етан |
1 % |
10,5 % |
|
Пропан |
0,33 % |
11,1 % |
|
Бутан |
0,07 % (н-бутан) |
2,8 % (н-бутан) і 1,2 % (ізо-бутан) |
|
Пентан і вище |
0,03 % |
2 % |
|
Азот і рідкі гази |
3 % |
9 % |
|
Вуглекислий газ |
0,4 % |
— |
Природний газ широко використовується як паливо, оскільки має високу теплотворну здатність (з 1 м3 газу виділяється при спалюванні 55 000 кДж енергії). Цю властивість природного газу використовують у промисловості для виробництва сталі та скла.
Окрім спалювання, природний газ використовують як сировину для хімічної промисловості (одержання ацетилену, сажі, водню тощо). Розроблені технології переробки природних газів (перетворення насичених вуглеводнів у ненасичені).
Супутній газ раніше не мав застосування, тому його спалювали на місцях видобування нафти. Зараз його використовують як цінну дешеву сировину та як паливо у побутових цілях. Для оптимального використання супутнього газу, його слід поетапно розділити:
супутній газ газовий бензин (суміш пентану, гексану, гептану й октану) суміш пропану й бутану «сухий газ» (складається переважно з метану).
|
Клас:11 |
|||||||||
|
Урок: 11 |
|||||||||
|
Тема:Кам’яне вугілля, продукти його переробки. Основні види палива та їх значення в енергетиці країни |
Мета:ознайомити учнів зі складом кам’яного вугілля, процесами та продуктами його переробки, основними видами палива та їх значенням в енергетиці країни; розглянути напрямки охорони навколишнього середовища від забруднень під час переробки вуглеводневої сировини та використання продуктів її переробки. |
||||||||
|
|
Дома |
На уроці |
|||||||
|
Діяльність учня |
Переглядають відео (Нуково-популярний фільм та відеоінструкції учителя). Відповідають на питання для самоконтролю |
Сідають групами.Слухають учителя. За необхідністю ставлять питання вчителю |
Працюють з ключовими поняттями, теми (завд_11.1) |
Кожна група презентує вою роботу, відповідаючи на раніше потавлені питання (завд.11.2) та на питання, які поступають |
Фіш-Боун в групах на ватмані по темі уроку, ключові завдання (11.1) поміняні між групами (завд.11.3) |
Обговорення результатів роботи в класі між групамиі, відповіді на запитання |
У групах проводять Лабораторний дослід № 3 Ознайомлення зі зразками коксування вугілля та різних видів палива. (завд. 11.4) |
Знайомляться з роботами інших груп |
|
|
Час |
|
2хв |
7 хв |
12 хв |
10 хв |
7 хв |
5 хв |
2 хв |
|
|
Діяльність учителя |
Готує навчальне відео, питання для самоконтролю |
Знайомить учнів з особливістю провед. уроку, вимогами, моделлю організації роботи |
Організовує роботу учнів |
Координує роботу учнів, дає відповіді на запитання |
Координує роботу учнів |
Доповнює, уточнює, коментує, дає зворотний зв'язок |
Координує роботу учнів |
Доповнює, уточнює, коментує |
|
Завдання 11.1
Група №1
Склад кам'яного вугілля. Продукти переробки вугілля.
Група №2
Застосування продуктів переробки кам'яного вугілля.
Група №3
Негативний вплив продуктів переробки вугілля на навколишнє середовище (парниковий ефект, фотохімічний смог, кислотні дощі).
Група №4
Методи запобігання забрудненню навколишнього середовища.
Завдання 11.2
Група №1
1.Яка існує теорія походження вугілля? Під час якого геологічного періоду утворилися основні запаси вугілля? Чому він так називається?
2. Види вугілля, його запаси на території України.
3. Переробка вугілля. Які основні методи переробки вугілля вам відомі?
4. Які продукти утворюються під час коксування вугілля? Де вони використовуються?
5. Які продукти утворюються під час газифікації вугілля? Де вони використовуються?
Група №2
1.Де використовуються продукти які утворюються під час коксування вугілля?
2.Де використовуються продукти які утворюються під час газифікації вугілля?
3. Як змінюється співвідношення використання видів палива у різні роки?
4. Спрогнозуйте, на яких видах палива у майбутньому буде ґрунтуватися енергетика.
5. Які види палива будуть зменшувати «свою частку» в світовій енергетиці? Чому?
Група №3
1.Як впливають на навколишнє середовище продукти переробки вугілля?
2.Що таке парниковий ефект, фотохімічний смог, кислотні дощі?
3. Як впливають зазначені явища на стан здоров’я людини? Наведіть приклади.
4. Що, крім атмосфери, зазнає забруднення? Як це відбувається?
5. Чи потерпають інші живі організми від наслідків енергетичної діяльності людини? Наведіть приклади.
Група №4
1.Яким чином можна позбутися або зменшити кількість шкідливих забрудників?
2.Що таке альтернативні види енергії?
3. Запропонуйте свої методи заохочення підприємств використовувати безпечні джерела енергії.






 Завдання 11.3
Завдання 11.3









![]()

Голова: тема ( завдання групі)
Хвіст: висновок
Ребра зверху : Ключові поняття
Ребра знизу: наслідки, значення, застосування, свої коментарі
Завдання 11.4
Лабораторний дослід № 3
Тема: ознайомлення за зразком продуктів коксування вугілля та різних видів палива.
Мета: дослідити властивості продуктів коксування кам’яного вугілля та різних видів палива.
Досліджувані об’єкти: колекція продуктів коксування та різних видів палива.
Хід роботи
1. Розгляньте запропоновані продукти коксування кам’яного вугілля.
2. Заповніть порівняльну таблицю, в якій слід зазначити фізичні властивості (агрегатний стан, колір, наявність запаху), особливості хімічного складу та галузь застосування.
3. Зробіть висновки (поясніть залежність застосування від хімічного складу та фізичних властивостей продуктів коксування).
Додатки до 11.1
Склад кам'яного вугілля. Продукти переробки вугілля
Вугілля — це тверда горюча копалина органічного походження, що утворилась із вимерлих рослин і планктону в результаті діяльності мікроорганізмів. Кам'яне вугілля, як і нафта, не індивідуальна речовина. До його складу входять вільний вуглець (до 10 %), органічні речовипи, що містять Карбон, Гідроген, Оксигеп, Сульфур, Нітроген, мінеральні речовини
Вам відомо, що вугілля використовується як паливо, але не менше зпачення надається хімічній переробці вугілля з метою вилучення величезної кількості цінних речовин. Унаслідок нагрівання до 1000 °С без доступу повітря вугілля перетворюється па кокс. Цей процес називається коксування. Кокс па 96-98 % складається з вуглецю. Разом із коксом утворюються коксовий газ, амоніакова вода й кам'яповугільна смола, що є багатим джерелом різноманітних речовин, — з пеї їх виділено близько 500. Осповна галузь застосуваппя коксу — металургія. Він необхідний для добуванпя заліза з РУД.
Застосування продуктів переробки кам'яного вугілля.
Перегонкою й хімічною обробкою кам'яновугільної смоли добувають ароматичні вуглеводні: толуен, нафталін, феноли, інші цінні речовини. Кам'яновугільна смола й коксовий газ перероблюються на коксохімічних заводах. У розвитку сиптетичпої органічної хімії кам'яновугільна смола відіграла особливу роль. Як джерело хімічних сполук кам'яне вугілля почало використовуватися раніше, ніж нафта і природний газ. Па основі продуктів, виділених із кам'яновугільної смоли, виникли цілі галузі хімічної промисловості — виробництво синтетичпих барвпиків, лікарських препаратів, засобів захисту рослин, вибухових речовин, тощо. Кам'яновугільна смола виявилася доступною сировипою для виробництва всіх цих продуктів, що уможливило їх багатотоннажне виробництво. Після фракціонування залишається чорна маса — пек, що застосовується в шляховому будівництві, для виготовлення електродів, кровельних матеріалів, лаків.
|
Компоненти |
Формула |
Вміст, % |
|
Водень |
На |
60 |
|
Метан |
сн4 |
5 |
|
Карбон(ІІ) оксид |
со |
5 |
|
Етилен |
С2ІІ4 |
2 |
|
Азот |
N2 |
4 |
|
Карбон(ІУ) оксид |
со2 |
2 |
|
Інші гази |
|
2 |
З амоніакової води вилучають амоніак і солі амонію й направляють на виробництво нітратних добрив.
Коксовий газ після очищення містить багато газів. Коксовий газ використовується як паливо в промисловості, а також як хімічна сировина. З нього виділяють водень для різних синтезів.
Отже, кам'яне вугілля — цінна хімічна сировина, яку вигідніше переробляти, ніж спалювати. Завдяки значній різноманітності його складу можна одержувати набагато більший асортимент продуктів, ніж із нафти та природного газу.
Негативний вплив продуктів переробки вугілля на навколишнє середовище
Коксовий газ після очищення містить багато газів. Коксовий газ використовується як паливо в промисловості, а також як хімічна сировина. З нього виділяють водень для різних синтезів.
Життя людини повсякденно пов'язане зі спалюванням горючих речовин у побуті, на транспорті, у промисловості. Крім користі, застосування нафтопродуктів, вугілля і природпого газу створює ряд проблем, негативних для розвитку цивілізації та загалом для виживання людства.
Тепловий баланс нашої планети підтримується завдяки тому, що діоксид Карбону й вода, які містяться в атмосфері, поглинають енергію сонячного випромінювання (інфрачервону частину спектра), а потім перевипромінюють її. Таким чином на планеті зберігається тепло. Поглинання і випромінювання енергії діоксидом Карбону та іншими речовинами спричиняє парниковий ефект. Отже, можна сказати, що ми живемо в умовах парникового ефекту, і це відповідає нормальному стану атмосфери, комфортному для нас. Проте посилення цього ефекту може мати згубні наслідки, зокрема — глобальне підвищення температури й, у зв'язку з цим, зміну клімату.
До цього може призвести підвищення концентрації вуглекислого газу за рахунок спалювання горючих речовин. Протягом останніх 100 років у результаті техногенної діяльності людини вміст вуглекислого газу в атмосфері невпинно зростає.
Крім парникового ефекту в результаті переробки й використання горючих корисних копалин атмосфера забруднюється шкідливими речовинами, такими як карбон(ІІ) оксид СО (від невпинного згоряння пального у двигунах), сульфур(ІУ) оксид S02 (утворюється із сірки, що міститься у вугіллі й бензині), метап СН4 (витік газу), гідроген сульфід Н2S (виділяється під час перегонки нафти), оксиди Нітрогену N0, N02 (нід час високотемпературного горіння) та ін. Усі ці речовини спричинюють фотохімічний смог, кислотні дощі тощо.
Фотохімічний смог утворюється в результаті реакцій, що відбуваються Під впливом сонячного світла (фотохімічні реакції). При цьому, крім наявних у повітрі забруднювачів, додатково утворюються діоксид Нітрогену й озон. Останній реагує з вуглеводнями, що виділяються в повітря від неповного згоряння пального. У результаті утворюються сполуки, небезпечні для здоров'я людей і шкідливі для довкілля. Фотохімічний смог уперше спостерігався в Лос-Анджелесі.
Крім цього, під час згоряння пального утворюється дим, в якому містяться дрібні частинки вуглецю і твердих вуглеводнів, що не згоріли, а також сполуки Кадмію, Плюмбуму, Меркурію та інших елементів, надзвичайно шкідливих для здоров'я.
Методи запобігання забрудненню навколишнього середовища
Яким чином можна позбутися шкідливих забрудників, що утворюються в результаті використання палива й пального?
По-перше, можна ощадливо використовувати ці продукти, тим самим зменшуючи кількість шкідливих викидів.
По-друге, можна вилучати з палива сірку ще до його використання.
По-третє, створювати технологічні умови для повного згоряння вугілля в котельнях, па теплоелектростанціях і бензипу у двигунах автомобілів.
По-четверте, можна вловлювати відходи після згоряння палива з допомогою фільтрів.
По-п'яте, можна замінити джерела енергії: замість енергії палива використовувати енергію сонця, вітру, води, ядерну та геотермальну енергію.
Додаткові матеріали до 11.1
1. Походження вугілля
Практично неможливо встановити точну дату (близько десяти тисяч років тому) початку використання людиною вугілля. Археологами знайдені доісторичні розробки покладів вугілля.
Пізніше, у Давньому Римі, поширилося його використання, але лише за часів Аристотеля з’явився опис властивостей вугілля. У 315 р. до н. е. його учень описує вугілля як горючий матеріал і називає його «антраксом» (пізніше з’явилося назва «антрацит»).
На підставі численних фактів (виявлення у вугільних пластах відбитків листя, кори, стовбурів дерев тощо) та використання ізотопного методу аналізу було доведено теорію про органічне походження вугілля. Разом із тим складність природних процесів вуглеутворення і впливу на ці процеси таких чинників, як клімат, температура, тиск тощо, призвели до виділення хімічних, мікробіологічних і геологічних аспектів цієї теорії. До сьогодні немає єдиної думки про те, які компоненти органічних речовин є вихідним матеріалом при утворенні різних видів вугілля, немає єдиної схеми його генетичних перетворень.
Для утворення вугілля необхідне значне накопичення рослинної маси. У торф’яних болотах палеозойської ери (кам’яновугільний період) накопичувалася органічна речовина, з якої без доступу кисню формувалися поклади вугілля. Більшість промислових родовищ викопного вугілля належить до кам’яновугільного періоду, хоча існують і пізніші родовища. Вік найдавнішого вугілля оцінюється приблизно в 350 млн років.
Вугілля утворюється в умовах, коли гниючий рослинний матеріал накопичується швидше, ніж відбувається його бактеріальне розкладання. Ідеальні умови для цього є в болотах, де в стоячій воді мало кисню, що перешкоджає життєдіяльності бактерій і тим самим зберігає рослинну масу від повного руйнування. На певній стадії процесу, кислоти, що виділяються, запобігають подальшій діяльності бактерій. Так виникає торф — початковий продукт для утворення вугілля. Потім відбувається його покриття наносними шарами і торф під дією стиснення втрачає воду і гази, перетворюючись на вугілля.
Під тиском товщі осадів глибиною 1 кілометр із 20-метрового шару торфу утворюється пласт бурого вугілля завтовшки 4 метри. Якщо глибина розміщення рослинного матеріалу досягає 3 кілометри, то такий же шар торфу перетвориться на пласт кам’яного вугілля завтовшки 2 метри. На глибині близько 6 кілометрів і при значно вищій температурі 20-метровий шар торфу стає пластом антрациту завтовшки в 1,5 метра.
У результаті руху земної кори, вугільні пласти зазнавали підняття і складкоутворення. З часом підняті нагору частини руйнувалися за рахунок ерозії, а нижчі зберігалися в широких неглибоких басейнах, де вугілля розташовано на рівні не менш, як 900 метрів під земною поверхнею.
2. Види вугілля, його запаси на території України
Види вугілля:
• буре вугілля;
• кам’яне вугілля;
• антрацити.
Види вугілля розрізняються за вмістом у його складі вільного вуглецю (до 10 %), органічних та неорганічних речовин.
Запаси вугілля на території України (117,1 млрд т) зосереджені переважно в трьох басейнах: Донецькому — 87,0 % (101,9 млрд т), Львівсько-Волинському 2,0 % (2,3 млрд т) та Дніпровському 3,5 % (4,1 млрд т).
Крім того, запаси вугілля є на території Харківської та Полтавської областей — 8,7 млрд т та Закарпатської — 0,2 млрд т.
Запасів вугілля в Україні цілком достатньо для задоволення власних потреб і забезпечення експортних поставок. Однак складні гірничо-геологічні та технологічні умови розробки вугільних родовищ України (в першу чергу Донбасу), суттєво впливають на економічну ефективність виробництва у вугільній промисловості.
3. Переробка вугілля
Коксування (суха перегонка) вугілля полягає в його хімічному розкладанні при нагріванні без доступу повітря.
Розрізняють два варіанти сухої перегонки вугілля — напівкоксування (швелювання) і коксування, перший процес здійснюється за температури 500–550 °С, друга — 900–1050 °С.
Головне завдання напівкоксування кам’яного вугілля — одержання рідких вуглеводнів (бензину); одночасно утворюються напівкокс і суміш газів (CO, CO2, H2, N2, CH4 та ін.). Напівкокс не можна застосовувати в металургії, його використовують у виробництві кальцій карбіду та для газифікації вугілля. Температура, за якої відбувається напівкоксування, не повинна перевищувати 550 °С, оскільки при більш високій температурі вихід рідких вуглеводнів зменшується. Із 1 т кам’яного вугілля одержують 110 м3 газу, 750–800 кг напівкоксу та 8 кг смоли й дьогтю.
Коксування кам’яного вугілля має велике промислове значення. Процес коксування здійснюється на коксохімічних заводах, де переробляють жирне вугілля (з виходом летких речовин 10–30 %), і на газових заводах, де переробляють газове вугілля (з виходом летких речовин 35–40 %). Процес проводять у щільно закритих камерних печах, що вміщають 30–40 т вугілля; печі обкладені жаростійкою силікатною цеглою. Між камерами розташовані канали, у яких спалюють частину газів, що відходять, для підтримки високої температури.
Газифікація — це перетворення органічної частини викопного вугілля на горючі гази під час високотемпературної (1000–2000 °С) взаємодії з окиснювачами (O2, повітря, водяна пара,CO2). При цьому вугілля майже повністю перетворюється на генераторний і водяний гази (твердий залишок — зола). Для газифікації використовують буре вугілля та продукт переробки кам’яного вугілля — кокс.
Газифікацію вугілля проводять у газогенераторах. Крізь шар коксу (товщиною 3 м) знизу нагору поперемінно пропускається повітря (гаряче дуття) і водяна пара (холодне дуття).
При гарячому дутті відбувається екзотермічний процес:
![]() ;
; ![]()
Утворений CO реагує з N2 (із повітря) і утворює генераторний (повітряний) газ. Його теплотворна здатність становить 4300 кДж / м3, що досить мало в порівнянні з теплотою згоряння природного газу (38 000 кДж / м3), тому генераторний газ використовують як паливо тільки в металургійному виробництві та на коксохімічних заводах.
При холодному дутті відбувається ендотермічний процес:
![]() ;
; ![]()
Утворена суміш CO і H2 називається водяним газом. Його теплотворна здатність 11 кДж / м3. Водяний газ використовується в багатьох промислових синтезах, наприклад при одержанні метанолу й амоніаку.
4. Продукти переробки кам’яного вугілля та їх застосування
Головні продукти переробки кам’яного вугілля:
• коксовий газ — використовують для обігрівання коксових печей, проте це застосування є нераціональним, оскільки його теплотворна здатність не дуже велика. Переважно коксовий газ використовують у хімічній промисловості — з нього одержують водень, етилен, із яких синтезують різноманітні речовини. Шляхом контакту з іншим продуктом (кам’яновугільною смолою) із коксового газу одержують технічний бензол — рідку суміш легкокиплячих аренів;
• амоніачна вода — з неї шляхом обробки вапняним молоком (водною суспензією кальцій гідроксиду) одержують амоніак;
• кам’яновугільна смола — є основним джерелом ароматичних вуглеводнів. Її розділяють шляхом перегонки на арени, феноли й похідні піридину, що є важливою сировиною для виробництва барвників, розчинників, вибухових речовин, лікарських і запашних препаратів, пестицидів тощо;
• залишок перегонки смоли — кам’яновугільний пек — використовується для виготовлення асфальту й ущільнюючих засобів;
• кокс, отриманий з вугілля, використовується в металургії у процесах виплавляння металів у доменних печах.
Основні види палива та їхнє значення в енергетиці країни
|
Джерела енергії |
Вироблення енергії, 1018 Дж |
|||
|
1972 р. |
1985 р. |
2000 р. |
2020 р. |
|
|
Вугілля |
66 |
115 |
170 |
269 |
|
Нафта |
115 |
216 |
195 |
106 |
|
Газ |
46 |
77 |
143 |
125 |
|
Ядерне паливо |
2 |
23 |
88 |
314 |
|
Разом |
229 |
431 |
596 |
814 |
Забруднення навколишнього середовища при використанні вуглеводневої сировини
Як переробка, так і використання продуктів переробки вуглеводневої сировини пов’язане з проблемою забруднення довкілля та необхідністю охорони навколишнього середовища. Але доки застосування нафти, природного газу та вугілля дає економічний ефект, доти неможливо припинити їхнє видобування та переробку. Тому проблема вдосконалення існуючих процесів та створення нових технологій у цих галузях промисловості є актуальною для всіх країн світу.
Хімічними речовинами, що найбільше забруднюють довкілля є: оксиди Карбону (CO та CO2); сульфур(IV) оксид, оксиди Нітрогену (NO та NO2), сірководень H2S, етан CH4 та багато інших.
До основних забрудників атмосфери належать:
• ТЕС, що працюють на викопних видах палива;
• автомобільний транспорт, що викидає у атмосферу небезпечні вихлопні гази;
• нафтопереробні та коксохімічні підприємства.
Одним із негативних наслідків безконтрольного забруднення атмосфери є парниковий ефект. Він спричиняється збільшенням кількості вуглекислого газу і має згубні наслідки — підвищення середньорічної температури і зміну клімату.
В результаті складних фотохімічних реакцій, у повітрі, забрудненому вуглеводнями, пилом, сажею й оксидами Нітрогену під впливом сонячного світла та підвищеної температури виникає смог. Оксиди Сульфуру та Нітрогену, що викидаються в атмосферу внаслідок роботи ТЕС та автодвигунів, сполучаються з атмосферною вологою й утворюють краплі сульфатної та нітратної кислот. Вони переносяться вітром у вигляді кислотного туману й випадають кислотними дощі
|
Клас: 11 |
||||||||||
|
Урок: 12 |
||||||||||
|
Тема: Синтез органічних сполук різних класів на основі вуглеводневої сировини |
Мета: З’ясувати напрямки синтезу органічних сполук різних класів на основі вуглеводневої сировини. |
|||||||||
|
|
Дома |
На уроці |
||||||||
|
Діяльність учня |
Переглядають відео (Нуково-популярний фільм та відеоінструкції учителя). Відповідають на питання для самоконтролю |
Сідають групами.Слухають учителя. За необхідністю ставлять питання вчителю |
В групах складають схеми на основі вивченого матеріалу (завд 12.1) |
Взаємоперевірка (ротація), пояснення схеми іншої групи, доповнення, обговорення, відповіді на питання, взаємооцінювання |
"Творча лабораторія", робота в групах (завд. 12.2) |
Взаємоперевірка.Виконання завдання"Асоціативний кущ" (завд. 12.3) |
Обговорення |
Самостійна робота, індивідуальне завдання кожному учню в групі (завд. 12.4) |
Ланцюжок, взаємоперевірка |
|
|
Час |
|
2хв |
7 хв |
10 хв |
15 хв |
3 хв |
2 хв |
4 хв |
2 хв |
|
|
Діяльність учителя |
Готує навчальне відео, питання для самоконтролю |
Знайомить учнів з особливістю проведення уроку, вимогами до кожного учня |
Організовує роботу учнів |
Організує роботу учнів, дає відповіді на запитання |
Організує і координує роботу учнів |
Координує роботу учнів |
Координує роботу учнів, дає відповіді на запитання |
Організує і координує роботу учнів |
Організовує роботу учнів |
|
Завдання 12.1
Група №1
Складіть схему продуктів коксування кам'япого вугілля.
Група №2
Складіть схему, яка відображає склад коксового газу й галузі його застосування.
Група №3
Складіть схему, яка відображає склад кам'яновугільної смоли та продукти, які з неї добувають.
Група №4
4.Складіть схему,яка відображає основні продукти первинної переробки вуглеводневої сировини.
Завдання 12.2
Виконують всі групи
Закінчіть рівняння реакцій:
а) СН4+С12-> б) С2Н4 + Н2-»
в) С2Н6+Вг-> г) С2Н2+Н20-»
д) СН4+02-> е) С2Н4 + НС1->
ж) С2Н4+Н20-> . з) С2Н4+02->
Напишіть рівняння реакцій, з допомогою яких можна здійснити перетворення:
С -> СН4 -> СН3С1 -» С2Н6 -» С2Н4 -> С2Н50Н -> С2Н50Na
↓
СО2
Розв'язуємо задачу.
У результаті спалювання 10 г антрациту утворилося 18 л карбон(ІУ) оксиду (н.у.). Обчисліть масову частку вуглецю в антрациті.
Завдання 12.3
Скласти схему за асоціаціями:
Група №1
Камяне вугілля
Група №2
Природні органічні сполуки
 Група №3
Група №3
Органічний синтез
Група №4

 Коксовий газ
Коксовий газ
![]()



![]()

![]()
![]()
![]()

![]()


Завдання 12.4
Складіть рівняння реакцій для здійснення ланцюга перетворень
I варіант
![]()
II варіант
![]()
III варіант
![]()
IY варіант
![]()
![]()
![]()
![]()
![]() С8Н18 С24Н10 СН4 С2Н2 СО2
С8Н18 С24Н10 СН4 С2Н2 СО2
V варіант
![]()
![]()
![]() С2Н6 С2Н4 С2Н5ОН СО2
С2Н6 С2Н4 С2Н5ОН СО2
Додатковий матеріал до 12.1
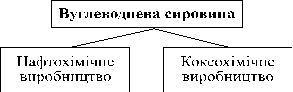
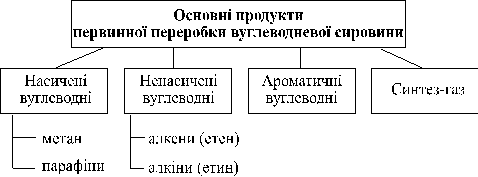
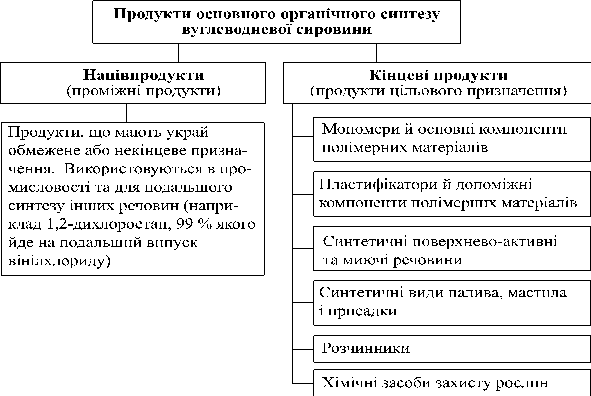
- Складання схеми синтезу органічних речовин різних класів на основі вуглеводневої сировини
2. Одержання вуглеводнів та їх застосування
1. Методи одержання алканів
Промислові методи:
1. Насичені вуглеводні з довжиною ланцюга до одинадцяти атомів Карбону одержують переважно методами:
• фракційної перегонки нафти;
• переробки природного газу;
• гідрогенізації вугілля: ![]()
2. Синтез Фішера — Тропша ![]() .
.
Лабораторні методи:
1. Гідроліз алюміній карбіду:
![]()
2. Синтез Вюрца:
![]() ;
;
![]() .
.
3. Гідрування (гідрогенізація) алкенів:
![]()
2. Одержання ненасичених вуглеводнів
Алкенів
Промислові методи:
Крекінг алканів нафти
|
|
|
|
|
|
|
|
|
Лабораторні методи:
1. Дегідратація спиртів:
![]() ;
;
![]() .
.
2. Відщеплення галогенів (Cl, Br):
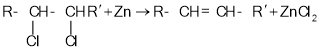 .
.
3. Гідрування алкінів:
![]() .
.
Промислові методи отримання етину:
1. Гідроліз кальцій карбіду:
![]() ;
;
![]() .
.
2. Піроліз метану:
![]() .
.
Лабораторні методи:
1. Одержання через галогенопохідні:

. Застосування вуглеводнів
Насичені вуглеводні
Метан. Оскільки внаслідок згоряння метану виділяється велика кількість теплоти, його використовують як дешеве паливо у побуті та в багатьох промислових процесах (доменному, скловарному). Продукт хімічної переробки метану — вуглець (у вигляді сажі) — використовують для виготовлення гуми, друкарської фарби; водень — для синтезу амоніаку та гідроген хлориду.
Продукти неповного окиснення метану є вихідними речовинами для виготовлення пластмас. Із метану добувають етин.
Пропан і бутан — гази, що легко скраплюються. Це зумовлює їх використання у побуті як палива. Ці алкани є сировиною для добування багатьох органічних речовин.
Парафін — суміш твердих вуглеводнів (C18—C35) — використовують у медицині, виробництві мийних засобів, пластмас, свічок, жувальної гумки.
Озокерит (гірський віск) — суміш вуглеводнів нафтового походження, використовують у медицині.
Ненасичені вуглеводні
Застосування етену:
• добування 1,2-дихлороетану (розчинник, інсектицид);
• добування хлороетану (анестезуюча речовина);
• добування етанолу (для синтетичного каучуку, барвників, ліків);
• добування поліетилену (для ізоляційних матеріалів, корозійно-стійких покрить тощо).
Застосування етину:
• газове зварювання і різання металів;
• добування хлоропохідних (розчинників);
• добування хлоровінілу (для добування поліхлорвінілу);
• добування етанової кислоти;
• добування хлоропрену (для виробництва синтетичного каучуку).
3. Одержання оксигеновмісних органічних сполук та їх застосування
Насичені одноатомні спирти (метанол й етанол)
Добування метанолу:
![]() .
.
Добування етанолу:
1. Зброджування цукристих речовин:
![]() .
.
2. Гідроліз крохмалю та клітковини з наступним зброджуванням утвореної глюкози:
![]() .
.
![]() .
.
3. Гідратація етену:
![]() .
.
Застосування
Найважливіші промислові продукти серед спиртів — метанол і етанол.
Застосування одноатомних спиртів
|
Речовина |
Застосування |
|
|
Добування метаналю (для виробництва пластмас) |
|
В органічному синтезі |
|
|
Як розчинник |
|
|
Добування бутадієну (для виробництва синтетичного каучуку) |
|
|
Етанол
|
Добування діетилового етеру (для фармацевтичної промисловості) |
|
Добування хлороетану (засіб знеболювання) |
|
|
Добування етанової кислоти |
|
|
Як розчинник |
|
|
Як пальне (у суміші з бензеном) |
Багатоатомні спирти
Методи добування багатоатомних спиртів
Двохатомні спирти добувають окисненням алкенів:
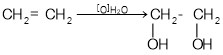 .
.
Гліцерол добувають омиленням жирів:
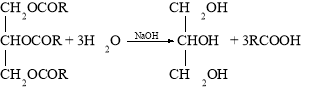
Застосування багатоатомних спиртів ґрунтується не лише на їхніх хімічних, а й фізичних властивостях. Наприклад, завдяки низькій температурі замерзання етиленгліколь входить до складу антифризів — рідин для охолодження двигунів. Завдяки гігроскопічності гліцерол входить до складу зм’якшувальних засобів у парфумерії, фармації, шкіряній і текстильній промисловості. Продукт нітрування гліцеролу (нітрогліцерол) — вибухова речовина, а розчин цієї сполуки використовується як серцеві ліки.
Застосування багатоатомних спиртів
|
Речовина |
Застосування |
|
Етиленгліколь |
Виробництво полімеру для синтетичного волокна лавсан |
|
Виробництво вибухових речовин |
|
|
Як антифриз |
|
|
Виготовлення розчинників |
|
|
Гліцерол
|
Добування синтетичних смол для лакофарбової промисловості |
|
У медицині, парфумерії як пом’якшуючий засіб |
|
|
У шкіряному виробництві та текстильній промисловості |
|
|
Виробництво вибухових речовин |
Карбонові кислоти
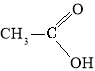
Добування
Загальний спосіб добування карбонових кислот— окиснення спиртів та альдегідів. Перспективними є способи добування карбонових кислот окисненням алканів.
Окиснення етанолу:
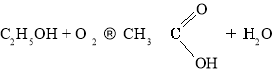
Окиснення етаналю:
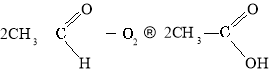
Окиснення бутану:
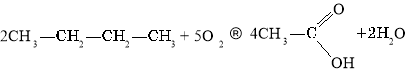
Застосування
|
Речовина |
Застосування |
|
Етанова кислота
|
Виробництво барвників |
|
Виробництво лікарських препаратів |
|
|
Виробництво ацетатного волокна |
|
|
Як розчинник |
|
|
Як консервуючий засіб |
|
|
Добування естерів (розчинники, запашні речовини) |
|
|
Виробництво хімічних засобів захисту рослин |
Естери, жири
Продукти взаємодії карбонових кислот і спиртів належать до класу естерів. Реакція їх утворення називається реакцією естерифікації.
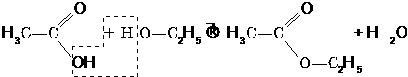
Жири — це естери трьохатомного спирту гліцеролу і вищих (насичених і ненасичених) карбонових кислот.
Застосування
Естери, що мають приємний квітковий чи фруктовий запах, використовують
у парфумерній та харчовій промисловості, з них виготовляють есенції.
Естери застосовуються як добрі розчинники органічних речовин. Деякі естери використовують у медицині.
Жири — це необхідна складова частина їжі. Також їх широко використовують у промисловості для добування жирних кислот, мила, гліцеролу.
Вуглеводи
Сахароза — цінний харчовий продукт, тому її добувають у великій кількості. Добування цукру полягає у виділенні його з природної сировини (цукрових буряків), очищенні та перекристалізації продукту.
Крохмаль є цінною хімічною сировиною, його добувають із природної сировини механічним способом. Проміжні продукти гідролізу використовують у кондитерській промисловості. З крохмалю виробляють етиловий спирт. Для цього крохмаль піддають гідролізу, а глюкозу, що утворилась, за допомогою спиртового бродіння перетворюють на спирт. У текстильній промисловості крохмаль використовують для проклеювання тканин, у паперовій — для склеювання паперу і картону, у медицині — для виготовлення лікарських препаратів.
Целюлозу (C6H10O5) використовують у текстильній промисловості (виробництво тканин, ниток); у виробництві штучних волокон; кіноплівки; нітролаків; у будівництві; у виробництві паперу; для добування етанолу.
4. Одержання нітрогеновмісних органічних сполук і їх застосування
Аміни
Велике промислове значення має анілін, він є сировиною для виробництва барвників, лікарських засобів, пластмас, вибухових речовин тощо.
Основний спосіб добування аніліну — відновлення нітробензену воднем за температури 250—350оС та наявності каталізатора:
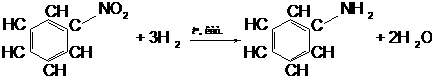
Ця реакція відновлення нітробензену до аніліну відома в історії хімії як реакція
М.М. Зініна (1842 р.).
Амінокислоти
Амінокислоти використовуються:
• у тваринництві (для підгодівлі тварин);
• у виробництві синтетичних волокон;
• у медицині (як зміцнюючий і лікувальний засіб).
Білки
Білки є основним будівельним матеріалом тваринних організмів, а саме їх клітин. Білки їжі безпосередньо не засвоюються організмом, спочатку вони гідролізуються до амінокислот. Ті, у свою чергу всмоктуються у кров, нею переносяться до печінки, де організм синтезує білки, властиві саме йому.
|
Клас:11 |
||||||||
|
Урок:13 |
||||||||
|
Тема: Охорона навколишнього середовища від забруднень під час переробки вуглеводневої сировини та використання продуктів її переробки |
Мета: оцінити вплив продуктів переробки вуглеводневої сировини і відходів цих виробництв на довкілля, поглибити знання про вуглеводневу сировину та її переробку |
|||||||
|
|
Дома |
На уроці |
||||||
|
Діяльність учня |
Переглядають відео. Відповідають на питання для самоконтролю |
Сідають групами. Слухають учителя. За необхідністю ставлять питання вчителю |
В групах опрацьовують питання (завд_13.1) та завдання (13.2) |
Знайомляться з роботами інших груп |
Диспут: "За" і "Проти",обговорення вислову Тейяр де Шарден (завд.13.3) |
"Творча лабораторія".Вправа "Творча уява", моя мрія здійсниться , якщо… (завдання 13.4) |
Обговорення в класі з записами схеми на ватмані |
|
|
Час |
|
2хв |
7 хв |
3 хв |
20 хв |
3 хв |
10 хв |
|
|
Діяльність учителя |
Готує навчальне відео, питання для самоконтролю |
Знайомить учнів з особливістю проведення уроку, вимогами до учнів |
Організовує роботу учнів |
Організує роботу |
Доповнює, уточнює, коментує, дає зворотний зв'язок |
Організує і координує роботу учнів |
Координує роботу учнів |
|
Завдання 13.1
Група №1
Які екологічні наслідки виробництва енергії із вуглеводневої ировини?
Група №2
Що таке «Парниковий ефект»?
Група №3
Які проблеми пов’язані з кислотними дощами?
Група №4
Що таке « Фотохімічний смог»?
Завдання 13.2
Група №1
Які ви знаєте альтернативні джерела енергії?
Група №2
У який спосіб можна використовувати сонячне випромінювання?
Група №3
Як можна одержати енергію з біомаси?
Група №4
Ваші пропозиції отримання альтернативних джерел енергії.
Завдання 13.3
Чотири групи.
Одна група «За», друга група «Проти», третя група шукає компромісу, четверта група- експерти.
Обговорення вислову
Однією з найбільш гострих проблем сучасності є збереження навколишнього середовища. Будь-які успіхи науково-технічного прогресу будуть знецінені, якщо вони супроводжуються руйнуванням природи. Людина не зможе жити без чистого повітря, вільного від шкідливих домішок, води та продуктів харчування.
Тейяр де Шарден
— Чи можна на сучасному етапі розвитку цивілізації повністю відмовитися від шкідливих промислових технологій?
— Як поєднати науково-технічний прогрес і охорону природного середовища?
--Які у вас аргументи «За» і «Проти»
--Чи є у вас свої пропозиції зниження екологічної безпеки?





![]() Завдання 13.4
Завдання 13.4
Вправа "Творча уява", моя мрія здійсниться , якщо…
Кожна група формулює своє бачення екологічної безпеки в майбутньому і представляє на розгляд інших груп.
Гуртом вирішують як цього досягти, заповнюючи відповіді як сонячні промені

![]()
![]()
![]()
![]()
![]()
![]()
![]()

![]()
![]()
![]()

![]()
Додатковий матеріал до 13.1
Екологічні наслідки виробництва енергії
Парниковий ефект
Парниковий ефект обмежує кількість теплової енергії, що випромінює Земля в космічний простір. Одночасне нагромадження пилу у верхніх шарах атмосфери призводить, навпаки, до охолодження Землі, оскільки підсилює відбиття сонячного випромінювання земною атмосферою.
Та частина сонячного випромінювання, що пройшла крізь озоновий шар і досягала поверхні Землі, складається з ультрафіолетового, видимого світла та інфрачервоного випромінювання. Інфрачервоне випромінювання називають ще тепловим, оскільки підвищує температуру речовин. Нагріта земна поверхня в свою чергу стає джерелом інфрачервоного випромінювання. Його поглинають випари води, вуглекислий газ, метан й інші компоненти атмосфери, створюючи парниковий ефект. Без парникового ефекту Земля була б безжиттєвою пустелею: усе її тепло йшло б у космос, температура на її поверхні становила б –15 °С, а не +18 °С як зараз.
Однак збільшення промислових викидів і ріст концентрації CO2 в атмосфері може призвести до глобального потепління клімату. Тоді внаслідок танення полярного льоду підніметься рівень Світового океану, і частина суші виявиться затопленою.
Проблема задоволення зростаючих потреб людства в енергії зараз полягає не в тім, щоб зберегти навколишнє середовище та звести до мінімуму його руйнування, а в тім, щоб як найефективніше використати навколишнє середовище. У деяких країнах, що розвиваються, зростає небезпека того, що звичайні харчові сільськогосподарські культури будуть витиснуті з полів культурами, що використовуються як сировина для одержання пального. Це означає, що бідняки залишаться без їжі, а багатії будуть їздити в автомашинах. Країни, що розвиваються, змушені дотепер використовувати деревину як основний вид палива. У деяких країнах до 90 % виробленої енергії одержують спалюванням деревини, спричиняючи тим самим величезну шкоду навколишньому середовищу.
Кислотні дощі
Уперше про кислотні дощі заговорили ще в 1852 році. Людина на прізвище Сміт, яка проживала в Манчестері, зібрала у фотографічну кювету дощову воду й чомусь додала туди розчин солі Барію. Вода стала мутною. Оскільки це відома якісна реакція на сульфат-іон (SO42-), то стало зрозуміло, що в дощовій краплі є сульфатна кислота. Хоча задовго до Сміта в 1696 році Р. Бойль також виявив кислу реакцію дощової води, але він так і не визначив, чому це відбувається. Тому довгий час вважали, що в краплинах дощу розчиняється CO2 й утворюється слабка карбонатна кислота. Коли Сміт виявив сульфатну кислоту, йому не одразу повірили, і почали перевіряти його результат ще раз. Виявилося, що, крім сульфатної, у дощовій краплі є ще й нітратна кислота, потім знайшли метанову, а згодом — щавлеву й етанову. Чому ж саме в середині XIX століття вдалося виявити цілий набір кислот у дощових краплях, причому найпростішими способами? Справа в тому, що це був початок технологічної й індустріальної революції: в Англії з’явилися перші майстерні, підприємства та котельні, де у великій кількості спалювали вугілля. А спалювання будь-якого викопного палива, твердого або рідкого, дає не тільки вуглекислий газ(CO2), але й сульфур(IV) оксид (SO2). Спочатку вважали, що механізм утворення сульфатної кислоти простий — це звичайне розчинення сульфур(IV) оксиду в дощовій краплі, але, цей механізм виявився значно складнішим. Спочатку вчені навіть зраділи кислотним дощам, адже кожна хмара приносила на поля не тільки вологу для ґрунту, але й добриво — Сульфур і Нітроген. Але радість була передчасною.
Проблеми, пов’язані з кислотними дощами
Якщо розташувати проблеми, пов’язані з кислотними дощами, у міру убування їхньої шкідливості, то вийде такий ряд:
• Зниження врожайності основних сільськогосподарських культур (пшениці, жита, кукурудзи тощо), оскільки в закиснених ґрунтах гине ґрунтова біота. Тільки деякі рослини (кропива, щавель, виноград) люблять кислий ґрунт. Захистити ґрунт від кислотних дощів дуже важко, хоча це намагаються зробити, вносячи в нього вапняк. Але масштаб природних явищ і людських дій не можна порівняти.
• Загибель лісів. Через кислотні дощі дерева втрачають імунітет, хворіють на різні нетипові хвороби, у них знижується фотосинтез, і вони гинуть. На сьогодні уражена значна частина лісів Європи, а в США й Канаді масштаби шкоди вражають. Такі ліси мають вигляд як після пожежі: голі стовбури й жодного листочка. Картина, треба зізнатися, страшна.
• Загибель водойм (озер). Від кислотних дощів гине водна біота. Не залишається ані риб, ані равликів, ані черв’яків. Відбувається це поступово: під дією кислоти розчиняються алюмосилікатні породи (там, де вони є) з утворенням токсичних речовин. Загибель всієї біоти вчені спостерігають при такому рівні pH, коли концентрація Алюмінію у водоймі досягає летальної дози. У минулі роки «загинули» вже тисячі озер у США, Канаді й Швеції (правда, є надія, що на цьому процес зупиниться).
• Корозія й руйнування вапняних, кам’яних будинків, металевих дахів і різних споруд. У XIX столітті в Європі саме із цієї причини стали покривати дахи черепицею — вона служить набагато довше.
Для дощової краплі потрібна сіль або пил
Отже, дощова крапля містить цілий набір кислот, а також йони амонію, Феруму, Натрію, Кальцію, Мангану, Магнію. Щоб зрозуміти, як збирається такий хімічний букет, треба згадати, як утворюється хмара. Зазвичай небо Землі більш ніж наполовину вкрито хмарами. Всі вони існують близько години, потім 85 % хмар розсіюється, а інші випадають у вигляді дощу. Якщо хмара потрапляє до зони з меншою вологістю або більш високою температурою, то дощу не буде: краплі випаруються й хмара, тепер уже газова, буде рухатися далі. Так, випаровуючись і конденсуючись знову, хмара може переміщуватися на значні відстані, до 2000 км. Тому хмара, що утворилася в одній країні, може випасти кислотним дощем в інший, розташованій далеко від місця забруднення. Це називається трансграничним перенесенням: хмара утвориться у Німеччині, а випадає на Швецію або Данію, утвориться в США, а озера гинуть у Канаді...
Переважна частина хмар розташована в тропосфері, на висоті 1–5 км. Водяна пара піднімається угору, де значно нижчі температури (температура зменшується з висотою близько 6 °С на кілометр), тому спочатку ненасичена водяна пара угорі стає насиченою. У цьому стані випари мають сконденсуватися, тобто перетворитися на краплю, але цього не відбувається, оскільки краплі потрібний центр конденсації. Над поверхнею океану, там, де найбільше утворюються хмари, цими центрами конденсації є кристалики солі (NaCl). Вони з’являються через те, що вітер підхоплює з поверхні океану краплі морської води, висушує їх, і кристалики, що утворилися, піднімаються вгору. А сіль — це гідрофільна сполука, на яку осідає вода, тобто конденсується. Крапелька швидко росте й через п’ять хвилин досягає розміру 10 мікронів. Це стійкий розмір існування водяної краплі, і саме в цьому стані вона «живе» близько години. У такий спосіб утворюються хмари над морем чи океаном.
Над індустріальною зоною центрами конденсації крапель є інші аерозольні частинки, наприклад оксиди Феруму й Мангану. Їх викидають у повітря промислові підприємства, наприклад теплові електростанції, що працюють на вугіллі або мазуті. На ТЕС сполуки, що містилися у вугіллі або нафті, згоряють і потрапляють в атмосферу у вигляді прожарених, повністю збезводнених оксидів. Такі прожарені оксиди є гідрофільними й тому стають центрами конденсації для хмарних крапель. От чому в дощових краплях містяться йони Феруму й Мангану, причому в значних концентраціях (до 10-6 моль/л). А ще — йони Кальцію, Магнію, амонію.
Екологічний аспект енергетичної проблеми
Однією з найважливіших проблем, пов’язаних з використанням горючих копалин є проблема забруднення навколишнього середовища. Усім відомі проблеми, пов’язані із забрудненням моря нафтою. Спалювання горючих копалин призводить до загального забруднення атмосфери. Щохвилини у світі спалюються сотні мільйонів тонн вугілля. Продуктами його спалювання, крім корисної енергії, є дим, сажа, оксиди Карбону й Сульфуру. На сучасних теплоелектростанціях, що працюють на вугіллі, видалення пилу й окалини з газів здійснюється за допомогою спеціальних фільтрів. Потім очищені гази через високу трубу випускаються у верхні шари атмосфери. Це призводить до виникнення так званого парникового ефекту та багатьох інших негативних наслідків.
Забруднення навколишнього середовища при використанні вуглеводневої сировини
Як переробка, так і використання продуктів переробки вуглеводневої сировини пов’язане з проблемою забруднення довкілля та необхідністю охорони навколишнього середовища. Але доки застосування нафти, природного газу та вугілля дає економічний ефект, доти неможливо припинити їхнє видобування та переробку. Тому проблема вдосконалення існуючих процесів та створення нових технологій у цих галузях промисловості є актуальною для всіх країн світу.
Хімічними речовинами, що найбільше забруднюють довкілля є: оксиди Карбону (CO та CO2); сульфур(IV) оксид, оксиди Нітрогену (NO та NO2), сірководень H2S, етан CH4 та багато інших.
До основних забрудників атмосфери належать:
• ТЕС, що працюють на викопних видах палива;
• автомобільний транспорт, що викидає у атмосферу небезпечні вихлопні гази;
• нафтопереробні та коксохімічні підприємства.
Що, крім атмосфери, зазнає забруднення? Як це відбувається?
Одним із негативних наслідків безконтрольного забруднення атмосфери є парниковий ефект. Він спричиняється збільшенням кількості вуглекислого газу і має згубні наслідки — підвищення середньорічної температури і зміну клімату.
В результаті складних фотохімічних реакцій, у повітрі, забрудненому вуглеводнями, пилом, сажею й оксидами Нітрогену під впливом сонячного світла та підвищеної температури виникає смог. Оксиди Сульфуру та Нітрогену, що викидаються в атмосферу внаслідок роботи ТЕС та автодвигунів, сполучаються з атмосферною вологою й утворюють краплі сульфатної та нітратної кислот. Вони переносяться вітром у вигляді кислотного туману й випадають кислотними дощами.
Додаткова інформація
- Вміст вихлопних автомобільних газів
Карбон(II) оксид. Отруйний газ без кольору і запаху. При вдиханні сполучається з гемоглобіном крові. Невеликі концентрації викликають запаморочення, головний біль, почуття втоми й уповільнення реакції у водія. Висока концентрація навіть при короткочасному впливі може призвести до смерті. Кисневе голодування насамперед руйнує головний мозок і особливо небезпечно для серцевого м’яза, спричиняє захворювання серця — стенокардію.
Альдегіди. Належать до отруйних речовин, подразнюють очі, дихальні шляхи, вражають нирки й печінку.
Оксиди Нітрогену. Розчиняючись у воді, утворюють нітратну і нітритну кислоти, є причиною кислотних дощів. Ці кислоти утворюються у верхніх дихальних шляхах організму, роз’їдаючи їх.
Сажа. Діє на органи дихання, але найнебезпечнішим є те, що на поверхні часток сажі осідають канцерогенні речовини.
Канцерогенні речовини (зокрема бензопірен). Дуже небезпечні для людини навіть у малій концентрації, оскільки накопичуючись в організмі, ці речовини спричиняють ракові захворювання.
Сполуки Плюмбуму. Отрути, що вражають центральну нервову систему, шлунково-кишковий тракт, порушують процеси обміну речовин. Накопичуються в організмі до небезпечних концентрацій. Поблизу автомагістралей вони накопичуються в ґрунті та рослинах.
Гідроген сульфід (сірководень). Із водяною парою в атмосфері утворює сульфатну кислоту. Тривале вдихання спричиняє порушення діяльності нервової системи.
Додатковий матеріал до 13.2
Альтернативні джерела енергії
Пряме перетворення сонячної енергії
У який спосіб можна безпосередньо використовувати сонячне випромінювання?
1. Найважливішим способом прямого перетворення сонячної енергії є використання сонячних панелей. Їх виготовляють із металів, оскільки вони є гарними провідниками тепла. Найчастіше використовується мідь.
На панель наносять покриття чорного кольору, щоб вона краще поглинала сонячне світло. Сонячні панелі зазвичай розміщують на дахах будинків і використовують для обігріву осель.
2. Перетворення сонячної енергії на електричну можливе за допомогою фотоелементів. Проте вони мають невисоку ефективність: їхній коефіцієнт корисної дії не перевищує 20 %. Важливим завданням є підвищення ефективності фотоелементів. Одна з можливостей їхнього поліпшення полягає у використанні скляних панелей, що містять оксид Урану й рідкоземельний елемент Неодим, що підсилює поглинання світла фотоелементом.
3. В останні роки велику увагу вчених привернуло використання сонячної енергії для одержання водню (як пального) з води. Водень — найпоширеніший елемент у Всесвіті, проте цього не можна сказати про Землю. Більша частина Гідрогену в земних умовах перебуває у формі води. Отриманий будь-яким способом водень можна перетворити потім в інші види пального, наприклад у метанол. Найпростішим способом одержання водню з води є електроліз. Ефективність цього процесу досягає 83 %. Однак зараз ще економічно невигідно використовувати електроенергію, що вироблена за допомогою сонячної енергії шляхом її електролізу.
Більш привабливим є пряме використання сонячної енергії для одержання водню з води за допомогою її фотохімічного розкладання. Цей процес називається фотолізом. На сьогодні розглядаються два головних підходи до рішення цієї проблеми — біологічний і біохімічний.
4. У рамках біологічного підходу для розкладання води на водень і кисень використовуються живі організми. Цей процес називається біофотолізом. При біохімічному підході для одержання водню з води використовуються ферменти, отримані з живих організмів. Цим методом уже вдається одержувати водень із води, однак швидкість і тривалість цього процесу поки ще незадовільні.
5. Ще одне перспективне джерело енергії — це використання сонячних колекторів, здатних концентрувати сонячне випромінювання і досягати високих температур, необхідних для термохімічного розкладання води. Цей процес запишемо рівнянням
![]()
Одержання енергії з біомаси
Біомаса складається з будь-яких речовин тваринного й рослинного походження. Їжа, деревина, органічні відходи тварин і рослин — усе це різновиди біомаси. Біомаса є важливою формою запасання енергії. Наприклад, вуглеводи, жири й білки, що містяться у їжі, забезпечують енергією людський організм. Людство вже давно використовує деревину як паливо. В останні десятиліття біомаса цікавить учених і технологів як джерело таких видів пального, як біогаз і спирт.
Біогаз — подібно до природного газу — це переважно метан. Для одержання біогазу широко застосовуються певні біологічні процеси при очищенні побутових і сільськогосподарських стічних вод. На заводах для одержання біогазу як сировину використовують відходи тваринного й рослинного походження, що перегнивають у генераторах або автоклавах. У цих установках гниття відбувається без доступу кисню, тобто в анаеробних умовах, за яких певні різновиди бактерій розкладають відходи з утворенням газоподібного метану. Газоподібний метан збирають, і потім безпосередньо використовують для опалення осель, готування їжі, або для одержання електричної енергії за допомогою електрогенераторів.
Виробництво біогазу швидко збільшується в країнах, що розвиваються. У Китаї розміщено близько 4,3 млн установок, що виробляють біогаз, і підготовлено близько 100 000 фахівців для їхнього обслуговування. В Індії діє понад 60 000 установок з виробництва біогазу.
Використання «зелених відходів» у країнах, що розвиваються, виявляється привабливим із кількох причин. По-перше, такий біогаз можна одержувати в сільській місцевості. По-друге, залишки після одержання біогазу із зелених відходів мають високий вміст Нітрогену й можуть використовуватися як добрива. Землі, що є непридатними для вирощування зернових культур, можуть бути використані для вирощування біомаси з метою наступного одержання біогазу. Багато водяних рослин, наприклад водяні гіацинти, що засмічують канали й водойми в деяких країнах, теж можуть бути використовані для одержання біогазу. Нарешті, використання біогазу дозволяє зменшити витрати деревини як пального.
Іншим різновидом біопалива є спирт, що вже давно використовується як пальне, наприклад у лампах-спиртівках або в суміші з бензином. Спирт можна одержувати з таких рослин, як, наприклад, цукровий очерет і маніок, шляхом ерментації (зброджування) і перегонки. Бразилія виробляє його із зернових культур, а також розробляє й випускає автомашини із двигунами, що працюють на суміші бензину зі спиртом.
Певний інтерес фахівці виявляють до використання деякої рослинної олії як дизельного палива й мастильних матеріалів.
Останнім часом в цьому напрямку проводяться випробування олії, що одержують із соєвих бобів, соняшника, земляних горіхів (арахісу), суріпки (рапсу), евкаліпта, гарбуза, а також пальмової, кокосової й касторової олії.
За даними Всесвітньої енергетичної конференції, видобуток нафти й газу скоро досягне максимуму. Разом з цим одержання енергії з вугілля, ядерного пального, а також сонячних і геотермальних джерел у найближчі 30 років буде постійно зростати. У більш віддаленому майбутньому переважними джерелами
енергії стануть ядерний розподіл, ядерний синтез, а також сонячна енергія. Однак сьогодні ще не визначено, до якого ступеня є можливою розробка зручної, безпечної й економічно вигідної технології одержання енергії з цих джерел.
Тривалість експлуатації нафтопровідної системи
|
Термін експлуатації |
% нафтопроводів |
|
Більш 30 років |
26% |
|
20 - 30 років |
29% |
|
Менш 20 років |
45% |
|
Клас:11 |
|||||||
|
Урок:14 |
|||||||
|
Тема: Узагальнення та систематизація знань з теми |
Мета: узагальнити знання про склад, властивості, застосування природного й супутнього нафтового газів, нафти, кам’яного вугілля та продуктів їх переробки, про основні види палива та їх значення в енергетиці країни; закріпити вміння характеризувати напрямки охорони навколишнього середовища від забруднень під час переробки вуглеводневої сировини та використання продуктів її переробки, напрямки синтезу органічних сполук різних класів на основі вуглеводневої сировини. |
||||||
|
|
Дома |
На уроці |
|||||
|
Діяльність учня |
Переглядають відео по темі. Відповідають на питання для повторення і самоконтролю |
"Мікрофон". Актуалізація опорних знань. (завд.14.1) |
Міні тести за варіантами (завдання 14.2) |
Взаємоперевірка. Формування груп |
"Творча лабораторія". Робота в групах за рівнем складності (завд.14.3) |
Знайомляться з роботами інших груп. "Питання-відповідь".Обговорення проблемних питань |
Рефлексія.Підводять підсумок вивчення теми."Я знаю"__"Потрібно доопрацювати"_ |
|
Час |
|
3хв |
3 хв |
2 хв |
25 хв |
10 хв |
2 хв |
|
Діяльність учителя |
Готує питання для повторення самоконтролю |
Організує і координує роботу учнів |
Координує роботу учнів |
Організує, координує, допомогає учням |
Організує роботу учнів |
Доповнює, уточнює,коментує, дає зворотний зв'язок |
Координує роботу учнів |
Завдання 14.1
«Мікрофон»
Учні по черзі дають відповіді на основні терміни теми, отримуючи по черзі уявний мікрофон (питання висвітлені на екрані)
-Вугілля, його склад;
-метод переробки кам'яного вугілля;
-продукти коксування кам'яного вугілля;
-склад коксового газу;
-застосування коксового газу;
-склад кам'яновугільної смоли;
-продукти, які добувають з кам'яновугільної смоли;
-галузі хімічної промисловості, які виникли на основі застосування продуктів, що добувають з кам'яновугільної смоли;
-органічний синтез;
-українські науковці, які зробили внесок у розвиток синтетичної органічної хімії;
-природні органічні сполуки;
- синтетичні органічні сполуки.
Завдання 14.2
І варіант
1. Вкажіть основну теорію походження нафти:
а) теорія будови органічних речовин;б) теорія мінерального походження;
в) теорія О. М. Бутлерова;г) теорія органічного походження.
2. Вкажіть чим відрізняється супутній нафтовий газ від при-
родного:
а) найкращий вид палива;б) містить менше метану;
в) хімічною переробкою з нього отримують пропан і бутан;
г) його спалюють під час добування нафти.
3. Вкажіть правильну відповідь щодо складу нафти:
а) суміш газуватих, рідких і твердих вуглеводнів;
б) суміш рідких і твердих вуглеводнів; в)суміш рідких вуглеводнів;
г) суміш газуватих і твердих вуглеводнів.
4. Вкажіть речовини, які, крім коксу, утворюються під час
коксування кам'яного вугілля:
а) бензин; б) амоніакова вода; в) мазут; г) кам'яновугільна смола.
5. Вкажіть галузь застосування коксу:
а) виробництво лікарських препаратів;б)металургія;в)виробництво барвників;
г) виробництво вибухових речовин.
6. Вкажіть світлі нафтопродукти:
а) мазут б) бензин в) етан; г) газойль.
7. Вкажіть правильне твердження щодо застосування газойлю:
а) паливо в котельних установках; б) паливо для тракторів;
в) пальне для дизелів; г) пальне для ракет.
8. Вкажіть спосіб первинної переробки нафти:
а) фільтрування; б) порегонка; в) відстоювання; г) випарювання.
9. Вкажіть основний компонент кам'яного вугілля:
а) графіт; б) вуглець; в) органічні речовипи; г) водень.
10. Вкажіть причину, що викликає парниковий ефект:
а) озонові діри; б) кислотні дощі;в) фотохімічний смог;
г) дисбаланс між умістом кисню й карбоп(ІУ) оксиду в атмосфері планети.
11. Напишіть рівняння хімічних реакцій, з допомогою яких
можна здійснити перетворення. Назвіть отримані речовини.
С2Н4 -> С2Н6 -> С2Н5С1-> С4 Н10 -> СО2
II варіант
- Вкажіть природні джерела вуглеводнів:
а) вода б) кам'яне вугілля; в) вапняк; г) нафта.
- Вкажіть фізичні властивості нафти:
а) рідина темпо-бурого кольору; б) безбарвна рідина;
в) густа оліїста рідина;г) добре розчинна у воді.
- Вкажіть правильне твердження, що характеризує крекінг:
а) процес сполучення низькомолекулярних речовин з утво-
ренням високомолекулярних;
б) розщеплення вищих вуглеводнів з утворенням нижчих;
в) приєднання водню до молекул вуглеводнів;
г) відщеплепня водню від молекул вуглеводнів.
-
Вкажіть правильне твердження щодо детонаційної стійкос-
ті бензину:
а) здатність бензину вибухати у двигунах внутрішнього
згоряння;
б) здатність бензину згоряти без вибуху у двигуні з іскро-
вим запалюванням;
в) підвищення октанового числа бензину з допомогою спе-
ціальних добавок;
г) стійкість бензину до нагрівання.
- Вкажіть переваги природного газу:
а) екологічно чисті продукти згоряння; б) потребує більшого об'єму повітря для спалювання; в)дає вищу теплоту згоряння;г) є сировиною для хімічної промисловості.
- Вкажіть основні продукти перегонки нафти:
а) водень б) гас; в) етан; г) газойль.
- Вкажіть осповні компопепти природного газу:
а) азот; б) метан; в) етап; г) гелій.
-
Вкажіть речовипи, які, крім коксу, утворюються під час
коксуванпя кам'яного вугілля:
а) бензин б) амоніакова вода; в) мазут; г) кам'яновугільна смола.
- Вкажіть причину, що викликає фотохімічний смог:
а) дисбаланс міле умістом кисню й карбон(ІУ) оксиду в ат-
мосфері планети;
б) підвищення вмісту пітрогеп(ІУ) оксиду в атмосфері;
в) дія сонячного світла; г) озонові діри.
10.Вкажіть речовини, які спричиняють кислотні дощі:
а) карбон(ІУ) оксид б) сульфур(ІУ) оксид; в) азот; г) нітроген(ІУ) оксид.
11.Напишіть рівняння реакцій, з допомогою яких можна здійснити такі перетворення. Назвіть продукти речовипи.
СН4 -> С2Н2 -> СН3СНО -> СН3 - СООН
↓
С2Н4
Завдання14.3
Робота в групах
Завдання групі до 6 балів
1. За текстами підручника й конспектів згадайте правила між-
народної номенклатури й назвіть наведені речовини:
СН3
│
а) СН3-С-СН3 │ б) СН3-СН-СН2-СН3
│ │
СН3 СН3
2. Складіть формули речовин за назвами:
а) 2,3,3,5- тетраметилгексан; б) 3-етил - 2,2-діетилгептан.
3. З якою метою застосовують кокс у промисловості?
Складіть рівняння реакцій, пам'ятаючи, що кокс є відновником металів з їх оксидів.
а) FеО + С-> б) СиО + С->
4. Розв'яжіть задачу.
Яка маса сажі (С) утвориться в результаті повного розкладу 32 г метану?
Завдання групі 7-10 балів
1.Вкажіть склад і способи переробки природного газу. Які синтези проводять на основі природного газу? Наведіть рівняння конкретних реакцій.
2.Назвіть речовини за міжнародною номенклатурою:
С2Н5
│
а) СН3 – СН2 - СН - СН – СН3
│
С2Н5
СН3 – СН2 СН3 С2Н5
│ │ │
б) СН3 - СН - СН - СН - СІН2 - С - СН2 – СН3
│ │
СН3 С6Н13
3. Назвіть речовини за міжнародною номенклатурою:
а) 3,3-діетил-2,2,5,5-тетраметилоктану;б)1,4-дихлоро-3,3-диметилпентану;
в) 3,5-діетил-3,4,6-триметилгептану.
4. Яка маса етену (масова частка домішок у якому 2 %) необ-
хідна для одержання 10 кг етанолу?
Завдання групі до 12 балів
1.Як відрізнити крекінг-бензил від бензину прямої перегонки? Складіть план досліду. Запишіть відповідні рівняння реакцій.
2.Складіть формули ізомерів октану, які мають у своєму складі чотири, п'ять, шість атомів Карбону в основному лапцюгу. Дайте їм назви.
3.Складіть формули речовин за назвами:
а) 4,3-діетил-2,3,5,5-тетраметилоктан;
б) 2,4-дибромо-2,4-диметилпентан;
в) 3,3- діетил-5,4,6-триметилгептан
4. Обчисліть об'єм повітря (н. у.), яке містить 21% кисню за об'ємом, необхідний для спалювання 80 кг гасу, якщо враховувати, що він складається з 86% Карбону й 14% Гідрогену.
1


про публікацію авторської розробки
Додати розробку