Дидактичний матеріал "Компетентнісно діяльнісні завдання з хімії"
Матеріал підготувала вчитель хімії
Давиденко Оксана Василівна
КОМПЕТЕНТНІСНО ДІЯЛЬНІСНІ ЗАВДАННЯ З ХІМІЇ
Організація процесу навчання хімії має відбуватися на засадах особистісно орієнтованого, компетентнісного і діяльнісного підходів.
Компетентнісно зорієнтовані (діяльнісні) завдання спонукають учнів під час уроку займати активну позицію, творчо і креативно їх вирішувати. При виконанні таких завдань здобувачі освіти вчаться самоорганізовуватись (витрачання часу, власне бачення проблеми). Практична сторона - це формування вмінь, навичок і застосування отриманих теоретичних знань при вирішенні різних проблемних ситуацій. Такі завдання спрямовують здобувачів освіти до самостійності, розвивати вміння прогнозувати вирішення завдань. Компетентнісно зорієнтовані (діяльнісні) завдання (КОЗ) мають міжпредметний характер і пов'язані з різноманітними життєвими ситуаціями.
Компетентнісно орієнтовані завдання можна використовувати на різних етапах уроку: на етапі мотивації навчальної діяльності учнів; на етапі актуалізації та корекції опорних знань; повторення й аналізу основних понять, властивостей, законів; на етапі творчого перенесення знань і навичок учнів у новій ситуації; на етапі узагальнення та систематизації навчальних досягнень учнів; на етапі контролю навчальних досягнень. Даний тип завдань можна використовувати при будь-якій роботі в класі (як синхронно так і в асинхронному режимах): індивідуально, в парах, в групі.
Приклади КОЗ з хімії, 7 клас
Тема. Хімічні елементи і їх символи. Будова атома. Періодична система.
№1. Використовуючи таблицю, знайдіть як можна більше назв хімічних елементів (шукаємо по різних напрямках), зазначте їх символи (за допомогою періодичної системи хімічних елементів) - 7 балів
|
Г |
Ц |
И |
Р |
І |
Б |
А |
Л |
Ь |
Т |
|
М |
І |
Н |
А |
Й |
О |
Р |
Г |
О |
Н |
|
О |
К |
Д |
Б |
М |
К |
А |
Л |
І |
Й |
|
Р |
Ф |
Е |
Р |
У |
С |
У |
Л |
Ь |
Ф |
|
Х |
Л |
У |
О |
О |
И |
Л |
І |
Ц |
У |
|
У |
К |
Р |
Е |
М |
Г |
Н |
Т |
І |
Р |
|
Р |
А |
Д |
О |
Н |
Е |
Е |
А |
Й |
О |
|
І |
Д |
П |
Л |
А |
Т |
И |
Н |
І |
Л |
|
Й |
О |
Д |
А |
Л |
Ю |
М |
І |
Н |
Х |
ЗАВДАННЯ:
оберіть п’ять хімічних елементів і заповніть таблицю (5 балів):
|
Хімічний символ |
Назва хім. елементу |
період |
група |
Порядковий номер |
Заряд ядра |
Кількість електронів |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
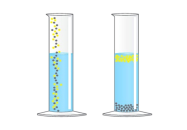
№1. Уважно подивіться на малюнки. Що їх об’єднує? (1 бал)
В склянку помістили речовини: 1) порошок речовини темно-сірого кольору, яка утворена хімічним елементом, що в своєму складі містить 26 електронів; 2) порошкоподібну речовину жовтого кольору, що утворена хімічним елементом з порядковим номером 16; речовину, яка має наступний якісний і кількісний склад - С:Н:О=6:12:6.
- що було отримано в склянці? класифікуйте цю речовину (2 бали)
- зазначте, які речовини є в складі склянки (2 бали);
- спрогнозуйте план розділення речовин окремо кожну, що є в складі склянки (3 бали);
- які способи необхідно застосувати для розділення речовин, аргументуйте свою думку (4 бали).
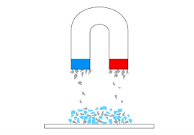
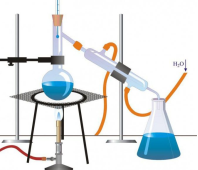
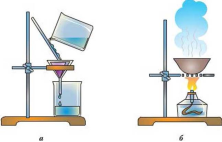
№2. Уважно передивіться малюнки.
- дайте назву кожному способу розділення сумішей (3 бали);
- приведіть у відповідність малюнок і назву способу розділення, заповніть таблицю (3 бали);
|
назва способу розділення |
малюнок (літера) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- зазначте, які способи використовують для однорідних сумішей, а які для неоднорідних (3 бали);
- приведіть у відповідність малюнок (спосіб розділення суміші) і суміш (3 бали)
3 - вода+етиловий (медичний) спирт
Тема. Періодичний закон і періодична система хімічних елементів.
№1. Визначте протонне число хімічного елемента Х за такими даними: знаходиться в ІV групі періодичної системи хімічних елементів, відносна молекулярна маса (формульна маса) його вищого оксиду дорівнює 80. ЗАВДАННЯ:
а) про який хімічний елемент Х йде мова в завданні? Напишіть символ, назву хімічного елемента Х, наведіть формулу простої речовини, яку утворює даний хімічний елемент (3 бали);
б) напишіть формулу вищого оксиду, дайте назву отриманій сполуці (3 бали);
в) наведіть схему розподілу електронів за енергетичними рівнями хімічного елемента Х (3 бали);
г) напишіть не менше двох рівнянь хімічних реакцій, які характерні для даної речовини (3 бали).
№2. В атомі хімічного елемента Х електрони розподілені по енергетичних рівнях так: 2, 8, 6.
ЗАВДАННЯ:
а) визначте хімічний елемент (1 бал);
б) надайте характеристику заданого хімічного елемента за положенням в періодичній системі і будовою атомів (11 балів).
№3. Відомо, що невідомий хімічний елемент Х знаходиться в VІІ групі, відносна молекулярна маса найвищого оксиду невідомого елемента 183. Х утворює жовтувато-зелений газ Y, відомий як сильна отрута. В 1915 році біля містечка Іпр на заході Фландрії невiдомий газ Y був використаний як перша хімічна зброя. Газова атака призвела до загибелі 5 тисяч французьких та англійських солдат, більш ніж 15 тисяч стали каліками.
ЗАВДАННЯ:
- встановіть хімічний елемент Х (2 бали);
- вкажіть число протонів, електронів і нейтронів в атомі Х (3 бали);
- вкажіть число електронів, яких не вистачає до завершення зовнішнього шару Х (1 бал);
- назвiть невiдомий газ Y, що утворює Х (2 бали);
- надайте коротку характеристику хiмiчного елемента Х за мiсцем у ПСХЕ (4 бали).
Тема. Хімічний зв’язок і будова речовини.
№1. Сполука утворена хімічним елементом Х, в атомі якого електрони по енергетичних рівнях розподілені як 2, 8, 8, 1, утворює з елементом Y, в атомі якого електрони по енергетичних рівнях розподілені як 2, 8, 6.
ЗАВДАННЯ:
- ідентифікуйте невідомі хімічні елементи Х і Y, що утворюють сполуку (2 бали);
- вкажіть тип хімічного зв’язку в отриманій сполуці (2 бали);
- надайте схему утворення хімічного зв’язку за прикладом
(приклад  ) - 3 бали
) - 3 бали
- яку кристалічну гратку має отримана сполука (2 бали)
- спрогнозуйте фізичні і хімічні властивості отриманої речовини на основі хімічного зв’язку і будови кристалічної гратки (3 бали).
Приклади КОЗ з хімії, 9 клас
Тема. Розчини
№1. До недавнього часу на очисних спорудах промислових стічних вод як реагент використовували вапняне молоко. У цього методу є низка недоліків (поміркуйте яких), яких можна уникнути, якщо використовувати замість вапняного молока розчин натрій гідроксиду.
ЗАВДАННЯ:
- які ще назви має вапняне молоко (2 бали);
- назвіть недоліки описаного методу (3 бали);
- складіть у молекулярній, повній йонній і скороченій йонній формах рівняння реакцій осадження катіонів Феруму (ІІІ) і Купруму (ІІ) вапняним молоком. (7 балів).
№2. Мiдну дротинку нагрiли в полум'ï спиртiвки, потiм скальпелем зняли з дроту верхнiй шар. Отриманий порошок розчинили в кислотi (сильний електролiт). В результатi розчин набув блакитного забарвлення. До отриманого розчину додали безбарвний розчин, який змінює забарвлення iндикатора на малиновий. Пiсля проходження реакцiï випав осад.
ЗАВДАННЯ:
- напишiть всi згаданi в описi реакцiï (3 бали);
- до останньоï реакцiï напишiть рiвняння в молекулярному, повному йонному i скороченому йонному виглядi (3 бали);
- дайте назви всiм продуктам реакцiй в кожному рiвняннi (2 бали);
- зазначте якісний і кількісний склад отриманого осаду (2 бали);
- знайдіть інформацію де застосовують отриманий осад (2 бали).
Приклади КОЗ з хімії, 10 клас
Тема. ВУГЛЕВОДНІ
№1. Невідома хімічна сполука Х органічного складу відноситься до класу з загальною формулою СnH2n+2. За агрегатним станом Х - рідина зі слабким запахом. В умовах ароматизації нафтопродуктів і каталітичного риформінгу невідома речовина дегідроциклізується в бензен. Застосовується дана невідома речовина Х і в нанотехнології, зокрема нанопорошок заліза обов'язково змочують речовиною Х для запобігання самозайманню на повітрі.
ЗАВДАННЯ:
- про яку речовину йде мова? (2 бали);
- напишіть молекулярну формулу і назву невідомої речовини (2 бали);
- напишіть формули 2 гомологів і 5 ізомерів (5 балів);
- дайте назви всім формулам речовин за систематичною номенклатурою (3 бали).
№2. Насичений вуглеводень А, що містить в своєму складі два атоми карбону піддали різним хімічним реакціям: бромуванню (отримали речовину Б), дегідруванню (отримали речовину В). Після процесу бромування було отримано речовину Г, яка в своєму складі містить 10 атомів гідрогену, яку потім піддали дегідруванню (отримали речовину Д) і повному окисненню (отримали речовину Е).
ЗАВДАННЯ:
- ідентифікуйте АБВГДЕ, зазначте формули і назви вихідних речовин та продуктів реакцій (3 бали);
- напишіть всі згадані рівняння хімічних реакцій (5 балів);
- зазначте умови за яких дані реакції відбуваються і типи хімічних реакцій (2 бали);
- знайдіть інформацію про використання речовин А і Б (2 бали).
№3. За реакцією Кучерова добули речовину Х масою 44 г (інформація щодо невідомої речовини Х - безбарвна рідина з різким задушливим запахом, при розбавленні водою набуває фруктового запаху, є проміжним продуктом обміну речовин в живому організмі; застосовується для виробництва ацетатів целюлози, оцтової кислоти, бутанолу та ін.; канцерогенна для людини), використавши 28 л етину (н.у.).
ЗАВДАННЯ:
1) Визначте речовину Х, зазначте її молекулярну і структурну формули. 3 бали
2) Визначте вміст домішок в етині за об’ємом (у відсотках). 4 бали
2) Запропонуйте рівняння реакцій, що ілюструють хімічні властивості речовини Х. 3 бали
3) Напишіть рівняння якісного визначення речовини Х. 2 бали
№4. За ланцюгом перетворень виконайте завдання:
вапняк → кальцій оксид → кальцій карбід → етин → етаналь → етанова кислота → кальцій ацетат
ЗАВДАННЯ:
- напишіть ланцюг у вигляді молекулярних (структурних) формул - 1 бал
- здійсніть ланцюг перетворень (напишіть рівняння хімічних реакцій) - 6 балів
- вкажіть типи реакцій і умови їх проходження - 2 бали
- до 6 рівняння напишіть реакцію в молекулярному, повному йонному і скороченному йонному вигляді - 3 бали
Тема: Карбонові кислоти
№1. У 1838 році Р. Піріа (1814–1865; Італія) вперше виділив невідому кислоту Х з кори верби білої. Невідома кислота Х є безбарвною, кристалічною органічною кислотою з температурою плавлення 159оС. Вона добре розчинна в спирті та мало розчинна у воді. Фрукти та овочі є натуральним джерелом кислоти Х. Значний вміст солей кислоти Х мають ягоди. Деякі трави та спеції, бобові, горіхи, зернові, мигдаль, каштани і арахіс містять значну кількість солей кислоти Х. Однак, м'ясо, домашня птиця, риба, яйця і молочні продукти не містять їх зовсім. У 1853 році Ш. Жерар (1816–1856; Франція) добув із невідомої кислоти Х неочищену кислоту Y. З 1874 року кислоту Х виготовляли у Німеччині як лікарський засіб, однак препарат завдавав шкоди шлунку. Над його удосконаленням працювали хіміки фармацевтичної фірми «Баєр» («Bayer»), яка приписує винахід кислоти Y Ф. Гофману (1868–1946; Німеччина — Швейцарія): методом ацетилювання він отримав хімічно чисті й стабільні зразки кислоти Y, придатні для медичного застосування.
ЗАВДАННЯ:
- про яку органічну кислоту Х йде мова; 1 бал
- ідентифікуйте синтетичний аналог кислоти Х - кислоту Y, напишіть її структурну і молекулярну формули, дайте тривіальну і хімічну назви; 3 бали
- запропонуйте хімічне рівняння отримання кислоти Y за методом ацетилювання; 3 бали
- опишіть фізичні властивості і напишіть рівняння, що ілюструють хімічні властивості кислоти Y; 3 бали
- які галузі застосування кислоти Y? 2 бали
Приклади КОЗ з хімії, 11 клас
Тема. Періодичний закон і періодична система хімічних елементів
№1. Невідомий елемент виявляє в вищому оксиді валентність V. Відносна молекулярна маса вищого оксиду має масу 142.
ЗАВДАННЯ:
- знайдіть невідомий хімічний елемент Х, напишіть хімічний символ, дайте назву (3 бали);
- надайте характеристику хімічного елемента Х за місцем в періодичній системі і будовою атома (6 балів);
- яку просту речовину утворює Х? які галузі застосування утвореної простої речовини? (3 бали).
№2. Невідома неорганічна сполука Х, за агрегатним станом безбарвний газ з запахом гнилої риби. Проявляє слабкі осно́вні властивості, може утворювати солі — малостійкі сполуки. Речовина Х - є токсичною речовиною та використовується, як хімічна зброя. Також Х - є легкозаймистою сполукою (температура займання 150°C), є сильним відновником, відновлює значну кількість металів з водного розчину їхніх солей. Х існує на Землі лише завдяки біологічним процесам (певні мікроби в безкисневому середовищі можуть його генерувати) або в промислових процесах, де його виробляють люди. Створений Х руйнується з часом різними процесами, наприклад, реакціями з киснем і воднем або ультрафіолетовими радіаційними реакціями. Це означає, що без джерела, що виробляє Х, він повинен повільно зникати з часом. Кількість електронів на зовнішньому рівні основного елемента в речовині Х - 5 електронів.
ПИТАННЯ:
- про яку речовину Х йде мова в описі (2 бали);
- який тип хімічного зв’язку між атомами в речовині Х, напишіть схему утворення хімічного зв’язку (3 бали);
- вкажіть тип кристалічної гратки, до кристалічної чи аморфної речовини відноситься Х (3 бали);
- опишіть фізичні і хімічні властивості Х (зазначте не меньше 2-х хімічних рівнянь) (4 бали).
№3. Оксид сульфуру, в якому S виявляє С.О. +4 прореагував з газоподібною речовиною Х. Речовина Х, як хімічний елемент була виділена в XVIII столітті. Ще близько 6000 років тому в країнах Середземномор'я видобували речовину що містить Х, і широко використовували її в повсякденному житті – навчившись, перш за все, консервувати з її допомогою продукти – рибу, м'ясо, овочі. Використання речовини що містить Х описане ще Геродотом; в середні віки алхіміки, проводячи свої досліди, теж отримували Х, хоча не знали про його властивості; у XIX столітті англійські і французькі хіміки розібралися, що за жовто-зеленувата речовина виділяється при нагріванні мінералу піролюзиту з соляною кислотою, і дали йому назву. Першовідкривачем Х є шведський хімік – Карл Вільгельм Шеєле (дата відкриття 1774 р.). Х був однією з найперших хімічних отруйних речовин. Він був застосований Німеччиною у Першій світовій війні під час битви при Іпрі в 1915 році. В організмі людини в середньому міститься 95 г речовини Х. Речовина Х потрібна для вироблення в шлунку соляної кислоти, яка сприяє травленню і знищенню хвороботворних бактерій. Х з давніх часів використовується як відбілюючий засіб (але тільки з водою).
ПИТАННЯ:
- ідентифікуйте вихідні речовини (сполуку сульфуру і невідому речовину Х) - 2 бали
- напишіть рівняння реакції взаємодії вихідних речовин - 2 бали
- надайте характеристики для хімічної реакції за типами: а) сполучення чи заміщення, розкладу, обміну; б) екзо- чи ендотермічна; в) оборотна чи необоротна; г) каталітична чи некаталітична - 4 бали
- як вплине підвищення тиску, підвищення температури, підвищення концентрації сполуки сульфуру та наявність каталізатора на рівновагу в реакції згідно принципу Ле-Шательє - 4 бали
№4. На початку 60-х років радянські хіміки В. В. Коршак, Ю. П. Кудрявцев, А. М. Сладков і В. І. Касаточкін каталітичним окисненням етину синтезували «одномірний» полімер хімічного елементу Х, який на зовнішньому енергетичному рівні має 4 електрони. Невідомий полімер має атоми Х, що з'єднані в ланцюжок одинарними і потрійними зв'язками, які чергуються -
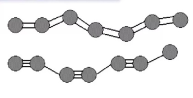
Зовнішнім виглядом невідомий полімер - чорний дрібнодисперсний порошок, має напівпровідникові властивості -

В історії хімії багато прикладів, коли отриману в лабораторних умовах речовину потім знаходили в природі. Так, невідома речовина (полімер) була знайдена в кратері Ріс, розташованому недалеко від Мюнхена, яка складається практично з чистого Х, тільки колір був сірий (деякі властивості полімерів залежать від ступеня полімеризації).
ЗАВДАННЯ:
- ідентифікуйте невідомий хімічний елемент Х (1 бал)
- ідентифікуйте алотропну модифікацію у вигляді невідомого полімеру (2 бали)
- опишіть будову, властивості і застосування полімера (6 балів)
- які ще алотропні модифікації Х відомі? надайте їх коротку характеристику і галузі використання (3 бали)


про публікацію авторської розробки
Додати розробку