До теми "Будова атома. Порядок заповнення електронних орбіт атома"
Пояснено чому в атомі заповнюються вищі орбіти при неповному заповненні нижніх. Описано як розрахувати кількість електронів на орбіті. Пояснено фізичний зміст квантових чисел
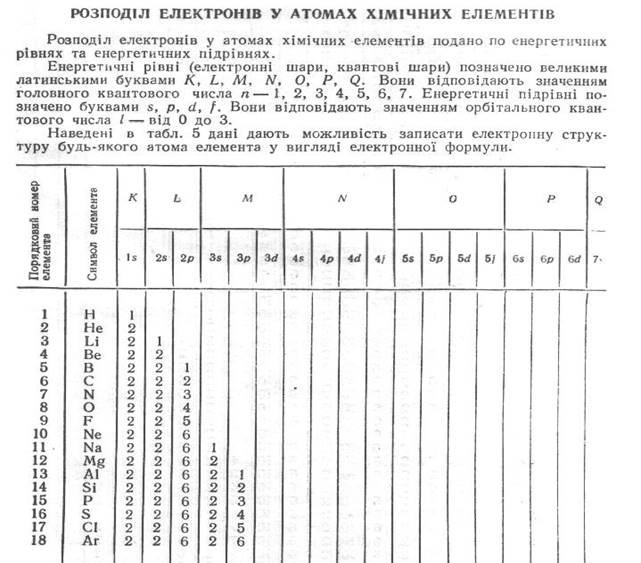
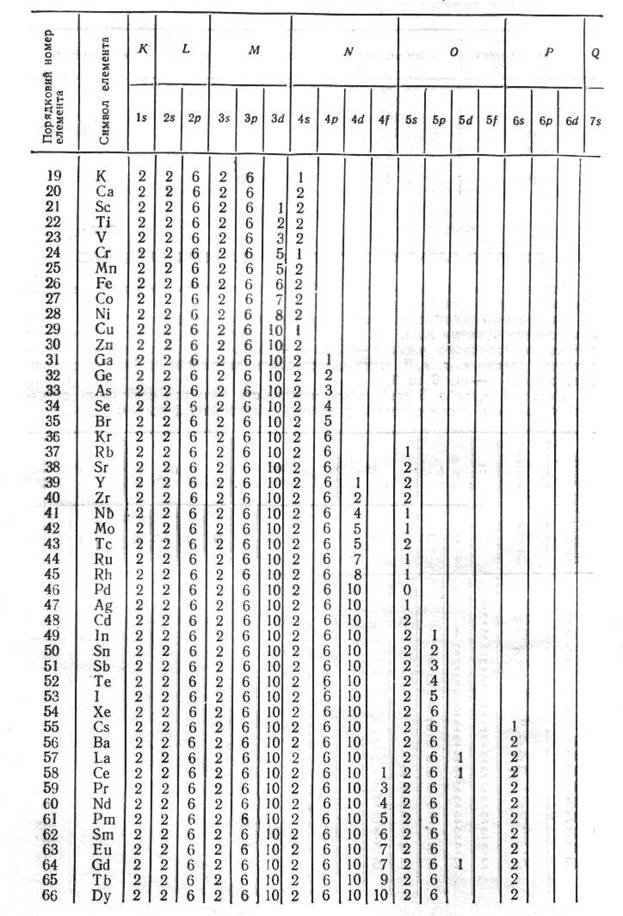
Заповнення електронних орбіт атома.
Атом це система з мікрочастинок, які несуть позитивний електричний заряд – протонів, мікрочастинок з негативним зарядом – електронів і мікрочастинок електронейтральних – нейтронів. Теорія будови атома пройшла шлях від атома (Демокріт) – неподільної мікрочастинки; до атома – мікрочастинки з будовою, подібною до будови Сонячної системи (ядерна модель атома Е.Резерфорда), далі через теорію Н.Бора, побудовану на квантових уявленнях, до квантово-механічної теорії. За сучасними уявленнями, атом являє собою складну мікросистему з атомного ядра та електронних шарів, у яких, відповідно до їх енергії та стану, розподіляються електрони даного атома. Електрони атома проявляють двоїсту корпускулярно-хвильову природу (рівняння де Бройля). Крім того, аналізуючи стан електрона в атомі, слід зважати на принцип невизначеності Гейзенберга. Отже, атом у сучасному розумінні – це мікросистема, де навколо атомного ядра рухаються електрони, місця яких визначити в даний момент в об’ємі атома неможливо. Електрони в атомі подаються певними об’ємами – орбіталями, або електронними хмарами. Електронна хмара – це геометрична сукупність найімовірніших положень даного електрона в об’ємі атома. Умовно до неї відноситься 90-95% загального об’єму хмари.
Кожна така атомна орбіталь характеризується сукупністю квантових чисел. Квантові числа – система квантових характеристик електрона, що змінюються стрибкоподібно (дискретно). Для позначення стану електрона в атомі використовують такі квантові числа.
1. Головне квантове число n (номер рівня), яке характеризує запас енергії електрона. Головне квантове число може набирати значення від 1 до +. Енергетичний рівень – це сукупність орбіталей, які характеризуються однаковим значенням головного квантового числа. Чим далі від ядра знаходиться орбіталь одного рівня, тим більшу енергію вона має.
2. Орбітальне (побічне, азимутальне) квантове число l (номер підрівня), яке характеризує форму атомної орбіталі. Воно змінюється від 0 до n – 1. Залежно від значення l електрон перебуває на одному з енергетичних підрівнів: при значенні l = 0 на s-підрівні; при l = 1 на p-підрівні; при l = 2 на d-підрівні; при l = 3 на f-підрівні, при l =4 на g-підрівні, при l = 5 на h підрівні, при l =6 на i-підрівні. Орбіталі, які характеризуються однаковим n і різним l , мають різну енергію. Тому поруч з поняттям “енергетичний рівень” існує поняття “енергетичний підрівень”, як сукупність орбіталей з певним значенням головного та побічного квантових чисел. Енергетичний рівень розщеплюється на n енергетичних підрівнів.
3. Магнітне квантове число ml (номер орбіталі) пов’язане з магнітним моментом електрона. Воно визначає орієнтацію орбіталі в просторі. Його величина змінюється від –l до +l, набираючи залежно від l різні цілочисельні значення. Число можливих значень ml дорівнює 2·l+1. Число значень магнітного квантового числа пов’язане з числом положень атомної орбіталі в просторі. Максимальне число різних положень атомних орбіталей дорівнює: для s–орбіталі 1, для p–орбіталі 3, для d–орбіталі 5 і для f–орбіталі 7.
Таким чином, набір значень магнітного квантового числа визначає число орбіталей на енергетичному підрівні. Загальне число орбіталей на енергетичному рівні n становить n2. Так енергетичний рівень n = 2 має два підрівні 2s і 2p (l змінюється від 0 до n - 1, тобто набуває значень 0 і 1). На 2sпідрівні знаходиться одна s-орбіталь (ml змінюється від – l до + l, тобто для значення l=0 можлива лише одна s-орбіталь), на 2p-підрівні – три p-орбіталі (ml змінюється від – l до + l ,тобто для значення l=1 ml набуває значень –1, 0, +1 і тому можливі три p-орбіталі, орбіталь з номером l =1 позначається p). Отже, кожний енергетичний рівень містить певний набір енергетичних підрівнів, кожний енергетичний підрівень має певні орбіталі.
4. Спінове квантове число s характеризує обертання електрона навколо своєї осі, тобто власний магнітний момент. Воно може мати два значення
+1/2 і –1/2.
Якщо врахувати число можливих енергетичних підрівнів на енергетичному рівні, число станів електрона та можливість двох значень спіна електрона то можна показати що на енергетичному підрівні максимальне число електронів рівне 2·(2·l + 1); на електронному шарі – 2·n2.
Заповнення орбіталей електронами підпорядковане принципу Паулі і правилу Гунда. Принцип Паулі дає можливість розрахувати електронну ємність енергетичних рівнів та підрівнів атома.

Заповнення енергетичних рівнів та підрівнів (атомних орбіталей) відбувається по принципу найменшої енергії. Наприклад, розподіл семи електронів азоту на енергетичних рівнях записують так: 1s22s22p3. У цій формулі великі цифри означають головне квантове число n, латинські букви – побічне квантове число l, цифри праворуч зверху над латинськими буквами – кількість електронів на енергетичному підрівні. Широко застосовують і такий запис конфігурації атома: 1s22s22p1xp1yp1z, який детальніше характеризує розподіл електронів по атомних орбіталях бо відображає принцип Гунда. Для першого запису сумарне спінове число дорівнює + 3/2, для другого - +1/2.
Енергія орбіталі залежить не лише від відстані від ядра а й від типу орбіталі, тому енергія орбіталі вищої оболонки може бути менша ніж в нижньої (перекриття оболонок). На малюнку показано схему енергетичних рівнів в атомі: орбіталі взаємно пронизують одна одну.
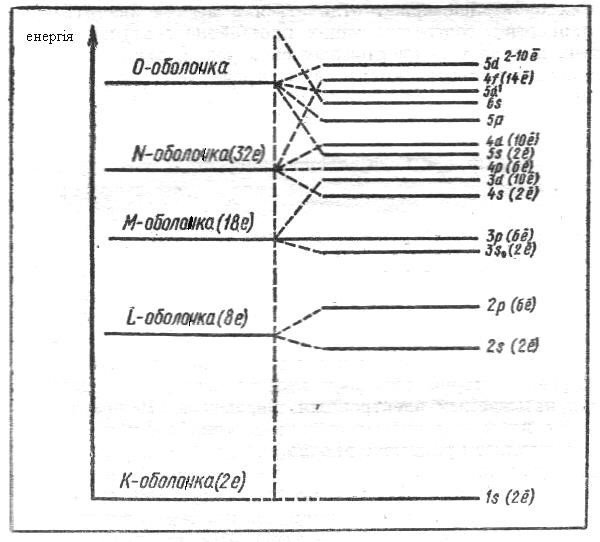
Взагалі, при знаходженні розподілу електронів в атомі, використовують слідуючі правила.
1. Принцип Паулі – в атомі не може бути двох електронів з однаковими значеннями квантових чисел.
2. Правило Клечковського. Електрони заповнюють енергетичні підрівні за зростанням їх енергії, яка характеризується сумою n + l. При цьому, якщо сума n + l кількох різних підрівнів однакова, рівні заповнюються за збільшенням значень n.
3. Правило Гунда – в даному енергетичному підрівні атома електрони займають максимальне число вільних атомних орбіталей так, щоб сумарне спінове число було найбільшим. Під час заповнення підрівня електрони посідають різні орбіталі доти поки це можливо. Спіни поодиноких електронів, що знаходяться на різних орбіталях паралельні (однаково напрямлені).
На малюнках s-, p-, d- і f- електрони умовно зображають у вигляді певних геометричних фігур.
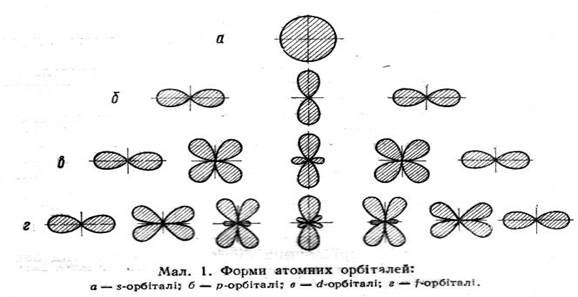
Література
1. Г.А.Зісман і О.М.Тодес, том ІІІ, 1968 р.
2. А.А.Астахов. Довідник з хімії для вчителів, 1975 р.
3. М.Є.Фонкич. Нові розділи шкільного курсу фізики, 1971 р.


про публікацію авторської розробки
Додати розробку
