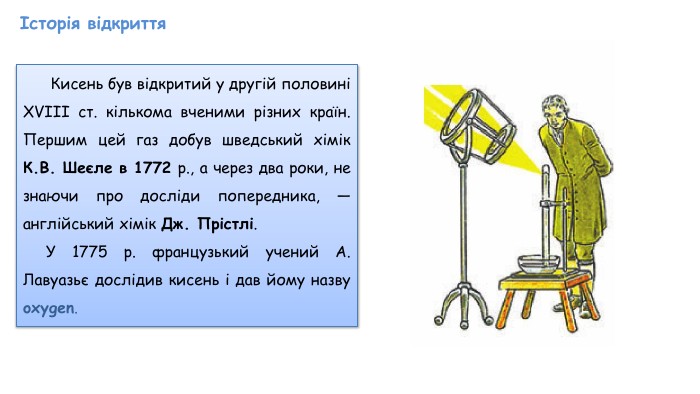
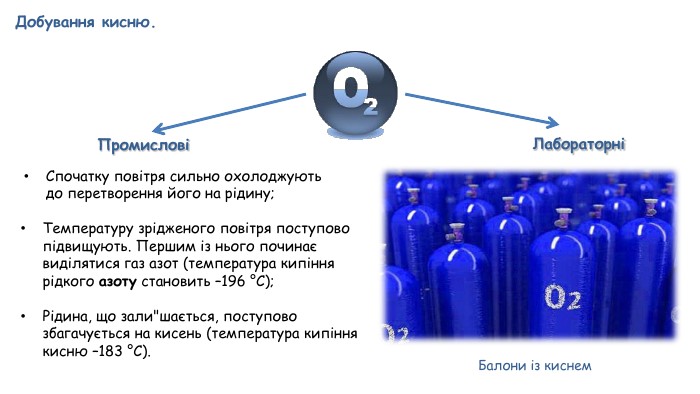
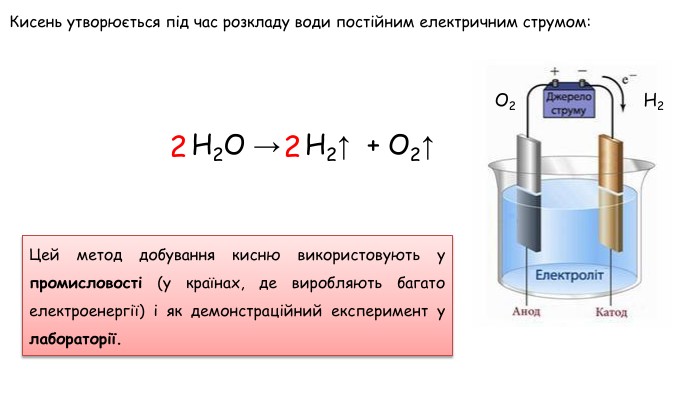
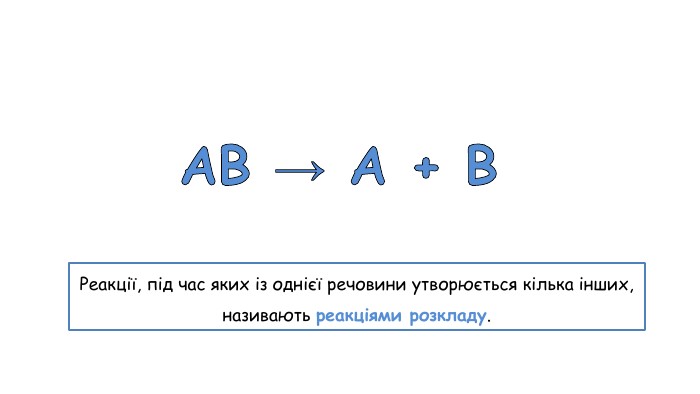
Добування кисню в лабораторії та промисловості. Поняття про каталізатор. Реакція розкладу.
Про матеріал
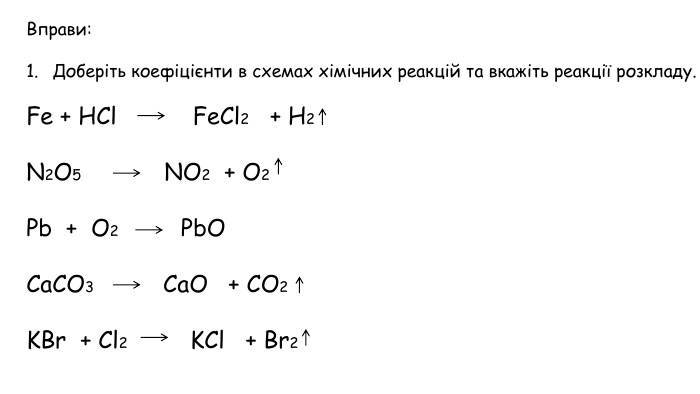
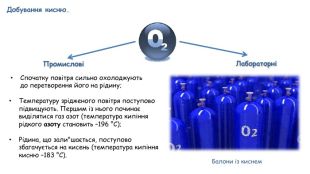
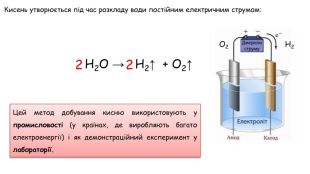
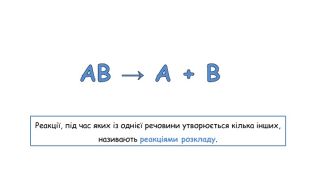
Презентація з хімії для учнів 7-х класів. Тема "Кисень". Питання які розглядаються : Добування кисню в лабораторії та промисловості. Поняття про каталізатор. Реакція розкладу.
Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку