Довідник з курсу хімії
Міністерство освіти і науки, молоді та спорту України
Кіровоградська обласна державна адміністрація
Гайворонський професійний аграрний ліцей
Довідник
з курсу хімії
(при підготовці учнів до ЗНО з предмету)
Гайворон
2017
Викладач хімії, викладач вищої категорії, викладач-методист: Стародуб Інна Анатоліївна
Довідник з хімії допоможе учням систематизувати, конкретизувати та поглибити набуті знання та вміння, а також навчитися працювати самостійно.
Навчальний матеріал згрупований за програмними темами і поданий у наявній формі: у вигляді таблиць, схем, які супроводжуються необхідними коментарями.
Змістовний ілюстративний матеріал довідника посилює емоційне сприйняття навчальної інформації, активізує творче осмислення і більш глибоке засвоєння набутих знань.
Наочний довідник призначено для учнів.
Відповідальний за випуск: Стародуб Н.О., викладач математики, викладач вищої категорії, викладач-методист.
Розглянуто на засіданні методичної комісії природничо-математичного циклу ГПАЛ (протокол № 4 від 25.11.2017 року
Зміст
- Початкові хімічні поняття ……………………………….…2
- Складні речовини. Основні класи неорганічних речовин..4
- Хімічні реакції …………………………………………......13
- Періодичний закон і періодична система хімічних елементів Д.І.Менделєєва.
Будова атома …………………………………………...….15
- Хімічний зв'язок і будова речовини ………………...……17
- Розчини ………………………….……………………..…...21
- Загальні відомості про метали ……………………..……..25
- Теоретичні основи органічної хімії …………………..…..26
- Якісні реакції …………………………………………........37
- Словник термінів ………………….……....……….………39
- Література ……………………………………………..…..42
ПРЕДМЕТ НЕОРГАНІЧНОЇ ХІМІЇ. ЗНАЧЕННЯ ХІМІЇ В НАРОДНОМУ ГОСПОДАРСТВІ ТА ПОБУТІ
Хімія — це наука про речовину,її будову, властивості та реакції,внаслідок яких утворюються нові
речовини.
Хімічна наука розглядає властивості та зміни тіл, склад тіл, пояснює причину того, що відбувається
з речовинами під час хімічних перетворень.
Неорганічна хімія вивчає елементи та їхніх сполуки (окрім більшості сполук Карбону)
Органічна хімія вивчає сполуки Карбону (окрім карбон оксидів, карбонатної кислоти, карбонатів, простих сполук Карбону)
Тема 1. Початкові хімічні поняття
Речовина — це те, що складається з частинок одного або декількох хімічних елементів, може бути в твердому, рідкому або газоподібному стані, а також має масу й об’єм.
Із речовин складаються тіла.
Властивість речовин — це ознаки, за якими речовини схожі між собою або відрізняються одна від одної.
Фізичні властивості речовини не залежать від дії на неї інших речовин. До фізичних властивостей належать: форма, забарвлення, запах,розчинність, температура плавлення, густина та ін.
Чисті речовини складаються з частинок тільки одного виду.
Суміші складаються з частинок декількох чистих речовин. Наприклад, повітря — суміш із молекул азоту, кисню й інших речовин.
Явища — це будь-які зміни, які відбуваються в навколишньому середовищі.
Унаслідок фізичних явищ можуть змінюватись деякі фізичні властивості речовин (агрегатний стан, температура), але при цьому не утворюються нові матеріали або
речовини.
Унаслідок хімічних явищ з одних речовин утворюються інші.
Реагенти — речовини, що вступають у хімічні реакції.
Продукти реакції — речовини,що утворилися внаслідок реакції.
Фізичні явища Хімічні явища
Зміна фізичних властивостей Зміна забарвлення
речовин (агрегатного стану, Поява запаху
густини, електро- і теплопровідності) Утворення осаду
Виділення газу
Виділення або поглинання теплоти
Атоми — це найдрібніші хімічно неподільні частинки речовини.
Хімічний елемент — це певний вид атомів.
Атомною одиницею маси (а. о. м.) називається 1/12 частина маси атома Карбону.
Відносною атомною масою (Ar) називається число, яке показує,у скільки разів маса атома більша за 1/12 частину маси атома Карбону.
Проста речовина — речовина, що складається з атомів одного хімічного елемента.
Складна речовина — речовина, що складається з атомів різних хімічних елементів.
Хімічна формула — умовний запис якісного та кількісного складу молекули хімічної сполуки.
Відносна молекулярна маса (Mr) речовини показує, у скільки разів маса молекули даної речовини більша за 1/12 маси атома Карбону.
Молекулярна формула - показує, з яких елементів складається дана речовина
і скільки атомів кожного елемента входить до складу молекули.
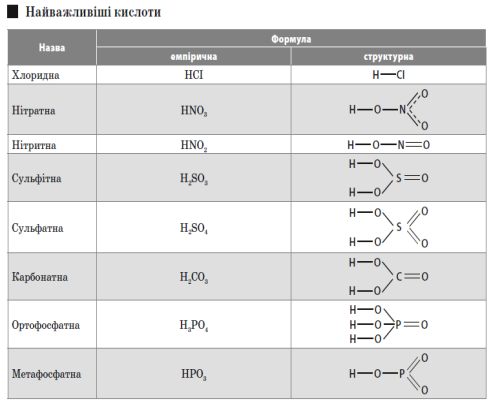
Структурна формула - показує послідовність сполучення атомів у молекулі даної речовини.
Валентність — це властивість атома (або групи атомів) сполучатися з певним числом інших атомів (груп атомів).
Молекула — найменша частинка речовини, яка має такий самий склад і всі її властивості. Молекули складаються з атомів.
Кількість речовини (n) — це величина, яка визначається числом структурних одиниць (атомів або інших частинок) цієї речовини (моль).
Моль — міра кількості речовини. Моль дорівнює кількості речовини, що містить стільки ж структурних частинок даної речовини, скільки атомів міститься у вуглеці масою 12 г.
Молярна маса (М) — маса одного моля речовини (г/моль).
Хімічне рівняння — це умовний запис хімічної реакції за допомогою хімічних формул.
Молярний об’єм (Vm) — об’єм 1 моль речовини за заданих умов.
Число (стала) Авогадро (NA) —кількість частинок в 1 моль речовини. Приблизне значення цієї сталої дорівнює 6,02•1023 моль–1.
Нормальні умови (н. у.) — температура 0 °C і тиск 1 атм. (101,3 кПа).
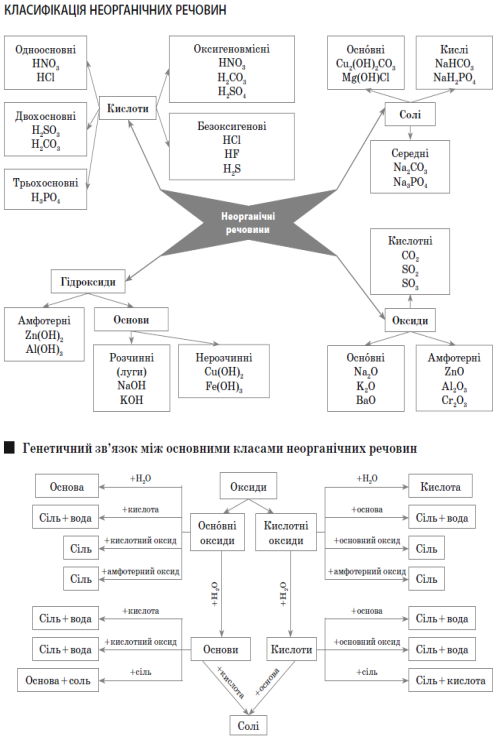
Тема 2. Складні речовини. Основні класи неорганічних речовин.
Оксиди
Оксиди — це складні речовини, утворені двома елементами (бінарні сполуки), одним із яких є Оксиген.
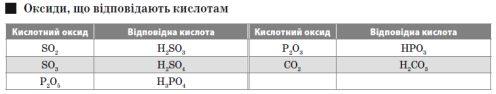
Кислотні оксиди — це оксиди неметалів (або оксиди, яким відповідають кислоти). Це оксиди елементів з валентністю III і вищою.
Основні оксиди — це оксиди металів (або оксиди, яким відповідають основи). Це оксиди елементів з валентністю I і II.
Амфотерні оксиди — це оксиди, які мають властивості і кислотних, і основних оксидів. Це оксиди деяких дво- і тривалентних елементів. (Zn, Al, Cr)
Кислоти
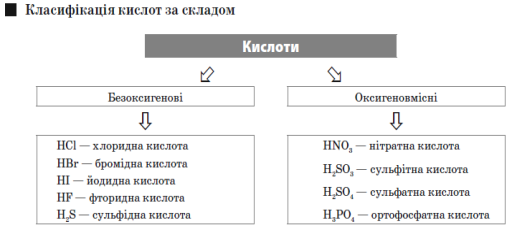
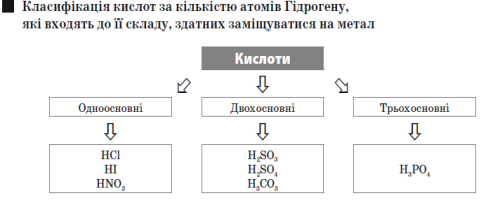
Кислоти — це складні речовини, що складаються з атомів Гідрогену й кислотного залишку.
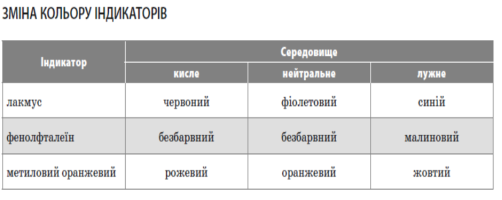
Індикатор — хімічна речовина, забарвлення якої змінюється залежно від кислотності середовища.

Основи
Основи — складні речовини, що складаються з атомів металу та гідроксильної групи
(—ОН).
Амфотерний гідроксид — основа, яка виявляє властивості основий кислоти.
Луг —це розчинна основа.
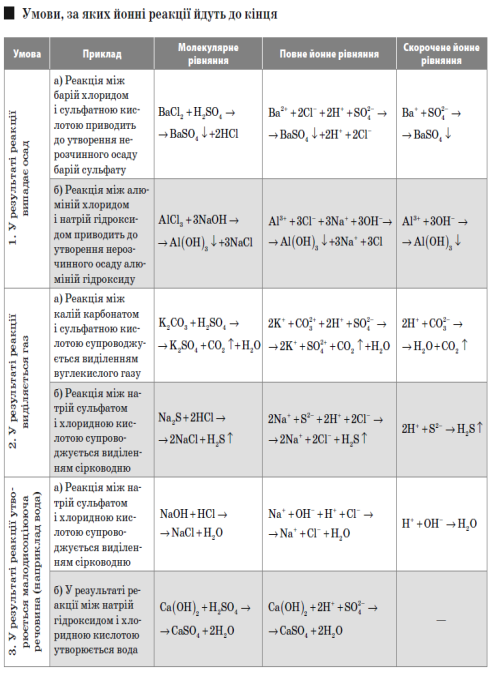
Реакції нейтралізації — це реакції між основами та кислотами, в результаті яких утворюються сіль і вода.


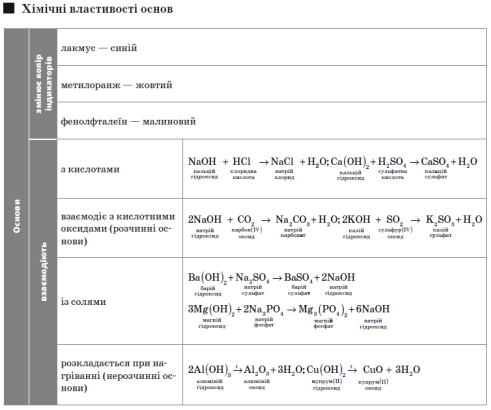
Солі
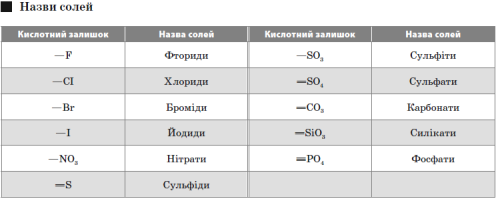
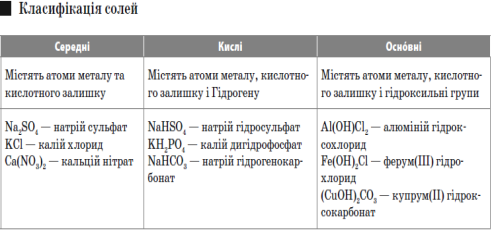
Солі — це складні речовини, утворені атомами металів і кислотними залишками.


Тема 3. Хімічні реакції
Хімічна реакція — це процес, під час якого утворюються нові речовини, тобто відбувається хімічне перетворення.
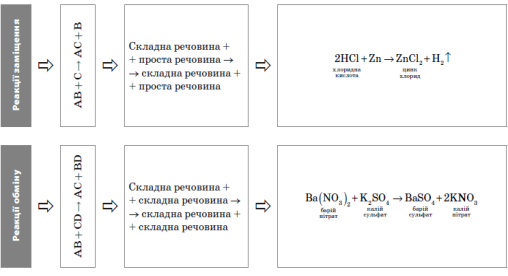
Реакція сполучення — це хімічна реакція, в результаті якої з двох або декількох простих або складних речовин утворюється одна складніша речовина.
Реакція розкладу — це хімічна реакція, в результаті якої з однієї складної речовини утворюється дві або декілька простих або складних речовин.
Реакція заміщення — це хімічна реакція, що відбувається між простою і складною речовинами, а якої атоми простої речовини заміщують атоми одного з елементів у складній речовині.
Реакція обміну — це хімічна реакція, що відбувається між двома складними речовинами, за яких вони обмінюються складовими частинами.

Каталізатори — це речовини, які прискорюють хімічні реакції, беручи активну участь у них, але при цьому не витрачаються.
Хімічна рівновага — стан системи, за якого швидкості прямої та зворотної реакцій однакові.
Оборотна реакція — це реакція, за якої продукти реакції, що утворюються, можуть реагувати один з одним, даючи знову вихідні речовини.
Необоротна реакція — це реакція, продукти якої не реагують один з одним.
Тема 4. Періодичний закон і періодична система хімічних елементів
Д. І. Менделєєва. Будова атома
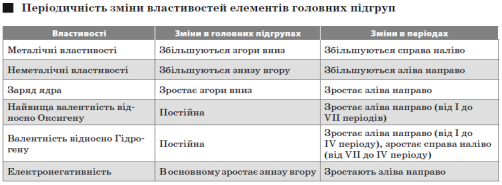
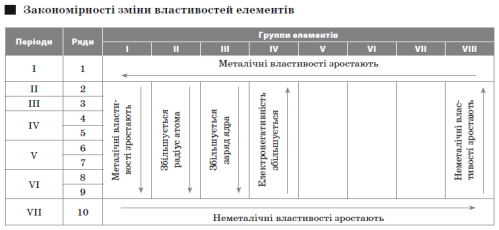
Періодичний закон Д. І. Менделєєва (сучасне формулювання): властивості хімічних елементів, а також простих і складних речовин, які вони утворюють, перебувають у періодичній залежності від величини заряду ядра атомів цих елементів.
Атом — електронейтральна частинка, що складається з позитивно зарядженого ядра та негативно заряджених електронів.
Ядро атома — частина атома, що розміщується в його центрі й заряджена позитивно; ядро атома складають протони та нейтрони, в ядрі зосереджена основна маса атома.
Протони — позитивно заряджені
частинки ядра атома.
Нейрони — електрично нейтральні частинки ядра атома, що входять до складу ядра.
Електрони — негативно заряджені частинки, які рухаються з дуже великою швидкістю навколо ядра й утворюють електронну оболонку атома.
Електрони розподілені за електронними орбіталями.
Радіоактивність — мимовільний розпад атомів електролітів.
Ядерна реакція — перетворення ядер одного елемента на ядра іншого елемента.
Ізотопи — атоми з однаковим атомним номером, але з різними відносними атомними масами.
Орбіталь — область простору, в якому велика ймовірність перебування електронів, що входять до складу атома.

Тема 5. Хімічний зв’язок і будова речовини
Електронегативність — умовна величина, що характеризує відносну здатність атома в молекулі притягати до себе електрони.
ПОЛЯРНИЙ І НЕПОЛЯРНИЙ КОВАЛЕНТНИЙ ЗВ’ЯЗКИ
Хімічний зв’язок утворюється внаслідок взаємодії між атомами, в результаті якого утворюється струнка багатоатомна система (взаємне тяжіння атомів, що приводить до утворення молекул).
Ковалентний зв’язок — це зв’язок, що утворюється спільною електронною парою.
Ковалентний полярний зв’язок — хімічний зв’язок, утворений
атомами, електронегативності яких мало відрізняються.
Ковалентний неполярний зв’язок — хімічний зв’язок, утворений атомами з однаковою електронегативністю за рахунок утворення спільних електронних пар.
ЙОННИЙ ЗВ’ЯЗОК
Йон — атом, який втратив або приєднав один або декілька електронів і таким чином дістав електричний заряд.
Йонний зв’язок — хімічний зв’язок між йонами.
Кристалічні ґратки.
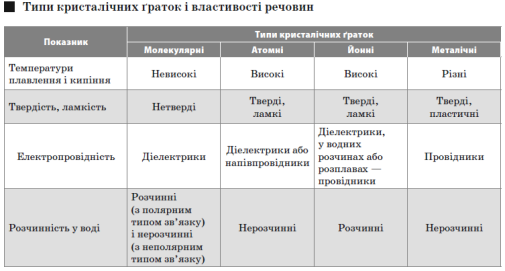
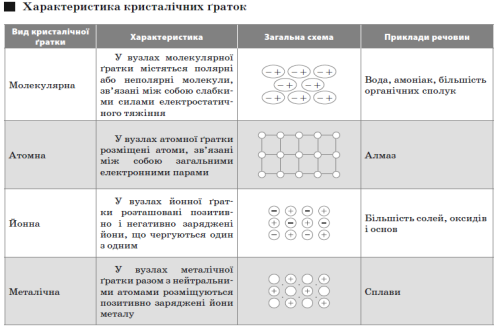
СТУПІНЬ ОКИСНЕННЯ І ВАЛЕНТНІСТЬ
Ступінь окиснення — поняття, що характеризує стан елемента в хімічній сполуці та його поведінку в окисно-відновних процесах.
Це умовний заряд, величина якого розраховується виходячи з припущення, що всі електрони, які утворюють хімічний зв’язок, повністю переходять до більш електронегативного елемента.
Валентність — характеристика здатності атома утворювати хімічні зв’язки. Визначається числом зв’язків, які утворюють даний атом з іншими атомами в молекулі.
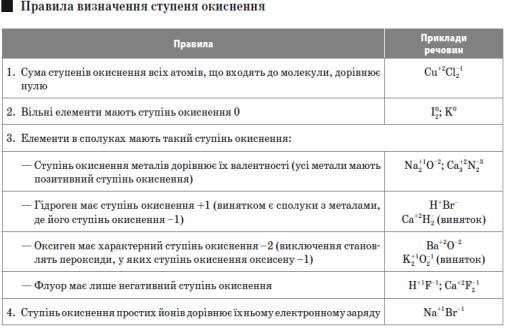
Окисно-відновні реакції — це реакції, що відбуваються зі зміною ступенів окиснення елементів, які входять до складу реагуючих речовин.
Окиснення — 1) приєднання кисню до елемента або сполуки; 2) вилучення водню зі сполуки; 3) вилучення електрона з атома або йона; 4) підвищення ступеня окиснення
елемента.
Відновлення — 1) вилучення зі сполуки; 2) приєднання водню до елемента або сполуки; 3) приєднання електронів до атома або йона; 4) зменшення ступеня окиснення
елемента.
Окисник — 1) речовина, яка окиснює елементи або сполуки; 2) речовина, що приймає електрони.
Відновник — 1) речовина, яка відновлює сполуки; 2) речовина, що віддає електрони.


Тема 6. Розчини
Розчин — система, що утворюється в результаті розчинення твердої, рідкої або газоподібної речовини в розчиннику.
Розчини бувають рідкі, тверді та газоподібні.
Розчинена речовина — тверда, рідка або газоподібна речовина, яка розчинена в будь-якому розчиннику.
Розчинник — речовина, в якій однорідно розподілена розчинена речовина.
Розчинність — здатність речовини розчинятися в якому-небудь розчиннику.
Насичений розчин — це розчин, що містить максимально можливу кількість розчиненої речовини за конкретних умов.
Ненасичений розчин — розчин, в якому розчинна речовина може ще розчинятися за даних умов.
Розбавлений розчин — розчин з низькою концентрацією розчиненої речовини.
Концентрований розчин — розчин з високою концентрацією розчиненої речовини.
Концентрація — відносна кількість розчиненої речовини в розчині.
Малорозчинна речовина — речовина, яка погано розчиняється в розчиннику.
Нерозчинна речовина — тверда або газоподібна речовина, яка не розчиняється в конкретному розчиннику за даних умов.
Електроліти — сполуки, розчини або розплави яких проводять електричний струм.
Неелектроліти — сполуки, розчини або розплави яких не проводять електричного струму.
Електролітична дисоціація — процес розпаду електроліту на йони в розчині або розплаві.
Йони — позитивно або негативно заряджені частинки, яким притаманна рухливість у водних розчинах кислот, солей і основ.
Аніони — негативно заряджені йони.
Катіони — позитивно заряджені йони.

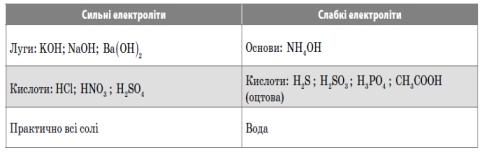
Сильні електроліти — це електроліти, які повністю (необоротно) дисоціюють на йони.
Слабкі електроліти — це електроліти, які частково (оборотно) дисоціюють на йони.
Ступінь дисоціації α — це відношення числа дисоційованих молекул до загального числа молекул, що містяться в розчині.
РЕАКЦІЇ ЙОННОГО ОБМІНУ
Йонне рівняння — тип хімічного рівняння, в якому реагенти і продукти реакції записані в йонному вигляді.
Тема 7. Загальні відомості про метали
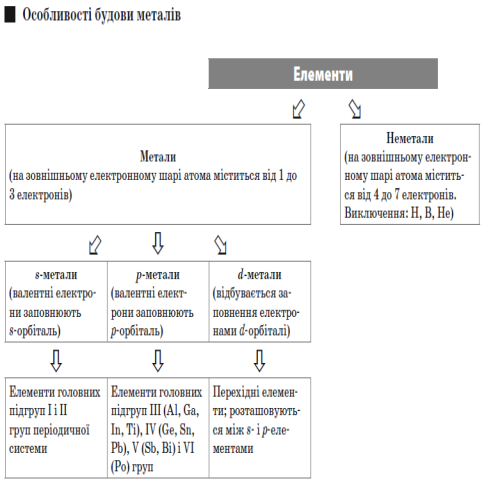
Метали — елементи, які утворюють прості речовини, що характеризуються хорошою теплопровідністю, електропровідністю і металічним блиском.
Електроліз — це окисно-відновний процес, що відбувається в розчинах або розплавах електролітів під впливом постійного електричного струму.
Електрод — електропровідне тіло (пластинка), за допомогою якого здійснюється електричний контакт з електролітом.
Корозія — мимовільний процес руйнування металів або їхніх сплавів під дією навколишнього середовища.
Інгібітори корозії — речовини, які вводяться в незначній кількості в корозійне середовище для різкого зменшення швидкості корозії.
Сплав — суміш якого-небудь металу з одним або кількома іншими елементами.
ТЕОРЕТИЧНІ ОСНОВИ ОРГАНІЧНОЇ ХІМІЇ
Основою органічних сполук є Карбон. На відміну від інших хімічних елементів, властивості атомів Карбону дозволяють йому утворювати величезну кількість сполук, різноманітних за властивостями і функціями, які вони можуть виконувати. Різноманіття органічних сполук пояснюється двома важливими властивостями Карбону:
— здатністю атомів Карбону утворювати між собою міцні хімічні зв’язки, тобто з’єднуватися в досить довгі ланцюжки або цикли;
— здатністю атомів Карбону утворювати різні зв’язки: одинарні, подвійні і потрійні
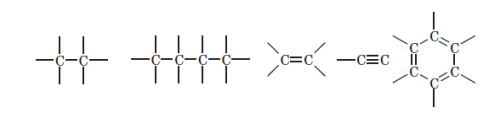
Класифікація органічних сполук
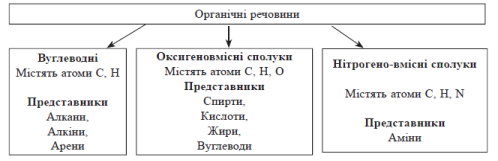
Класифікація органічних сполук за функціональними групами
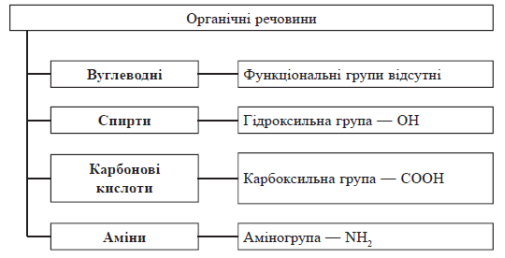
Сполуки одного класу, що мають подібну будову, але відрізняються за складом на одну або кілька груп CH2, називають гомологами.
Групу CH2 називають гомологічною різницею. Сукупність всіх гомологів утворює гомологічний ряд.
Деякі різні речовини мають однакову хімічну формулу, але різну структуру. Таке явище називають ізомерією.
Ізомери — це речовини, що мають однакову молекулярну формулу, але різну будову.
Теорія хімічної будови органічних сполук – це вчення про взаємний зв'язок, розміщення і взаємний вплив атомів у молекулах органічних речовин.
Хімічну будову речовини можна зобразити за допомогою структурних формул, які показують послідовність зв’язків між атомами в молекулі.
Наприклад:
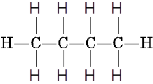
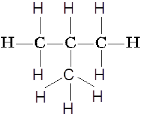
Бутан 2-метилпропан (ізобутан)
Ці дві різні структурні формули мають однаковий молекулярний склад C4H10.
Радикали — це частинки (атоми або молекули) з неспареним електроном на зовнішній атомній або молекулярній орбіталі.
Найпростішими вуглеводневими радикалами є одновалентні радикали, що утворюються внаслідок віднімання одного атома Гідрогену від молекули насиченого вуглеводню.
Правила складання назв алканів:
1. У молекулі визначають найдовший (головний) карбоновий ланцюг і нумерують у ньому атоми Карбону. Нумерацію починають із того кінця ланцюга, до якого ближче розташований замісник.
2. Визначають назву кожного замісника.
3. Назви замісників розміщують на початку назви сполуки (за алфавітом). Перед назвою кожного замісника через дефіс указують номер атома Карбону, з яким сполучений замісник. Останньою записують назву алкану нерозгалуженої будови, молекула якого містить стільки атомів Карбону, скільки їх у головному ланцюзі.
4. За наявності кількох однакових замісників їхню кількість указують, додаючи до назви замісника числовий префікс (ди-, три-, тетра- тощо), а поперед нього вказують номери відповідних атомів Карбону, розділені комами.
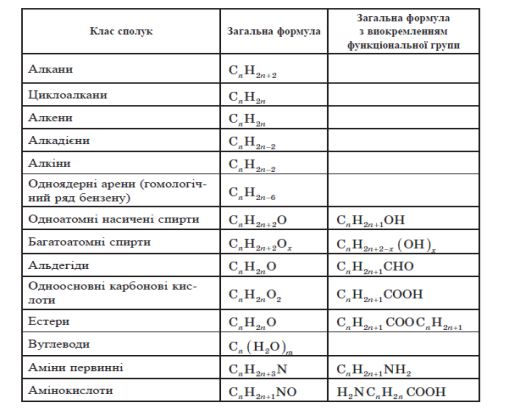
Насичені вуглеводні. Алкани
Усі насичені вуглеводні можна вишикувати в ряд, в якому порядковий номер вуглеводню буде дорівнювати кількості атомів Карбону в молекулі. Такий гіпотетичний ряд називають гомологічним рядом,а сполуки, з яких складається цей ряд, називають гомологами.
Загальна формула: СnH2n+2.
Перші чотири члени гомологічного ряду алканів мають традиційні назви, інші назви походять від назв грецьких числівників з додаванням суфікса — ан.
|
Назва вуглеводню |
Формула |
Назва радикала |
Формула |
|
Метан |
CH4 |
Метил |
CH3 |
|
Етан |
C2H6 |
C2H5 |
|
|
Пропан |
C3H8 |
Пропіл |
C3H7 |
|
Бутан |
C4H10 |
Бутил |
C4H9 |
|
Пентан |
C5H12 |
Аміл (пентил) |
C5H11 |
|
Гексан |
C6H14 |
Гексил |
C6H13 |
|
Гептан |
C7H16 |
Гептил |
C7H15 |
|
Октан |
C8H18 |
Октил |
C8H17 |
|
Нонан |
C9H20 |
Ноніл |
C9H19 |
|
Декан |
C10H22 |
Децил |
C10H21 |
Алкени
Алкенами називають ненасичені вуглеводні, молекули яких містять один подвійний зв’язок. Перший представник цього класу етилен CH2= CH2, у зв’язку із чим алкени також називають етиленовими вуглеводнями.
Загальна формула гомологічного ряду алкенів CnH2n.
Алкіни
Алкінами називають ненасичені вуглеводні, молекули яких мають один потрійний зв’язок. Перший. представник цього класу — ацетилен С2Н2, у зв’язку із чим алкіни також називають ацетиленовими вуглеводнями.
Загальна формула гомологічного ряду алкінів CnH2n −2.
Ароматичні вуглеводні (Арени)
Ароматичними вуглеводнями (аренами) називають речовини, в молекулах яких міститься одне або кілька бензенових кілець — циклічних груп атомів Карбону з особливим характером зв’язків.
До одноядерних аренів належать бензен та його похідні, загальна формула вуглеводнів ряду бензену: CnH2n- 6. Відповідно, першим членом гомологічного ряду одноядерних аренів є вуглеводень із шістьма атомами Карбону, тобто C6H6 — бензен.
Природні джерела вуглеводнів та їхня переробка
Природний газ
Основним компонентом природного газу є метан. Середній вміст метану за об’ємом становить 80–97%. Крім метану у природному газі є його гомологи (2-3%) – етан, пропан, бутан та невелика кількість домішок – сірководню, азоту, оксиду карбону (IV) і водяної пари.
Природний газ – цінне паливо. Він є важливою сировиною для хімічної промисловості. З нього добувають сажу, водень, ацетилен, синтез – газ тощо.
Супутній нафтовий газ
Супутній нафтовий газ за своїм походженням також є природним газом. Такий газ відрізняється від природного за складом: у нього міститься менше метану (30–50% за об’ємом), але більше етану, пропану, бутану, пентану (7–20% за об’ємом), ніж і природному газі. Його вловлюють і використовують як паливо і як дешеву сировину.
Під час хімічної переробки попутного газу виділяють індивідуальні вуглеводні: етан, пропан, бутан тощо. З них добувають ненасичені вуглеводні, з яких далі синтезують пластмаси, каучуку.
Склад нафти
За хімічним складом нафта – це природна суміш великої кількості органічних речовин, близько 90% яких становлять різні вуглеводні: насичені, циклопарафіни, ароматичні тощо. Співвідношення цих вуглеводнів у нафтах різних родовищ коливається. Крім вуглеводнів нафта містить також оксигено-, сульфуро- та нітрогеновмістні органічні сполуки.
Нафтопродукти та їх властивості
Розрізняють дві групи нафтопродуктів: світла та темні.
До світлих нафтопродуктів належать:
бензин, що містить вуглеводні складу С5 – С11 з температурою кипіння від 40 до 200 0С,
лігроїн, що містить вуглеводні складу С8 – С14 з температурою кипіння від 150 до 250 0С, гас,який складається з вуглеводнів складу С12 – С18 з температурою кипіння від 180-3000С,
газойль С15 – С20 з температурою кипіння понад 300 0С.
До темних нафтопродуктів належать: мазут, з якого виробляють мастила (веретенне, машинне, тощо ), вазелін, парафін, гудрон.
Переробка нафти
Первинна переробка нафти полягає в її перегонці, тобто розділенні на фракції: світлі та темні нафтопродукти.
Вторинна переробка нафти включає методи переробки на бензин важких нафтових фракцій (гас, солярові масла, мазут).
Коксохімічне виробництво
Основний метод переробки кам’яного вугілля – коксування (піроліз)
Піролізом називається процес розкладання органічних речовин без доступу повітря за високої температури.
Синтез органічних сполук різних класів на основі вуглеводневої сировини.
Промислові методи:
1. Насичені вуглеводні з довжиною ланцюга до одинадцяти атомів Карбону одержують переважно методами:
• фракційної перегонки нафти;
• переробки природного газу;
• гідрогенізації вугілля: ![]()
Лабораторні методи:
1. Гідроліз алюміній карбіду:
![]()
2. Синтез Вюрца:
![]() ;
;
2. Одержання ненасичених вуглеводнів
Алкенів
Промислові методи:
Крекінг алканів нафти
|
|
|
Лабораторні методи:
1. Дегідратація спиртів:
![]() ;
;
![]()
Алкінів
Промислові методи отримання етину:
1. Гідроліз кальцій карбіду:
![]() ;
;
![]() .
.
2. Піроліз метану:
![]() .
.
Одержання оксигеновмісних органічних сполук та їх застосування
Насичені одноатомні спирти (метанол й етанол)
Добування метанолу:
![]() .
.
Добування етанолу:
1. Зброджування цукристих речовин:
![]() .
.
2. Гідроліз крохмалю та клітковини з наступним зброджуванням утвореної глюкози:
![]() .
.
![]() .
.
3. Гідратація етену:
![]()
Методи добування багатоатомних спиртів
Двохатомні спирти добувають окисненням алкенів:
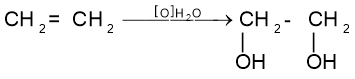 .
.
Гліцерол добувають омиленням жирів:
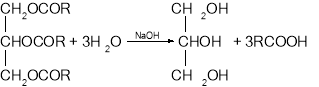
Карбонові кислоти
Добування
Загальний спосіб добування карбонових кислот— окиснення спиртів та альдегідів. Перспективними є способи добування карбонових кислот окисненням алканів.
Окиснення етанолу:
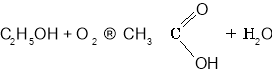
Окиснення етаналю:
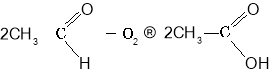
Окиснення бутану:
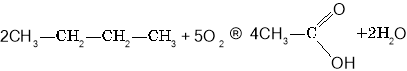
Естери, жири
Продукти взаємодії карбонових кислот і спиртів належать до класу естерів. Реакція їх утворення називається реакцією естерифікації.
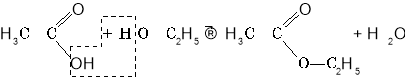
Жири — це естери трьохатомного спирту гліцеролу і вищих (насичених і ненасичених) карбонових кислот.
Поняття про вуглеводи та їхня класифікація
ВУГЛЕВОДИ
Моносахариди Дисахариди Полісахариди
глюкоза, фруктоза сахароза крохмаль, целюлоза
С6Н12О6 С12Н22О11 (С6Н10О5)
Каучук — це еластичний матеріал, який отримують при коагуляції латексу каучуконосних рослин.
Полімери — це високомолекулярні сполуки, молекули яких складаються з великого числа мономерних ланок, що сполучені між собою хімічними зв’язками.
Наприклад, полімер (—CH2—CH2—)n складається з n ланок етену.
Число n називається ступенем полімеризації.
«Полі» — багато, «моно» — один, «мерос» — частина. Полімери — це високомолекулярні сполуки. Мономери — це низькомолекулярні речовини, з яких одержують полімери.
Ступенем полімеризації (поліконденсації) називають середнє число структурних ланок у молекулі полімеру.
Повторювану ділянку молекули полімеру називають структурною ланкою.
Харчові добавки — природні або синтезовані речовини, що цілеспрямовано вводяться в продукти харчування з метою надання їм необхідних властивостей (наприклад, органолептичних, технологічних). Вони не вживаються безпосередньо у вигляді самостійних компонентів їжі.
Класифікація харчових добавок
1. Речовини, що регулюють смак продукту (ароматизатори, смакові добавки, що підсолоджують речовини, регулювальники кислотності).
2. Речовини, що поліпшують зовнішній вигляд продукту (барвники, стабілізатори кольору, вибілювачі).
3. Речовини, що регулюють консистенцію та формують текстуру (загусники, гелеутворювачі, стабілізатори, емульгатори).
4. Речовини, що підвищують збереження продуктів та збільшують терміни їх зберігання (консерванти, антиоксиданти).
Вітаміни — необхідні для життєдіяльності людини органічні речовини різної хімічної природи, що надходять до організму з їжею (рідше утворюються в ньому).
За розчинністю всі вітаміни поділяють на дві групи: жиророзчинні (A, D, E, K) і водорозчинні (B, C, PP).
Амінокарбонові кислоти, або амінокислоти — це клас органічних сполук, які містять одночасно дві функціональні групи: аміногруппу NH2 − та карбоксильну групу −COOH.
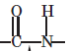 пептидний зв'язок
пептидний зв'язок
Білки (білкові речовини) — макромолекулярні природні сполуки (біополімери), структурну основу яких становлять поліпептидні ланцюги, побудовані із залишків амінокарбонових кислот. Білки неодмінно містять елементи C, H, N та O, майже завжди S, часто P, рідше Fe, Cu, Zn тощо.
Якісні реакції
Якісні реакції спиртів
* реакція з металічним натрієм
При спиртів з металічним натрієм утворюються алкоголяти Натрію і молекулярний водень:
2R - OH + 2Na → 2R - ONa + H2↑
В дану реакцію вступають також карбонові кислоти.
* якісна реакція на багатоатомні спирти
Багатоатомні спирти (наприклад, гліцерин) утворюють з гідроксидом Купруму(ІІ) комплексні сполуки темно-синього кольору, подібну реакцію дає і етиленгліколь.
Якісні реакції альдегідів
* реакція срібного дзеркала
При взаємодії альдегідів з аміачним комплексом Аргентуму спостерігається утворення осаду срібла у вигляді блискучого шару на поверхні хімічного посуду.
В реакцію срібного дзеркала вступають також глюкоза і фруктоза
* реакція з гідроксидом Купруму(ІІ)
При нагріванні гідроксиду Купруму(ІІ) з альдегідами блакитний осад замінює забарвлення на червоний в наслідок утворення оксиду Купруму(І).
Якісна реакція на крохмаль
* реакція зі спиртовим розчином йоду (спостерігається поява темно-синього забарвлення.)
Якісні реакції білків
* біуретова реакція
При взаємодії білків з солями міді у лужному середовищі спостерігається поява фіолетового забарвлення.
* ксантопротеїнова реакція
При дії нітратної кислоти на білки спостерігається поява жовтого забарвлення.
Якісні реакції на аніони
S042-+ Ва2+=BaS04 – утворення білого осаду
РО43-+ Ag+= Аg3Р04 – утворення світло жовтого осаду
СО32-+ Са2+= СаСОз – утворення білого осаду
SO32-+ Н+= Н20 + S02 – виділення характерного запаху
Cl-+ Аg+= AgCl – утворення білого осаду



Література
- Ахметов Н.С. Неорганическая химия: Учебное пособие. – М.: Высшая школа, 1998.
- Бочкваров А. Д., Жикол О. А. Хімія у визначеннях. таблицях і схемах. — Харків: Веста: Видавництво «Ранок», 2005. — 128с.
- Буринська Н. М. Хімія. Підручник для 8 класу середньої загальноосвітньої школи. — К.: ВТФ «Перун», 2001. — 160 с.
- Буринська Н. М. Хімія. Підручник для 9 класу середньої загальноосвітньої школи. — К.: ВТФ «Перун», 2001. — 160 с.
- Глинка Н. Л. Общая химия.— Л.: Химия, 1979.
- Голуб А. М. Загальна та неорганічна хімія.— К.: Вища школа, 1968—1971.
- Коттон Ф., Уилкинсон Дж. Основы неорганической химии.— М.: Мир, 1979.
- Пилипенко А.Т. Справочник по элементарной химии. – К. «Наукова думка», 1977
- Ходаков Ю. В. Общая и неорганическая химия.— М.: Просвещение, 1965.
- Холин Ю. В., Слета Л. А. Репетитор по химии: Для школьников и абитуриентов.— Харьков: Фолио, 1998.
- Хомченко Г. П. Пособие по химии для поступабщих в ВУЗы.— 4-е узд.,испр. И доп. - М.: ООО «Изд-во «Новая Волна», 2002.- 480с.
- http://www.chemistry.ssu.samara.ru
- http://www.alhimik.ru
- http://www.chem.asu.ru
- http://www.hij.ru
1


про публікацію авторської розробки
Додати розробку
