Робочий зошит з хімії (органічна хімія)
__________________
Теорія як вища форма наукових знань
Органічна хімія вивчає сполуки, до складу яких обов’язково входить елемент Карбон.
Виняток становить __________________________________________________
___________________________________________________________________
Крім Карбону, до складу органічних сполук можуть входити елементи ___________________________________________________________________
___________________________________________________________________
Органічна хімія -_______________________________________________
___________________________________________________________________
___________________________________________________________________
В курсі 9-го класу були ознайомленні з різними класами органічних речовин.
![]()
![]()
![]()


![]()
![]()
![]()
![]()
![]()

![]()


![]()
![]()
![]()



![]()
![]()
![]()
![]()
Насичені вуглеводні
метан________________
етан_________________
пропан_______________
бутан________________
пентан_______________
гексан_______________
гептан_______________
октан________________
нонан________________
декан_________________
Тренувальні вправи.
№1. Розподіліть наведені формули за класами сполук, назвіть речовини
C2H4; C3H8; C6H6; C6H14; C2H2; C5H12; C10H8
____________________________________________________________________________________________________________________________________________________________________________________________________________
____________________________________________________________________
№2. До складу органічних речовин входять елементи: ___________________________________________________________________
№3. Природні джерела органічних речовин: ____________________________________________________________________________________________________________________________________________________________________________________________________________
Домашня робота
- Розподіліть наведені формули за класами сполук, назвіть речовини ( по 0.5 б)
C2H6; C3H6; C6H12; C6H8; C5H8; C7H16; C10H22; С7Н8
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
_______________________________________________________________
_______________________________________________________________
- Складіть молекулярні формули алканів, до складу молекул яких входять: (по 0,5 б)
- Вісім атомів Карбону - ________________________________________
- Чотирнадцять атомів Гідрогену - ________________________________
Складіть молекулярні формули алканів, до складу молекул яких входять:
- 6 атомів Карбону - ____________________________________________
- 10 атомів Гідрогену - __________________________________________
- Визначте молекулярну формулу насиченого вуглеводню, молекулярна маса якого: а) 86; б) 142. (по 2 б)
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
__________________
Теорія хімічної будови органічних сполук О.М.Бутлерова
Основні положення теорії хімічної будови органічних сполук О.М.Бутлеров сформував у 1858-1861рр.
О.М. Бутлеров увів уявлення про хімічну будову - ________________________
________________________________________________________________________________________________________________________________________
Валентність елементів-________________________________________________
________________________________________________________________________________________________________________________________________
Згідно з теорією О.М.Бутлерова сполучення атомів у молекулі відбувається відповідно до їхньої валентності.
Валентність Карбону в органічних сполуках ______________________________
Структурні формули -____________________________________________
________________________________________________________________________________________________________________________________________
Явище ізомерії - ________________________________________________
________________________________________________________________________________________________________________________________________
Ізомери – _______________________________________________________
________________________________________________________________________________________________________________________________________
Основне положення теорії хімічної будови органічних речовин: властивості органічних речовин залежать не лише від їхнього якісного і кількісного складу, а й від будови молекул.
О.М.Бутлеров не лише пояснив явище ізомерії, а й передбачив існування різноманітних ізомерів.
Теорія хімічної будови органічних сполук – це вчення про взаємний зв'язок, розміщення і взаємний вплив атомів у молекулах органічних речовин.
Частинки, що мають неспарені електрони, називаються _______________
Тренувальні вправи.
№1. Скільки речовин зображено цими структурними формулами:
Н Н Н Н Н Н
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() Н С С С С Н СН3 – СН2 – СН3 Н С С Н
Н С С С С Н СН3 – СН2 – СН3 Н С С Н
Н Н Н Н Н
![]()
![]()
![]() Н С Н
Н С Н
Н Н Н
![]()
![]()
![]() Н
Н
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() Н С С С Н СН2 – СН2 – СН3 Н
Н С С С Н СН2 – СН2 – СН3 Н
![]()
![]()
![]() Н Н Н СН3 СН3 С СН3
Н Н Н СН3 СН3 С СН3
![]() СН3 СН3
СН3 СН3
![]()
![]()
![]() СН3 С Н
СН3 С Н
СН3 ______________________________________________________________
№2. Напишіть структурні формули ізомерних насичених вуглеводнів складу С8Н18, головний ланцюг яких складається з п’яти вуглецевих атомів
Домашня робота
- Які речовини називають ізомерами? (1б)
А) з однаковим якісним складом і різною формою молекул;
Б) з однаковою кількістю атомів у молекулі і різною будовою;
В) з однаковою будовою молекул і різним хімічним складом;
Г) з однаковим хімічним складом і різною хімічною будовою.
- Який науковець створив теорію хімічної будови органічних сполук?(1 б)
А) Ф.Велер; Б) О.Бутлеров; В) Я.Берцеліус; Г) Д.Менделєєв.
- Яке явище було пояснено за допомогою теорії хімічної будови органічних сполук? (1 б)
А) кислотні дощі; Б) ізотопія;
В) ізомерія; Г) парниковий ефект.
- Що зміниться внаслідок зміни послідовності сполучення атомів у молекулі? (2 б)
А) кількість і об’єм речовини;
Б) кількісний склад і густина речовини;
В) маса молекули і геометрична форма; Г) хімічна будова і властивості.
- Напишіть структурні формули ізомерних насичених вуглеводнів складу С7Н16 (по 1б)
__________________
Явище ізомерії. Структурна ізомерія.
Самостійна робота.
Вуглеводні з одним подвійним зв’язком називаються _____________________
Вуглеводні з одним потрійним зв’язком називаються _____________________
Вуглеводні з одинарними зв’язками називаються _________________________
Загальна формула алканів _____________________________________________
Загальна формула алкінів _____________________________________________
Загальна формула алкенів _____________________________________________
Речовина складу С2Н6 називається _____________________________________
Речовина складу С2Н4 називається _____________________________________
Речовина складу С5Н12 називається _____________________________________
Формула пентену ____________________________________________________
Формула бутену _____________________________________________________
Формула гексану ____________________________________________________
З курсу хімії основної школи ви пам’ятаєте, що алкани утворюють гомологічний ряд, загальна формула якого ______________________________.
Алканам властива ізомерія. У гомологічному ряду алканів структурні ізомери є не в усіх гомологів. Число ізомерів зростає зі збільшенням числа атомів Карбону в молекулі.
Гомологи – речовини з однаковим якісним складом, подібні за будовою і хімічними властивостями. За кількісним складом вони відрізняються один від одного на певну кількість груп –СН2- . Цю групу називають гомологічною різницею. Гомологи, розташовані за зростанням їхньої відносної молекулярної маси, утворюють гомологічний ряд.
Структурна ізомерія алканів зумовлена здатністю атомів Карбону утворювати ланцюги різної будови.
Принцип побудови структурних формул ізомерів:
- Спочатку зобразимо карбоновий ланцюг лінійного ізомеру;
- Скоротимо ланцюг на атом Карбону і приєднаємо його до будь-якого атома карбонового ланцюга, за винятком крайніх;
- Після того як усі положення головного ланцюга будуть вичерпані, знову скоротимо його на атом Карбону;
- Додаємо атоми Гідрогену згідно з валентністю Карбону (ІV)
Якщо атоми Карбону об’єднані в ланцюг без відгалужень, то такі вуглеводні називаються нерозгалужені, а якщо атоми Карбону відходять угору, вниз від основного ланцюжка, тобто розгалужуються, то такі вуглеводні називають розгалуженими.
Структурні ізомери – сполуки однакового складу, що різняться послідовністю сполучення атомів у молекулі, тобто хімічною будовою і властивостями.
Домашня робота
- Речовини, що мають подібну будову та властивості, але відрізняються за складом молекули на групу атомів - СН2- , називають (1б)
А) ізомерами; Б) гомологами; В) радикалами.
- Сполуки однакового складу, що різняться послідовністю сполучення атомів у молекулі, тобто хімічною будовою і властивостями, називаються (1б)
А) гомологічний ряд; Б) структурні ізомери; В) ізомери.
- Порядок сполучення атомів у молекулах виражає формула: (1б)
А) молекулярна; Б) структурна; В) електронна.
- Карбоновий ланцюг в алканів має будову: (1б)
А) лінійну; Б) зигзагоподібну; В) іншого типу.
- Зобразити структурну формулу пентану та його ізомери. (3б)
- Визначте якісний і кількісний склад ізомерів, зображених структурними формулами: (4б)
- Н Н Н Н 2) Н Н
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() Н С С С С Н 3) СН3 – СН2 – СН3 Н С С Н
Н С С С С Н 3) СН3 – СН2 – СН3 Н С С Н
Н Н Н Н Н
![]()
![]()
![]() Н С Н
Н С Н
- Н Н Н
![]()
![]()
![]() Н
Н
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() Н С С С Н 5) СН2 – СН2 – СН3 6) Н
Н С С С Н 5) СН2 – СН2 – СН3 6) Н
![]()
![]()
![]() Н Н Н СН3 СН3 С СН3
Н Н Н СН3 СН3 С СН3
![]() 7) СН3 СН3
7) СН3 СН3
![]()
![]()
![]() СН3 С Н
СН3 С Н
СН3 ____________________________
____________________________
____________________________
____________________________
____________________________
____________________________
____________________________
__________________
Номенклатура насичених вуглеводнів.
Хімічний диктант.
_________________________________________________________________________________________________________________________________________________________________________________________________________
Сполуки, що мають однакові молекулярні формули, але різну будову і різні властивості, називають ізомерами. Явище існування таких сполук називається ізомерією.
Хімічну будову речовини можна зобразити за допомогою структурних формул, які показують послідовність зв’язків між атомами в молекулі.
Наприклад:
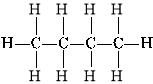
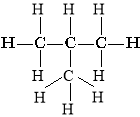
Бутан 2-метилпропан (ізобутан)
Ці дві різні структурні формули мають однаковий молекулярний склад C4H10.
Радикали — це частинки (атоми або молекули) з неспареним електроном на зовнішній атомній або молекулярній орбіталі.
Найпростішими вуглеводневими радикалами є одновалентні радикали, що утворюються внаслідок віднімання одного атома Гідрогену від молекули насиченого вуглеводню.
Назви одновалентних радикалів насичених вуглеводнів
|
Назва вуглеводню |
Формула |
Назва радикала |
Формула |
|
Метан |
CH4 |
Метил |
CH3 |
|
Етан |
C2H6 |
C2H5 |
|
|
Пропан |
C3H8 |
Пропіл |
C3H7 |
|
Бутан |
C4H10 |
Бутил |
C4H9 |
|
Пентан |
C5H12 |
Аміл (пентил) |
C5H11 |
|
Гексан |
C6H14 |
Гексил |
C6H13 |
|
Гептан |
C7H16 |
Гептил |
C7H15 |
|
Октан |
C8H18 |
Октил |
C8H17 |
|
Нонан |
C9H20 |
Ноніл |
C9H19 |
|
Декан |
C10H22 |
Децил |
C10H21 |
Радикали утворюються під час хімічних реакцій. Хімічно вони надзвичайно активні, тому можуть існувати лише тисячні частки секунди. Сполучаючись між собою або іншими атомами чи молекулами, радикали відразу ж утворюють молекули інших речовин.
Правила складання назв алканів:
1. У молекулі визначають найдовший (головний) карбоновий ланцюг і нумерують у ньому атоми Карбону. Нумерацію починають із того кінця ланцюга, до якого ближче розташований замісник.
2. Визначають назву кожного замісника.
3. Назви замісників розміщують на початку назви сполуки (за алфавітом). Перед назвою кожного замісника через дефіс указують номер атома Карбону, з яким сполучений замісник. Останньою записують назву алкану нерозгалуженої будови, молекула якого містить стільки атомів Карбону, скільки їх у головному ланцюзі.
4. За наявності кількох однакових замісників їхню кількість указують, додаючи до назви замісника числовий префікс (ди-, три-, тетра- тощо), а поперед нього вказують номери відповідних атомів Карбону, розділені комами.
Лабораторний дослід № 1
Тема. Виготовлення моделей молекул парафінів.
Мета: навчитися виготовляти моделі ізомерів алканів, закріпити набуті знання про просторову будову насичених вуглеводнів.
Обладнання: пластилін і палички (сірники) або набір «Моделі молекул».
Хід роботи
1. Зберіть кулестрижневу модель молекули
а) метану;
б) етану;
в) бутану;
г) 2-метилпропану.
2. Напишіть молекулярні та структурні (розгорнуті й напіврозгорнуті) формули всіх речовин із п. 1.
3. Укажіть подібність і чим відрізняються просторові будови молекул речовин.
4. Зробіть висновок.
Домашня робота
- Складіть структурну формулу 2,2-диметилгексану.(2б)
- Складіть структурну формулу 2,4-диетилгептану (2б)
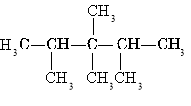
- Назвіть речовину за структурною формулою (2б)
 _____________________________________________________________
_____________________________________________________________
- Назвіть речовину за структурною формулою (2б)
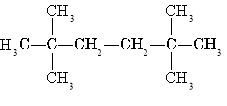 ______________________________________________________________
______________________________________________________________
- Складіть молекулярні формули цих сполук.(2б)
___________________________________________________________________
- Яка пара речовин є гомологами: (1б)
А) бутан і гексан; Б) бутан і етен;
В) бутан і метил пропан; Г) бутан і 2-метилпентан.
__________________
Багатоманітність органічних сполук, їхня класифікація.
Багатоманітність органічних сполук зумовлена унікальними особливостями атомів Карбону. Наявність чотирьох електронів на зовнішньому енергетичному рівні й найменший у IVA групі радіус атома – причина того, що атом Карбону не схильний ані втрачати, ані приєднувати електрони. Тому Карбон утворює переважно ковалентні зв’язки.
Унаслідок безлічі хімічних перетворень з вуглеводнів утворюються найрізноманітніші органічні сполуки.
Циклічні та ациклічні органічні сполуки
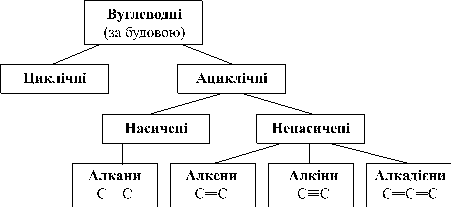
Особливістю будови молекул кожної групи є наявність різних зв’язків. В ациклічних вуглеводнях існує три види зв’язків: одинарний, подвійний та потрійний.
Оксигеновмісні органічні сполуки. Поняття «функціональна група»
Органічні сполуки класифікують не тільки за будовою карбонового ланцюга і типом зв’язків між атомами Карбону, а також за наявністю в їхніх молекулах певних груп. Функціональні (характеристичні) групи — це атом, або група атомів, що зумовлюють характерні властивості органічних сполук та їх належність до певного класу сполук.
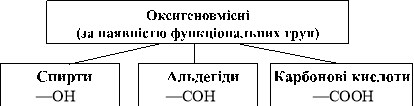
Нітрогеновмісні сполуки
За наявністю функціональних груп —NH2 і —NO2 нітрогеновмісні органічні речовини поділяють на аміни й нітросполуки.

Завдання «Розподіли на групи»
а) ![]() ;
;
б) ![]() ;
;
в) ![]() ;
;
г) ![]() ;
;
д) ![]() ;
;
е) ![]() ;
;
є) ![]() ;
;
ж) ![]() ;
;
з) ![]() ;
;
алкани — ____________; алкени — _____________; алкіни — ___________;
алкадієни — ____________; карбонові кислоти — ____________;
аміни — ____________.
Домашня робота.
- Складіть структурну формулу вуглеводню, в якому з атомом Карбону з’єднані чотири групи СН3. Складіть структурні формули його ізомерів. Назвіть усі сполуки.
2. Складіть структурні формули ізомерів гексану, у яких ланцюжок з атомів Карбону:
а) найдовший; б) найкоротший.
____________________
Органічні речовини в живій природі. Рівні структурної організації органічних речовин.
Жива природа – невичерпне джерело органічних речовин.
Хімія живого – один зі стратегічних напрямів розвитку сучасної хімічної науки.
Білки
Білки — високомолекулярні сполуки.
Жири
Жири — органічні речовини, що є сполукою естерів (складних ефірів) трьохатомного спирту (гліцеролу) і жирних кислот.
Вуглеводи
Вуглеводи — складова частина клітин усіх живих організмів.Вуглеводи поділяють на моносахариди, дисахариди, олігосахариди і полісахариди. Низькомолекулярні вуглеводи відомі також як цукри.
Нуклеїнові кислоти
Нуклеїнові кислоти — складні високомолекулярні біополімери, мономерами яких є нуклеотиди. Природні нуклеїнові кислоти виконують у всіх живих організмах роль передачі й експресії генетичної інформації.
Порівняльна характеристика ДНК і РНК
• ДНК — дезоксирибонуклеїнова кислота. Моносахарид — дезоксирибоза, нітрогеновмісні основи: пуринові — гуанін (Г), аденін (A), піримідинові — тимін (T) і цитозин (Ц). ДНК складається з двох полінуклеотидних ланцюжків.
• РНК — рибонуклеїнова кислота. Моносахарид — рибоза, нітрогеновмісні основи: пуринові — гуанін (Г), аденін (A), піримідинові — урацил (У) і цитозин (Ц). РНК складається з одного полінуклеотидного ланцюга.
У клітинах тіла людини виявлено близько 88 хімічних елементів. Основними з них є Гідроген, Оксиген, Карбон і Нітроген, які називають органогенними. До складу клітин входять неорганічні й органічні речовини.
З неорганічних речовин у клітині містяться вода, мінеральні солі тощо.
З органічних сполук у клітинах є білки, вуглеводи, жири, нуклеїнові кислоти, АТФ.
Організм людини складається з величезної кількості клітин, різних за формою, розмірами, масою і функціями. Усі вони мають однакові структурні елементи: цитоплазматичну мембрану, цитоплазму, ядро і органели (ендоплазматичну сітку, комплекс Гольджі, рибосоми, лізосоми, мітохондрії, клітинний центр), які функціонують взаємоузгоджено. Отже, клітина є цілісною біологічною системою.
Рівні організації живих організмів – молекулярний, клітинний, організменний, популяційно-видовий, біогеоценотичний, біосферний.
Самостійна робота
1. За поданими частинами складіть максимальну кількість формул органічних сполук (по 0,5 б)
а) CH3—
б) OH—
в) CH3—CH2—
г) NH2—
д) —COOH
е) CH3—CH(CH3) —CH—
2. Яка зі сполук належить до органічних речовин живої природи?
А) вода; Б) глюкоза; В) алмаз; Г) поліетилен.
3. Яка рослина є головним промисловим джерелом крохмалю?
А) ріпак; Б) льон; В) картопля; Г) виноград.
4. яка рослина є головним промисловим джерелом духмяної есенції?
А) троянда; Б) капуста; В) буряк; Г) пальма.
5. Що є головним промисловим джерелом природного барвника бета-каротину?
А) цибуля; Б) капуста; В) яблука; Г) морква.
6. Який харчовий продукт найбагатший на білки?
А) сало; Б) капуста; В) риба; Г) кетчуп.
7. Яка з речовин здатна до самоорганізації?
А) глюкоза; Б) ДНК; В) ЛСД; Г) крохмаль.
8. Який об’єкт належить до молекулярного рівня структурної організації матерії?
А) етанол; Б) атом Оксигену; В) натрій хлорид; Г) РНК.
9. Що визначає масу молекули полімеру?
А) міжмолекулярні зв’язки; Б) внутрішньо молекулярні зв’язки;
В) ступінь розгалуженості; Г) ступінь полімеризації.
10. Речовина містить 75% Карбону та 25% Гідрогену. Виведіть формулу речовини.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
__________________
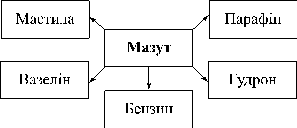
Природні джерела органічних речовин. Природний і супутній нафтові гази, їхній склад, використання
Природні гази, нафта й кам’яне вугілля — основні джерела вуглеводнів. При їхній переробці одержують практично всі органічні сполуки, що використовуються в різних галузях народного господарства. Обсяги їхнього видобутку зростають із кожним роком, але ще швидше зростає потреба в них. Якщо раніше основна частина природних вуглеводнів використовувалася тільки як паливо, то зараз акценти зміщуються у бік переробки їх із метою одержання органічних речовин: синтетичних волокон, барвників, розчинників, різних видів палива, лікарських препаратів, мастил, пластмас, каучуків тощо.
Основні джерела вуглеводнів — нафта, кам’яне вугілля, природний газ сформувалися на Землі в давні часи і належать до невідновлюваних природних ресурсів.
Неконтрольоване й нераціональне використання існуючих запасів вуглеводнів може призвести до повного виснаження родовищ.
Перед людством постає складне завдання: відшукати більш ефективні шляхи переробки нафти, газів, вугілля, сланців; удосконалити вже існуючі (перегонка, крекінг, піроліз, коксування); розробити технології одержання рідкого палива з вугілля та сланців; одержання й використання водню як моторного палива; одержання синтетичного рідкого палива з водню.
2. Природний і супутній гази
Найбільші родовища природного газу розташовані на території Росії. Склад газу з різних родовищ може відрізнятися за відсотковим вмістом основних складових. Запаси природного газу є і в Україні (Шебелінське, Дашевське, Семенівське, Абазівське родовища тощо).
У родовищах газ перебуває у стислому стані у товщі земної кори. Для його добування роблять свердловини, а для транспортування на великі відстані — будують газопроводи.
Супутній газ є різновидом природного газу. Він залягає разом із нафтою і виділяється на поверхню під час її добування.
Склад природного й супутнього газів
|
Складова газу |
Природний газ |
Супутній нафтовий газ |
|
Метан |
95,6 % |
63,4 % |
|
Етан |
1 % |
10,5 % |
|
Пропан |
0,33 % |
11,1 % |
|
Бутан |
0,07 % (н-бутан) |
2,8 % (н-бутан) і 1,2 % (ізо-бутан) |
|
Пентан і вище |
0,03 % |
2 % |
|
Азот і рідкі гази |
3 % |
9 % |
|
Вуглекислий газ |
0,4 % |
— |
Природний газ широко використовується як паливо, оскільки має високу теплотворну здатність (з 1 м3 газу виділяється при спалюванні 55 000 кДж енергії). Цю властивість природного газу використовують у промисловості для виробництва сталі та скла.
Окрім спалювання, природний газ використовують як сировину для хімічної промисловості (одержання ацетилену, сажі, водню тощо). Розроблені технології переробки природних газів (перетворення насичених вуглеводнів у ненасичені).
Супутній газ раніше не мав застосування, тому його спалювали на місцях видобування нафти. Зараз його використовують як цінну дешеву сировину та як паливо у побутових цілях. Для оптимального використання супутнього газу, його слід поетапно розділити:
супутній газ газовий бензин (суміш пентану, гексану, гептану й октану) суміш пропану й бутану «сухий газ» (складається переважно з метану).
Переваги природного газу
_________________________________________
_________________________________________
_________________________________________
Робота з підручником.
Схема використання різних видів природної вуглеводневої сировини
Розв’язування вправ.
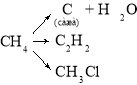
Запишіть рівняння реакції добування з природного газу: а) водню; б) сажі; в) ацетилену; г) хлорпохідних алканів.
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
__________________
Нафта. Склад, властивості нафти
Нафта є найважливішим джерелом хімічної сировини, а не лише паливом.
Завдання
У складі нафти містяться різні вуглеводні, переважно алкани. Напишіть 5 різних структурних формул алканів, у складі яких міститься 12 атомів Карбону. Назвіть їх.
Нафта - _____________________________________________________________
____________________________________________________________________________________________________________________________________________________________________________________________________________
Первинна перегонка нафти, фракції нафти, їхнє застосування
Сиру нафту зазвичай не використовують. Щоб одержати з видобутої нафти потрібні речовини, її слід піддати переробці після видалення механічних домішок.
Перегонка — це фізичний метод розподілу нафти на її складові, що заснований на різних температурах кипіння фракції.
|
Фракції |
Склад фракції |
t кипіння, °C |
Застосування |
|
Газова |
|
— |
Паливо |
|
Бензин |
|
40–200 |
Пальне для автомобільних і авіаційних двигунів |
|
Лігроїн |
|
120–240 |
Пальне для дизельних двигунів, розчинник лаків та фарб |
|
Гас |
|
150–310 |
Пальне для реактивних двигунів, побутове пальне |
|
Газойль |
C18 і вище |
250–275 |
Дизельне паливо |
|
Мазут |
Залишок після перегонки |
Сировина для одержання мастил рідке котельне паливо |
|
Недолік процесу первинної перегонки нафти —___________________________
____________________________________________________________________
Домашня робота.
Виберіть правильні відповіді. Відповідей може бути декілька. (по 1 б.)
- Вкажіть природні джерела вуглеводнів:
А) вода; Б) кам’яне вугілля; В) вапняк; Г) нафта.
- Вкажіть основну теорію походження нафти:
А) теорія будови органічних речовин;
Б) теорія мінерального походження4
В) теорія органічного походження.
- Вкажіть основні компоненти природного газу:
А) азот; Б) метан; В) етан; Г) гелій.
- Вкажіть чим відрізняється супутний нафтовий газ від природного:
А) кращий вид палива; Б) містить менше метану;
В) має більш різноманітний склад; Г) його спалюють під час добування.
- Вкажіть переваги природного газу перед вугіллям:
А) більш екологічно чисті продукти згорання;
Б) потребує більшого об’єму повітря для спалювання;
В) має вищу теплоту згорання;
Г) є сировиною для хімічної промисловості.
- Вкажіть правильну відповідь щодо складу нафти:
А) газуваті, рідкі та тверді вуглеводні; Б) рідкі та тверді вуглеводні;
В) рідкі вуглеводні; Г) газуваті та тверді вуглеводні.
- Вкажіть фізичні властивості нафти:
А) рідина темно-бурого кольору; Б) безбарвна рідина;
В) густа оліїста рідина; Г) добре розчинна у воді.
- Вкажіть спосіб первинної переробки нафти:
А) фільтрування; Б) перегонка; В) відстоювання; Г) випарювання.
- Вкажіть основні продукти первинної перегонки нафти:
А) водень; Б) гас; В) етан; Г) газойль.
- Вкажіть світлі нафтопродукти:
А) мазут; Б) бензин; В) етан; Г) газойль.
- Здійсніть перетворення (2 б)
![]() С
С
![]()
![]()
![]()
![]()
![]() С СН4 С2Н2 С2Н4 С2Н5ОН
С СН4 С2Н2 С2Н4 С2Н5ОН
СН3Сl
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
__________________
Продукти перегонки нафти, їх застосування.
Детонаційна стійкість бензину
1. Методи вторинної переробки нафти
Переробка нафти та нафтопродуктів
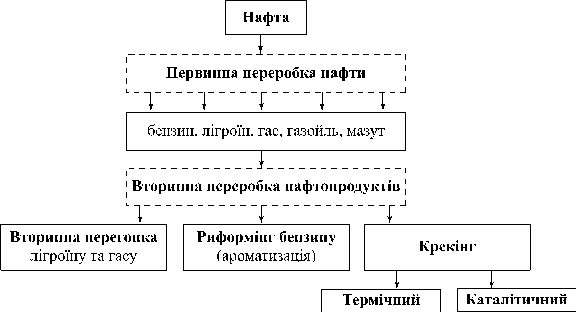
Переробка мазуту
Крекінг — __________________________________________________________
________________________________________________________________________________________________________________________________________
2. Продукти переробки нафти, їхнє застосування
3. Риформінг
Риформінг —________________________________________________________
________________________________________________________________________________________________________________________________________
4. Детонаційна стійкість бензину
Швидкість згоряння пального визначається його хімічним складом (вмістом вуглеводнів). Якщо у бензині переважають такі вуглеводні як гексан, гептан та октан, то швидкість згоряння буде дуже високою і може статися вибух — детонація. Детонація палива в моторах пояснюється нерівномірністю процесу його згоряння й залежить від якості бензину. Мірою детонаційної стійкості палива є октанове число (ОЧ). Воно чисельно дорівнює вмісту (в об’ємних %) ізооктану (ОЧ = 100) у його еталонній суміші з н-гептаном (ОЧ = 0), за якого ця суміш має однакові з випробуваним паливом антидетонаційні властивості.
6.1. Лабораторний дослід № 2
Тема. Ознайомлення зі зразками нафтопродуктів.
Мета: дослідити фізичні властивості нафтопродуктів, та взаємозв’язок між хімічним складом та властивостями.
Досліджувані об’єкти: колекція нафтопродуктів.
Хід роботи
1. Розгляньте запропоновані зразки продуктів нафтопереробки. Складіть порівняльну таблицю, в якій слід зазначити фізичні властивості (агрегатний стан, колір, наявність запаху тощо) та вказати галузі переважного застосування.
2. Зробіть висновки (поясніть залежність між фізичними властивостями нафтопродуктів та галуззю застосування).
Домашня робота
1- 6 завдання – по 1б, 7,8 завдання – по 2 б.
- Укажіть головну складову нафти:
А) спирти; Б) вуглеводи; В) жири; Г) вуглеводні.
- Укажіть, на чому ґрунтується нафто перегонка:
А) однакова густина складових; Б) різна густина складових;
В) відмінність в температурах кипіння; Г) однакова температура кипіння компонентів.
- Який апарат використовують для перегонки нафти?
А) ректифікаційну колону; Б) колону синтезу;
В) контактний апарат.
- Розташуйте продукти перегонки нафти за зростанням температури кипіння:
А) газовий бензин; Б) дизельне пальне; В) гас; Г) лігроїн.
______________________________________________________________
- Укажіть, що характеризує октанове число бензину:
А) вміст Карбону; Б) густину;
В) детонаційну стійкість; Г) вміст октану.
- Укажіть вуглеводні, вибрані еталонами для створення шкали детонаційної стійкості:
А) октан й ізогептан; Б) ізооктан і гептан;
В) гептан і ізогептан; Г) октан і ізооктан.
- Каталітична переробка бензинових фракцій первинної перегонки нафти за допомогою водню під тиском із використанням каталізаторів та під дією високих температур - ______________________________________________________________
- Високотемпературна переробка нафтової фракції з метою одержання низькомолекулярних продуктів із нижчою температурою кипіння - ______________________________________________________________
__________________
Кам’яне вугілля, продукти його переробки
Схема переробки кам’яного вугілля:
Коксування (суха перегонка) вугілля полягає в його хімічному розкладанні при нагріванні без доступу повітря.
Розрізняють два варіанти сухої перегонки вугілля — напівкоксування (швелювання) і коксування, перший процес здійснюється за температури 500–550 °С, друга — 900–1050 °С.
Головне завдання напівкоксування кам’яного вугілля — одержання рідких вуглеводнів (бензину); одночасно утворюються напівкокс і суміш газів (CO, CO2, H2, N2, CH4 та ін.).
Газифікація — це перетворення органічної частини викопного вугілля на горючі гази під час високотемпературної (1000–2000 °С) взаємодії з окиснювачами (O2, повітря, водяна пара,CO2). При цьому вугілля майже повністю перетворюється на генераторний і водяний гази (твердий залишок — зола). Для газифікації використовують буре вугілля та продукт переробки кам’яного вугілля — кокс.
Продукти переробки кам’яного вугілля та їх застосування
Головні продукти переробки кам’яного вугілля:
• коксовий газ — використовують для обігрівання коксових печей. Переважно коксовий газ використовують у хімічній промисловості — з нього одержують водень, етилен, із яких синтезують різноманітні речовини. Шляхом контакту з іншим продуктом (кам’яновугільною смолою) із коксового газу одержують технічний бензол — рідку суміш легкокиплячих аренів;
• амоніачна вода — з неї шляхом обробки вапняним молоком (водною суспензією кальцій гідроксиду) одержують амоніак;
• кам’яновугільна смола — є основним джерелом ароматичних вуглеводнів. Її розділяють шляхом перегонки на арени, феноли й похідні піридину, що є важливою сировиною для виробництва барвників, розчинників, вибухових речовин, лікарських і запашних препаратів, пестицидів тощо;
• залишок перегонки смоли — кам’яновугільний пек — використовується для виготовлення асфальту й ущільнюючих засобів;
• кокс, отриманий з вугілля, використовується в металургії у процесах виплавляння металів у доменних печах.
Лабораторний дослід № 3
Тема: ознайомлення за зразком продуктів коксування вугілля та різних видів палива.
Мета: дослідити властивості продуктів коксування кам’яного вугілля та різних видів палива.
Досліджувані об’єкти: колекція продуктів коксування та різних видів палива.
Хід роботи
1. Розгляньте запропоновані продукти коксування кам’яного вугілля.
2. Заповніть порівняльну таблицю, в якій слід зазначити фізичні властивості (агрегатний стан, колір, наявність запаху), особливості хімічного складу та галузь застосування.
3. Зробіть висновки (поясніть залежність застосування від хімічного складу та фізичних властивостей продуктів коксування).
Самостійна робота
Дайте відповіді на запитання тесту (можуть бути декілька правильних відповідей)
- Вкажіть основний компонент кам’яного вугілля:
А) графіт; Б) вуглець; В) органічні речовини; Г) водень.
- Вкажіть назву процесу нагрівання вугілля понад 10000С без доступу кисню:
А) крекінг; Б) розклад; В) коксування; Г)піроліз.
- Вкажіть речовини, які, крім коксу, утворюються під час коксування кам’яного вугілля:
А) бензин; Б) амоніакова вода; В) мазут; Г) кам’яновугільна смола.
- Вкажіть складову переробки кам’яного вугілля, яка містить найбільше речовин:
А) кокс; Б) кам’яновугільна смола; В) амоніакова вода; Г) коксовий газ.
- Вкажіть галузь застосування коксу:
А) виробництво лікарських препаратів; Б) металургія;
В) виробництво барвників; Г) виробництво вибухових речовин.
- Вкажіть речовину, яка спричиняє «парниковий ефект» на планеті:
А) кисень; Б) азот; В) вуглекислий газ; Г) сульфур (ІV) оксид.
- Вкажіть причину, що викликає розвиток парникового ефекту:
А) озонові дири; Б) кислотні дощі; В) фотохімічний смог;
Г) дисбаланс між умістом кисню й карбон (ІV) оксиду в атмосфері планети.
- Вкажіть речовини, які спричиняють кислотні дощі:
А) карбон (ІV) оксид; Б) сульфур (ІV) оксид; В) нітроген (ІV) оксид.
- Вкажіть причину, що викликає фотохімічний смог:
А) дисбаланс між умістом кисню й карбон (ІV) оксиду в атмосфері планети;
Б) підвищення вмісту нітроген (ІV) оксиду в атмосфері;
В) дія сонячного світла; Г) озонові дири.
- Вкажіть основні заходи, що забезпечують зменшення шкідливих забрудників атмосфери в результаті використання палива:
А) ощадливо використовувани ці продукти, тим самим зменшуючи кількість шкідливих викидів;
Б) уловлювати відходи фільтрами;
В) пошук альтернативних джерел енергії;
Г) створення технологій повного згорання палива.
___________________
Основні види палива і їхнє значення в енергетиці країни. Охорона навколишнього середовища від забруднень при переробці вуглеводневої сировини й використанні продуктів її переробки
Самостійна робота. Здійсніть перетворення. Визначте тип реакції, назвіть одержані речовини. (по 3 бала)
![]()
 СН2Сl2
СН2Сl2
Основні види палива та їхнє значення в енергетиці країни
|
Джерела енергії |
Вироблення енергії, 1018 Дж |
|||
|
1972 р. |
1985 р. |
2000 р. |
2020 р. |
|
|
Вугілля |
66 |
115 |
170 |
269 |
|
Нафта |
115 |
216 |
195 |
106 |
|
Газ |
46 |
77 |
143 |
125 |
|
Ядерне паливо |
2 |
23 |
88 |
314 |
|
Разом |
229 |
431 |
596 |
814 |
Хімічними речовинами, що найбільше забруднюють довкілля є: оксиди Карбону (CO та CO2); сульфур(IV) оксид, оксиди Нітрогену (NO та NO2), сірководень H2S, етан CH4 та багато інших.
До основних забрудників атмосфери належать:
• ТЕС, що працюють на викопних видах палива;
• автомобільний транспорт, що викидає у атмосферу небезпечні вихлопні гази;
• нафтопереробні та коксохімічні підприємства.
Одним із негативних наслідків безконтрольного забруднення атмосфери є парниковий ефект. Він спричиняється збільшенням кількості вуглекислого газу і має згубні наслідки — підвищення середньорічної температури і зміну клімату.
В результаті складних фотохімічних реакцій, у повітрі, забрудненому вуглеводнями, пилом, сажею й оксидами Нітрогену під впливом сонячного світла та підвищеної температури виникає смог. Оксиди Сульфуру та Нітрогену, що викидаються в атмосферу внаслідок роботи ТЕС та автодвигунів, сполучаються з атмосферною вологою й утворюють краплі сульфатної та нітратної кислот. Вони переносяться вітром у вигляді кислотного туману й випадають кислотними дощами.
Вміст вихлопних автомобільних газів
Карбон(II) оксид. Отруйний газ без кольору і запаху. При вдиханні сполучається з гемоглобіном крові. Невеликі концентрації викликають запаморочення, головний біль, почуття втоми й уповільнення реакції у водія. Висока концентрація навіть при короткочасному впливі може призвести до смерті. Кисневе голодування насамперед руйнує головний мозок і особливо небезпечно для серцевого м’яза, спричиняє захворювання серця — стенокардію.
Альдегіди. Належать до отруйних речовин, подразнюють очі, дихальні шляхи, вражають нирки й печінку.
Оксиди Нітрогену. Розчиняючись у воді, утворюють нітратну і нітритну кислоти, є причиною кислотних дощів. Ці кислоти утворюються у верхніх дихальних шляхах організму, роз’їдаючи їх.
Сажа. Діє на органи дихання, але найнебезпечнішим є те, що на поверхні часток сажі осідають канцерогенні речовини.
Канцерогенні речовини (зокрема бензопірен). Дуже небезпечні для людини навіть у малій концентрації, оскільки накопичуючись в організмі, ці речовини спричиняють ракові захворювання.
Сполуки Плюмбуму. Отрути, що вражають центральну нервову систему, шлунково-кишковий тракт, порушують процеси обміну речовин. Накопичуються в організмі до небезпечних концентрацій. Поблизу автомагістралей вони накопичуються в ґрунті та рослинах.
Гідроген сульфід (сірководень). Із водяною парою в атмосфері утворює сульфатну кислоту. Тривале вдихання спричиняє порушення діяльності нервової системи.
Домашня робота.
Кожна правильна відповідь – 3 бала.
- Назвіть альтернативні джерела енергії.
- Запропонуйте свої методи заохочення підприємств використовувати безпечні джерела енергії.
- Назвіть найважливіші природні джерела вуглеводнів.
- Назвіть можливі наслідки парникового ефекту.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
____________________________________________________________________
__________________
Синтез органічних сполук різних класів на основі вуглеводневої сировини.
Промислові методи:
1. Насичені вуглеводні з довжиною ланцюга до одинадцяти атомів Карбону одержують переважно методами:
• фракційної перегонки нафти;
• переробки природного газу;
• гідрогенізації вугілля: ![]()
Лабораторні методи:
1. Гідроліз алюміній карбіду:
![]()
2. Синтез Вюрца:
![]() ;
;
2. Одержання ненасичених вуглеводнів
Алкенів
Промислові методи:
Крекінг алканів нафти
|
|
|
Лабораторні методи:
1. Дегідратація спиртів:
![]() ;
;
![]()
Алкінів
Промислові методи отримання етину:
1. Гідроліз кальцій карбіду:
![]() ;
;
![]() .
.
2. Піроліз метану:
![]() .
.
Одержання оксигеновмісних органічних сполук та їх застосування
Насичені одноатомні спирти (метанол й етанол)
Добування метанолу:
![]() .
.
Добування етанолу:
1. Зброджування цукристих речовин:
![]() .
.
2. Гідроліз крохмалю та клітковини з наступним зброджуванням утвореної глюкози:
![]() .
.
![]() .
.
3. Гідратація етену:
![]()
Методи добування багатоатомних спиртів
Двохатомні спирти добувають окисненням алкенів:
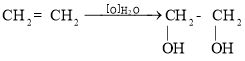 .
.
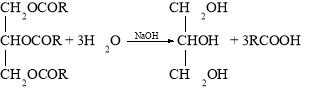
Гліцерол добувають омиленням жирів:
Карбонові кислоти
Добування
Загальний спосіб добування карбонових кислот— окиснення спиртів та альдегідів. Перспективними є способи добування карбонових кислот окисненням алканів.
Окиснення етанолу:
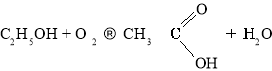
Окиснення етаналю:
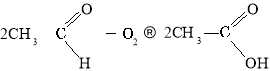
Окиснення бутану:
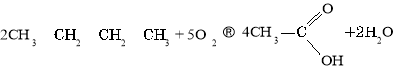
Естери, жири
Продукти взаємодії карбонових кислот і спиртів належать до класу естерів. Реакція їх утворення називається реакцією естерифікації.
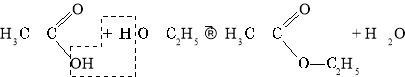
Жири — це естери трьохатомного спирту гліцеролу і вищих (насичених і ненасичених) карбонових кислот.
Домашня робота
Складіть рівняння реакцій для здійснення перетворень.(кожне рівняння – 1 бал)
I![]() .
.
II ![]() .
.
III![]() .
.
___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
_________________
Органічні речовини як основа сучасних матеріалів. Пластмаси
Хімічна галузь постачає промисловості та сільському господарству різні матеріали і сировину. Це паливо, мастила, хімічні волокна, пластмаси, синтетичні каучуки, мінеральні добрива, мийні засоби, парфуми, фармацевтичні препарати, луги, кислоти, розчинники, вибухові речовини тощо.
Створення нових матеріалів — це життєва необхідність сьогодення. Матеріали, що зараз використовуються, зокрема в машинобудуванні, недостатньо стійкі та міцні. Тому обладнання передчасно зношується, потребуючи частих замін та ремонтів. Нових матеріалів вимагають і нові галузі техніки: космічна, атомна тощо. Для практичних потреб необхідні такі матеріали, як метали, полімери, кераміка та композити.
Полімери — це високомолекулярні сполуки, молекули яких складаються з великого числа мономерних ланок, що сполучені між собою хімічними зв’язками.
Наприклад, полімер (—CH2—CH2—)n складається з n ланок етену.
Число n називається ступенем полімеризації.
ВМС — це сполуки, молекули яких складаються з великого числа повторюваних ланок.
Приклади природних ВМС: органічні сполуки — целюлоза, білки, крохмаль, натуральний каучук; неорганічні — графіт, силікати.
Штучні ВМС одержують із природних ВМС, використовуючи хімічні методи, що не змінюють головний ланцюг. Синтетичні ВМС одержують реакціями полімеризації й поліконденсації низькомолекулярних речовин.
Штучні органічні полімери — ацетилцелюлоза, нітроцелюлоза, гума; синтетичні органічні полімери — поліетилен, полістирол, полівінілхлорид, капрон, лавсан, каучуки; синтетичні неорганічні полімери — скловолокно, керамічні волокна.
«Полі» — багато, «моно» — один, «мерос» — частина. Полімери — це високомолекулярні сполуки. Мономери — це низькомолекулярні речовини, з яких одержують полімери.
Ступенем полімеризації (поліконденсації) називають середнє число структурних ланок у молекулі полімеру.
Повторювану ділянку молекули полімеру називають структурною ланкою.
Полімери стереорегулярної будови мають регулярно розташовані радикали з одного або з двох боків головного ланцюга.
У ході реакцій полімеризації утворюються тільки полімери; при реакціях поліконденсації утворюються полімери і побічні продукти — низькомолекулярні речовини.
Відносна молекулярна маса для полімеру є його середньою відносною молекулярною масою, оскільки ступінь полімеризації не є величиною постійною.
6.1. Лабораторний дослід № 4
Тема. Ознайомлення зі зразками пластмас.
Мета: ознайомитися з властивостями пластмас.
Обладнання: склянки, тигельні щипці, нагрівальний прилад, металева пластинка, скляна паличка, штатив із пробірками.
Досліджувані об’єкти: шматочки поліетилену, поліпропілену, полівінілхлориду чи інші, що є в лабораторії.
Реактиви: розчин лугу, кислоти та калій перманганату, вода.
Хід роботи
1. Розгляньте зразки пластмас, опишіть їхні зовнішні ознаки.
2. Порівняйте густину кожного зразка із густиною води.
3. Визначте термопластичність зразків пластмас.
4. Визначте відношення пластмас до дії кислот та лугів.
5. За всіма спостереженнями складіть порівняльну таблицю.
6. Зробіть висновки. Визначте загальні властивості пластмас та відмінності у поданих зразках.
Домашня робота
Позначте правильну відповідь (по 1 б)
- Яким матеріалом є целулоїд?
А) природним; Б) синтетичним; В) штучним; Г) будівельним.
- Які компоненти надають пластмасам еластичності?
А) наповнювачі; Б) антипірени; В) барвники; Г) пластифікатори.
- Класифікуйте хімічну реакцію синтезу поліетилену з етену:
А) полімеризація; Б) поліконденсація; В) гідрування; Г) дегідрування.
- Укажіть здатність полімерів і пластмас багаторазово розм’якшуватися і тверднути внаслідок нагрівання і наступного охолодження:
А) термореактивність; Б) термопластичність; В) терморегуляція.
- Створіть реальну чи віртуальну колекцію пластмас, які ви використовуєте в повсякденному житті. В описі прокоментуйте маркування, виявлене вами на виробах із цих матеріалів, установіть зв'язок між їхніми властивостями і застосуванням. (8 б)
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
__________________
Синтетичні каучуки, гума.
Каучук — це еластичний матеріал, який отримують при коагуляції латексу каучуконосних рослин.
Природний каучук — полімер ненасиченого вуглеводню ізопрену C5H8. Його добувають із молочного соку деяких рослин, переважно з гевеї, що росте в тропічних країнах. Полімеризацію ізопрену можна схематично зобразити таким рівнянням:
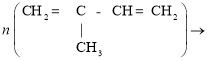
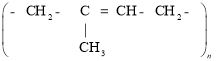
Молекули природного каучуку мають лінійну будову. Відносна молекулярна маса природного каучуку становить 150–500 тис., а число елементарних ланок в молекулі — до 2500.
Чистий каучук має густину 0,9–0,95 г / см3, легший за воду, не розчиняється у воді. Природний каучук не проводить електричний струм.
Усі існуючі каучуки можна розділити на два великих сегменти: каучуки загального призначення й каучуки спеціального призначення.
|
Синтетичні каучуки |
|
|
загального призначення |
спеціального призначення |
|
Бутадієн-стирольний |
Хлоропреновий |
|
Бутадієн-метил-стирольний |
Бутадієн-нітрильний |
|
Полібутадієновий |
Галогенірувані ізобутілени |
|
Бутилкаучук |
Уретани |
|
Етиленпропіленовий |
Силікони |
|
Етиленпропілендієновий |
Полісульфідні каучуки |
|
Цис-1,4-поліізопреновий |
|
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Гума — високоеластична, міцна сполука, складна багатокомпонентна система, що складається з полімерної основи (каучуку) і різних добавок.
Гума — матеріал, необхідний для виробництва різноманітних виробів — від автомобільних шин до хірургічних рукавичок. Головна перевага гуми — її еластичність. Вона може розтягуватися й гнутися, а потім приймати початкову форму. Гума може бути як м’якою, так і твердою.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Ебоніт — вулканізований каучук з високим вмістом сірки (30–50 % від маси каучуку), зазвичай темно-бурого або чорного кольору. На відміну від м’якої гуми, ебоніт не виявляє високої еластичності за звичайних температур і нагадує тверду пластмасу.
Зараз ебоніти практично витіснені пластмасами і майже не використовуються.
6.1. Лабораторний дослід № 5.
Тема. Ознайомлення зі зразками каучуків.
Мета: ознайомитися з властивостями каучуків.
Досліджувані об’єкти: зразки натурального та синтетичних (декілька різних видів) каучуків).
Обладнання: нагрівальний прилад, штатив із пробірками, водяна баня, тигельні щипці, ножиці, лінійка.
Хід роботи
1. Розгляньте зовнішні ознаки зразків каучуків.
2. Дослідіть еластичні властивості каучуків за звичайних умов.
3. Визначте відношення каучуків до нагрівання.
4. За результатами досліджень складіть порівняльну таблицю.
5. Зробіть висновки, зазначте спільні властивості та відмінності у досліджуваних видів каучуків.
Домашня робота
Позначте правильну відповідь (по 1 б)
- Природний каучук – це:
А) термопласти; Б) еластомер; В) пластмаса; Г) гума.
- Яке дерево є джерелом натурального каучуку?
А) гевея; Б) береза; В) яблуня; Г) клен.
- Укажіть матеріал, що є продуктом вулканізації природного каучуку:
А) пластмаса; Б) поліхлорпреновий каучук; В) гума.
- Яке призначення хлоропренового каучуку?
А) загальне; Б) спеціальне; В) ексклюзивне; Г) таємне.
- Яка речовиина є вулканізувальним агентом?
А) вода; Б) кисень; В) сірка; Г) вуглець.
- Відносна молекулярна маса природного каучуку становить
А) 150–500 тис; Б) 500-650 тис; В) 50-150 тис; Г) 500-1=950 тис.
- Вулканізований каучук з високим вмістом сірки
А) гума; Б) пластмаса; В) ебоніт; Г) волокно.
- Створіть реальну або віртуальну колекцію канчуків і гуми, які ви використовуєте в повсякденному житті. (5 б)
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
_____________________
Штучні й синтетичні волокна.
1. Класифікація волокон
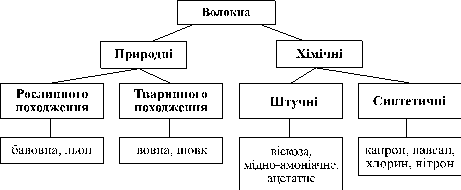
Натуральними називаються волокна природного походження (рослинного або тваринного).
Хімічними називаються волокна, що були вироблені з молекулярних сполук (природних або синтетичних).
Штучними є волокна, що одержані хімічною обробкою природних полімерів, зокрема клітковини.
Синтетичними є волокна, що були синтезовані з низькомолекулярних сполук хімічним способом.
Капрон добувають реакцією полімерізації:
![]()
![]() .
.
Молекули капрону мають лінійну будову.
Лавсан добувають реакцією поліконденсації між етиленгліколем і терефталевою кислотою:
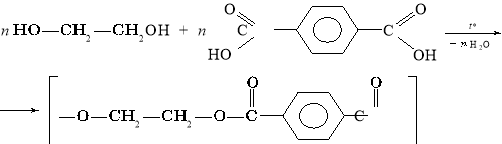
Молекули лавсану мають розгалужену будову.
Тканини із синтетичних волокон
Сировиною для виробництва синтетичних волокон є гази — продукти переробки кам’яного вугілля й нафти. У результаті складних хімічних реакцій одержують синтетичні волокна, що відрізняються одне від одного хімічним складом, властивостями, характером горіння.
Найпоширеніші з них:
• поліефірні волокна (лавсан, кримплен й ін.);
• поліамідні волокна (капрон, нейлон);
• поліакрилонітрильні волокна (нітрон, акрил);
• еластанове волокно (лайкра, дорластан).
Застосування капрону на основі його фізичних властивостей. Види продукції на основі капрону
1. Кордна тканина — у шинній промисловості, як каркас для виготовлення покришок, пневматичних шин.
2. Штапельне капрон-волокно — у текстильній і килимовій промисловості.
3. Поліамід-6 — для виготовлення технічних виробів, деталей, що використовуються в машинобудуванні, автомобільній промисловості.
4. Мононить — для виготовлення щіток комунальних машин.
5. Технічні нитки — для виготовлення технічних тканин, канатів, у рибній промисловості.
6. Текстильні нитки — у виробництві панчішних та шкарпеткових виробів.
7. Капронова смола — для виготовлення пластмасових виробів.
8. Волокнистий матеріал — для дорожнього покриття у важкодоступних районах країни.
Тканини зі штучних волокон
Віскозне волокно
Сировиною для виробництва віскозного волокна є целюлоза з деревини. Її одержують з ялинової тріски й тирси додаючи хімічні речовини. Віскозне волокно дуже схоже на волокно натурального шовку.
Віскозні волокна м’які, гладкі, менш міцні за натуральний шовк. Віскоза краще за бавовну вбирає вологу, але має слабку пружність, тому тканини з віскозних волокон дуже мнуться.
Горять віскозні волокна швидко, рівно, полум’я яскраве, залишається запах паленого паперу. Після згоряння залишається попіл сірого кольору.
Ацетатне волокно
Сировиною для ацетатного волокна є відходи бавовни з додаванням хімічних речовин. Ацетатні волокна погано вбирають вологу, мають більшу пружність ніж віскоза, тому майже не мнуться й добре зберігають форму. Горить ацетатне волокно дуже повільно, жовтим полум’ям, залишаючи оплавлену кульку й кислуватий запах.
Лабораторний дослід № 6
Тема. Ознайомлення зі зразками натуральних, штучних і синтетичних волокон.
Мета: дослідити та порівняти деякі фізичні та хімічні властивості різних видів волокон.
Обладнання: штатив із пробірками, нагрівальний прилад, тигельні щипці, скляні палички, металева пластинка.
Досліджувані об’єкти: зразки різних видів волокон (бавовна, вовна, шовк (натуральний та ацетатний), капрон, лавсан, нейлон та інші.
Хід роботи
1. Ознайомитися із зовнішніми ознаками усіх видів волокон. Звернути увагу на колір, блиск, структуру, товщину волокон.
2. Визначити відношення всіх видів волокон до нагрівання.
3. Визначити відношення всіх видів волокон до горіння.
4. Скласти порівняльну таблицю за результатами спостережень.
5. Зробити висновок, де зазначити загальні властивості і відмінності у досліджуваних видах волокон.
Домашня робота
Позначте правильну відповідь (по 1 б)
- Яке волокно є природним?
А) вовна; Б) нітрон; В) лавсан; Г) триацетат.
- Яке волокно є штучним?
А) бавовна; Б) віскоза; В) капрон; Г) нітрон.
- Яке волокно добувають прядінням з розплаву?
А) вовна; Б) віскоза; В) триацетат; Г) капрон.
- Яке волокно має білкову природу?
А) бавовна; Б) вовна; В) лавсан; Г) нітрон.
- Волокно, що належить до поліамідних:
А) віскоза; Б) лавсан; В) капрон; Г) ацетатне.
6. Метод одержання синтетичного волокна капрону:
А) полімеризація4 Б) поліконденсація; В) ізомеризація; Г) етерифікація.
7. Будова полімерного ланцюга молекул капрону:
А) лінійна; Б) розгалужена; В) просторова.
8. Перевірте достовірність інформації на етикетках щодо складу тканини, з яких виготовлено ваш одяг.(5 б)
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
_________________
Органічні сполуки і здоров’я людини.
|
Назва речовини |
Галузь застосування |
Вплив на організм людини |
|
|
позитивний |
негативний |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Самостійна робота
I варіант
1. Метод одержання синтетичного волокна капрону:
А) полімеризація; Б) поліконденсація;
В) ізомеризація; Г) етерифікація
2. Вихідні речовини для синтезу лавсану:
А) терефталева кислота; Б) гліцерол
В) етиленгліколь; Г) ацетальдегід
3. Волокна, що належать до синтетичних:
А) капрон; Б) віскоза; В) нітрон; Г) вовна
4. Волокно, що належить до поліамідних:
А) віскоза; Б) лавсан; В) капрон; Г) ацетатне
5. Будова полімерного ланцюга молекул капрону:
А) лінійна; Б)розгалужена; В)просторова
6. Укажіть схему одержання волокна капрону і допишіть відповідне рівняння реакції:
А ![]()
Б ![]()
В ![]()
Г ![]()
II варіант
1. Метод одержання синтетичного волокна лавсану:
А) полімеризація; Б) поліконденсація
В ізомеризація; Г) етерифікація
2. Вихідні речовини для синтезу капрону:
А) α-амінокапронова кислота; Б) β-амінокапронова кислота
В) ε-амінокапронова кислота; Г) терефталева кислота
3. Волокна, що належать до штучних:
А) капрон; Б) віскоза; В) ацетатне; Г) нітрон
4. Волокна, що належать до поліестерних:
А) ацетатне; Б) капрон; В) лавсан; Г) віскоза
5. Будова полімерного ланцюга макромолекул лавсану:
А) лінійна; Б) розгалужена; В) просторова
6. Укажіть схему, що відображає процес одержання волокна лавсану і допишіть відповідне рівняння реакції:
А 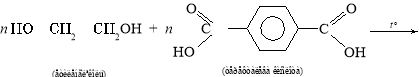
Б 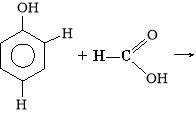
В ![]()
Г ![]()
______________________
Жири й вуглеводи як компоненти їжі, їхня роль в організмі.
Жири й вуглеводи — необхідні компоненти харчування. Для правильної організації харчування необхідно знати, які з цих органічних речовин і в якій кількості необхідні людині.
Жири забезпечують близько 30 % добової енергетичної цінності добового раціону.
Вуглеводи є основною частиною харчового раціону. Вони забезпечують 50–55 % потреби людини в енергії, а в деяких державах, зокрема в Україні, навіть до 70 %. Норма споживання вуглеводів на добу становить 300–500 г або 5–8 г на кожен кг маси тіла. При значних фізичних та розумових навантаженнях норма споживання вуглеводів збільшується до 700 г.
Жири — це складні естери трьохатомного спирту гліцеролу і карбонових кислот.
Здебільшого жири утворені вищими насиченими і ненасиченими карбоновими кислотами, переважно пальмітиновою ![]() , стеариновою
, стеариновою ![]() , олеїновою
, олеїновою ![]() , лінолевою
, лінолевою ![]() та деякими іншими. Меншою мірою в утворенні жирів беруть участь нижчі кислоти, наприклад масляна
та деякими іншими. Меншою мірою в утворенні жирів беруть участь нижчі кислоти, наприклад масляна ![]() (у вершковому маслі), капронова
(у вершковому маслі), капронова ![]()
Вуглеводи або сахариди — одна з основних груп органічних сполук організму.
Глюкоза C6H12O6 ,сахароза C12H22O11. До складу похідних вуглеводів можуть входити й інші елементи. Усі вуглеводи поділяють на прості (моносахариди) і складні (полісахариди).
Роль жирів
Жир використовується організмом не тільки як джерело енергії, він входить до складу клітин. Жир є обов’язковою складовою частиною протоплазми, ядра і оболонки. Залишок жиру, що надійшов в організм після задоволення його потреби відкладається в запас у вигляді жирових крапель. Жир відкладається переважно в підшкірній клітковині, сальнику, навколо нирок, утворюючи ниркову капсулу, а також в інших внутрішніх органах і в деяких інших ділянках тіла. Значна кількість жирового запасу міститься в печінці та м’язах. Цей жир є в першу чергу джерелом енергії, що мобілізується, коли витрата енергії перевищує його надходження.
Роль вуглеводів
Основна роль вуглеводів пов’язана з їх енергетичною функцією. При ферментативному розщеплюванні й окисненні жирів виділяється енергія, яка використовується клітиною. Полісахариди відіграють переважно роль запасних продуктів і джерел енергії (наприклад, крохмаль і глікоген), а також використовуються як будівельний матеріал (целюлоза, хітин).
Продукти, що містять корисні жири: оливкова олія, рапсова олія, олія з арахісу, соняшникова олія, соєва олія, олія з горіхів (грецькі, кедрові), конопляна, лляна олії, жир морської риби, що живе в холодних водах.
Продукти, де містяться шкідливі жири: тваринні жири (сало, вершкове масло, яловичий жир тощо)
Окиснені жири (жири, що пройшли гарячу обробку): креми, крекери, бісквіти, соуси, майонези тощо.
Норма споживання жирів на добу: 90–100 г (з них 1/3 частина повинна надходити з рослин).
Норма споживання вуглеводів на добу: 300–500 г або 5–8 г на кожен кг маси тіла. При значних фізичних та розумових навантаженнях норма споживання збільшується до 700 г.
Домашня робота
Прочитати пропонований текст і скласти раціональне меню на один день з оптимальним вмістом жирів і вуглеводів.
Текст (для складання меню)
Вуглеводи в їжі поділяють: складні або полісахариди: крохмаль, глікоген, клітковина, пектин; прості у вигляді моносахаридів: глюкоза, фруктоза, галактоза і дисахаридів: сахароза, лактоза, мальтоза.
Головна функція вуглеводів — забезпечувати організм енергією. Основне джерело енергії — глюкоза. Організм одержує її при поступовому розщепленні крохмалю або із простих вуглеводів. У крові здорової людини підтримується постійний рівень глюкози, щоб вона завжди була доступна органам і тканинам. Нормальний рівень глюкози в крові — 3,3–5,5 ммоль/л. Це важливий показник вуглеводневого обміну. Вуглеводи мають щодня надходити з їжею й становити 60–70 % калорійності раціону. Добова потреба у вуглеводах дорослої людини зі звичайною руховою активністю становить 300–400 г. Вуглеводи містяться в рослинних продуктах. Головним джерелом вуглеводів при правильному харчуванні має бути крохмаль: хліб, крупи, картопля. Прості вуглеводи повинні переважно надходити із фруктами, ягодами й овочами, медом, які крім моно- і дисахаридів містять цілу низку корисних речовин. Оптимальне співвідношення простих вуглеводів до складних у харчуванні повинне становити 1 : 4–5. Здорова людина без шкоди може з’їдати в день 50–100 г простих вуглеводів.
Жири — необхідний компонент харчування. Харчові жири складаються із гліцеролу й жирних кислот, з’єднаних естерними зв’язками. Жирні кислоти розділяють на насичені, мононенасичені й поліненасичені. Останні у свою чергу розділяють на два основних типи: омега-6 і омега-3. Середня потреба в жирі становить близько 30 % від загальної калорійності (1–1,5 г на кг маси тіла в день, 70–100 г при вазі 70 кг). Причому це не тільки жир сала, вершкового й рослинного масел, але й схований жир інших продуктів. Така кількість жиру припустима для осіб, які ведуть активний спосіб життя та не страждають на ожиріння. Останнім часом дієтологи переглядають норму потреби в жирі й радять зменшити його споживання до 20–25 % від загальної калорійності раціону, відповідно до 50–70 г на день.
__________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
_________________________
Білки, вітаміни як компоненти їжі, їхня роль в організмі
Білки — це складні органічні сполуки, що складаються з Карбону, Гідрогену, Оксигену, Нітрогену. До складу деяких входить Сульфур. Частина білків утворює комплекс з іншими молекулами, що містять Ферум, Флуор, Цинк, Купрум. Молекули білків — це ланцюги побудовані з амінокислот. Оскільки число амінокислот дуже велике, то білкові молекули називають макромолекулами. Білкова молекула — це полімер, мономером якого є амінокислоти. У природі існує 20 різних амінокислот. Хімічний зв’язок між карбоксильною групою (COOH) і аміногрупи (NH2) називається пептидним. Пептидні зв’язки утворюються в результаті взаємодії карбоксильної групи однієї амінокислоти з аміногрупою іншої. З трьох амінокислот утворюються трипептиди. А тому що в білковій молекулі величезна кількість пептидних зв’язків, то білки є поліпептидами.
Білки поділяють на:
• прості (складаються тільки з амінокислот): альбумін; глобуліни; гістони; скеропротеїни.
• складні (складаються з глобулярних кислот і небілкового матеріалу): Фосфопротеїни; глікопротеїни; нуклеопротеїнів; ліпопротеїни; флабопротеїни.
Гормони — біологічно активні сполуки, що впливають на обмін речовин.
Ферменти — це специфічні білки, що входять до складу всіх клітин і тканин живих організмів і які виконують роль біологічних каталізаторів.
Необхідно, щоб білки були в правильних співвідношеннях з іншими харчовими речовинами — жирами, вуглеводами і вітамінами. За відсутності або недостатньому вмісті в їжі вуглеводів, жирів або вітамінів в організмі значно посилюються процеси розщеплювання білків, і рекомендовані норми добового споживання білків можуть виявитися недостатніми.
Норма споживання білка на добу: 1,5 г на 1 кг маси тіла.
Вітаміни — необхідні для життєдіяльності людини органічні речовини різної хімічної природи, що надходять до організму з їжею (рідше утворюються в ньому). Вони не є пластичним матеріалом або джерелом енергії, а служать компонентами ферментних систем і каталізаторами різних обмінних процесів. Джерелами вітамінів є харчові продукти рослинного і тваринного походження. Добова потреба організму у вітамінах мала. За тривалої їхньої відсутності розвивається захворювання — авітаміноз, за їхньої нестачі — гіповітаміноз. На сьогодні описано декілька десятків вітамінів. Їх прийнято позначати великими літерами латинського алфавіту. За розчинністю всі вітаміни поділяють на дві групи: жиророзчинні (A, D, E, K) і водорозчинні (B, C, PP). Якщо самостійно приймати вітамінні препарати у значній кількості без нагляду лікаря, то може розвитися гіпервітаміноз.
Вітамін A (ретинол) ______________________________________________________________________________________________________________________________________________________________________________________________________
Вітамін C (аскорбінова кислота) ______________________________________________________________________________________________________________________________________________________________________________________________________
Вітаміни групи В — B1, B2, B6 — (тіамін, рибофлавін, піридоксин) ______________________________________________________________________________________________________________________________________________________________________________________________________
Вітамін E (токофероли) ______________________________________________________________________________________________________________________________________________________________________________________________________
Домашня робота
Дати визначення термінам (по 1 б):
- Білки - _______________________________________________________
_____________________________________________________________
- Вітаміни -____________________________________________________
_____________________________________________________________
- Жири -_______________________________________________________
_____________________________________________________________
- Сахароза - ____________________________________________________
_____________________________________________________________
- Глюкоза -____________________________________________________
_____________________________________________________________
- Назвіть функції білків (2 бала)___________________________________
_____________________________________________________________
- Скласти збалансоване за кількістю білків і вітамінів меню на один день для жінки (чоловіка) (5 балів)
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
____________________
Харчові добавки. Е-числа.
Самостійна робота «Знайди відповідність»
(Кожне завдання оцінюється по 2 бала)
|
Речовина |
Характеристика |
|
1 Білки |
А Естери (складні ефіри) гліцеролу та вищих кислот |
|
2 Жири |
Б Вуглевод, мономер |
|
3 Глюкоза |
В Речовини різної хімічної будови, необхідні для життєдіяльності людини |
|
4 Сахароза |
Г Полімери, мономерами яких є амінокислоти |
|
5 Вітаміни |
Д Дисахарид із класу вуглеводів |
Відповідь:
|
1 |
2 |
3 |
4 |
5 |
|
|
|
|
|
|
Харчові добавки — природні або синтезовані речовини, що цілеспрямовано вводяться в продукти харчування з метою надання їм необхідних властивостей (наприклад, органолептичних, технологічних). Вони не вживаються безпосередньо у вигляді самостійних компонентів їжі.
Класифікація харчових добавок
1. Речовини, що регулюють смак продукту (ароматизатори, смакові добавки, що підсолоджують речовини, регулювальники кислотності).
2. Речовини, що поліпшують зовнішній вигляд продукту (барвники, стабілізатори кольору, вибілювачі).
3. Речовини, що регулюють консистенцію та формують текстуру (загусники, гелеутворювачі, стабілізатори, емульгатори).
4. Речовини, що підвищують збереження продуктів та збільшують терміни їх зберігання (консерванти, антиоксиданти).
Згідно із системою кодифікування харчових добавок, усі вони розподілені на групи:
Е100–Е182 — барвники;
Е200–Е280 — консерванти;
Е300–Е391 — антиокиснювачі (антиоксиданти);
Е400–Е481 — стабілізатори, емульгатори, загусники;
Е500–Е585 — регулювальники кислотності, розпушувачі;
Е600–Е699 — підсилювачі смаку та аромату;
Е700-Е899 — запасні індекси для іншої можливої інформації;
Е900–Е999 — глазуруючі агенти, підсолоджувачі, піногасники;
Е1000-Е1521 — емульгатори, герметики, ферменти, вологозатримувачі.
Негативні наслідки вживання харчових добавок
|
Небезпечні харчові добавки |
Номер небезпечного «Е» |
|
Барвники |
Е102, Е110, Е120, Е124 |
|
Канцерогени |
Е103, Е105, Е110, Е121, Е123, Е125, Е126, Е130, Е131, Е142, Е152, Е153, Е210, Е211, Е213–Е217, Е231, Е232, Е240, Е251, Е252, Е321, ЕЗЗО, Е431, Е447, Е900, Е905, Е907, Е952, аспартам |
|
Мутагенні та генотоксичні |
Е104, Е124, Е128, Е230–Е233, аспартам |
|
Алергени |
Е131, Е132, Е160Ь, Е210, Е214, Е217, Е230, Е231, Е232, Е239, Е311–Е313, аспартам |
|
Небажано вживати астматикам |
Е102, Е107, Е122 —Е124, Е155, Е211–Е214, Е217, Е221–Е227 |
|
Небажано вживати людям, чутливим до аспірину |
Е107, Е110, Е122–Е124, Е155, Е214, Е217 |
|
Негативно впливають на печінку та нирки |
Е171–Е173, Е220, Е302, Е320–Е322, Е510, Е518 |
|
Порушують функції щитовидної залози |
Е127 |
|
Призводять до захворювань шкіри |
Е230–Е233 |
|
Подразнюють кишечник |
Е220–Е224 |
|
Спричинюють розлад травлення |
Е338–Е341, Е407, Е450, Е461, Е463, Е465, Е466 |
|
Заборонено вживати немовлятам та маленьким дітям |
Е249, Е262, Е310–Е312, Е320, Е514, Е623, Е626–Е635 |
|
Впливають на рівень холестерину в крові |
Е320 |
|
Руйнують вітаміни в організмі |
Е220 (В1), Е222–Е227 (В12), Е320 (D), Е925 (Е) |
Лабораторний дослід № 7
Тема. Ознайомлення зі змістом етикеток до харчових продуктів.
Мета: ознайомитися з інформацією, що міститься на етикетках до харчових продуктів.
Досліджувані об’єкти: етикетки до різноманітних харчових продуктів.
Хід роботи
1. Роздивіться надані етикетки до різних видів продуктів.
2. Визначте, що є спільного, а чим вони відрізняються.
3. Для однієї з етикеток зробіть докладне визначення її змісту. Випишіть з етикетки інформацію за розділами: назва продукту; виробник; вміст у продукті білків, жирів, вуглеводів, вітамінів; калорійність; харчові добавки; E — числа; строк придатності; спосіб зберігання.
4. Зробіть висновок, у якому зазначте, для чого необхідні етикетки на продуктах харчування.
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Домашня робота.
Дати правильну відповідь (по 1 б)
- Яку харчову добавку здавна використовують люди?
А) етилмальтол; Б) метилцелюлоза; В) аспартам; Г) шафран.
- Яка харчова добавка є консервантом?
А) хлорофіли; Б) каротини;
В) аскорбінова кислота; Г) молочна кислота.
- Яка харчова добавка є стабілізатором консистенції?
А) кальцій карбонат; Б) кармін; В) лимонна кислота; Г) агар.
- Яким кодом позначено барвник?
А) Е 100; Б) Е 200; В) Е 600; Г) Е 900.
- Встановіть відповідність між технологічними функціями харчових добавок і Е-числами.( 2 б)
- Антиоксидант А) Е 450
- Емульгатор Б) Е 500
- Стабілізатор консистенції В) Е 700 - Е 800
- Розпушувач Г) Е 300
Д) Е 400
- Дослідити етикетку кондитерського виробу. ( 2 б)
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
- Розробити спеціальну абетку здорового харчування. (4 б)
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
__________________
Поняття про синтетичні лікарські препарати (на прикладі аспірину)
Завдання «Закінчи речення» (по 1б)
- Консерванти — це речовини, які служать для ___________________
__________________________________________________________________
- Барвники — це речовини, які служать для ______________________
__________________________________________________________________
- Речовини, які підтримують потрібну консистенцію продукту; часто містяться у вареннях, джемах, згущеному молоці — це ___________
__________________________________________________________________
- Антиоксиданти — це речовини, які служать для _________________
___________________________________________________________________
- Речовини, які забезпечують однорідність продукту; можуть міститися в хлібі, вареннях, джемах, згущеному молоці — це ______
_________________________________________________________________
- Підсилювачі смаку — це речовини, які служать для ______________
__________________________________________________________________
- Речовини, що розпушують продукт, називаються ________________
__________________________________________________________________
- Речовини, які заміняють цукор на некалорійний, називаються _____
__________________________________________________________________
Сучасні синтетичні лікарські препарати:
а) анальгізуючі й жарознижуючі;
б) дезінфектори;
в) антибіотики й сульфаніламідні препарати;
г) заспокійливі й снодійні препарати.
Правила застосування лікарських препаратів.
Терміни придатності деяких найпоширеніших ліків
Аспірин — 4 роки;
Анальгін — 5 років;
Валідол — 2 роки;
Валокордин — 5 років;
Настоянка валеріани — 5 років;
Димедрол — 5 років;
Діазолін — 3,5 року;
Парацетамол — 2–3 роки;
Вугілля активоване — 2 роки;
Йод — 3 роки.
Якщо ви захворіли, не кидайтеся на пошуки найновіших і найпресіижніших ліків. Головне - не зашкодити своєму здоров'ю. Будьте уважні до самолікування, вивчайте інструкцію, стежте за реакцією організму на вживані ліки, не приймайте більше 3-х засобів одночасно.
Домашня робота
Питання 1-4 оцінюється по 1 балу, питання 5 та 6(на вибір),оцінюється 6 балів
- Яка рослина є природним джерелом саліцилової кислоти?
А) мальва; Б) пальма; В) верба; Г) орхідея.
- Як називають речовини, що виявляють антимікробну дію?
А) антисептик; Б) антиоксидант; В) анальгетики; Г) анаболіки.
- Яка кислота є діючою речовиною аспірину?
А) аскорбінова; Б) ацетилсаліцилова;
В) лимонна; Г) карболова.
- Укажіть сировину для промислового синтезу аспірину?
А) глюкоза; Б) етанол; В) етанова кислота; Г) фенол.
5. Скласти рекомендації для своїх однолітків щодо вибору харчових продуктів з оптимальним співвідношенням білків, жирів, вуглеводів і вітамінів.
6. Скласти рекомендації для своїх однолітків щодо застосування лікарських речовин.
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
__________________________________________________________________
__________________
Органічні сполуки в побуті. Поняття про побутові хімікати. Загальні правила поводження з побутовими хімікатами
План засвоєння нового матеріалу
1. Мийні засоби.
2. Косметичні засоби.
3. Дезодоранти й антиперспіранти.
Лабораторний дослід № 8
Тема. Ознайомлення зі змістом інструкцій до товарів побутової хімії.
Мета: дослідити зміст інструкції до товарів побутової хімії.
Досліджувані об’єкти: етикетки з інструкціями до товарів побутової хімії
Хід роботи
1. Ознайомтеся з однією з інструкцій до товарів побутової хімії, заповніть таблицю.
|
Розділ інструкції |
Короткий зміст розділу |
Рейтинг значущості для споживача |
Розділи інструкції, інформацією яких я користуюся |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2. Зробіть висновок, відповівши на запитання.
Для чого необхідні інструкції до товарів побутової хімії.
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
___________________________
Мило, його склад, мийна дія. Синтетичні мийні засоби
Найбільш важливими хімічними властивостями жирів, що мають промислове значення, є здатність піддаватися омиленню або гідролізу, гідрогенізації й окисненню.
Практичне значення мила зумовлене широкою сферою його застосування та важливим гігієнічним значенням.
Жирам як естерам властива зворотна реакція гідролізу, каталізатором якої є мінеральні кислоти.
За участю лугів відбувається незворотний гідроліз жирів.
Продуктами в цьому випадку є мила — солі вищих карбонових кислот і лужних металічних елементів.
Скласти опорну схему за темою «Мило, його склад, мийна дія».
Синтетичні мийні засоби (детергенти) (СМЗ) — це мультикомпонентні водні розчини, до складу яких, крім поверхнево-активних речовин (тобто безпосередньо миючих речовин), входять фосфати і карбонати. Ці солі неорганічних кислот мають цілу низку корисних властивостей, наприклад:
підсилення дії мийного засобу; дезінфекція; відбілювання, ароматизація; піноутворення (піногасіння); забарвлення.
Лабораторний дослід № 9
Тема. Порівняння властивостей мила і синтетичних мийних засобів.
Мета: порівняти мийні властивості мила та синтетичного прального порошку у твердій воді.
Обладнання: штатив із пробірками.
Досліджуваний об’єкт: господарче мило, пральний порошок.
Реактиви: фенолфталеїн, тверда вода.
Хід роботи
I. Виявлення середовища розчину мила і синтетичного мийного порошку.
1. Візьміть дві пробірки. У пробірку № 1 налийте розчин мила об’ємом 2 мл, у пробірку № 2 — розчин прального порошку об’ємом 2 мл.
2. Додайте в обидві пробірки по 2–3 краплі розчину фенолфталеїну. Запишіть спостереження. Зробіть висновки.
II. Порівняння мийних властивостей мила й синтетичних мийних засобів у твердій воді.
1. Візьміть дві пробірки. Налийте в кожну по 3–4 мл твердої води.
2. У пробірку № 1 додайте 5 крапель розчину мила, у пробірку № 2 — 5 крапель розчину прального порошку.
3. Вміст пробірок збовтайте. Зверніть увагу на появу піни. Запишіть спостереження. Зробіть висновки.
__________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Інші назви синтетичних мийних засобів (СМЗ) — детергенти.
Якісний мийний засіб завдає меншої шкоди вашій шкірі та довкіллю.
Вибираючи мийні засоби, слід пам’ятати:
• якість мийних засобів оцінюються за їх піноутворенням;
• необхідно, щоб рівень pH мийних засобів був у межах 5–10 одиниць;
• в’язкі мийні засоби легше дозувати. Це допоможе зекономити кошти;
• обов’язково стежите за терміном придатності засобу;
• не застосовуйте для ручного миття мийні засоби, що призначені для мийних машин.
«Закінчи речення»
— Сьогодні на уроці я дізнався………………………………………………...
— Сьогодні на уроці я зрозумів………………………………………………
— Сьогодні на уроці найцікавішим було…………………………………….
— У мене виникло запитання щодо…………………………………………..
Домашня робота
Підготувати відповіді на запитання:
- Назвіть основні компоненти СМЗ.
- Чим відрізняються властивості мила та СМЗ?
3. До яких наслідків для організму може призвести неправильне використання СМЗ?
4. Чому не можна використовувати для посудомийних машин засоби для ручного миття?
5. Чи можна при виборі мийного засобу орієнтуватися виключно на високу ціну як показник якості?
6. Назвіть відомих виробників СМЗ.
______________________________________________________________________________________________________________________________________________________________________________________________________
__________________________
Органічні розчинники, їх застосування
Розчинники — індивідуальні хімічні сполуки або суміші, здатні розчиняти різні речовини, тобто утворювати з ними однорідні системи змінного складу, що складаються з двох або більшого числа компонентів. Зазвичай розчинники застосовуються для розчинення твердих речовин.
Усі розчинники поділяють на неорганічні та органічні.
Класифікація розчинників
__________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Домашня робота
- Який розчинник є полярним?
А) етанол; Б) бензин-калоша; В) гас; Г) уайт-спірит.
- Який розчинник видобувають з рослинної сировини?
А) гас; Б) скипидар; В) сольвент; Г) перхлоретилен.
- Який розчинник використовують у медицині для виготовлення настоянок лікарських рослин?
А) етанол; Б) метанол; В) бензин; Г) бутилетаноат.
- Який розчинник добувають фракційною перегонкою нафти:
А) бензин; Б) денатурат; В) етанол.
5. Підготувати презентацію «Як моя родина безпечно використовує органічні розчинники» (7 б)
__________________________
Практична робота. Видалення забруднень із поверхні тканин
Тема. Видалення забруднень із поверхні тканини
Мета: навчитися видаляти з тканини забруднення (плями) різного походження.
Обладнання: пробірки з пробками, стаканчик, ніж, тигельні щипці або пінцет, піпетка, фільтрувальний папір, ватні тампони, або серветки, праска.
Досліджуваний об’єкт: клаптики тканини, забруднені рослинним або тваринним жиром, воском.
Реактиви: шматочки мила, мильна стружка, синтетичний мийний засіб (СМЗ), рідкий і порошкоподібний, розчинник, нашатирний спирт, гідроген пероксид, дрібний крейдяний порошок.
З правилами техніки безпеки ознайомлений(а), зобов'язуюсь виконувати
___________________________ (підпис)
Хід роботи
Дослід 1. Визначення складу СМЗ по етикетці
1. Візьміть етикетки від різних СМЗ.
2. Визначте, які добавки використовуються в кожному засобі.
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Дослід 2. Виведення жирових плям за допомогою екстракції
На тканину нанесіть невелику кількість рослинної олії. Під тканину підкладіть шар фільтрувального паперу. Ватним тампоном, змоченим теплим розчином суміші нашатирного спирту й будь-якого універсального мийного засобу (по 5 мл засобу і 5 мл нашатирного спирту розчиніть у 100 мл теплої води), протріть пляму, а потім пропрасуйте гарячою праскою через чисту білу бавовняну тканину.
Дотримуйтесь правил безпеки. Пляму обробляйте від країв до центру. Будьте уважні при роботі з нашатирним спиртом!
Запишіть спостереження.
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Дослід 3. Виведення жирових плям за допомогою адсорбції
Тепер спробуйте вивести пляму методом адсорбції. Для цього підготовлений зразок тканини (див. дослід 6) посипте подрібненим крейдяним порошком. Через деякий час очистіть тканину за допомогою щітки.
Запишіть спостереження.
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Дослід 4. Видалення жирової плями
Зразок тканини з жировою плямою дослідіть на стійкість фарбування. Для цього на невеликий фрагмент тканини нанесіть кілька крапель розчинника й почекайте 5 хвилин. Якщо змін не спостерігається, можна продовжити роботу. Під зразок підкладіть кілька шарів серветок або фільтрувального паперу. Обробіть пляму ватним тампоном, змоченим розчинником. Періодично міняйте серветки. Після повного видалення плями промокніть зразок тканини серветкою.
Запишіть спостереження.
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Дослід 5. Виведення плями від воску
Видаліть надлишок воску тупим краєм ножа. Дотримуйтесь правил безпеки! Після цього обробіть пляму, як описано у досліді 4.
Запишіть спостереження.
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Дослід 6. Видалення плям від соку
Нанесіть на пляму невелика кількість гідроген пероксиду, додавши до нього кілька крапель нашатирного спирту. Дотримуйтесь правил безпеки під час роботи: не вдихайте випари, оскільки нашатирний спирт (концентрований розчин амоніаку) може обпекти слизову оболонку носа. Протріть пляму ватним тампоном й промийте водою.
Запишіть спостереження.
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Зробіть висновки.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
__________________________
Попередження забруднення середовища при використанні органічних речовин у побуті. Захист навколишнього середовища від забруднення синтетичними мийними засобами
Органічні речовини, що забруднюють навколишнє середовище
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Забруднення навколишнього середовища СМЗ
_________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________Заходи, що убезпечують навколишнє середовище від шкідливого впливу на нього органічних речовин, що використовуються у побуті
Технічні заходи, використовувані задля унеможливлення небезпеки промислових відходів.
1. Проектування будь-якого виробництва таким чином, щоб викиди були явно мінімальними.
2. Суворе дотримання технологічних режимів виробництва.
3. Обов’язкова герметизація устаткування виробництва, у якому використовують і виробляють хімічні сполуки.
4. Впровадження безперервних технологічних процесів і безвідходних циклів виробництва, обігового водоспоживання.
5. Проведення заходів щодо запобігання аваріям (наприклад, планово-профілактичний ремонт устаткування).
6. Боротьба із втратами при транспортуванні (запобігання аварій газо- і нафтопроводів).
7. Боротьба з емісією (виділенням) промислових газів у атмосферу.
8. Застосування систем очищення стічних вод і води із забрудненнями.
9. Обов’язкова переробка та утилізація відходів, вторинне використання відходів.
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
__________________________
Завдання для підсумкового самоконтролю.
- Укажіть головну складову природного газу:
А) пропан; Б) бутан; В) метан; Г) октан.
- Укажіть процес, що не супроводжується зміною хімічного складу речовин:
А) крекінг нафти; Б) перегонка нафти;
В) коксування вугілля; Г) напівкоксування вугілля.
- Яка кількісна характеристика детонаційної стійкості бензину?
А) екомаркування; Б) метанове число;
В) Е-код; Г) октанове число.
- Які рівні структурної організації притаманні органічним речовинам?
А) атомний і молекулярний; Б) атомний і полімерний;
В) молекулярний і полімерний; Г) полімерний і клітинний.
- Розташуйте рівні структурної організації матерії за зростанням складності:
А) клітинний; Б) молекулярний; В) полімерний; Г) атомний
____________________________________________________________
- Укажіть відновлюваний природний ресурс:
А) нафта; Б) природний газ; В) рослинна біомаса; Г) вугілля.
- Укажіть властивість фенолу, що зумовлює застосування його водного розчину для дезінфікування:
А) летка речовина; Б) легко окислюється;
В) обмежено розчиняється у воді; Г) зумовлює денатурацію білка.
- Укажіть ознаку, що є перевагою СМЗ порівняно з милом:
А) здатність прати у твердій воді; Б) приємний запах;
В) приваблива упаковка; Г) здатність пінитися у гарячій воді.
- Укажіть волокно, стійке до стирання:
А) бавовна; Б) вовна; В) капрон; Г) віскоза.
- Укажіть сировину для промислового синтезу аспірину:
А) крохмаль; Б) метанол; В) фруктоза; Г) фенол.
- Яка пара наркотиків є легальною?
А) етанол і нікотин; Б) героїн і гашиш;
В) морфін і нікотин; Г) кодеїн і ЛСД.
- Які розчинники видобувають з рослинної сировини?
А) гас; Б) скипидар; В) сольвент; Г) бензен.
Зміст
- Теорія як вища форма наукових знань………………………...……..… 1
- Теорія хімічної будови органічних сполук О.М.Бутлерова …….……... 4
- Явище ізомерії. Структурна ізомерія……………………………………. 7
- Номенклатура насичених вуглеводнів…………………………….…….. 9
- Лабораторний дослід №1………………………………………………... 11
- Багатоманітність органічних сполук, їхня класифікація…………...…. 13
- Органічні речовини в живій природі. Рівні структурної
організації органічних речовин………………………………………..... 16
- Природні джерела органічних речовин. Природний і супутній
нафтові гази, їхній склад, використання………..……………………… 18
- Нафта. Склад, властивості нафти………………………………………. 21
- Продукти перегонки нафти, їх застосування. Детонаційна
стійкість бензину………………………………………………………… 24
- Лабораторний дослід №2………………………………………………... 25
- Кам’яне вугілля,продукти його переробки…………………………….. 27
- Лабораторний дослід №3……………………………………………….. 28
- Основні види палива і їхнє значення в енергетиці країни.
Охорона навколишнього середовища від забруднень при
переробці вуглеводневої сировини й використанні продуктів її переробки…………………………………………………………….….. 30
- Синтез органічних сполук різних класів на основі вуглеводневої сировини…………………………………………………………….…… 33
- Органічні речовини як основа сучасних матеріалів. Пластмаси…….. 36
- Лабораторний дослід №4……………………………………………….. 38
- Синтетичні каучуки, гума………………………………………………. 40
- Лабораторний дослід №5……………………………………………….. 41
- Штучні і синтетичні волокна…………………………………………… 43
- Лабораторний дослід №6……………………………………………...… 45
- Органічні сполуки і здоров’я людини…………………………..….…. 47
- Жири й вуглеводи як компоненти їжі,їхня роль в організмі….…….. 49
- Білки, вітаміни як компоненти їжі, їхня роль в організмі………....… 52
- Харчові добавки. Е-числа……………………………………………… 55
- Лабораторний дослід №7………………………………………………. 58
- Поняття про синтетичні лікарські препарати…………………………. 60
- Органічні сполуки в побуті. Поняття про побутові хімікати.
Загальні правила поводження з побутовими хімікатами………..…… 62
- Лабораторний дослід №8…………………………………………….… 62
- Мило, його склад, мийна дія. Синтетичні мийні засоби…………..…. 64
- Лабораторний дослід №9………………………………………….…… 65
- Органічні розчинники, їх застосування………………………….……. 67
- Практична робота. Видалення забруднень із поверхні тканин…….... 68
- Попередження забруднення при використанні органічних
речовин у побуті. Захист навколишнього середовища від
забруднення синтетичними мийними засобами………………………. 70
- Завдання для підсумкового самоконтролю……………………………..72
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
1


про публікацію авторської розробки
Додати розробку
