Електричний струм у рідинах та газах. Закон електролізу
Учитель: Бутрим Т. А.
Тема уроку. Закони електролізу. Розв’язування задач
Мета: роз’яснити учням фізичну природу електропровідності рідких провідників, навчити учнів застосовувати закони електролізу Фарадея під час розв’язання задач. Розвивати уміння застосовувати вивчений матеріал при розв’язанні задач та у повсякденному житті. Виховати старанність, самостійність та відповідальність при виконанні завдань, поставлених вчителем.
Тип уроку: виклад нового матеріалу
Демонстрації: явище електролізу.
Обладнання: склянка з водним розчином сульфату міді (CuSO4); мідні електроди; джерело постійного струму; ключ; з'єднувальні провідники; лампа.
Хід уроку
- Організаційний етап ( привітання, перевірка присутніх)
- Актуалізація опорних знань
Робота в парах
- Гра «Чи знаєш ти формули?» ( учні працюючи в парах встановлюють відповідність між математичним змістом та назвою, почергово підбігають до дошки, де знаходяться формули, та вказують правильну назву,переміщаючи їх. Дають пояснення про зміст і застосування формули)
![]()
![]()
![]()
![]()
![]()
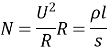
Напруга електричного поля
Робота струму
Сила струму
Закон Ома
Закон Джоуля-Ленца
Потужність струму
Електричний опір провідника
- Фронтальне опитування
- Що таке електричний струм? За яких умов він існує?
- Які частинки проводять струм у рідинах?
- Які речовини називають електролітами? Навести приклади.
- Що таке електролітична дисоціація?
- Мотивація навчальної діяльності
Діти, на вашу думку, де можна використати явище проходження електричного стуму у електролітах в побуті та техніці? (Міркування учнів)
Отже, сьогодні на уроці, ми повинні зрозуміти, де це ми можемо використати і дослідити закони проходження електричного струму в електролітах.
Розгортаємо наші робочі зошити та записуємо тему сьогоднішнього уроку “Електроліз. Закони електролізу. Розв’язування задач”
- Вивчення нового матеріалу
Для цього розглянемо дослід по проходженні електричного струму у розчині мідного купоросу . Для цього нам необхідно скласти електричне коло (складемо коло за схемою рис.1). ( Картки із схемою кола знаходяться на кожній парті, один учень демонстративно складає електричне коло під керівництвом вчителя, а інші перевіряють правильність складання)
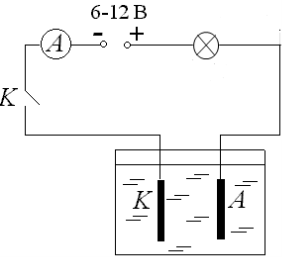
Рис.1.
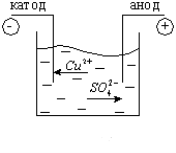
В результаті електролітичної дисоціації CuSO4 = Cu2+ + SO42-. Позитивно заряджені іони міді під дією електричного струму будуть переміщуватися до катода, де отримають електрони і виділяться на ньому у вигляді нейтральних атомів міді (рис. 2.). Негативно заряджені іони під дією електричного поля перемістяться до анода, де віддадуть вільні електрони і також виділяться на ньому.
Розімкнемо коло. Висушимо електроди і розглянемо їх. Що ми побачимо?
Катод укрився тонким шаром міді. Отже, йони при проходженні електричного струму переносять на собі не тільки заряд, а речовину яка виділяється на електродах. Явище виділення речовини на електродах під дією електричного струму називають – електролізом.
Можемо зробити висновки, що один із прикладів використання проходження електричного струму є електроліз, це нанесення тонкого шару речовини на предмети.
Діти, на вашу думку від чого залежить маса перенесеної речовини, яка виділяється на катоді? ( Міркування учнів)
Як визначити масу чистої міді, яка виділилася на катоді?
![]() (1)
(1)
- А ще як?
Масу одного іона Cu помножити на їхню кількість:
![]() (2)
(2)
А як знайти масу одного іона Cu ?
- Потрібно молярну масу Cu поділити на число Авогадро:
![]() (3)
(3)
і знайдений вираз підставити у формулу(2).
Як же знайти кількість іонів Cu в розчині під час проходження крізь нього електричного струму? Потрібно загальний заряд іонів поділити на заряд одного іона:
![]() (4)
(4)
![]() (5)
(5)
Знайдені вирази(3) і(5) підставимо у формулу(2).
- Ми отримали закон електролізу:
![]() , (6)
, (6)
де m0 - маса одного атома, μ - молярна маса речовини.
Для кожного хімічного елемента можна у виразі (6) виділити сталу величину k, яку називають електрохімічним еквівалентом речовини:
![]() , (7)
, (7)
У СІ електрохімічний еквівалент вимірюють у кілограмах на кулон: [k] = кг/Кл.
Виходячи з цього можна записати, що
![]() (8)
(8)
Маса речовини, яка виділяється на катоді за час t, пропорційна силі струму і часу. Це твердження, встановлене експериментально Фарадеєм (1831 р.), має назву першого закону Фарадея для електролізу.
Електрохімічний еквівалент речовини визначено для всіх хімічних елементів. Він є табличною величиною, але його не важко розрахувати:, де ![]() – хімічний еквівалент речовини. Добуток числа Авогадро на заряд електрона називають сталою Фарадея:
– хімічний еквівалент речовини. Добуток числа Авогадро на заряд електрона називають сталою Фарадея:
F = NAe = 6,02·1023 1/моль ×1,6·10-19 Кл = 96500 Кл/моль.
Стала Фарадея дорівнює заряду, під час перенесення якого одновалентними іонами через розчин або розплав електроліту виділяється 1 моль речовини.
З цих міркувань вираз (4) набуде вигляду: ![]() (9)
(9)
Формула (9) виражає другий закон Фарадея для електролізу: електрохімічні еквіваленти різних речовин прямо пропорційні їх хімічним еквівалентам. Якщо у вираз (4) підставити співвідношення (7), то отримаємо об'єднаний закон Фарадея для електролізу:
![]()
- Закріплення нових знань
Робота в групах ( Учні діляться на групи по4 учні, на партах знаходяться картки із якісною задачею, протягом 30 секунд діти обговорюють відповідь)
- Якісна задача
Електричний струм пропускають через розчин мідного купоросу. Чи зміниться маса міді, Яка виділиться на електроді якщо…
Група 1: Збільшити напругу
Група 2: Долити електроліту
Група 3: Зблизити електроди
Група 4: Зменшити занурену частину катода
Група 5: Підвищити температуру електроліту
Якщо зміниться, то як? Думку обґрунтувати.
- Обрахункові задачі
Група1: Під час проведення експерименту з визначення електрохімічного еквівалента міді протягом 18 хв пропускався електричний струм 10 А через розчин мідного купоросу. За час досліду маса катода збільшилася на 3, 2 г. Яке значення електрохімічного еквіваленту було отримано?
Група 2: Визначте масу міді, яка виділилася на катоді під час електролізу розчину мідного купоросу за 1 год, якщо до електроліту підведена напругу 36 В, а опір ванни 4,5 Ом. ( k=0,33*![]() кг\Кл)
кг\Кл)
Група 3: Під час електролізу виділилося 128 г міді. Визначте витрачену роботу, якщо напруга на електролітичній ванні становила 5 В. ( k=0,33*![]() кг\Кл)
кг\Кл)
Група 4:
Скільки часу потрібно для нікелювання металевого виробу площею поверхні 0,012 ![]() , якщо товщина покриття повинна бути 0,03 мм? Сила струму під час електролізу дорівнює 0,5 А. ( густина нікелю 8900
, якщо товщина покриття повинна бути 0,03 мм? Сила струму під час електролізу дорівнює 0,5 А. ( густина нікелю 8900 ![]()
- Самостійна робота
Варіант 2
- Електричний струм у рідинах проводять…
- Позитивні йони
- Позитивні та негативні йони
- Електрони
- Йони та електрони
- Електроліз – це …
- Розпад нейтральних атомів, молекул на йони
- Виділення речовини під час проходження електричного стуму на електродах
- Утворення нейтральних атомів з позитивно та негативно заряджених йонів
- Одиниця вимірювання електрохімічного еквіваленту в СІ…
- Електрохімічний еквівалент речовини можна визначити за формулою…
- Електрод, який підключений до позитивного полюса джерела струму називають…
- Анод
- Катод
- Аніон
- Катіон
- Негативний йон, який рухається в електролітичній ванні під дією електричного поля називають…
- Анод
Варіант 1
- Електричний струм у металах проводять…
- Позитивні йони
- Позитивні та негативні йони
- Електрони
- Йони та електрони
- Електролітична дисоціація – це …
- Розпад нейтральних атомів, молекул на йони
- Виділення речовини під час проходження електричного стуму на електродах
- Утворення нейтральних атомів з позитивно та негативно заряджених йонів
- Електрохімічний еквівалент позначають…
- Вкажіть математичний запис закону Фарадея
- Електрод, який підключений до негативного полюса джерела струму називають…
- Анод
- Катод
- Аніон
- Катіон
- Позитивний йон, які рухається в електролітичній ванні під дією електричного поля називають…
- Анод
- Катод
- Аніон
- Катіон
- Домашнє завдання
§37, конспект зошита, підготувати доповідь «Використання електролізу»
- Підсумки уроку


про публікацію авторської розробки
Додати розробку
