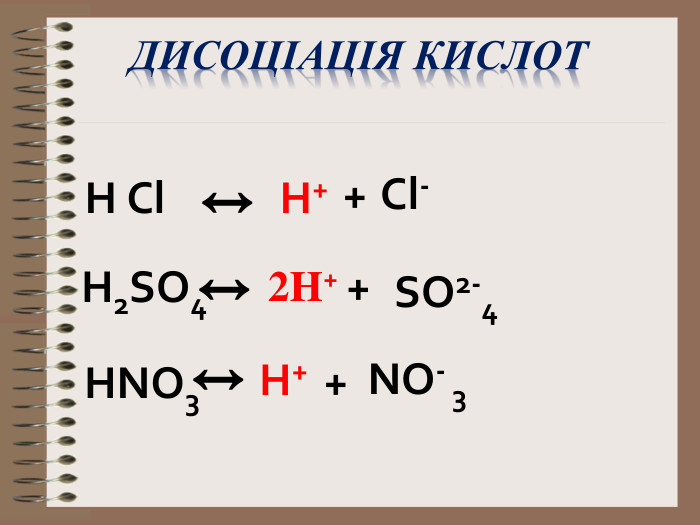
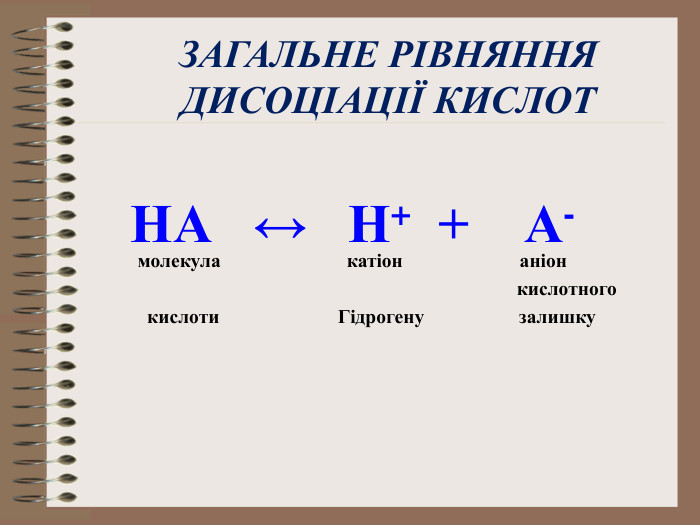
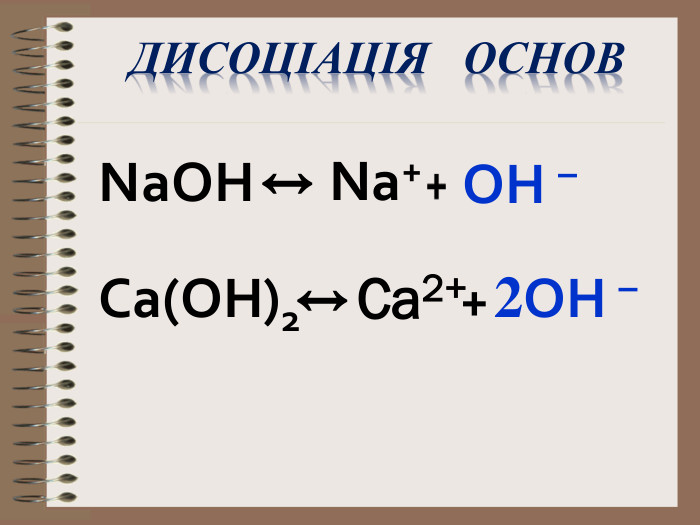
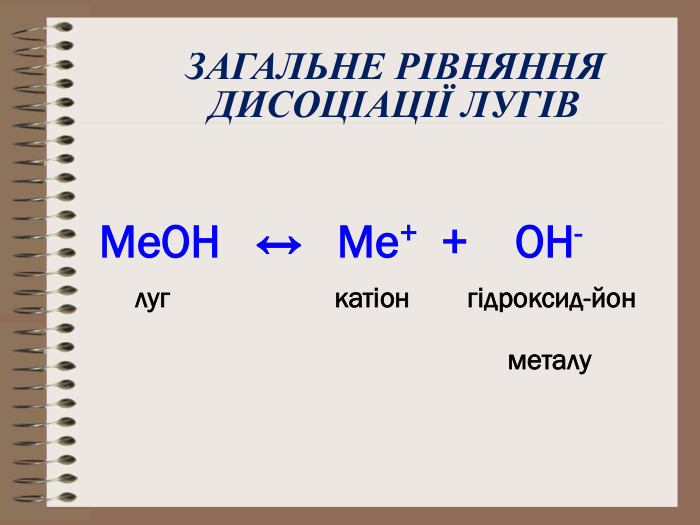
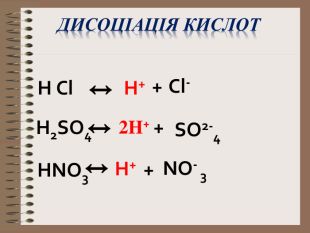
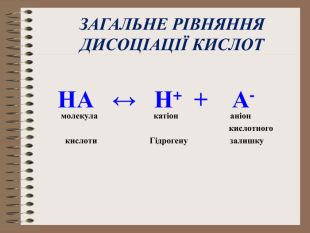
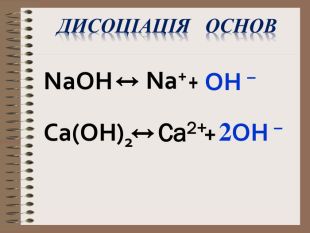
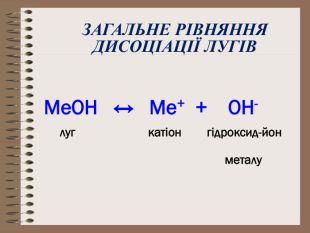
Електролітична дисоціація кислот, основ, солей у водних розчинах
Про матеріал
Презентація до уроку на тему «Електролітична дисоціація кислот, основ, солей у водних розчинах» (Хімія, 9 клас) Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку