Електронні і графічні електронні формули атомів s-, p-, d-елементів. Принцип «мінімальної енергії».
11 клас
Урок № 3
Тема: Електронні і графічні електронні формули атомів s-, p-, d-елементів. Принцип «мінімальної енергії».
Мета:
- освітня: узагальнити і поглибити знання зі складання електронних формул, схем розподілу електронів по квантових комірках для елементів I—III періодів; сформувати вміння учнів визначати електронну будову атома за його положенням у періодичній системі; формувати уявлення учнів про єдину природу матеріального світу;
- розвивальна: розвивати уважність, вміння учнів порівнювати, класифікувати, розв’язувати творчі завдання;
- виховна: виховувати повагу, умотивувати необхідність знань, зацікавленість дисципліною, прагнення отримати нові знання самостійно.
Матеріали та обладнання: Періодична система хімічних елементів Д.І. Менделєєва, робочі зошити, ручки, підручники, таблиці.
Очікувані результати: На кінець уроку учні:
- складають електронні й графічні електронні формули атомів s-, р-, d-елементів (Феруму) 1-4 періодів з урахуванням принципу «мінімальної енергії»;
- складаютьелектронні й графічні електронні формули атомів неметалічних елементів 2-го і 3-го періодів в основному й збудженому станах;
- аналізують відмінності електронних конфігурацій атомів s-, р-, d-елементів (Феруму) 1-4 періодів;
- порівнюють можливі ступені окиснення неметалічних елементів 2-го і 3-го періодів, що розміщені в одній групі, на основі електронної будови їхніх атомів.
Компетентності: спілкування державною мовою (використовувати в мовленні хімічні терміни, поняття, символи, сучасну українську наукову термінологію і номенклатуру; обговорювати результати дослідження і робити висновки), математична компетентність (будувати і тлумачити графіки), уміння вчитися впродовж життя (прагнути самовдосконалення; осмислювати результати самостійного вивчення хімії).
Наскрізні змістові лінії: громадянська відповідальність (усвідомлення учнями відповідальності за результати навчання; сумлінне виконання завдань).
Тип уроку: комбінований.
ХІД УРОКУ
Організаційний етап уроку
Вчитель вітається з учнями, записує відсутніх до журналу.
І. Перевірка д/з
Вчитель перевіряє виконані домашні завдання в учнів.
ІІ. Мотивація навчальної діяльності учнів
«Знайди помилку»
Вчитель на дошці записує текст, в якому учні повинні знайти помилки та вказати, які самі.
Електрони, протони і нейтрони є головними «будівельними складовими» атомів і називаються субатомними частинками. На даний час в ядрі атома відкрито багато елементарних частинок. Найважливішими з них є протони та електрони (нейтрони). знаючи масу атома та його заряд, можна розрахувати число нейтронів, які входять до складу атомного ядра: A = N + Z (N = А – Z). Заряд ядра атома чисельно дорівнює відносній атомній масі (порядковому номеру) елемента в періодичній системі.
ІІІ. Повідомлення теми, мети уроку
Вчитель записує тему на дошці, називає мету уроку разом з учнями.
ІV. Вивчення нового матеріалу
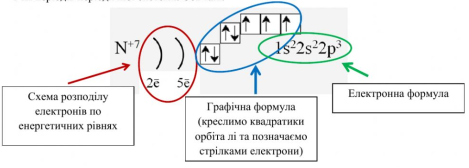
Електронна формула атома ‒ це запис розподілу електронів в електронній оболонці атома, де коефіцієнтами позначають енергетичні рівні (1, 2, ... 7), символами — підрівні (s, p, d, f), верхніми індексами ‒ кількість електронів на підрівнях. Наприклад, електронна формула атома Силіцію 14Si така: 1s22s22p63s23p2.
Графічна електронна формула атома — відображення розподілу електронів за енергетичними комірками. Графічні електронні формули доповнюють інформацію про будову електронної оболонки атома відомостями про кількість енергетичних комірок (кожну комірку позначають квадратиком) та заповнення їх електронами. Два спарені електрони однієї комірки позначають двома протилежно спрямованими стрілками ⇅, неспарений електрон — однією ↑. Протилежно спрямовані стрілочки вказують на те, що спарені електрони обертаються навколо своєї осі в протилежних напрямках.
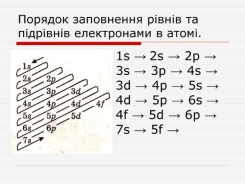
Заповнення електронами підрівнів залежить від їх енергії. Згідно з принципом мінімуму енергії найстійкішому стану ē в атомі відповідає мінімальна енергія, тобто електрон займає атомну орбіталь (АО) з найнижчою енергією (енергія залежить від значень двох квантових чисел n і l ). Послідовність заповнення підрівнів електронами визначається правилом Клечковського: енергетичні підрівні заповнюються за зростанням суми n+l; якщо для двох підрівнів ця сума є однаковою, то нижчу енергію має підрівень з меншим значенням n. В багатоелектронних атомах заповнення електронами всіх енергетичних рівнів і підрівнів залежно від їхньої енергії відбувається у такій послідовності:
V. Первинна перевірка та закріплення придбаних знань
Вчитель разом з учнями записують приклади графічних електронних формул атомів.
VI. Контроль і самоперевірка знань
Учні записують графічні електронні формули атомів 2-х хімічних елементів (на свій вибір).
VIII. Підсумки уроку
- Виставлення оцінок за урок.
IX. Повідомлення домашнього завдання
- балів §2. Ст. 9-15.
- балів Відповісти на питання параграфу (письмово).


про публікацію авторської розробки
Додати розробку
