Елементи І групи. Гідроген, лужні та благородні метали.
Власний переклад цікавого наукового збірника Л.Ф. Попової з хімії "От лития до цезия! Москва, Просвещение 1972 г. Перекладено, відредаговано та доповнено у відповідності з пізнішими науковими відкриттями. Цікава книга для читання!

Розділ І
Елементи І групи в природі.
Поширеність елементів в земній корі. Вчені давно займаються вивченням складу земної кори. Умовно було прийнято, що оболонка Землі (літосфера) простягається до глибини 16 км, а її маса дорівнює 2,2-2,5-1019т. Для визначення її складу застосовують звичайні аналітичні методи – аналізують гірські породи, глину, граніт, слюди і т.д. Потім визначають поширеність проаналізованих гірських порід і розраховують середній процентний вміст елементів в земній корі.
Перші таблиці складу земної кори опублікував в 1889 р американський геофізик Франк Кларк. Великий внесок у цю область внесли російські вчені- академіки В. І. Вернадський (1847-1931) і А. Е. Ферсман (1883-1945). На підставі численних аналізів різних гірських порід В. І. Вернадський склав таблицю поширеності елементів в земній корі по декадах, яка потім була доповнена А.Е.Ферсманом (табл. 1). Всього в таблиці тринадцять декад. У першій поміщені елементи, вміст яких за масою більше 10%, у другій знаходяться елементи, вміст солей яких дано в межах від 1 до 10% і т.д.
З елементів I групи найбільш поширені в природі лужні метали натрій і калій і водень. Літію і рубідію в земній корі приблизно в 100-1000 разів менше. Ще рідше зустрічається цезій. Всі ці елементи відносяться до рідкісних. Однак в природі вони так само широко поширені, як, наприклад, олово, свинець і багато інших метали. Рідкісними ці елементи називаються тому, що вони, за винятком літію, не утворюють самостійних родовищ і відносяться до розсіяних елементів. У гірських породах вони знаходяться в невеликих кількостях, тому, незважаючи на значну поширеність, солі рубідію і цезію коштують дорого.
Таблиця 1 Поширення хімічних елементів у земній корі по декадах
|
Декада |
% от маси |
Світові запаси, т |
Елементи |
|
1 |
<10 |
1018 |
О, Si |
|
2 |
1—10 |
1017—1013 |
Al, Fe, Са, Na, Mg, К, Н |
|
3 |
10-1—10 |
1016—1018 |
Ті, С, Cl, Р, S, Мn |
|
4 |
10-2—10-1 |
1015—1019 |
F, Ва, N, Sr, Сг, Zr, V, Ni, Zn, В, Cu |
|
5 |
10-3—10-2 |
1014—1016 |
Rb, Li, Y, Be, Ce, Co, Th, Nd, Pb, Ga, Mo, Br |
|
6 |
10-4—10-3 |
1013—1014 |
U, Yb, Dy, Gd, As, Pr, Hf, Ar, Sm, Er, La, Sn, Sc, W, Cs, Cd |
|
7 |
10-5—10-4 |
1012—1013 |
Lu, Hg, Tu, No, To, I, Ge, Se, Sb, Nb, Та, Eu, In, Bi, T1 |
|
8 |
10-6—10-5 |
1011—1012 |
Ag, Pd, Pt, Ru, Os, Po, Au, Rh, Ir, Те, Не |
|
9 |
10-7—10-6 |
1010—1011 |
Ne, Re |
|
10 |
10-8—10-7 |
109—1010 |
Kr |
|
11 |
10-9—10-8 |
108—109 |
Xe |
|
12 |
10-10—10-9 |
107—108 |
Ra |
|
13 |
10-11—10-10 |
106—107 |
Pa |
З елементів побічної підгрупи найбільш поширена мідь. Золото і срібло – рідкісні метали, але вони утворюють в природі скупчення, і тому їх легко виявити за блиском. У таблиці 2 наведені середні кількості елементів, що містяться в 1 м3 гірських порід і води.
Таблиця 2 Середня кількість елементів першої групи в 1 м3 земної кори
|
Элементи |
Кількість, кг |
Элементи |
Кількість, кг |
|
Гідроген |
27 |
Купрум |
0,0081 |
|
Літій |
0,176 |
Аргентум |
5,9-10—5 |
|
Натрій |
71,3 |
Аурум |
1,4-10-е |
|
Калій |
63,5 |
|
|
|
Рубідій |
0,71 |
|
|
|
Цезій |
0,019 |
|
|

В. І. Вернадський. О. Є. Ферсман.
Ці цифри наочно показують, яка кількість елементів знаходиться в природних сполуках.
Розподілені елементи на Землі нерівномірно. Наприклад, літій входить головним чином до складу гірських порід, водень – до складу води. Всього води на земній кулі 1,5-1018т. Великі кількості лужних металів знаходяться в вигляді солей у воді морів і океанів, і їх зміст в процентах одно (за А. П. Виноградовим): Na – 1,06; К – 0,038; Rb – 0,00002; Cs – 0,000005. Якщо врахувати, що обсяг води в Світовому океані дорівнює 1070 млн. км3, то загальний вміст в ньому навіть рідкісних елементів - рубідію та стронцію відповідно дорівнює 214 млрд.т і 1070 млн. т. Всього в Світовому океані розчинено 50 000 000 000 000 000 т різних солей, в тому числі 38 000 000 000 т кухонної солі. Якщо розчинені солі рівномірно розподілити по поверхні земної кулі, вони покрили б її шаром товщиною в 4,5 м.
Найбільше в природі легких елементів, на що свого часу звернув увагу Д.І.Менделєєв. Пояснюється це більшою міцністю атомних ядер легких елементів. У міру зростання атомних мас в ядрах елементів збільшується відносна кількість нейтронів, що знижує стійкість ядер. Найважчі елементи, як правило, спонтанно розпадаються, тобто є радіоактивними.
Природні сполуки елементів I групи та їх утворення. Земля утворилася близько 6-7 млрд. Років тому. З того часу її склад суттєво змінився. Багато радіоактивних елементів за такий термін розпалися, наприклад технецій, і з них виникли нові. Кількість інших радіоактивних елементів, наприклад радію, урану, значно зменшилася. Початкові речовини, які були стійкі при високих температурах, також зазнали великих змін.
Материкові, або первинні, сполуки лужних металів кілька мільярдів років тому входили в основному до складу складно побудованих силікатів і алюмосилікатів, тобто солей кремнієвої кислоти, що включають також і оксид алюмінію. Під впливом двоокису вуглецю і води алюмосилікати поступово розпадалися і давали солі вугільної, сірчаної та соляної кислот. Розчинні сполуки цих кислот накопичувалися в морях і океанах і при випаровуванні води утворювали поклади, наприклад хлориду натрію в районі Солікамська.
Склад силікатів і алюмослікатов зазвичай висловлюють у вигляді оксидів, наприклад силікат кальцію СаSіО3 (сіль кремнієвої кислоти Н2SiО3 і кальцію) – СаО SiО3. Звичайно, такий запис не відображає реальної будови подібних сполук, але вона зручна в тих випадках, коли сіль має складний склад і її будову недостатньо відомо. До того ж при такому написанні формул видно основні і кислотні оксиди. Найбільш поширені в природі первинні алюмосилікати:
шпати
![]() Na2О А12О
3 6SiО2
— альбіт
Na2О А12О
3 6SiО2
— альбіт
К2О А12О3 6SiО 2 — ортоклаз пшпатиольов і
CaО Al2О3 2SiО2 —анортит
BaО Al2О3 2SiО2 — барієвий польовий шпат
К2О А12О3 4SiО2 — лейцит
Li2О А12О3 4SiО2 — сподумен
Li2О А12О3 8SiО2 — петаліт
К2О 3А12О3 6SiО2 2Н2О — калієва слюда
Вторинні сполуки лужних і лужноземельних металів, наприклад сульфати, карбонати, хлориди, утворюються з цих первинних материкових сполук. Польові шпати, наприклад альбіт, ортоклаз, під впливом води і двоокису вуглецю дають карбонати, кварц і каолін:
Na2О А12О3 6SiО2 + CО2 + 2H2О = Na2CО3 + А12О3 2SiО2 2H2О+4SiО2
Надалі карбонати поступово переходять в сульфати, хлориди, фториди і нітрати. У сульфати вони перетворюються під впливом сірчаної кислоти, що утворюэться внаслыдок окислення різних сульфідів і в першу чергу піриту FeS2:
4FeS2+2H2О+15О2 = 2Fe2 (SО4)3 + 2H2SО4
Слабкий розчин сірчаної кислоти виходить при протіканні підземних вод, що містять кисень, через поклади піриту. Надалі кислота вступає в реакцію з карбонатами, наприклад:
Na2CО3+H2SО4=Na2SО4+H2О+CО2↑
К2СО3+Н2SО4 = K2SО4 + Н2О+СО2↑
Нітрати утворюються під впливом азотної кислоти, яка виникає при грозових розрядах: азот сполучається з киснем, даючи окис азоту NО, а останній при окисленні киснем повітря переходить в двоокис азоту NO2. При «розчиненні» двоокису азоту в дощовій воді утворюється нітратна кислота:
4NО + 3О2 + 2Н2О – 4HNО3, яка потім вступає в реакцію з карбонатами:
Na2CО3+2HNО3 = 2NaNО3+H2О+CО2 ↑
Якщо врахувати, що щорічно зі зливами потрапляють на Землю тисяч тонн сполученого азоту, то можна уявити, скільки солей азотної кислоти утворюється. Однак ці солі в грунті не накопичуються, тому що вони вимиваються водою, споживаються рослинами і т. д.
Такому ж перетворенню піддаються і солі рубідію і цезію, які завжди містяться в невеликих кількостях в мінералах, що включають натрій і калій.
Кілька відрізняються за складом мінерали літію. Йон літію має порівняно невеликий розмір, дає з кислотними оксидами більш стійкі сполуки в порівнянні з іншими лужними металами, тому його силікати і алюмосилікати міцніші. Найбільш поширеним мінералом є сподумен LіАl[SiO3], або Li2О Аl2О3 4SiO2. Оскільки літій дає нерозчинні фосфати і фториди, він входить до складу мінералів, що включають фосфати і фториди. Всі ці мінерали мають складний склад. Наприклад, лепідолітом надається формула {KLi2Al [Si4O10]F2(OH)2}. У цих сполуках літій може частково заміщуватися магнієм, залізом, алюмінієм, так як розміри іонів Mg2+, Fe3+ і А13+ мало відрізняються від розмірів іона Li+. «Вивітрювання» мінералів літію, тобто їх розклад під дією води, двоокису вуглецю і т. д., дає добре розчинні солі літію, головним чином хлориди.
Метали підгрупи міді мають невелику хімічну активність, тому вони знаходяться частково у вигляді хімічних сполук, а частково в вільному вигляді, особливо золото.
Мідь у далекі геологічні епохи, очевидно, перебувала лише у вигляді сірчистих сполук – халькопириту CuFeS2 (або CuS FeS) і халькозіну Cu2S. Пояснюється це тим, що мідь має досить велику хімічну спорідненість до сірки, в даний час сульфіди – найпоширеніші мінерали міді. При високих температурах, наприклад в районах вулканічної діяльності, під дією надлишку кисню відбувалося перетворення сульфідів міді в окисли, наприклад:
2Cu2S+3O2 = 2Cu2O + 2SО2
При температурі нижче 1000°С відбувалося утворення окису міді, яка в невеликих кількостях зустрічається в природі:
2Cu2О + О2 = 4CuO
Самородна (металева) мідь, очевидно, виникла в природі при сильному нагріванні частково окислених сірчистих руд. Можна собі уявити, що після землетрусів, грандіозних вивержень окислені мінерали міді були поховані під товстим шаром гірських порід і нагрівалися за рахунок земного тепла. При цьому відбувалося взаємодія оксидів з сульфідами (мал. 1).
Подібні процеси протікають при виплавці міді на металургійних заводах. Такі природні «металургійні заводи» виплавляли величезні кількості міді: найбільший із знайдених самородків міді важив 420 т. Мабуть, в менших масштабах взаємодія оксидів деяких металів з сульфідами йде і в наш час, наприклад в районі деяких Курильських островів.

Деякі інші мінерали міді вийшли з окисних руд. Наприклад, під дією вологи і двоокису вуглецю відбувалася гідратація оксиду міді і утворення основних карбонатів:
2CuO + СО2 + Н2О = CuCO3 Сu (ОН)2
У лабораторії ми ці процеси не спостерігаємо, так як вони йдуть повільно. У «лабораторії» природи терміни в кілька тисяч років цілком незначні. Надалі під впливом тиску верхніх гірських порід і деякого нагрівання відбувалося ущільнення основного карбонату міді, і він перетворився в дивовижний за красою мінерал – малахіт. Особливо гарний полірований малахіт. Він буває забарвлений від світлозеленого до темно-зеленого кольору. Переходи відтінків вигадливі та створюють фантастичний малюнок на поверхні каменю.
Перехід нерозчинних сульфідних сполук міді в розчин міг здійснюватися за рахунок впливу розчинів сульфату заліза
(III): Cu2S + 2Fe2(SO4)3 = 4FeSO4 + 2CuSO4 + S
Розчини сульфату заліза, як зазначено вище, виходять в природі при дії води, насиченою киснем, на пірит. Ці процеси повільно йдуть в природі і в даний час.
Срібло в самородному стані, як і мідь, зустрічається досить рідко. Найбільший самородок срібла важив 13,5 т. У вигляді самостійних мінералів срібло також зустрічається рідко. До них відносять аргентит Ag2S, тобто сульфід срібла. Велика частина срібла домішана у вигляді сульфіду до сірчистим руд свинцю, міді, цинку.
Золото, зважаючи на незначну хімічної активності, зустрічається в основному у вигляді вільного металу. У корінних родовищах золото зустрічається як вкраплення в силікати, найчастіше в кварцити. Це так зване жильне золото. При руйнуванні золотоносних кварцитів утворюється розсипне золото. Дуже рідко в природі зустрічається золото у вигляді сполук, головним чином з телуром. Це явище вразило учених, так як золото вважали інертним металом. Сполуку золота з телуром, відкрите в кінці XVIII століття, назвали «парадоксальним золотом».
У природі іноді спостерігається рідкісне явище – відновлення солей золота до металу. Наприклад, іноді знаходять кварцовий пісок, вкритий тонким шаром золота. Відкладання металевого золота могло відбуватися за рахунок відновлення слідів його солей іонами двовалентного заліза, яке утворюється при окисленні сульфідних руд заліза в присутності води:
AuCl3 + 3FeSО4 = Fe2(SО4)3 + FeCl3 + Au
Велика кількість золота у вигляді солей і в колоїдному стані знаходиться у воді океанів. В 1 т води міститься від 0,0001 до 0,08 мг золота, або в в 1 км3 від 7 до 80 кг. Всього в Світовому океані міститься близько 8 млн. т золота, тобто, на кожного мешканця Землі припадає близько 35 кг золота.
 Мал.
2. Руйнування гірських порід в природі
Мал.
2. Руйнування гірських порід в природі
В утворенні і формуванні природних сполук, елементів виняткову роль відіграє вода сполука водню, першого елемента в I групі. Вода є універсальним розчинником і одним з універсальних каталізаторів багатьох хімічних процесів. Вона бере участь в механічному руйнуванні гірських порід. Відомо, що при переході в лід вода розширюється. Якщо вона замерзає в глибоких тріщинах, то тиск, що розвивається льодом, так само 2400 атм. Такий тиск здатний розірвати найміцніші гірські породи (мал. 2).
У деяких районах якутської тундри спостерігається цікаве явище – грунт розколота на глибину в кілька метрів на квадрати, один квадрат відділений від іншого льодом, який заповнює тріщини. Як виникло таке руйнування грунту? Коли відтавала грунт, вода затікала в невеликі тріщини. Взимку вона замерзала, збільшувалася в обсязі, і тріщина кілька розширювалася і видовжувалася. Процес, що йшов протягом декількох десятків тисяч років, привів до руйнації грунту на великі нерівні квадрати.

Мал. 3. Розтріскування грунту в якутскій тундрі.
У районах «вічної» мерзлоти в окремих місцях грунт промерз на глибину до 700 м. «Вічна» мерзлота займає більше половини території Росії, а загальний обсяг льоду в грунті доходить до 60-80%. Вічна мерзлота була описана вже в XVII ст. Якутські воєводи в ті часи писали в Москву: «А в Якутську, государю, за розповідями торгових і промислових служивих людей, хлібної ріллі не варто сподіватися; земля, государю, і серед літа вся не розтає». Багато європейських вчених в це явище тривалий час не вірили.
Великі запаси води у вигляді льоду знаходяться в Арктиці і особливо Антарктиді. Площа льодового покриву в Арктиці становить 12 млн. км2, а товщина його місцями доходить до 4330 м. Якщо весь лід розтопити, то рівень Світового океану підніметься на 50-60 м. Незважаючи на виключно величезні запаси води на Землі, в окремих районах її не вистачає не тільки для промислових, а й для побутових потреб і її доводиться здалеку транспортувати або будувати опріснювальні установки для отримання чистої води з морської. У деяких районах земної кулі природні води настільки забруднені, що їх небезпечно застосовувати через отруйності.
Як ми бачимо, форма знаходження елементів в природі цілком визначається їх хімічними властивостями. Водень у вільному стані в природі майже не зустрічається зважаючи на свою високу хімічну активність. В атмосфері його 0,00005%. Дещо більше його в самих верхніх шарах атмосфери. Лужні метали найбільш часто зустрічаються у вигляді хлоридів – міцних і добре розчинних у воді солоні, у вільному стані в природі лужні метали не зустрічаються. Елементи підгрупи міді внаслідок невеликої хімічної активності, особливо золото, можуть зустрічатися як вільні метали.
Родовища сполук елементів I групи. Найголовніше, найцінніше сполука водню, без якого неможливе життя, - це вода. У сучасну епоху вода - одне з найнеобхідніших з'єднань, і відкриття її «родовищ» дає життя пустелях.

Мал. 4. Кристали кухонної солі.
Сучасні поклади кухонної солі і хлориду калію утворилися за рахунок випаровування стародавнього моря, який покривав значну частину нинішньої території Туркменістану, Казахстану та Росії. По складу води воно відрізнялося від води Світового океану. Вивчення останків морських тварин, характер залягання солей дозволяють відновити умови висихання стародавнього моря. Первинне випадання солей відбувалося при 15-35°С в сухому кліматі. Спочатку випадав карбонат кальцію за рахунок розкладання кислої солі. Потім відбувалося випадання гіпсу CaSО4 2H2О. У міру збільшення концентрації хлориду натрію в воді створювалися умови для випадання ангідриту (безводного гіпсу) спільно з кохонною сіллю. Поступово море внаслідок зміни ландшафту і випаровування води розпалося на озера. У цей період і відбулося відкладення основної частини кухонної солі, що кристалізується у вигляді кубиків (мал. 4). Потім випадали хлориди калію і магнію, які більш розчинні в порівнянні з кухонною сіллю. Ці відкладення покривалися пісками і поверхневе гірськими породами. У мезозойської період значна частина сольових відкладень опустилася вниз внаслідок геологічних процесів і утворила глибинні поклади. Солі, що відклалися піддавалися впливу підвищеної температури і тиску. Це призвело до зміни їх хімічного складу, зокрема до зневоднення, утворення ангідриту і сильвініту. В окремих місцях відкладення солі плавилися, а потім перекрісталлізовивают з розплаву. У третинному періоді в окремих місцях настав підняття сольових відкладень внаслідок появи складок в земній корі. Утворилися так звані соляні куполи. Вони складаються з потужних пластів солі і в вигляді пагорбів підносяться над поверхнею Землі. Зверху вони зазвичай покриті грунтом. У деяких місцях земної кулі кам'яна сіль покриває поверхню Землі товстим шаром і утворює цілі гори. На острові кислих в Перській затоці така гора має довжину 6 км і висоту 150 м.
Великі поклади солі зустрічаються в степових і пустельних областях під піском. Відомо, що дюни під впливом вітру поступово пересуваються і можуть «пройти» великі відстані. Коли вони підходять до соляного озера, то засипають його. Багато таких озер в гирлі Волги засипані шаром піску.
Один з дослідників пустелі так описує район соленосних відкладень в гирлі Волги: «Оточене високими жовтими піщаними дюнами, лежить гладке і біле, як тільки що занесене снігом, солоне озеро у Моллахкара. З нього щорічно видобуваються тисячі центнерів солі і перевозяться довгими караванами верблюдів на Закаспийскую залізницю, але запаси солі постійно поновлюються, так як до басейну без стоку завжди течуть солоні притоки. Вінок зелених кущів оточує його берега і дає різкий колірний контраст з блакитною водою, покритим сіллю берегом і світло-жовтими дюнами. Схожі на дрік кущі ефедри, зарості ситника і колючої акації утворюють товсту огорожу. Між ними піднімаються світло-жовті тамариски. Їх красиво звисаючи гілки несуть червоні як кров кисті квітів. Сухі гілки, листя і квіти падають в насичену сіллю воду і завдяки повільному гниття дають сильно пахне сірководнем чорний мул, який можна було б розглядати як бітумінозну солону глину.
На всіх коренях та звисають гілках утворюються кристали кухонної солі, а на протилежному березі сіль утворює досить твердий шар в дюйм товщиною, схожий на крижаний покрив. У воді ми помічаємо хмари Artemia salina - маленьких ніжних черепашок, червонуваті шкаралупи яких іноді потрапляють в сіль в такій кількості, що вона набуває червонуватого відтінку. У соленосних глину можуть легко потрапляти порівняно великі ссавці, а також і комахи і там чудово зберігатися. Коли навесні буває пташиний переліт, тоді берега солоного озера кишать хмарами всіляких птахів. Сліди змій, ящірок і жуків вкарбовуються на сусідніх піщаних дюнах, а іноді випадково і самі тварини можуть перетворюватися в скам'янілості в утворюються тут шарах солі ».
Найбагатші запаси сульфату натрію (мірабіліту) є в затоці Каспійського моря - Кара-Богаз-Гол. 12 млрд. м3 води щорічно надходять з моря в затоку. Вода перетинає кам'яну гряду і з шумом падає вниз. Тут єдиний в своєму роді морський водоспад, або бар, як називають його місцеві жителі. При цьому утворюється піна, яка вітром розноситься по затоці, покриває берега. За порогом - Кара-Богаз-Гол, що в перекладі з туркменського означає «чорна паща». Ця назва виникла тому, що кочівники, які бачили цю затоку, вважали, що вода через отвір на дні перетікає в Індійський океан. Насправді вся надходить вода випаровується під палючими променями сонця, а солі залишаються в затоці. У цій природній «фабриці» накопичилися десятки мільярдів тонн солей, які є цінною сировиною для хімічної промисловості. У зимові місяці при охолодженні тут випадають величезні кількості мірабіліту (мал. 5):
MgSО4 + 2NaCl + 10Н2О D Na2SО4 10H2О + MgCl2
Вода цього затоки містить також і інші солі, які є сировиною для хімічної промисловості, зокрема солі літію, брому та ін.

Мал. 5. Випадання мірабіліту по берегах затоки Кара-Богаз-Гол.
Багато озер Західного Сибіру і Забайкалля містять розчинені солі лужних металів.
З водних розчинів кухонна сіль разом з іншими солями кристалізується не тільки у вигляді щільних відкладень, але іноді і у вигляді сталактитів – довгих стовпів, що спускаються зі стелі печер. Така печера з соляними сталактитами відома в Таджикистані. Її створила вода в соляному масиві Ходжа-Мумин. Водний розчин, насичений солями, просочується зі стелі печери. За рахунок деякого випаровування води солі кристалізуються, і утворюється зростаюча «бурулька». Печера називається Тигровою, вона має дивовижну властивість. Справа не тільки в дивовижну красу блискучих сталактитів, але і в тому, що печера звучить! Повітря, що проходить через печеру, коливає сталактити, і вони видають мелодійні звуки, тому Барсову печеру ще називають Лунаючою.
З'єднання елементів підгрупи міді розподілені в земній корі нерівномірно, що пояснюється відмінністю У геологічних умовах, що склалися в різних місцях земної кулі. Найбагатші родовища міді є в Конго (Катангский пояс), золота – в ПівденноАфриканській Республіці і т. д. Матеріали, зібрані археологами про стародавні родовища міді, срібла і золота, датуються тисячоліттями до нової ери. Стародавні вироблення золота і міді на території нашої країни знайдені в Закавказзі, на узбережжі Балхаша, в численних пунктах Сибіру. У Північно-Східному Казахстані знайдена порожня порода після промивання золота, що займає десятки квадратних кілометрів. Там же знайдено величезні кам'яні ступи і песто для подрібнення породи. На песто були залишки бронзових ланцюгів для приковування рабів. Хто проводив ці грандіозні роботи – невідомо.
На початку минулого століття найголовнішими родовищами, які розроблялися, були: в районі Північного Уралу – Богословський завод, в районі Нижнього Тагілу – Вийський завод, а на Кавказі – Калакентський і Кедабекський заводи.
В наш час відомі родовища міді в центральній і східній частині Казахстану, на східному схилі Уралу, в країнах Середньої Азії, Південного Кавказу і т. д.

Мал. 6. Конкреції на дні океану.
Велике кількості міді та інших копалин знаходиться на дні океанів, яке покрите так званими конкреціями – скупченнями у вигляді каменів округлої неправильної форми (мал. 6).
Вони містять в середньому 20% марганцю, 15% заліза і по 0,5% міді, нікелю, кобальту. За підрахунками вчених запаси цієї цінної і своєрідної руди становлять 5 млрд. т. Якщо врахувати, що в даний час щорічно отримують близько десятки млн. т міді, то запаси міді та інших металів на дні океанів є величезними. Походження цих конкрецій поки є науковою загадкою. Найімовірніше вони утворилися в результаті діяльності бактерій.
Потрібно сказати, що між життєдіяльністю багатьох живих організмів і родовищами елементів є певний зв'язок. Наприклад, деякі рослини «люблять» певні елементи. Так, окремі родовища міді були знайдені за допомогою рослин. В районі Алтаю часто можна зустріти рослина з сімейства гвоздикових, яке називають гіпсолюбка. Особливо добре вона росте там, де є сполуки міді. У цьому випадку цілі поля гіпсолюбки покривають великі площі.
У тому місці, де родовища міді закінчуються, починають проростати інші рослини.
Іноді надлишок того чи іншого елемента пригнічує життєдіяльність рослин. У цьому випадку на грунті з'являється «лисина» – місце, вільне від рослинності. За цією ознакою в США, в штаті Теннесі відкрили цинкову жилу. Серед густого лісу було виявлено своєрідна просіка – лісу заважали зростати сполуки цинку, що були в грунті.
Відкриттю корисних копалин за характером рослинності в Росії надавали великого значення. Так, в XVII ст. в грамоті царя Олексія Михайловича, даної дяка Желябужского, надісланому послом в Англію, давався наказ: «Щоб йому промишляти в Англії трави, як на золотих і срібних рудах ростуть»
Достовірні відомості про родовища золота в Росії починають надходити з 1723, причому майже всі вони були приурочені до родовищ міді. У 1745 р розкольник Єрофій Марков виявив «на верху світлі камінчики, подібних кришталю ... і тут же між камінчиками таких же особливо схожих на золото крупинки три або чотири». Так було відкрито найбільше родовище золота на Уралі – Березівське родовище.
Розділ II
Історія відкриття елементів I групи
 Перше знайомство людини з
металами відбулося кілька десятків тисяч років тому. Шматки самородних металів
– золота і срібла, метеоритного заліза, ко-торие він знаходив в розмитих
берегах або при падінь метеоритів, залучали його увагу. Однак на зорі свого розвитку
людина не вмів користуватися металами. Метеорити часто ставали предметом
обожнювання. Приклад – відомий метеорит, що впав приблизно 5-6 тис. Років тому
в Америці, на місці штату Арізона. Цей гігантський шматок, що складається зі
сплаву заліза з нікелем, залишив в земній корі воронку діаметром 1200 м і
глибиною 180 м. Індіанці прозвали це місце Яром диявола і вважали, що тут
колись на Землю зійшов якийсь небесний дух. Згодом вони стали користуватися
шматками метеоритного заліза, розкиданими навколо воронки, для виготовлення
ножів, наконечників списів, і т. д.
Перше знайомство людини з
металами відбулося кілька десятків тисяч років тому. Шматки самородних металів
– золота і срібла, метеоритного заліза, ко-торие він знаходив в розмитих
берегах або при падінь метеоритів, залучали його увагу. Однак на зорі свого розвитку
людина не вмів користуватися металами. Метеорити часто ставали предметом
обожнювання. Приклад – відомий метеорит, що впав приблизно 5-6 тис. Років тому
в Америці, на місці штату Арізона. Цей гігантський шматок, що складається зі
сплаву заліза з нікелем, залишив в земній корі воронку діаметром 1200 м і
глибиною 180 м. Індіанці прозвали це місце Яром диявола і вважали, що тут
колись на Землю зійшов якийсь небесний дух. Згодом вони стали користуватися
шматками метеоритного заліза, розкиданими навколо воронки, для виготовлення
ножів, наконечників списів, і т. д.
В середні віки люди познайомилися з миш'яком, сурмою, цинком, вісмутом, фосфором, платиною. Багато елементів були відкриті в XVIII в. і особливо в XIX ст. До цього часу (кінець XIX ст.) Було відомо вже 82 елемента.
Виняткову роль в прогнозі нових елементів зіграло відкриття Дмитром Івановичем Менделєєвим періодичного закону. Вчені могли передбачити властивості ще невідомих елементів. Можна було також припустити, в яких гірських породах знаходяться ще не відкриті елементи.
У відкритті водню і встановленні його хімічної природи брало участь багато вчених. Вперше точний опис отримання водню дією сірчаної кислоти на залізну тирсу було дано алхіміком Парацельс (1493-1541). Однак ні Парацельс, ні його учень Я. Б. Ван-Гельмонт не ізольовали водень; вони вважали, що гази не можна зберігати в судинах. Пізніше англійський учений Роберт Бойль (1627-1691) не тільки отримав водень, але зібрав його і спостерігав горіння.
Природу «пального повітря» встановив Генрі Кавендіш. Це був дуже багатий і скромна людина, яка зробила багато великих відкриттів. Один вчений про нього сказав, що він найбагатший з учених і самий вчений з багатіїв. У роботі, опублікованій в 1766 р, Г. Кавендіш дає багато способів отримання водню (дію сірчаної та соляної кислот на різні метали), встановлює, що водень не підтримує дихання, горіння і вибухає тільки в тому випадку, коли він змішаний з повітрям.
Отримання синтетичної води при спалюванні водню здійснили у Франції Маке і Антуан Лавуазьє, а в Англії – Г. Кавендіш, який провів кількісні досліди по з'єднанню водню з киснем. Згодом, в 1783 р А. Лавуазьє отримав водень із води, пропускаючи її пари через розпечені залізні ошурки.
З'єднання лужних металів відомі були людям в далекій давнині. Наприклад, поташ (карбонат калію) давно застосовували для прання білизни. У великих кількостях поташ вивозили в Європу з Росії, за часів Петра I він становив важливу статтю державного доходу. З незапам'ятних часів відома людству кухонна сіль.
Відкриття і виділення лужних металів могло бути здійснено тільки на певному
рівні розвитку науки. Пояснюється це тим, що лужні метали дуже активні і в чистому вигляді не зустрічаються; з іншими елементами, переважно неметаллами,
 вони
утворюють міцні сполуки. Отримання цих металів пов'язане з відкриттям і
застосуванням електричного струму. Перше джерело електричного струму винайшов в
1799 році італійський вчений А. Вольта. Це джерело, званий вольта стовпом,
складався зі срібних і цинкових кружечків, які відділялися один від одного
шкіряними прошарками, просоченими розчином лугу. При з'єднанні крайніх срібних
і цинкових кружечків дротом виникав електричний струм.
вони
утворюють міцні сполуки. Отримання цих металів пов'язане з відкриттям і
застосуванням електричного струму. Перше джерело електричного струму винайшов в
1799 році італійський вчений А. Вольта. Це джерело, званий вольта стовпом,
складався зі срібних і цинкових кружечків, які відділялися один від одного
шкіряними прошарками, просоченими розчином лугу. При з'єднанні крайніх срібних
і цинкових кружечків дротом виникав електричний струм.
Відкриття А. Вольта зацікавило вчених у всіх країнах. Почалося вивчення впливу електричного струму на різні речовини. Англієць Т. Карлейль за допомогою електричного струму розклав воду на кисень і водень. У 1802 р російський вчений Василь Володимирович Петров відкрив так звану електричну дугу, яка представляла собою потік електронів, що проходить через розпечене повітря.
Багато займався вивченням вольтова стовпа англійський учений Гемфрі Деві. У 1807 р він ставить досліди по розкладанню лугів електричним струмом з метою отримання металів і домагається виняткової успіху. Для отримання калію він клав шматочок їдкого калі на платиновий диск, з'єднаний з негативним полюсом вольтова стовпа. Зверху їдке калі наводилося в зіткнення з платинової дротом, яка була з'єднана з позитивним полюсом стовпа. Незабаром в місці зіткнення з електродами їдкий калі починав плавитися. На позитивному полюсі виділявся газ, а на негативному з'являлися дрібні блискучі кульки калію; більшість з них з тріском спалахували, а деякі
тьмяніли і поступово окислювались.
Слідом за відкриттям методу отримання калію Т. Деві приступає до відновлення натрію з їдкого натру. Використавши більш потужний вольтів стовп, він виділяє натрій. Калій і натрій виходили за рахунок приєднання електронів до іонів даних металів:
 K+ + ē = K
K+ + ē = K
Na+ + ē = Na
Незважаючи на гадану простоту досвіду Г. Деві, отримати цим методом натрій і калій не так-то просто. Пояснюється це тим, що тверді луги мають досить високий питомий опір. Тому спочатку застосовують велике напруження, наприклад 50-60 ст. У міру проходження електричного струму відбувається розігрівання лугу, її питомий опір падає. Тому напругу зменшують.
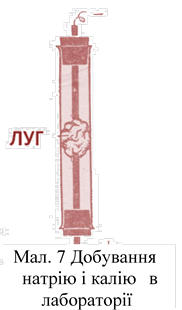
Для отримання невеликих кількостей калію або натрію можна рекомендувати простий прилад (мал. 7). В нього поміщають 2-3 г лугу в скляну трубку, закриту знизу пробкою, з пропущеної через неї залізним дротом діаметром
1,5-2 мм. Зверху луг стикається з іншим електродом. У
ланцюг включається низькоомний реостат. Як джерело струму використовується батарея акумуляторів або змінний струм міської мережі. Для його випрямлення зручний селеновий випрямляч типу ВСА-5, який має ручку для плавного регулювання напруги. Під час проведення електролізу поступово збільшують напругу приблизно до 20-30 ст. Як тільки луг починає плавитися у електродів, напруга трохи зменшують. Метали виходять у вигляді найдрібніших розплавлених кульок, які спалахують на повітрі. Через деякий час, коли весь кисень в трубці витратиться на окислювання, метали будуть зберігатися окислюючись.

Г. Й. Гесс. Я. Берцеліус.
Г. Деві, отримавши калій і натрій, детально вивчив їх властивості. Він виявив, що вони легкі і м'які, бурхливо взаємодіють з водою, легко сполучаються з різними неметалами.
Незабаром ці метали були отримані Ж. Гей-Люссаком і Л.Ж.Тенаром чисто хімічним способом, при сильному нагріванні суміші лугу з залізною тирсою, поміщеною в рушничний ствол:
4NaОH + 3Fe = Fe3О4 + 4Na + 2H2↑
Получавшийся натрій випаровувався і конденсировался на більш холодних стінках рушничного стовбура.
Через рік після відкриття металевого калію і натрію Г.Деві ставить досліди по електролізу сполук кальцію, стронцію, барію і магнію і отримує ці метали. Він також вивчає властивості галогенів і плавикову кислоту, пропонує для роботи в шахтах спеціально безпечну лампу.
Відкриття протягом двох років шести нових металів ставить Г.Деві в число вчених зі світовим ім'ям. Він дав і назви знову відкритим металів: калій - potassium (від карбонату калію, який називають «поташ»); натрій - sodium (від слова «сода»). Ці назви збереглися на англійській і французькій мовах до цих пір. В інших країнах прийняті на-звання «калій» і «натрій». Назва «калій» ввів в науку німецький вчений Д. Гільберт в 1810 р Воно походить від арабського слова «луг» - alkaly (al - невизначена частка і kali – попіл морських рослин).
Назва «натрій» введено в 1811 р шведським вченим Я. Берцелиусом, воно походить від слова natron – попіл морських водоростей, з яких добували соду. У Росії ці назви ввів Г. І. Гесс.
Відкриття Г. Деві лужних і лужноземельних металів було підготовлено історичним ходом раз-витку науки. У цьому виняткову роль зіграли досягнення, отримані в іншій науці – фізиці, а саме – відкриття електричного струму.
Лужний метал літій був відкритий в Швеції, в лабораторії видатного хіміка і мінералога Я. Берцеліуса. У його лабораторії не тільки велася розробка теоретичних основ хімії, але також проводилася велика робота з аналізу гірських порід і мінералів, що пояснювалося розвитком в Швеції гірничої справи та металургії. Тому новий мінерал, знайдений в одному з залізних рудників і названий петолітом, був доставлений для аналізу в лабораторію Я. Берцеліуса. Аналіз мінералу провів в 1817 р молодий вчений І.А.Арфведсон. Як показав аналіз, головною складовою частиною мінералу була окис алюмінію з невеликою домішкою інших елементів. В сумі вони становили 96%. Це змусило І.А.Арфведсона припустити, що в мінералі є якийсь новий елемент, який їм не був виявлений. Виявилося, що невідомий елемент дає добре розчинний сульфат. У вигляді сульфату він і був виділений.
Таким чином, в основі відкриття літію, по суті, лежав закон збереження маси речовини. Дійсність, сума складових частин мінералу повинна бути рівною сумі мас відкриваються елементів. Порушення цього співвідношення і вказувало на наявність нового елемента в мінералі.
Літій дає велику кількість солей, що нагадують за своїми фізичними і хімічними властивостями солі натрію. Однак його виявили не в розчинах солей, а в мінералі, тому Я. Берцеліус назвав новий елемент «літій». Ця назва походить від грецького слова «літе», що означає «камінь». Однак виділити літій у вигляді металу І.А.Арфведсону не вдалося. Це зробив в 1818 р Г.Деві, який отримав його електролізом окису літію.
Рубідій і цезій – вельми розсіяні елементи, і їх сполуки не утворюють самостійних родовищ. Тому вони вислизали від уваги хіміків, які використовували звичайні хімічні методи аналізу. Положення ускладнювалося ще й тим, що сполуки
рубідію і цезію за хімічними властивостями мало відрізнялися від сполук інших лужних металів і знаходилися в природі в якості домішок до їх солей.
Отримання цих елементів стало можливим після відкриття спектрального аналізу. У 1861 р Роберт Бунзен, досліджуючи солі деяких мінеральних джерел, виявив в них новий елемент, що дає при спектральному аналізі темно-червоні лінії, яких не давали інші елементи. Новий елемент назвали рубідій (rubidus - темно-червоний). Для вилучення невеликої кількості солей рубідію Р.Бунзену довелося випарувати 40 м3 води одного з мінеральних джерел. Металевий рубідій вперше отримав Р. Бунзен відновленням виннокислого рубідію.
 Цезій було відкрито в 1860
р Р. Бунзеном також в Р. Бунзен солях мінеральних джерел. Оскільки новий
елемент
Цезій було відкрито в 1860
р Р. Бунзеном також в Р. Бунзен солях мінеральних джерел. Оскільки новий
елемент
давав спектр з характерними синіми лініями, його назвали цезієм (caesius - синьосірий). Металевий цезій був вперше отриманий в 1882 р електролізом розплавленої солі.
Історія пошуків елемента 87, який є аналогом цезію, починається з відкриття Д.І.Менделєєвим періодичного закону. Д.І.Менделєєв писав, що в десятому ряду передбачаються ще кілька основних елементів, що належать до I, II і III груп, з атомною масою близько 210-230; оксид першого з них – R2О. З того часу було опубліковано багато робіт про відкриття цього елемента, але перевірка їх не підтвердила. Так, в 1929 р Ф.Аллісон (США) описав його відкриття в деяких рідкісних мінералах за допомогою запропонованого ним магнитооптического методу. Елемент був названий на честь штату в Америці віргінієм, описані його деякі сполуки. Пізніше, в 1931 р повідомив про відкриття цього ж елемента Д.Пепіш. Повідомлення теж не підтвердилося. Ці вчені і не могли його відкрити застосовувалися методами. Елемент знаходиться в природі в мізерно малих кількостях, він утворюється при радіоактивному розпаді рідкісного елемента актиния. Оскільки цей елемент радіоактивний і має період напіврозпаду дорівнює 21 хвилину, він не може накопичуватися в природі. Відкрито цей елемент Марією Пере в 1939 р і названо на честь її батьківщини – францієм. Він був виділений з продуктів радіоактивного розпаду радіоактивних елементів, наявних в природі. Штучним шляхом було отримано ще кілька ізотопів францію. Всі вони виявилися також радіоактивними і легко перетворювалися в інші елементи.
Мідь стала відома людині в кам'яному столітті – деякі самородки міді, що відносяться до цього часу, носять сліди впливів кам'яних знарядь, зокрема у них обрубані виступаючі частини. Очевидно, ці шматочки міді були використані доісторичним людиною як прикрас, а потім і як знаряддя. Поширенню мідних виробів сприяло властивість міді піддаватися куванню в нагрітому стані. Так обробляли мідні самородки індіанці ще за часів Колумба.
Де і коли був відкритий метод виплавки міді з руд, невідомо. Швидше, він був відкритий випадково. Самородна мідь завжди зустрічається спільно з рудою. І ось під час нагрівання самородка в розжареному вугіллі багаття шматочки мідної руди, які прилипли до самородку, могли перетворилися на мідь – відновилися вугіллям:
2CuО + C = 2Cu + CО2
Можливо, спочатку мідь виплавляли в невеликих вербових кошиках, обмазаних товстим шаром глини. У таку своєрідну плавильну піч завантажували руду разом з вугіллям і під нею розпалювали велике вогнище.
Руди міді часто зустрічаються спільно з рудами цинку, олова. Такі руди відновлюються легше і дають сплави міді більш тверді, ніж сама мідь. Ці сплави називають бронзами, а час, протягом якого людина широко використовував бронзу, - бронзовим віком. Назва «бронза» походить від назви невеликого італійського міста Бріндізі, .Через який серед інших товарів йшла торгівля виробами з сплаву міді з оловом. Цей сплав називали міддю з Бріндізі, а потім – бронзою.
Виготовлення виробів з міді і її сплавів почалося ще при перших фараонах Єгипту (4-5 тис. Років до н. е.). Відомі найдавніші мідні руди на острові Кіпр. Мабуть, сучасне латинську назву міді «купрум» походить від латинського назви цього острова.
Коли ж і де вперше була виплавлено мідь?
Вважалося, що люди 9-8 тис. Років тому не вміли як слід робити керамічний посуд, але в 1950 р археологами було зроблено цікаве відкриття. У районі річки Конья на південному заході Малої Азії в 1950 р проводилися розкопки. Поряд з кам'яними знаряддями були знайдені мідні проколки, прикраси, кільця. За визначенням фізиків, які використовували радіовуглецевий метод, культурний шар із залишками життєдіяльності людини виник в VII-VI тисячоліттях (!) До н. е. Цьому відкриттю важко повірити, але в 1963 р при розкопках в верхів'ях річки Тигр були знайдені найпростіші мідні вироби, що відносяться до того ж періоду. Там же знайшли і мідну руду.
Невідомо, хто і коли вперше знайшов золото і срібло. Безумовно, це відбулося в доісторичні часи. Самородне срібло і особливо золото легко помітити за їх своєрідним металевим блиском. Треба думати, що ці метали були «відкриті» раніше міді. Золото і срібло знаходять в найдавніших похованнях.
Розділ ІІІ
Фізичні властивості водню, лужних металів і металів підгрупи міді
 Хімічнм зв'язок в металах.
Як відомо, ковалентний зв'язок характеризується тим, що атоми елементів
утримуються одна біля одної за рахунок загальних електронів (єднальна
електронна пара утворюється з двох валентних електронів). У той же час зв'язок
між молекулами порівняно слабка.
Хімічнм зв'язок в металах.
Як відомо, ковалентний зв'язок характеризується тим, що атоми елементів
утримуються одна біля одної за рахунок загальних електронів (єднальна
електронна пара утворюється з двох валентних електронів). У той же час зв'язок
між молекулами порівняно слабка.
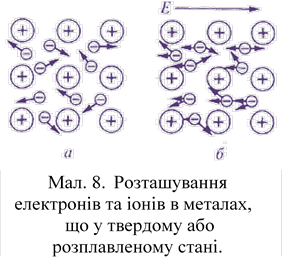
В металах також є загальні електрони. Перебуваючи в твердому або розплавленому стані, атоми металів втрачають зв'язок зі своїми валентними електронами і переходять в позитивно заряджені іони. Вивільнені валентні
електрони стають загальними і належать одночасно всім утворився іонів (мал. 8). Вільні електрони перебувають в безперервному хаотичному (хаотичному) русі. Але їх енергія недостатня для самовільного виходу з металу.
 При своєму русі
електрони можуть стикатися з іонами. Іноді ці зіткнення закінчуються
приєднанням електронів, і іон перетворюється в атом. Але атом металу тут же
втрачає електрон і знову перетворюється в позитивно заряджений іон, тому атоми
металу називають іон-атомами. В даний час встановлено, що електрони можуть
«пробігати» деяку відстань, перш ніж вони зіткнуться з іоном металу, тому атоми
металу більшу частину часу перебувають в іонізованому стані.
При своєму русі
електрони можуть стикатися з іонами. Іноді ці зіткнення закінчуються
приєднанням електронів, і іон перетворюється в атом. Але атом металу тут же
втрачає електрон і знову перетворюється в позитивно заряджений іон, тому атоми
металу називають іон-атомами. В даний час встановлено, що електрони можуть
«пробігати» деяку відстань, перш ніж вони зіткнуться з іоном металу, тому атоми
металу більшу частину часу перебувають в іонізованому стані.
Більшість фізичних властивостей металів обумовлено наявністю напіввільних електронів. Міцність металів пояснюється взаємодією між вільними електронами і іонами. Завдяки наявності великої кількості вільних електронів метали добре проводять електричний струм: при накладенні електричного поля електрони набувають спрямований рух.
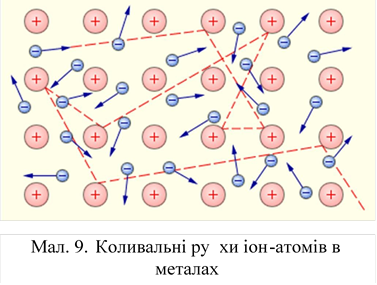
 Для металів характерно
зменшення електропровідності з підвищенням температуриПояснюється це тим, що з
підвищенням температури збільшуються коливальні рухи іон-атомів металів, що
ускладнює спрямований рух електронів (мал. 9). Навпаки, з пониженням температури
коливальні рухи іон-атомів зменшуються, а близько абсолютного нуля зовсім
припиняються. Внаслідок цього при зниженні температури електропровідності
металів збільшується, а близько абсолютного нуля у них виникає так звана
надпровідність.
Для металів характерно
зменшення електропровідності з підвищенням температуриПояснюється це тим, що з
підвищенням температури збільшуються коливальні рухи іон-атомів металів, що
ускладнює спрямований рух електронів (мал. 9). Навпаки, з пониженням температури
коливальні рухи іон-атомів зменшуються, а близько абсолютного нуля зовсім
припиняються. Внаслідок цього при зниженні температури електропровідності
металів збільшується, а близько абсолютного нуля у них виникає так звана
надпровідність.
У неметалів електропровідність, навпаки, з підвищенням температури зростає. У деяких неметалів – бору, кремнію та інших – електропровідність з підвищенням температури на 500-800° С збільшується в тисячі, а іноді в мільйони разів.
Таким чином, металом можна назвати простір речовина з металевим зв'язком, електричний опір якого з підвищенням температури збільшивши ється. З цієї точки зору всі елементи I групи, за винятком водню, у вигляді простих речовин є типовими металами.
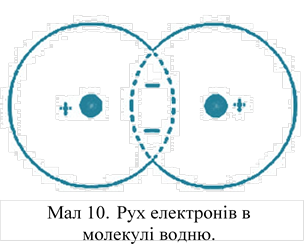
 Хімічна зв'язок в молекулі
водню ковалентная. Вона утворена двома електронами, і їх рух близько двох
протонів можна уявити як рух по вісімці (мал. 10). Коли один електрон займає
положення 1, то другий електрон займає положення 3 перший переміститься в1
положення 2, другий в положення 7 і т. д. Таким чином, не дивлячись на те чтр
електрони на якийсь момент можуть бути ближче до одного ядра, ніж до іншого,
все ж вони загальні у двох ядер водню. Завдяки великим швидкостям обертання
електронів (близько 20000 м/сек) протони як би оточені з усіх боків негативним
зарядом – електронною хмарою.
Хімічна зв'язок в молекулі
водню ковалентная. Вона утворена двома електронами, і їх рух близько двох
протонів можна уявити як рух по вісімці (мал. 10). Коли один електрон займає
положення 1, то другий електрон займає положення 3 перший переміститься в1
положення 2, другий в положення 7 і т. д. Таким чином, не дивлячись на те чтр
електрони на якийсь момент можуть бути ближче до одного ядра, ніж до іншого,
все ж вони загальні у двох ядер водню. Завдяки великим швидкостям обертання
електронів (близько 20000 м/сек) протони як би оточені з усіх боків негативним
зарядом – електронною хмарою.
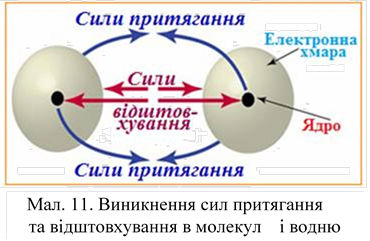
На периферії молекули водню скрізь є негативний заряд, тому молекули водню відштовхуються. Слабкий зв'язок між молекулами (межмолекулярная зв'язок) виникає за рахунок взаємодії протона однієї молекули з електронним хмарою інший (мал. 11). Цим пояснюється, що водень переходить в рідкий стан при дуже низьких температурах –252,8 ° С, а в твердий – при –259,2 ° С.
Вчені розрахували, що при великих тисках, приблизно в 400 000 атм, атоми водню зблизяться і електрони будуть загальними, як в металах. Отже, при високому тиску водень повинен набути металевих властивостей.
Такий тиск є в глибині багатьох небесних тіл. Можливо, металевий водень буде найміцнішим з металів, так як кількість вільних електронів (з огляду на невеликі розміри протона) у нього в одиниці об'єму найбільша.
Температури плавлення і кипіння. Лужні метали мають порівняно низькі температури плавлення і кипіння (табл. 3).
Пояснюється це тим, що хімічний зв'язок між іонами і електронним газом щодо нетривка, так як вільних електронів у них мало – на один йон припадає в середньому приблизно один електрон. При збільшенні кількості вільних електронів в переважній більшості випадків температури плавлення і кипіння підвищуються, тому в періодах періодичної системи (в міру зростання порядкових номерів) температури плавлення і кипіння металів зростають.
У підгрупах періодичної системи Д. І. Менделєєва зі зростанням порядкових номерів в більшості випадків температури плавлення і кипіння металів зменшуються. Це спостерігається і у металів головної підгрупи I групи, що можна пояснити послабленням сил хімічного зв'язку між іон-атомами металу. Тому цезій - самий легкоплавкий метал. Досить деякий час потримати ампулу з ним в руках, як цезій перейде в рідкий стан.
Таблиця 3 Температура плавлення та кипіння металів I групи
|
Метали |
Температура плавлення, °С |
Температура кипіння, °С |
Метали |
Температура плавлення, °С |
Температура кипіння, °С |
|
Літій |
180 |
1350 |
Мідь |
1083 |
2877 |
|
Натрій |
97,5 |
877 |
Срібло |
960,8 |
2163 |
|
Калій |
63,6 |
765 |
Золото |
1063 |
2847 |
|
|
|
|
|
||
|
Рубідій |
38,8 |
705 |
|
|
|
|
Цезій |
28,5 |
688 |
|
|
|
|
|
|
|
|
|
|
 Треба думати, що ослаблення
сил хімічного зв'язку відбувається в першу чергу внаслідок збільшення розмірів
атомів, яке особливо сильно проявляється в підгрупі лужних металів. Однак така
закономірність є не у всіх підгрупах періодичної системи: зі збільшенням числа
вільних електронів зазвичай відбувається збільшення температур плавлення і
кипіння. Особливо це проявляється у металів VI і VII груп періодичної системи
Д. І. Менделєєва, які є найбільш тугоплавкими металами (у вольфраму на один
атом припадає шість вільних електронів). Наприклад, хром плавиться при 1900 °
С, а вольфрам, який має велику атомну масу, - при 3380°С. Це збільшує сили
хімічного зв'язку і в підсумку призводить до підвищення температур плавлення.
Треба думати, що ослаблення
сил хімічного зв'язку відбувається в першу чергу внаслідок збільшення розмірів
атомів, яке особливо сильно проявляється в підгрупі лужних металів. Однак така
закономірність є не у всіх підгрупах періодичної системи: зі збільшенням числа
вільних електронів зазвичай відбувається збільшення температур плавлення і
кипіння. Особливо це проявляється у металів VI і VII груп періодичної системи
Д. І. Менделєєва, які є найбільш тугоплавкими металами (у вольфраму на один
атом припадає шість вільних електронів). Наприклад, хром плавиться при 1900 °
С, а вольфрам, який має велику атомну масу, - при 3380°С. Це збільшує сили
хімічного зв'язку і в підсумку призводить до підвищення температур плавлення.
Невеликі температури плавлення лужних металів пояснюються ще наявністю у них
«зазорів» - пустот між іон-атомами металів, які послаблюють сили хімічного зв'язку.
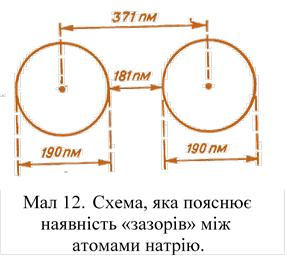
Розміри цих «зазорів» зі збільшенням атомних мас збільшуються. Наприклад, іони натрію мають обміни 190 пм, а відстань між ядрами цих іонів - 371 нм. Отже, між іонами є «зазор» в 181 пм (мал. 12). На відміну від металів підгрупи міді лужні метали під впливом зовнішнього тиску стискаються. Оскільки «зазори» дуже високі між іонами цезію, цей метал стискується легше, ніж інші. Так, при 10000 атм з одного обсягу цезію виходить всього 0,368 початкового об'єму. Цікаво відзначити, що з підвищенням зовнішнього тиску відмінність в температурах плавлення зникає. Наприклад, при тиску 30 000 атм температури плавлення рівні: Na – 234°С, К – 248°С, Rb – 251°С, Cs – 261°С. Отже, після «зникнення зазорів» цезій став плавитися при більш високій температурі, ніж літій.
При високих температурах лужні метали випаровуються і в пароподібному стані знаходяться в вигляді газу, що складається з одноатомних молекул. Однак невелика частина металу знаходиться у вигляді молекул, наприклад Li2, Na2 і т. д. У парах металів валентних електронів пов'язані з атомами, усуспільнені електрони з'являються тільки тоді, коли пари металів переходять й рідкий, а потім в твердий стан.
Метали підгрупи міді, як і лужні метали, мають по одному вільному електрону на один іон-атом металу. Здавалося б, ці метали не повинні особливо сильно відрізнятися від лужних. Але вони, відміну від лужних металів, мають досить високими температурами плавлення. Велика відмінність в температурах плавлення між металами цих підгруп пояснюється тим, що між іон-атомами металів підгрупи міді майже немає «зазорів» і вони розташовані ближче. Внаслідок цього кількість вільних електронів в одиниці об'єму, електронна щільність, у них більше. Отже, і міцність хімічного зв'язку у них більше. Тому метали підгрупи міді плавляться і киплять при більш високих температурах
Твердість і блиск. Лужні метали мають невелику твердість. Натрій, наприклад, настільки м'який метал, що його можна без будь-якого зусилля різати ножем. Твердість цих металів в підгрупі зі збільшенням атомної маси і розмірів атомів зменшується, тому літій найбільш твердий з лужних металів, майже як свинець, а цезій – найбільш м'який, як віск. Така зміна твердості пояснюється, як і зміна температур плавлення, збільшенням радіусів іонів, а отже, зменшенням кількості вільних електронів в одиниці об'єму, а також збільшенням розмірів зазорів між іон-атомами.
Зі збільшенням кількості валентних електронів в періодах періодичної системи Д.І.Менделєєва сили хімічного зв'язку між іонами елементів збільшуються, тому в періодах зліва направо спостерігається збільшення твердості. Самим твердим металом є хром – метал, що знаходиться в правому верхньому куті періодичної системи Д.І.Менделєєва Хром має максимальну кількість вільних електронів в одиниці об'єму. У той же час атом цього металу має невеликі розміри, у порівнянні з іншими атомами металів VI і VII груп періодичної системи. Відповідно до цією закономірністю найменшою твердістю повинні володіти метали, розташовані в лівому нижньому кутку періодичної системи, тобто, франций і цезій. Метали підгрупи міді мають, в порівнянні з лужними металами, більшу твердість. Пояснюється це збільшенням електронної щільності і відсутністю «зазорів» між іонатомами.
 Необхідно відзначити, що
твердість і міцність металів залежать від правильності розташування іон-атомів
в кристалічній решітці. У металах, з якими ми практично зіштовхуємося,
є різного роду порушення правильного розташування іон-атомів,
наприклад порожнечі в вузлах кристалічної решітки. До того ж метал складається
з дрібних кристаликів (кристалітів), між якими зв'язок ослаблена. Все це знижує
міцність металу. Вченими була отримана мідь без порушень в кристалічній
решітці. Для цього дуже чисту мідь переганяється при високій температурі в
глибокому вакуумі на спеціальну підкладку. Мідь виходила у вигляді невеликих
ниточок - "вусів". Як виявилося, така мідь в сто раз міцніша, ніж
звичайна. Вона міцніше найміцнішої сталі.
Необхідно відзначити, що
твердість і міцність металів залежать від правильності розташування іон-атомів
в кристалічній решітці. У металах, з якими ми практично зіштовхуємося,
є різного роду порушення правильного розташування іон-атомів,
наприклад порожнечі в вузлах кристалічної решітки. До того ж метал складається
з дрібних кристаликів (кристалітів), між якими зв'язок ослаблена. Все це знижує
міцність металу. Вченими була отримана мідь без порушень в кристалічній
решітці. Для цього дуже чисту мідь переганяється при високій температурі в
глибокому вакуумі на спеціальну підкладку. Мідь виходила у вигляді невеликих
ниточок - "вусів". Як виявилося, така мідь в сто раз міцніша, ніж
звичайна. Вона міцніше найміцнішої сталі.
Чистий мідь володіє і іншою цікавою особливістю. Червоний колір обумовлений слідами розчиненого в ній кисню. Виявилося, що мідь, багаторазово возогнанная в глибокому вакуумі (при відсутності кисню), має жовтуватий колір.
Як відомо, метали мають своєрідним металевим блиском. Це пояснюється наявністю вільних електронів, які перешкоджають поглинанню світла. У металів є відтінки в кольорі, наприклад: калій – блакитний, цезій – світло-коричневий. Істинний колір лужних і лужноземельних металів можна спостерігати тільки на свіжому зрізі (див. Хімічні властивості).
 У шкільних умовах легко
приготувати препарати натрію і калію, поверхня яких тривалий час залишається
блискучою. Для цього підбирають дві пробірки, одна з них повинна входити в
іншу. Для приготування зразка натрій або калій поміщають у велику пробірку, притискають
його меншою колбою і нагрівають. Як тільки метал розплавиться, меншу пробірку
всувають в ширшу так, щоб розплавлений метал розтікся між їх стінками (мал.
13). Після охолодження металу відкриті кінці пробірок заплавляются парафіном
або менделєєвської замазкою, щоб запобігти проникненню повітря між пробірками.
У шкільних умовах легко
приготувати препарати натрію і калію, поверхня яких тривалий час залишається
блискучою. Для цього підбирають дві пробірки, одна з них повинна входити в
іншу. Для приготування зразка натрій або калій поміщають у велику пробірку, притискають
його меншою колбою і нагрівають. Як тільки метал розплавиться, меншу пробірку
всувають в ширшу так, щоб розплавлений метал розтікся між їх стінками (мал.
13). Після охолодження металу відкриті кінці пробірок заплавляются парафіном
або менделєєвської замазкою, щоб запобігти проникненню повітря між пробірками.
При хорошій ізоляції метал зберігає блискучу поверхню протягом багатьох років.
Метали підгрупи міді в полірованому вигляді також мають сильний блиск. Особливо велика відбивна здатність у срібла, яка знаходить практичне застосування.
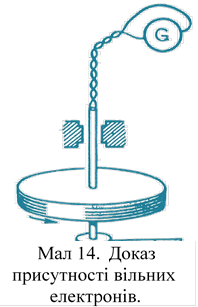
Електропровідність. Електропровідність металів визначається наявністю вільних електронів. Їх існування можна довести дослідним шляхом (мал. 14). При різкій зупинці котушки електрони продовжують рух за інерцією і відхиляють стрілку гальванометра. При проходженні електричного струму структура і маса металу не змінюються. Залишаються незмінними і його хімічні властивості. Все це говорить про те, що проходження електричного струму обумовлено рухом вільних електронів. Іони металів в електропровідності не беруть участь. Це підтверджують досліди Ріке. Ріке протягом десяти років пропускав електричний струм через мідні і алюмінієві циліндри, з'єднані між собою торцями: ніяких явищ перенесення іонів не спостерігалося, межа між металами залишилася без змін.
Прямої залежності між положенням металів в періодичній системі і їх електропровідністю не виявлено. Але деякі закономірності все ж є. Найбільшою електропровідністю володіють одновалентні метали: мідь, срібло, золото, лужні метали.
У таблиці 4 наведена величина, зворотна електропровідності, – питомий опір металів.
Таблиця 4 Питомий опір металів (при 0° С)
|
Элементи |
Порядковий номер |
Питомий опір, 10–8 ом м |
Элементи |
Порядковий Номер |
Питомий опір, 10–8 ом м |
|
Літій |
3 |
8,85 |
|
|
|
|
Натрій |
11 |
4,34 |
Мідь |
29 |
1,673 |
|
Калій |
19 |
6,15 |
Срібло |
47 |
1,6 |
|
Рубідій |
37 |
11,3 |
Золото |
79 |
2,19 |
|
Цезій |
55 |
18,8 |
|
|
|
Є невелика кількість металів, питомий опір яких трохи менше опору лужних.
Наприклад, питомий опір алюмінію одно 2,69 10–8 ом м, магнію – 4,4 10–8 ом м. У переважній більшості випадків опір металів одно 10-20 10–8 ом му у ртуті воно одно 95,8 10–8 ом м.
Як випливає з наведених у таблиці даних, зі збільшенням порядкових номерів, а отже, і розмірів атомів, опір зростає.
Теплопровідність. Лужні метали мають високу теплопровідність. Завдяки цьому лужні метали досить вигідно застосовувати для відводу теплоти. Так, наприклад, розплавлений натрій іноді використовують в якості теплоносія в атомних реакторах. Про це докладно розказано нижче.
Встановлено, що теплота в металах переноситься, пружними коливаннями іонатомів і головним чином вільними електронами.
Густина. Лужні метали, на відміну від інших металів, мають невелику щільність (табл. 5).
Як випливає з наведених даних, щільність металів зі збільшенням порядкового номера в підгрупах періодичної системи підвищується. Це пов'язано зі збільшенням кількості протонів і нейтронів в ядрах атомів, тобто. Пояснюється великим навантаженням ядер елементів. Щільність у трьох металів – літію, натрію і калію менше, ніж у води, і, отже, вони плавають на воді. Літій не тоне в гасі і в багатьох інших рідких органічних речовинах. Тому при зберіганні літію в гасі метал притискають зверху будь-яким вантажем, наприклад залізом. Можна також налити повний посудину гасу; при закриванні пробка тисне на літій, і він занурюється в гас.
Таблиця 5 Густина лужних металів і металів підгрупи міді
|
Элементи |
|
Радиус йона, нм |
|
Элементи |
|
Радиус йона, нм |
|
|
Літій |
3 |
68 |
534 |
|
|
|
|
|
Натрій |
11 |
98 |
972 |
Мідь |
29 |
98 |
8900 |
|
|
|
|
|
|
|
|
|
|
Калій |
19 |
133 |
860 |
Срібло |
47 |
113 |
10500 |
|
|
|
|
|
|
|
|
|
|
Рубідій |
37 |
149 |
1355 |
Золото |
79 |
137 |
19300 |
|
|
|
|
|
|
|
|
|
|
Цезій |
55 |
165 |
1900 |
|
|
|
|
Різке збільшення щільності металів підгрупи міді, на відміну від лужних, пояснюється відсутністю зазорів між атомами, а також меншими розмірами іонів: в одиниці об'єму розміщується більшу кількість атомів.
Радіоактивність. Як відомо, речовина у Всесвіті в залежності від зовнішніх умов знаходиться в різних станах: у вигляді розпечених зірок, планет, пилових і газових хмар і в розсіяному вигляді. Однією з форм існування речовини є хімічні елементи. На нашій планеті більшість елементів володіє відносною стабільністю, але деякі елементи (радіоактивні) піддаються розпаду і дають початок іншим елементам. Серед лужних металів також є радіоактивні: калій, рубідій і францій.
Природний калій складається з ізотопів з атомними масами 39, 40, 41. Слабкою радіоактивністю володіє ізотоп з атомною масою 40. Частина атомів цього ізотопу викидає з ядра β-частинки, тобто електрони, що призводить до перетворення одного нейтрона ядра в протон. Внаслідок цього утворюється кальцій з атомною масою 40:
1940K-2040Ca
Інша частина атомів ізотопу калію перетворюється в результаті радіоактивного розпаду в аргон. Це відбувається за рахунок того, що ядро атома калію захоплює електрон з найближчої до нього орбіти, в результаті чого один протон перетворюється в нейтрон і заряд зменшується на одиницю:
_
1940K e1840Ar
Наявністю радіоактивного розпаду і зумовлена поява відхилення в періодичній системі Д.І.Менделєєва: аргон, незважаючи на велику атомну масу в порівнянні з калієм, варто перед калієм. Треба думати, що за час існування Землі (близько 6,5 млрд. років) значна частина ізотопу калію розпалася, внаслідок чого атомна маса калію зменшилася, а атомна маса аргону збільшилася. Це ж підтверджує і аномально високий вміст аргону на Землі в порівнянні з іншими інертними газами.
Радіоактивний розпад кожного елемента протікає з певною швидкістю.
Швидкість розпаду характеризуєтся періодом напіврозпаду. Період напіврозпаду – це час, протягом якого розпадається половина радіоактивної речовини. Період напіврозпаду калію має велику величину: половина наявної кількості ізотопу калію розпадається за 1,26 106 років. Як відомо, при радіоактивному розпаді виділяється велика кількість теплоти. Вважають, що значна частка теплоти, наявна в надрах Землі, виникла за рахунок радіоактивного розпаду калію.
Наявність радіоактивності у калію дозволило вченим А.А.Полкановій і Е.К.Герлингену разробити калій-аргоновий метод визначення віку гірських порід. Дійсно, чим більше в гірській породі аргону з атомною масою 40, тим вона більш давня. Визначення віку гірських порід в результаті зводиться до визначення
40Ar
співвідношення
кількості ізотопів: ![]() 40K .
40K .
Інший лужної метал – рубідій також радіоактивний. Радіоактивного перетворення зазнає ізотоп з атомною масою 87, який випускає β-промені і безперервно перетворюється в стронцій:
3787Rb3887Sr
Рубідій має ще більший період напіврозпаду – 5 1010 років.
Володіє радіоактивністю і найважчий елемент з лужних металів – францій. У природі він зустрічається в незначних кількостях в продуктах розпаду радіоактивного елемента актиния. Виявили його в 1939 р Пізніше в результаті ядерних реакцій були отримані ізотопи францію. Всі вони виявилися радіоактивними, з невеликою тривалістю життя, тому вивчення хімічних властивостей франція пов'язано з серйозними труднощами. До того ж з'єднання франція важко відокремити від інших речовин через хорошою розчинності його солей. Раніше солі франція виділяли при спільній кристалізації з солями цезію, на які вони схожі за хімічними властивостями. В даний час для виділення солей франція застосовують катіонітові колонки. Як показало дослідження, францій є повним аналогом лужних металів і особливо близький до цезію, за яким він іде в періодичної системі Д.І.Менделєєва.
У елементів підгрупи міді також є радіоактивні ізотопи, але в природі вони не зустрічаються, а отримані штучним шляхом.
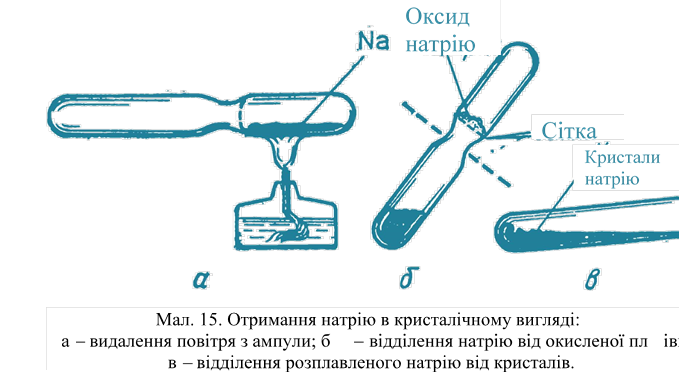
Кристалічні решітки. У твердому стані все метали, в тому числі і лужні, знаходяться в кристалічному стані. Отримати деякі лужні метали у вигляді кристалів можна наступним шляхом. У пробірку з перетяжкою помістити 5-6 г натрію, запаяти її і натрій тримати протягом декількох днів в розплавленому стані (мал. 15).
Для зберігання розплавленого натрію застосовують термостат, сушильна шафа і т. д. При цьому весь кисень в пробірці з'єднається з натрієм. Потім ртпобірку трохи нахиляють і переливають розплавлений натрій в друге відділення пробірки. Оксиди натрію затримуються металевою сіткою. Для отримання кристалів натрій плавлять, а потім повільно охолоджують (пробірку тримають у вертикальному положенні).
Як тільки частина натрію затвердіє, рідку частину зливають з отриманих кристалів, нахиливши пробірку. Кристалічну будову лужних металів пояснюється тим, що іон-атоми металів расположёни в просторі в певному порядку. Це розташування носить назву кристалічної решітки.
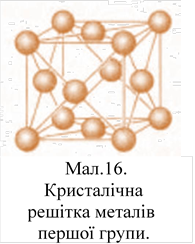 Лужні метали
кристалізуються за типом централізованого куба (мал. 16). Таку ж кристалічну
решітку мають і метали підгрупи міді.
Лужні метали
кристалізуються за типом централізованого куба (мал. 16). Таку ж кристалічну
решітку мають і метали підгрупи міді.
Для встановлення будови кристалічних решіток застосовують рентгеноскопічний або електронографічний метод.
На малюнку 17 наводиться електронограмма золота. Для цього золото у вигляді найтоншого шару Напилювана в глибокому вакуумі на кристалик кухонної солі. Потім сіль розчиняли у воді, а листочок золота поміщали в електронний мікроскоп. Тонкий пучок електронів, розігнаних в електричному полі, проходив через золото, розсіювався і
після цього падав на фотографічну пластинку. Розшифровка отриманої електронограми дозволила встановити тип кристалічної решітки. Оскільки у лужних металів і у металів підгрупи міді однаковий тип кристалічної решітки, то і електронограми абсолютно однакові за формою. Змінюється тільки відстань між світлими і темними проміжками, оскільки відстані між атомами у різних металів різні.

Мал. 17. Електрограма золота.
Розділ IV
Хімічні властивості елементів I групи
Будова
атомів елементів I групи. Хімічні властивості елементів визначаються в першу
чергу будовою зовнішніх електронних оболонок. Послідовне заповнення електронних
шарів атомів елементів I групи електронами показано на наведеній 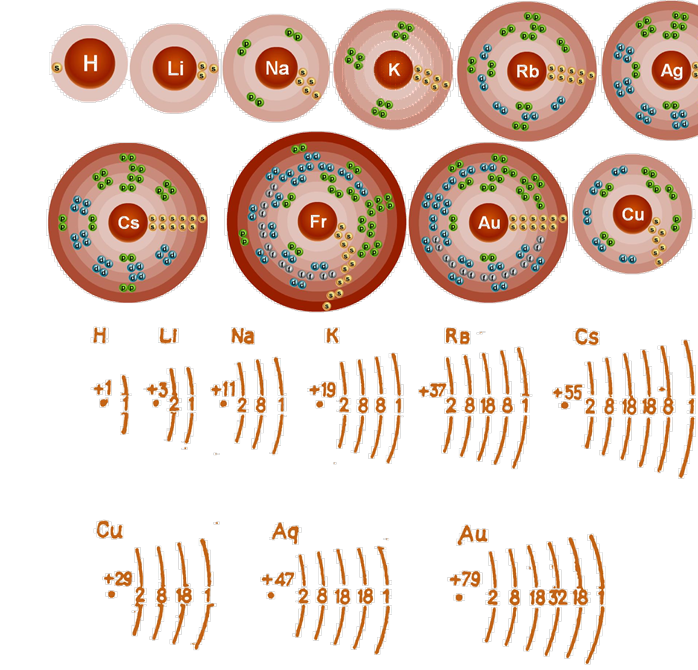 схемі (мал. 18).
схемі (мал. 18).
Мал.18. Будова атомів елементів першої групи
Електрони, розташовані в різних електронних шарах, знаходяться на різних відстанях від ядер елементів і мають різну міцність зв'язку з ядрами атомів. Тому вони мають різну енергію, як кажуть, вони знаходяться на різних енергетичних рівнях.
На останньому електронному шарі, або енергетичному рівні, у атомів елементів I групи є по одному електрону, тому вони все одновалентних. Крім цієї валентності, срібло може бути двовалентним, золото – тривалентним, а мідь - і двох- і тривалентною. Пояснюється це особливою будовою передостаннього енергетичного рівня цих елементів. На передостанньому енергетичному рівні у міді, срібла, золота знаходиться по 18 електронів. Але вони нерівноцінні, і в залежності від форми орбіти (форми створюваного електронного хмари) і інших причин енергія зв'язку їх з ядром різна. Електрони розподіляються по подуровням. Умовно підрівні позначають буквами s, р, d, f. Електрони, що знаходяться на цих подуровнях, відповідно називаються s-, р-, d- і / -Електронна.
Електронна будова атомів елементів I групи може бути представлене в такий спосіб:
|
1Н 3Lі 11Na 19K
37Rb
55Cs
87Fr |
29Cu
47Ag
79Au |
1s1 1s22s1 1s22s2р63s1 1s22s22p63s23p64s1 1s22s22p63s23p63d104s1 1s22s22p63s23p63dl04s24p65s1 1s22s22p63s23p63d104s24p64dl05s1 1s22s22p63s23p63d104s24p6 dl0 5s25p66s1 1s22s22p63s23p63d104s24p6 dl04f145s25p65d106s1 1s22s22p63s23p63d104s24p6 dl04f145s25p65d106s26p67s1 |
Видно велика різниця в електронному будову атомів елементів головної та побічної підгруп. У лужних металів, крім літію, на передостанньому енергетичному рівні є s- і р-електрони, кількість яких завжди дорівнює 8. Ці електрони створюють міцний енергетичний рівень, брати участь в утворенні хімічних зв'язків вони не можуть. У атомів елементів побічної підгрупи з'являється новий енергетичний підрівень d, електрони якого можуть брати участь в утворенні хімічних зв'язків. Так, у міді валентними є: один електрон, що знаходиться в 3d-, і один електрон в 4sстані; у срібла – це один електрон, що знаходиться в 4d-, і один в 5s-стані; а у золота - два електрони, що знаходяться в 5d-, і один електрон в 6s-стані.
У елементів головної групи d-електрони на передостанній орбіталі відсутні, і в утворенні хімічного зв'язку беруть участь тільки s-електрони останнього енергетичного рівня, тому ці елементи завжди одновалентнs.
Важливою характеристикою, що впливає на хімічні властивості елементів, є іонізаційні потенціали атомів і спорідненість до електрону. Енергія, необхідна для відриву електрона від атома, називається енергією іонізації. Вона виражається в джоулях на 1 кг-атом. Електрони з атомів можуть віддалятися під дією ударів інших електронів, які «разігнані» в електричному полі. Мінімальне значення електричного поля (в вольтах), при якому прискорюється цим полем вільний електрон стає здатним викликати іонізацію атома даного елемента, називається потенціалом іонізації.
Як відомо, атоми можуть також і приєднувати електрони. Енергія, що виділяється при приєднанні електрона до атома, називається спорідненістю до електрону. Вимірюється ця енергія в електрон-вольтах. Нижче наведені значення іонізаційних потенціалів:
Н Li Na К Rb Cs Fr
13,59 5,39 5,14 4,34 4,18 3,80 3,89
Cu Ag Au
7,72; 20,29; 36,83 7,57; 21,48; 32,82 9,22; 20,5; 30,5
Для міді, срібла і золота вказані іонізаційні потенціали для послідовного відриву першого, другого і третього електронів.
Як випливає з наведених цифр, у лужних металів спостерігається послідовне зменшення іонізаційних потенціалів, тобто послаблення зв'язку валентних електронів з ядром. Отже, при всіх інших рівних умовах, хімічна активність повинна збільшуватися зі збільшенням атомних мас. При переході від міді до срібла іонізаційний потенціал дещо зменшується і збільшується при переході до золота. Високе значення іонізаційного потенціалу золота говорить про його порівняно невисокої активності.
Спорідненість до електрону збільшується зі збільшенням атомних мас як у лужних металів, так і у металів підгрупи міді. Однак про хімічної активності можна судити тільки за іонізаційним потенціалом і спорідненості до електрону, так як хімічний процес процес утворення з'єднань – дуже складний і включає ряд послідовних стадій.
Розглянемо, наприклад, механізм утворення оксиду натрію Na2О з кисню і металевого (твердого) натрію. Спочатку енергія витрачається на руйнування! кристалічної решітки натрію, розрив хімічної) зв'язку в молекулах кисню, відрив електрона від атом.й натрію. Потім енергія виділяється при приєднань цього електрона до атома кисню при утворенні кристалічної решітки окису натрію. Іноді, особливо коли іони мають невеликі розміри, вся витрачається енергія має велике значення, що в підсумку впливає на загальну хімічну активність відповідного елемента. Наприклад, енергія, що виділяється при утворенні кристалічної решітки окису літію Li2O, набагато більше в порівнянні з енергією утворення кристалічної решітки окису натрію; тому спорідненість літію до кисню вище, ніж спорідненість натрію та інших елементів до кисню. У той же час енергії освіти кристалічної решітки хлоридів літію та інших лужних металів досить близькі за значеннями. Але оскільки іонізаційні потенціали зменшуються в ряду Li – Cs, інші метали витісняють літій з його хлоридів:
LiCl + Cs = CsCl + Li
LiCl + K = KCl + Li
Отже, спорідненість лужних металів до хлору збільшується від Li до Cs.
Коли ми говоримо про хімічні властивості елемента, то вказуємо його валентність, здатність з'єднуватися з іншими елементами або витісняти елементи з їх; сполук. Практично ці ж властивості відносяться і. до простого речовини, оскільки його матеріальною основою є атоми елементів. Але хімічні властивості; простого речовини можуть в деяких межах змінюватися в залежності від зовнішніх умов. Наприклад, кисень при кімнатній температурі є досить інертною речовиною і в реакції з металами вступає повільно. Однак при високих температурах це активна речовина: більшість металів горить в кисні алюміній, навіть мелкораздробленного, покритий окисной плівкою, на повітрі досить стійкий, Насправді він дуже активний по відношенню до кисню. Так, наприклад, порошкоподібний алюміній, який не має окисної плівки, застосовуваний для отримання алюмоорганічних сполук, спалахує на повітрі. Таким чином, швидкість реакцій не завжди може служити критерієм хімічної активності. Більш правильно визначати хімічну активність на підставі реакцій витіснення і теплоти, що виділяється при реакціях.
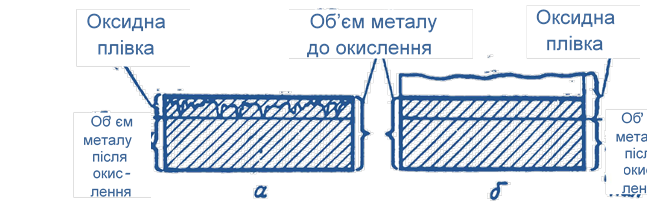
Мал. 19. Утворення окисної плівки: а – на лужних і лужноземельних металах; б – на інших металах.
Нижче наводяться дані, що говорять про високу хімічну активність лужних металів і невисокою – металів підгрупи міді.
Ставлення до кисню. Всі лужні метали швидко окислюються на повітрі. Блискучий свіжий зріз металу вже через кілька секунд або хвилин тьмяніє і покривається плівкою продуктів окислення. Швидкість окислення зростає зі збільшенням атомних мас.
Чому ж окисні плівки на лужних металах не є захисними, а на олові, цинку, алюмінії і деяких інших металах вони захищають метали від подальшого окислення?
Пояснюється ця особливість тими властивостями, які мають тільки лужні і лужноземельні метали. Як було виявлено, метали, стійкі на повітрі, мають міцну окисну плівку, добре зчеплену з основним металом. Така окісна плівка займає більший обсяг у порівнянні з обсягом окисленого металу (мал. 19). У лужних і лужноземельних металів окісна плівка займає менший обсяг у порівнянні з обсягом окисленого металу. Внаслідок зменшення обсягу вона не закриває поверхню і в ній є глибокі тріщини, проник кається до неокисленного металу. Можна підрахувати як ставиться обсяг отриманого оксиду до обсягу окисленого металу. Припустимо, при окисленні літію вийшов 1 кмоль окису літію Li2O. Його обсяг дорівнює масі кіломоля, поділеній на щільність оксиду, тобто. VLi2O = 29,88 : 2013 = 0,001484 (м3),
Обсяг окисленого металу, т. Е. Обсяг 2 кг-атом літію, дорівнює масі, поділеній на щільність металу:
V2Lі = 2 6,94: 534 = 0,002617 (м3)
Отже, при окисленні 26,17 м3 літію отримаємо всього 14,84 м3 окису літію. Таким чином, обсяг отриманого оксиду менше обсягу окисленого металу в 0,56 рази (14,84 : 26,17). Нижче, в таблиці 6, наведено відносшення обсягів оксидів до обсягу окисленого металу.
Як випливає з наведених даних, все метали можна розділити на дві великі групи. У одних це відношення обсягів менше одиниці. Такі метали нестійкі на повітрі, так як окісна плівка не захищає їх. У інших металів воно більше одиниці, тобто. Утворення окисної плівки у них відбувається зі збільшенням обсягу. Окісна плівка, що утворюється на цих металах, в тій чи іншій мірі захищає їх від окислення. Таблиця 6
|
Метали |
Оксиди |
Vок
Vмет |
Метали |
Оксиди |
Vок
Vмет |
|
Li |
Li2О Na2О К2О |
0,56 |
Cu |
Cu2О ZnO А12О3 |
1,57 |
|
Na |
0,57 |
Zn |
1,58 |
||
|
К |
0,44 0,43 0,52 |
A1 |
1,27 1,04 1,95 |
||
|
Rb |
Rb2О |
Sn |
SnO |
||
|
Cs |
Cs2О |
Ті |
TiО2 |
||
|
Са |
CaO SrO |
0,64 |
Cr |
Cr2O3 Fe3О4 |
1,94 |
|
Sr |
0,65 0,68 |
Fe |
2,13 1,52 |
||
|
Ва |
BaO |
Ni |
NiO |
Оксидна плівка, що утворюється на лужних металах, має невелику хімічну стійкість. З парами води вона вступає в реакцію:
Na2О + H2О = 2NaОH
Двоокис вуглецю, завжди наявна в атмосфері, також вступає в реакцію з оксидами і гідроокисами лужних металів, наприклад:
2NaOH + СО2 = Na2CО3 + H2О
Пара, що утворюється з води діє на поверхню металу і прискорює окислення:
2Na + 2Н2О = 2NaOH + H2↑
Виділення водню легко спостерігати при окисленні металу на повітрі. Якщо невеликий шматочок натрію, очищене від оксидів, залишити на повітрі, то він через деякий час спочатку покриється сірою плівкою, потім ця плівка робиться вологою, і на ній в окремих місцях з'являться невеликі пухирці водню.
При окисленні лужних металів на повітрі вони можуть загорятися. Цікаво відзначити, що здатність до самозаймання посилюється від літію до цезію, незважаючи на те що активність взаємодії цих металів з киснем збільшується від цезію до літію. У таблиці 7 наведені теплоти утворення окислів елементів I групи, розраховані в кілоджоулях на 1 кг-екв оксиду.
Таблиця 7 Теплоти утворення оксидів з елементів (при 25°С)
|
Оксиди |
Теплота утворення, кдж |
Оксиди |
Теплота утворення, кдж |
|
Li2О |
297691 І |
|
|
|
Na2О |
208070 |
Ag2O |
15200 |
|
К2О |
180330 |
Cu2O |
84935 |
|
Rb2О |
173426 |
Au2O3 |
13400 |
|
Cs2О |
171753 |
|
|
Це явище пов'язане як зі збільшенням проникності окисної плівки від літію до цезію, так і зі зменшенням температур плавлення. Рубідій і цезій є настільки легкоплавкими металами, що теплоти, що виділяється при їх окисленні, цілком достатньо для того, щоб перевести їх в рідкий стан. Рідкі метали окислюються дуже легко, тому рубідій і цезій на повітрі спалахують.
З таблиці 7 видно, що найбільшою активністю до кисню має літій. Це легко перевірити дослідним шляхом. Якщо змішати дрібно нарізаний літій з яким-небудь оксидом лужного металу, помістити в вакуум і нагріти (мал. 20), то відбудеться реакція витіснення лужного металу, що супроводжується виділенням великої кількості теплоти:
2Li + Cs2О Li2О + 2Cs + Q
2Li + K2О = Li2О + 2K + Q
Реакція з оксидами натрію, калію, заліза і цезію протікає настільки бурхливо і з таким великим виділенням теплоти, що виходять лужні метали переходять в пар і реакційна маса розбризкується. Таким чином, з лужних металів найбільшою активністю по відношенню до кисню має літій, так як він легко витісняє інші лужні метали з їх оксидів.
![]() Метали підгрупи міді, на Мал.
20. Витіснення лужних металів літієм
Метали підгрупи міді, на Мал.
20. Витіснення лужних металів літієм
відміну від лужних металів, проявляють до кисню незначну активність. Так само як і у лужних металів, активність зі збільшенням атомних мас в підгрупі міді падає. Золото і срібло на повітрі і в кисні зовні не змінюються, тому вважають, що з киснем золото і срібло в реакції не вступають ні при яких температурах. Насправді, як показали електронографічні дослідження, на цих металах утворюється найтонша окісна плівка, пов'язана з молекулами кисню електростатичними силами. Мідь, як відомо, у вологому повітрі поступово окислюється і покривається плівкою зеленуватого кольору, що складається з основних карбонатів міді;
2Cu + O2 + H2O + CO2 = Сu2(OH)2CO2
![]() У сухому повітрі
окислювання йде дуже повільно, на поверхні міді утворюється
найтонший шар закису міді:
У сухому повітрі
окислювання йде дуже повільно, на поверхні міді утворюється
найтонший шар закису міді:
4Cu + О2 + 2Cu2O
Зовні мідь при цьому не змінюється, так як закис міді, як і мідь, рожевого кольору. До того ж шар закису настільки тонкий, що пропускає світло, тобто просвічується. Інакше мідь окислюється при нагріванні, наприклад при 600-800°С. У перші секунди окислювання йде до закису міді, яка з поверхні перетворюється на окис міді чорного кольору. Утворюється двошарове окисне покриття (мал. 21). Шар окису міді починає виходити тільки після утворення шару закису товщиною в 250000-300000 нм.
Цікава особливість є у чистого срібла, яка була виявлена ще в давнину. Виливки зі срібла завжди виходили нерівними, з великою кількістю бульбашок на поверхні. Виявляється, розплавлене срібло добре розчиняє кисень – в 1 г металу розчиняється близько 11 см3 кисню. При застиганні розплавленого срібла відбувається виділення кисню, що супроводжується розбризкуванням металу; тому для приготування виливків застосовується не чисте срібло, а його сплави. Дещо поіншому поводиться по відношенню до кисню золото. Розплавлене золото майже не розчиняє кисень, а при температурі 400-450°С золото здатне розчиняти до 40 обсягів кисню.
Збільшення тиску також сприяє утворенню оксидів. Так, срібло при 300-400°С і при 20 ат можна без остачі перетворити в окис срібла:
4Ag + О2 = 2Ag2О
Якщо ж знизити тиск до атмосферного, окис срібла при вказаній температурі перетворюється в мелкодисперсное срібло.
Взаємодія з водою. Всі лужні метали енергійно взаємодіють з водою, утворюючи луг і водень:
2Na+2Н2О = 2NaOH + H2↑
За рахунок теплоти, що виділяється вони плавляться, і краплі розплавленого металу швидко, з шипінням переміщаються по поверхні води. Це рух пов'язано з нерівномірним виділенням водню, який і штовхає в різні боки плаваючий метал.
Зі збільшенням атомних мас металів кількість теплоти, що виділяється при утворенні гидроокисей, зменшується (табл. 8).
Таблиця 8 Теплоти утворення гидроксидів лужних металів в розрахунку на 1 кг-екв
|
Елемен- ти |
Атомна маса |
Речови- ни |
Теплота утворення, кдж |
Елемен- ти |
Атомна маса |
Речови- ни |
Теплота утворення, кдж |
|
Li |
7 |
LiOH |
487,22 |
Rb |
85 |
RbOH |
413,79 |
|
Na |
23 |
NaOH |
426,72 |
|
|
|
|
|
К |
39 |
КОН |
425,84 |
Cs |
133 |
CsOH |
406,68 |
У той же час швидкість взаємодії цих металів з водою посилюється зі збільшенням атомних мас. Наприклад, літій вступає в реакцію з водою повільно, натрій – швидко. Реакція з калієм і особливо з рубідій і цезієм протікає настільки інтенсивно, що виділяється водень спалахує. Ці особливості можна пояснити різною розчинністю утворюються гидроокисей, температурою плавлення металів і ставленням до кисню. Розчинність гідроксидів у воді зі зростанням атомних мас збільшується. Гідроокис літію розчинна гірше інших лугів, тому вона накопичується в шарі, що примикає безпосередньо до металу, який взаємодіє з водою. Краще за всіх розчинна гідроокис цезію, і це одна з причин, чому цезій особливо бурхливо реагує з водою. Треба думати, що деякий вплив робить також і зменшення температури плавлення від літію до цезію. Наприклад, літій плавиться при 180°С, а цезій – при 28,6°С; тому досить невеликої кількості теплоти, що виділяється при взаємодії рубідію і цезію з водою, щоб розплавити ці метали. Рейкціъ ж з розплавленими металами протікають набагато швидше.
Під час взаємодії лужних металів з водою відбувається також і окислення їх киснем повітря.
![]() Якщо виключити вплив кисню,
то натрій взаємодіє з водою навіть більш бурхливо, ніж калій. Це легко показати
на наступному простому досвіді. У дві пробірки наливають рівну кількість води і
гасу. В одну з пробірок поміщають шматочок натрію завбільшки з невелику
горошину, а в іншу - такий же шматочок калію. Про інтенсивність реакції можна
судити за кількістю що утворюється водню. Легко помітити, що
більше водню виділяється при взаємодії НЕ калію, а натрію, і натрій взаємодіє з
ВОДОЮ в ЦИХ умовах більш інтенсивно, ніж калій (мал. 22), так як при утворенні
окису натрію, а потім гідроксиду натрію виділяється більше енергії. Коли ж ці
метали стикаються зверху не з гасом, а з повітрям,
калій розігрівається більш сильно, що і викликає самозаймання виділяється
водню.
Якщо виключити вплив кисню,
то натрій взаємодіє з водою навіть більш бурхливо, ніж калій. Це легко показати
на наступному простому досвіді. У дві пробірки наливають рівну кількість води і
гасу. В одну з пробірок поміщають шматочок натрію завбільшки з невелику
горошину, а в іншу - такий же шматочок калію. Про інтенсивність реакції можна
судити за кількістю що утворюється водню. Легко помітити, що
більше водню виділяється при взаємодії НЕ калію, а натрію, і натрій взаємодіє з
ВОДОЮ в ЦИХ умовах більш інтенсивно, ніж калій (мал. 22), так як при утворенні
окису натрію, а потім гідроксиду натрію виділяється більше енергії. Коли ж ці
метали стикаються зверху не з гасом, а з повітрям,
калій розігрівається більш сильно, що і викликає самозаймання виділяється
водню.
Взаємодія натрію може йти і без займання водню, якщо беруть шматочки натрію Не більше горошини. Взаємодія великих шматків натрію часто супроводжується сильними вибухами гримучої суміші (суміші водню і кисню).
По відношенню до води і водних розчинів солей лужні метали найактивніші, так як в електрохімічних ряду напруг вони стоять на самому початку:
Li+ Rb+ К+ Cs+ Ва2+ Sr2+ Са2+ Na+
–3,045 –2,93 –2,925 –2,92 –2,90 –2,89 –2,87 –2,714
Mg2+ Al3+ Mn2+ Zn2+ Fe2+ Со2+ Nі2+
–2,37 –1,66 –1,18 –0,763 –0,440 –0,277 –0,250
Sn2+ Pb2+ 2Н Sb3+ Bi3+ Cu2+ Hg2+
–0,136 –0,126 +0,00 +0,20 +0,23 +0,337 +0,80
Ag+ Au+
+ 1,68 +1,50
![]() Цей ряд
був встановлений при вивченні гальванічних елементів. Цифри, які стоять під
символом елемента, - нормальні електродні потенціали (в
вольтах). Розглянемо ланцюга з деяких гальванічних елементів, наприклад
з залізного і мідного електродів (мал. 23). Перший електрод являє собою
залізну пластинку, занурену в 1 н. розчин залізного купоросу. Другим електродом
є мідна пластинка, занурена в 1 н. розчин мідного купоросу. Обидві осередки
з'єднані між собою містком – скляною трубкою, наповненою розчином хлориду
калію. Якщо з'єднати електроди за допомогою провідника електричного струму, то
від залізного електрода до мідного підуть електрони. Вони з'являються за
рахунок того, що атоми заліза втрачають
Цей ряд
був встановлений при вивченні гальванічних елементів. Цифри, які стоять під
символом елемента, - нормальні електродні потенціали (в
вольтах). Розглянемо ланцюга з деяких гальванічних елементів, наприклад
з залізного і мідного електродів (мал. 23). Перший електрод являє собою
залізну пластинку, занурену в 1 н. розчин залізного купоросу. Другим електродом
є мідна пластинка, занурена в 1 н. розчин мідного купоросу. Обидві осередки
з'єднані між собою містком – скляною трубкою, наповненою розчином хлориду
калію. Якщо з'єднати електроди за допомогою провідника електричного струму, то
від залізного електрода до мідного підуть електрони. Вони з'являються за
рахунок того, що атоми заліза втрачають
електрони і переходять в розчин у вигляді іонів:
Fe – 2ē → Fe2+
Електрони ж по провіднику переходять до мідного електрода. На цьому електроді іони міді, наявні в розчині, приєднують електрони і перетворюються в атоми:
Cu2+ + 2ē → Cu Отже, на мідному електроді буде виділятися мідь.
Якщо в ланцюг включити чутливий вольтметр з дуже великим опором, то він покаже напругу, рівну - 0,78 в.
Цю ж величину легко отримати з вище наведеного електрохімічного ряду напруг, якщо з нормального електродного потенціалу заліза відняти нормальний електродний потенціал міді: –0,44 в – (+0,34 в) = –0,78 в.
![]() Для визначення нормальних
електродних потенціалів знаходять напруга не по відношенню до мідного
електрода, а по відношенню до водневого. Водневий електрод - це платинова
пластинка, занурена в розчин сірчаної кислоти і омивається струмом чистого
водню. Якщо виміряти напругу між водневим електродом і між водневим електродом
і залізним (мал. 24), то це напруга буде дорівнювати –44 в (див.
Електрохімічний ряд напруг). Отже, при визначенні нормальних електродних
потенціалів потенціал водневого електрода приймається рівним нулю.
Для визначення нормальних
електродних потенціалів знаходять напруга не по відношенню до мідного
електрода, а по відношенню до водневого. Водневий електрод - це платинова
пластинка, занурена в розчин сірчаної кислоти і омивається струмом чистого
водню. Якщо виміряти напругу між водневим електродом і між водневим електродом
і залізним (мал. 24), то це напруга буде дорівнювати –44 в (див.
Електрохімічний ряд напруг). Отже, при визначенні нормальних електродних
потенціалів потенціал водневого електрода приймається рівним нулю.
Нормальні електродні потенціали лужних металів були визначені таким, же способом. Але в якості електродів брали не чисті метали, а їх амальгами, тобто сплави з ртуттю. Після визначення різниці потенціалів між водневим електродом і амальгамою виробляли перерахунок з урахуванням концентрації лужного металу.
Як випливає з електрохімічного ряду напруг, на самому початку його знаходиться літій. Валентний електрон у літію пов'язаний з атомом міцніше, ніж у інших лужних металів. У той же час літій, опущений в воду, легше переходить в іони в порівнянні з іншими лужними металами, так як його електродний потенціал дорівнює –3,045 в:
Li – ē → Li+
Пояснюється це тим, що його іон має сильне електричне поле невеликих розмірів. Тому він збирає навколо себе велику кількість молекул води – близько 300 молекул. Кажуть, що іон літію добре гідратіруется, а іони інших лужних металів гидратируются гірше.
Метали підгрупи міді стоять в кінці електрохімічного ряду напруг, після іона водню. Отже, ці метали не можуть витісняти водень з води. У той же час водень та інші метали можуть витісняти метали підгрупи міді з розчинів їх солей, наприклад:
Fe + CuCl2 = Cu + FeCl2
Pb + 2AgNО3 = 2Ag + Pb(NО3)2
3H2 + 2AuC13 = 2Au + 6HCl
Ці реакції - окислювально-відновні, так як відбувається перехід електронів, наприклад залізо віддає електрони міді і т. Д .:
Fe – 2ē → Fe2+
![]() Cu2+
+ 2ē → Cu0
Cu2+
+ 2ē → Cu0
Молекулярний водень витісняє метали підгрупи міді з великими труднощами. Пояснюється це тим, що зв'язок між атомами водню міцна і на її розрив витрачається багато енергії. Реакція ж йде тільки з атомами водню.
![]() Мал. 25.
Відновлення платини воднем Реакції витіснення платини, золота,
Мал. 25.
Відновлення платини воднем Реакції витіснення платини, золота,
(дослід М.М.Бекетова) срібла воднем були вперше проведені
Н.Н.Бекетовим в 1856 р Для проведення
реакції він використовував товстостінну скляну трубку, тиск водню в якій створювалося за рахунок взаємодії цинку з кислотою (мал. 25). Водень найлегше відновлював платину. Мідь, як випливає з електрохімічного ряду напруг, повинна відновлюватися найгірше і в описаних умовах вона взагалі не виділялася. Згодом деякі досліди з відновлення іонів металів воднем були поставлені В.Н.Іпатьєва. Як виявилося, мідь з розчинів її солей відновлюється воднем тільки під тиском близько 2000 ат:
CuSО4 + Н2 = Сu + H2SО4
Метали підгрупи міді при відсутності кисню з водою практично не взаємодіють. У присутності кисню мідь повільно взаємодіє з водою і покривається зеленої плівкою гідроксиду міді і основного карбонату:
2Cu + О2 + 2H2О + 2Cu(ОН)2
2Сu + О2 + Н2О + СО2 = Сu2(ОН)2СО3
Срібло з аналогічним реакцій переходить (у незначній кількості) в розчин у вигляді гідроксиду срібла AgOH. Якщо ж вода містить іони хлору, то в розчині утворюється хлорид срібла AgCl. Оскільки розчинність цих речовин незначна, концентрація іонів срібла в розчині також невелика. Золото з чистою водою практично не взаємодіє.
Таким чином, між лужними металами і металами підгрупи міді по відношенню до води є великі відмінності, що видно і з їх положення в електрохімічному ряду напружень. Слід зауважити, що даний ряд напруг застосуємо тільки до водних розчинів.
Ставлення до галогенів і деяким іншим неметаллам. Відомо, що одній метали взаємодіють з галогенами при кімнатній температурі, інші – тільки при нагріванні. Наприклад, порошок сурми, висипаний в циліндр з хлором, легко загорається і згоряє. У той же час лужні метали (за винятком рубідію і цезію) залишаються в атмосфері хлору без видимих змін, незважаючи на велику спорідненість цих металів до галогенів. Це цікаве явище можна пояснити різними температурами плавлення продуктів реакції – хлоридів. При внесенні натрію в атмосферу хлору відразу ж утворюється щільна плівка хлориду натрію, яка не випаровується з поверхні натрію (хлорид натрію плавиться при температурі 800°С). На поверхні сурми утворюється триххлорид сурми SbCl3, що легко випаровується вже при кімнатній температурі, тому продукти реакції не захищають сурму від дії хлору. Якщо ж шматок лужного металу нагріти і тут, же внести в атмосферу хлору, то піде бурхлива реакція, що протікає з виділенням великої кількості теплоти. Таке різне поведінку металу на холоді і при високій температурі пояснюється наступним. При нагріванні реакція починається бурхливо, і вже в перші секунди теплоти виділяється на поверхні натрію більше, ніж її розсіюється в навколишньому просторі. Це викликає сильне підвищення температури натрію і продукту реакції – хлориду натрію. Обидва ці речовини переходять в пар, і тому реакція йде бурхливо. Коли ж реакція протікає на холоді, невелика кількість теплоти, що виділилася за .рахунок, утворення тонкої плівки хлориду натрію, розсіюється в просторі, поглинається натрієм і реакція припиняється, так як витрата теплоти майже дорівнює її вступу.
З усіх металів лужні мають найбільшу активність по відношенню до галогенів. Нижче, в таблиці 9, наведені дані по теплотам освіти деяких хлоридів, розраховані на 1 кг-екв.
Таблиця 9
|
Речовини |
Теплота утворення, кдж |
Речовини |
Теплота утворення, кдж |
|
CsCl |
444800 |
СrСl3 |
215600 |
|
KCl |
435800 |
ZnCl2 |
207700 |
|
ВаС12 |
429400 |
CdCl2 |
194700 |
|
SrCl2 |
413900 |
PbCl2 |
178800 |
|
NaCl |
411400 |
FeCl2 |
171300 |
|
LiCl |
408500 |
CuCl |
134300 |
|
СаС12 |
398700 |
FeCl |
130400 |
|
MgCl2 |
320700 |
AgCl |
127000 |
|
МnС12 |
233400 |
CuC12 |
111700 |
|
AlCl3 |
232600 |
AuCl |
35100 |
Як видно з наведеного ряду теплот утворення хлоридів, лужні метали починають цей ряд. Найменш пробними є хлориди міді, срібла і золота. Якщо змішати хлорид міді з дрібно порізаними неокисленими калієм або натрієм і трохи підігріти, то вийде мідь і відповідний хлорид:
CuCl2 + 2Na = 2NaCl + Сu
Порядок розташування елементів в таблиці утворення хлоридів дещо нагадує порядок їх розташування в електрохімічному ряду напруг, хоча і є деякі відмінності. Наприклад, літій розташований не на початку ряду, а після всіх лужних металів, кальцій – після натрію, марганець – перед алюмінієм, свинець – перед залізом і т. д. Цей ряд можна назвати поруч активності металів за відношенням до хлору.
Приблизно так само змінюється активність металів по відношенню до інших галогенів, а також до сірки. І в цих випадках лужні метали є найактивнішими, і, отже, витісняють інші метали з галогенідів і сульфідів. З рідким бромом літій і натрій активно вступають в реакцію, але на поверхні утворюється плівка, яка затримує подальший розвиток реакції. Калій, рубідій і цезій, кинуті в рідкий бром, вступають з ним в реакцію з вибухом. Вибухи з розкиданням палаючого металу спостерігаються при спільному розтиранні металів і сірки.
Метали підгрупи міді також добре вступають в реакцію з галогенами, але з меншим виділенням теплоти. При дії галогенів при кімнатній температурі видимих змін не відбувається, але на поверхні спочатку утворюється шар адсорбованих молекул, а потім і найтонший шар галогенидов. При нагріванні реакція з міддю протікає дуже бурхливо. Нагріємо мідну зволікання або фольгу і опустимо її в гарячому вигляді в банку з хлором – близько міді з'являться бурі пари, що складаються із суміші хлориду міді (II) СuСl2 з домішкою хлориду міді (I) CuCl.
Реакція протікає мимовільно, за рахунок теплоти, що виділяється.
Срібло під дією галогенів при нагріванні покривається тонкою плівкою галогенідів, наприклад хлориду срібла AgCl, яка захищає метал від подальшого впливу галогенів.
На золото хлор в присутності води діє вже при кімнатній температурі. Така низька стійкість золота до хлорного воді пояснюється тим, що іони золота дають вельми стійкий, складно побудований іон [АuСl4]–, а катіонів золота Аu3+ у водному розчині практично немає. При дії хлорної води в розчині утворюється золотохлористоводнева кислота Н[АuСl4]. Очевидно, реакція йде в дві стадії: 2Au + 3Cl2 = 2AuCl3
AuC13 + HC1 = Н[АuСl4].
При нагріванні близько 200 ° С золото з хлором дає хлорид золота AuC13. При нагріванні до 300°С він розкладається:
AuC13 = AuC1 + C12
При подальшому нагріванні відбувається розкладання хлориду на елементи.
Розділ V
Видобуток і отримання солей лужних металів і металів підгрупи міді з природних родовищ
Видобуток хлориду натрію (кухонної солі) і хлориду калію. Величезні запаси кам'яної солі виникли в доісторичні епохи в результаті висихання стародавніх морів на місці сучасних міст Слов’янська та Бахмута. В окремих місцях на планеті шар кухонної солі доходить до декількох кілометрів.
У великих кількостях кухонну сіль добувають в пониззі Волги, зокрема з озер Баскунчак і Ельтон. Оскільки сіль лежить в цих озерах багатометровим шаром, її просто вичерпують екскаваторами і вантажать у вагони залізниці, прокладеної прямо череа озеро. Спершу праця з видобутку солі була виключно ручною, згодом її змінили екскаватори. В наш час при видобутку солі використовують Солекомбайни (мал. 26). Це високопродуктивні машини, які розробляють пласт солі на глибину до. 8 м і дають до 180 т солі на годину. Зараз ручна праця, практично зникла, що дозволило різко збільшити видобуток солі.
Мал. 26. Солекомбайн
У деяких країнах майже всю кухонну сіль отримують випаровуванням океанської води. В Україні так добувають сіль з Чорного моря (в районі Євпаторії) і а також з озера Сиваш.

Мал. 27. Добування солі з озера Сиваш
Раніше кухонну сіль добували на соляних копальнях шахтним шляхом з соляних печер, як кам'яне вугілля. В даний час все більшого поширення набуває інший спосіб: сіль розчиняють безпосередньо під землею, розсіл викачують на поверхню і кристалізують.
Поряд з кухонною сіллю в великих кількостях добувають і хлорид калію. Він зустрічається головним чином у вигляді мінералу сильвініту NaClKCl – суміш двох солей. Хлорид калію відокремлюють від хлориду натрію перекристаллизацией, що засноване на різній розчинності цих солей (табл. 10).
Як випливає з наведених даних, при 110°С в 1000 г води розчинено 253 г хлориду натрію і 390 г хлориду калію. Якщо такий розчин охолодити до 10°С, то з нього випаде 390 – 127 = 263 г хлориду калію. Кухонна сіль з розчину не випадає.
Практично в промисловості поділ солей ведуть у такий спосіб (мал. 27). Сильвініт розмелюють і обробляють при нагріванні лугом – розчином солей натрію і калію. Потім отриманий розчин фільтрують і охолоджують. Випав хлорид калію фільтрують, а фільтрат (луг) знову направляють на розчинення сильвініту. Кухонна сіль не розчиняється і залишається в залишку.
Таблиця 10 Спільна розчинність хлоридів натрію і калію в 1000 г води при різних температурах
|
Температура, °С |
Розчинність в 1000 г води |
|
|
хлориду натрію, г |
хлориду калію, г |
|
|
10 |
297 |
127 |
|
30 |
287 |
171 |
|
50 |
277 |
220 |
|
70 |
268 |
273 |
|
90 |
261 |
329 |
|
110 |
253 |
390 |
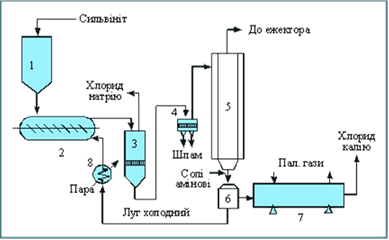
Мал. 28 Технологічна схема отримання хлориду калію із сильвініту галургічним методом:
1 — бункер сильвініту, 2 — шнековий змішувач, 3 — план-фільтр для відділення хлориду натрію, 4 — відстійник, 5 — вакуум-кристалізатор,
6 — центрифуга, 7 — барабанна сушарка, 8 — підігрівач лугу
Отримання солей літію, рубідію і цезію. Оскільки літієві руди містять порівняно небагато літію (близько 1%), їх завжди піддають збагаченню.
Застосовують термічний розклад руд і флотационное збагачення. Руду нагрівають приблизно до 1000°С і охолоджують. При цьому внаслідок відмінностей у коефіцієнтах розширення відбувається механічне руйнування руди за рахунок виникаючої напруги і відділення мінералів від порожньої породи. Для флотаційного збагачення руду подрібнюють, змішують з водою і через суспензію, після добавки флотореагентов, пропускають при перемішуванні повітря. Як флотореагента використовують олеїнову кислоту, а в якості піноутворювача – нафтенові кислоти. На 1 т руди беруть близько 200 г реагентів. Разом з піною спливають частинки з'єднань літію. Їх збирають, віджимають на фільтрпресі і отримують літієвий концентрат. Його нагрівають з сірчаною кислотою, отримують розчин сірчанокислих солей, що включають сульфат літію. Осаджують сіль літію содою:
Li2SО4 + Na2CО3 = Na2SО4 + Li2CО3↓
Карбонат літію погано розчинний, він випадає в осад. Очищають карбонат, пропускаючи через його водну суспензію двоокис вуглецю:
Li2СО3 + CО2 + H2О = 2LiHCО3
Утворюється добре розчинна кисле сіль. Її розчин профільтровивают і нагрівають:
2 LiНСО3 = Li2CО3↓ + CО2 + Н2О
При цьому знову випадає нерозчинний, але вже чистий карбонат літію. Ця сіль є вихідною для отримання інших сполук літію.
Отримання солей рубідію і цезію з природних сполук – складний процес. Їх, як правило, отримують як побічний продукт при отриманні інших солей. Наприклад, при кислотній переробці руд літію (див. вище) виходить сірчанокислий розчин різних солей. Для видалення солей калію і алюмінію розчин випарюють. При цьому випадають алюмокалієві галун, які містять також алюморубідіевие і алюмоцезієві галуни. Їх відокремлюють від солей калію дробової кристалізацією. Іншим джерелом для отримання сполук цих рідкісних елементів є карналліт, в якому рубідію 0,015-0,0370%, а цезію ще менше.
Отримання солей міді і золота з природних сполук. Близько 15% всіх руд міді переробляють гідрометалургійним методом – на подрібнену руду діють розчинником, який переводить мідь в розчин. На руди, що містять оксид міді, діють розведеною сірчаної кислотою:
CuО + H2SО4 = CuSО4 + H2О
У порівнянні з багатьма іншими оксидами, зустрічаються в руді, окис міді розчиняється порівняно добре. Виділення металевої міді з розчину проводять електролізом.
Якщо мідь перебуває в руді у вигляді сульфіду, то її в розчин можна перевести, обробляючи руду розчином сульфату заліза:
Cu2S + 2Fe2(SО4)3 = 4FeSО4 + 2CuSО4 + S
Для вилучення золота, що знаходиться в гірських породах у вигляді дрібних включень, часто застосовують ціанідний метод. Цей метод був запропонований П.Р.Багратіоном. Метод полягає в пропущенні через руду розведеного розчину ціаніду калію або ціаніду натрію в присутності кисню. При цьому золото переходить в розчин у вигляді складної сполуки:
4Au + 8KCN + 2H2О + О2 = 4К[Au(CN)2] + 4КОН
Перехід золота в розчин, очевидно слід пояснити наступним. Якщо золото (як і срібло) потримати у воді, що містить солі, то через деякий час в розчин перейде незначна кількість золота. Внаслідок хімічної інертності золота цей процес скоро припиниться – гальмуватимуть, перехід золота в розчин будуть іони золота. Якщо ці іони якимось способом видаляти, то процес розчинення піде неперервно. Ціаніди пов'язують іони золота в міцний комплексний іон, тобто. як би видаляють вільні іони з розчину; тому ціаніди і розчиняють золото. Виходячи зі сказаного, розчиняти золото повинні і інші речовини, що дають міцні сполуки з іонами золота, наприклад тіосечовина.
Золото з розчинів ціанідів легко витісняється багатьма більш активними металами, наприклад цинком:
2К[Au(CN)2] + Zn = К2[Zn (CN)] + 2Au Золото випадає у вигляді найтоншого порошку.
У розчинах ціанідів добре розчиняється і срібло, але цей метод для видобутку срібла не застосовують.
Розділ VІ
Отримання металів І групи
Сировина для отримання металів. В якості вихідних речовин для отримання лужних металів I групи використовують їх солі, а в деяких випадках - гідроксиду. Для отримання натрію і калію використовують хлорид натрію і хлорид калію, які в природі зустрічаються в чистому вигляді. Солі інших металів отримують при хімічній, переробці природного сировини.
Отримання металів методом електролізу. При пропущенні постійного електричного струму через водні або неводні розчини речовин або через їх розплави на електродах йдуть хімічні реакції: на аноді - окислення, а на катоді – відновлення. Цей окислювально-відновний процес, що протікає на, електродах під дією електричного струму, носить назву електролізу.
В даний час електроліз широко застосовують для отримання найрізноманітніших речовин, зокрема для отримання металів I групи. Однак використовувати для цієї мети водні розчини солей можна. Пояснюється це становищем даних металів в електрохімічному ряді напруг – вони все розташовані лівіше водню і здатні відновлювати водень з його іонів, – тому при електролізі водних розчинів солей на катові де розряджаються в першу чергу іони водню: Н+ + ē = Н
Н + Н = Н2
Іони активних металів, наприклад Na+, К+ та інші, також, рухаються під дією струму до катода. Але вони не відновлюються і з гідроксильними іонами води дають лугу. Так йде процес, коли в якості електрода взяти ртуть, то іони лужних металів розряджаються легше, так як виділяється метал дає з ртуттю сплав, який називається амальгамою.
![]() Отримати амальгаму лужних металів легко навіть в умовах
шкільної лабораторії. Для цього в широкий лочних металів, стакан або чашку
наливають водний розчин солі, наприклад сульфат натрію або хлорид натрію (мал.
28). Потім в стакан з розчином поміщають невеликий стаканчик з ртуттю. Для
підведення електричного струму в ртуть опускають провід з пластмасовим
покриттям (або ізолюють його скляною трубкою). Кінець дроту оголюють. Як анода
краще взяти вугільний або графітовий стрижень, так як залізний електрод під
впливом виділяється хлору буде розчинятися.
Отримати амальгаму лужних металів легко навіть в умовах
шкільної лабораторії. Для цього в широкий лочних металів, стакан або чашку
наливають водний розчин солі, наприклад сульфат натрію або хлорид натрію (мал.
28). Потім в стакан з розчином поміщають невеликий стаканчик з ртуттю. Для
підведення електричного струму в ртуть опускають провід з пластмасовим
покриттям (або ізолюють його скляною трубкою). Кінець дроту оголюють. Як анода
краще взяти вугільний або графітовий стрижень, так як залізний електрод під
впливом виділяється хлору буде розчинятися.
Потім до електродів підключають електричний струм напругою 5-10 ст. Через кілька хвилин електроліз припиняють, стаканчик з ртуттю виймають і амальгаму ртуті обережно переливають її пробірку з водою. При цьому можна бачити, як з поверхні ртуті будуть підніматися бульбашки водню. Їх поява пояснюється тим, що натрій, розчинений в ртуті, вступає в реакцію з водою:
2Na + 2Н2О = 2NaOH + Н2↑
![]() Наявність лугу легко
довести, додавши в пробірку розчин фенолфталеїну – відразу ж з'явиться малинове
забарвлення. Ртуть з електролізера можна і не переливати в пробірку. Звичайно,
і в цьому випадку після виключення струму амальгама буде розкладатися, а виділення
водню пояснюється взаємодією натрію з водою.
Наявність лугу легко
довести, додавши в пробірку розчин фенолфталеїну – відразу ж з'явиться малинове
забарвлення. Ртуть з електролізера можна і не переливати в пробірку. Звичайно,
і в цьому випадку після виключення струму амальгама буде розкладатися, а виділення
водню пояснюється взаємодією натрію з водою.
Таким чином, лужні метали можна отримати електролізом водних розчинів із застосуванням ртутного катода. Метали дають амальгаму і тим самим як би ізолюються від дії води. Однак цей метод не знайшов практичного застосування в промисловості, так як в подальшому метали потрібно відокремлювати від ртуті.
У промисловості для одержання натрію і калію застосовують електроліз їх розплавлених солей. Одна з конструкцій електролізера приведена на малюнку 30. Розплавлений натрій, що виділяється на катоді спливає нагору:
Na+ + ē =Na
Оскільки щільність натрію менше
щільності електроліту, натрій спливає і автоматично переливається в збірник. У центрі електролізера знаходиться анод. Анодна і катодного простір відокремлені один від одного залізним листом у вигляді кільця, в якому є отвори.
Хлор, що виділяється на аноді:
Сl– –ē = Сl
Сl + Сl = Сl2
відводиться по іншій трубі.
Електролізер виготовляють з вогнетривкої цегли і покривають залізним кожухом. Для зменшення теплових втрат між цегляною кладкою і залізним кожухом поміщають шар азбесту.
Оскільки хлорид натрію плавиться при високій температурі (800°С), для зниження температури плавлення електроліту в нього додають хлорид кальцію (5859%). Це знижує температуру плавлення електроліту до 575-585°С. Хлорид кальцію частково також піддається електролізу, кальцій виділяється на катоді і розчиняється в розплавленому натрію. Так, при 600°С в натрії розчиняється 5,5% кальцію. Однак у міру зниження температури розчинність кальцію в натрії зменшується. Наприклад, при 97,5°С, тобто при температурі плавлення натрію, кальцію розчиняється всього 0,01%. Тому в міру охолодження натрію в відвідної труби з розплавленого металу виділяються кристали кальцію, які внаслідок більшої щільності опускаються вниз, потрапляють в електроліт і вступають в реакцію з хлоридом кальцію:
СаС12 + Са = 2СаС1
Утворений субхлорид кальцію на аноді окислюється видаляється хлором:
СаС1 + С1 = СаС12
Поряд з даними способом деяку кількість натрію отримують електролізом розплаву їдкого натру. Цей спосіб раніше був більш поширений. Електроліз розплаву їдкого натру проходить при більш низькій температурі, так як він плавиться при 318,4°С. Для зниження температури плавлення електроліту в нього додають близько 10-11% соди. В цьому випадку електроліт плавиться при 300°С. Іноді в електроліт додають хлорид натрію, що також знижує його температуру плавлення.
При електролізі розплаву їдкого натру атоми натрію приймають від катода електрони:
4Na+ + 4ē = 4Na На аноді відбувається розрядка гідроксильних іонів:
4OH– – ē = 2Н2O + O2↑
Оскільки температура плавлення їдкого натру значно нижча за температуру плавлення хлориду натрію, цей метод значно простіший. Однак економічно він менш вигідний в порівнянні з електролізом розплаву кухонної солі внаслідок дорожнечі сировини: їдкий натр значно дорожче хлориду натрію.
В наш час в усьому світі щорічно отримують близько сотні тис. т натрію.
Подібним же чином нині отримують і літій. У чистому вигляді хлорид літію плавиться при досить високій температурі 614°С. При цій температурі він випаровується, і тому в якості електроліту застосовують суміш хлориду літію з добавкою хлориду калію. При 40-відсотковому вмісті хлориду калію електроліт плавиться вже при 352°С. Виробництво літію цим методом детально розроблено Н.А.Ізгаришевим зі співробітниками. Електролізером служить чавунна ванна, викладена зсередини плитами тальку. Анодна і катодного простір поділяють перегородкою, що має отвори. Катодом служить залізний стрижень, анодом – графітовий.
Одержуваний цим методом літій містить значну кількість калію. Для очищення від електроліту літій переплавляють в парафіні, а для відділення від калію нагрівають в струмі водню до 700°С. Калій при цьому випаровується. Літій при взаємодії з воднем переходить в гідрид літію LiH, який нагрівають у вакуумі при 1000°С. При цьому водень відщеплюється, і виходить чистий літій:
2LiH = 2Li + H2
Цей спосіб отримання літію досить складний, тому літій, так само як рубідій і цезій, все в більших кількостях отримують металотермічним способом.
Електроліз широко застосовують для очищення (рафінування) металів підгрупи міді. Для очищення міді з чорнової міді відливають аноди – товсті пластини. Їх підвішують в ванну, яка містить розчин мідного купоросу. Як катодів використовують тонкі листи чистої міді, на які під час електролізу осідає чиста мідь. На аноді відбувається розчинення міді. Атоми міді віддають електрони анода і переходять в іонну стан:
Сu = Сu2++ 2ē
До анода підходять також і іони SO42–, які з іонами міді дають мідний купорос. Іони міді пересуваються до катоду, приймають від катода електрони і переходять в атоми:
Сu2++ 2ē = Сu Чиста мідь осідає на катоді.
Домішки, що входять до складу чорнової міді, поводяться по-різному. Більш електронегативні елементи - цинк, залізо, кадмій та інші розчиняються на аноді. Але на катоді ці метали не виділяються, тому що в електрохімічному ряді напруг вони знаходяться лівіше міді і мають більш негативні потенціали. При тривалій роботі ванни в розчині накопичується велика кількість сторонніх солей, особливо цинку. В цьому випадку в ванну заливають новий електроліт.
У чорнової міді в невеликих кількостях часто присутні золото і срібло. Золото, при використанні в якості електроліту розчину мідного купоросу, що не розчиняється і у вигляді дрібних крупинок осідає на дно ванни. Цей осад називають шламом. У шлам потрапляє і срібло. Оскільки срібло при електролізі переходить у вигляді сульфату в розчин, в електроліт додають невелику кількість хлоридів, наприклад кухонної солі. Іони хлору з іонами срібла дають нерозчинний хлорид срібла, який також випадає в шлам. У шлам випадають і багато інших з'єднань, наприклад селен і телур у вигляді селеніду міді Cu2Se і телуриду міді Cu2Те. У міру накопичення шламу його видаляють з ванни і піддають хімічній переробці для виділення з нього золота, срібла, селену, телуру. До складу шламу входить 12-30% Сu, 30-50% Ag, 1-4% Аu, 5-14% Se, 0,3-1,1% Тe і т. д. Іноді вартість речовин, виділених з шламу, перевищує вартість витрат, що йдуть на рафінування міді.
Деякі елементи, які в електрохімічному ряді напруг стоять близько до міді, можуть частково відновлюватися на катоді і забруднювати рафіновану мідь. До цих елементів відносяться бісмут і сурма.
Срібло і золото завжди піддають рафінування методом електролізу. В якості електроліту при очищенні срібла застосовують розчин нітрату срібла. Аноди готують з очищуваного срібла, а катоди – з чистого листового срібла. При електролізі аноди розчиняються:
Ag – ē = Ag+
Золото, яке у сріблі, як більш електро-позитивний метал, що не розчиняється і випадає в шлам. У шлам випадають сірка, селен, телур і частково сурма і вісмут. Мідь на аноді розчиняється, але на катоді вона НЕ відновлюється, так як ее Потенціал віділення більш електроотріцателен в порівнянні з сріблом. У процесі роботи в електроліті відбувається поступове Накопичення нітрату міді, и через певний час електроліт замінюють.
Для очищення золота в якості електроліту застосовують розчин хлориду золота. При електролізі домішки (мідь, срібло и т. д) перехідні із золотих анодів в розчин. На катоді віділяється только золото, так як всі інші елементи відновлюються при більш негативних потенціалах.
![]() Металотермічні
методи отримання. Поряд з електрохімічнімі методами для получейія Лужний
металів в Сейчас, годину все більшою мірою застосовують термохимические, або,
як їх назівають, металотермічніх, методи. Вперше цею метод був
запропонований Н.Н.Бекетовим в 1859 р. Згідно металотермічніх
методи були їм докладно вівчені и опісані в 1865 р в его докторської
дисертації.
Металотермічні
методи отримання. Поряд з електрохімічнімі методами для получейія Лужний
металів в Сейчас, годину все більшою мірою застосовують термохимические, або,
як їх назівають, металотермічніх, методи. Вперше цею метод був
запропонований Н.Н.Бекетовим в 1859 р. Згідно металотермічніх
методи були їм докладно вівчені и опісані в 1865 р в его докторської
дисертації.
Як відновнікі Н. Н. Бекетов вікорістовував алюміній (его в тій годину називали глінієм) и магній. Отримання барію и калію він опісує в дисертації наступний чином: «... я взявши безводного окису барію і, додають до неї деяку кількість хлористого барію, як плавня, поклали Цю суміш разом з шматка глінію в вугільний тигель и розжарював его кілька
годин. За охолодженні тигля я знайшов в ньом металевий сплав вже зовсім іншого вигляду і фізичних властівостей, ніж гліній; аналіз показав, що він перебуває на 100 год. з 33,3 барію і 66,7 глінію, або, інакше, на одну частину барію містив дві частини глінію ...
Якщо гліні відновлює барій з окису, то можна було очікувати і подібного його дії на поташ ... ». Далі він пише, що зробив досвід в зігнутому рушничному стволі, в закритий кінець якого були покладені шматки їдкого калію і глінію, при досить високій температурі здалися пари калію, велика частина яких згущувалася в холодній частині стовбура, з якої я добув кілька шматочків м'якого металу, що плаває на воді і палаючого фіолетовим полум'ям, що має, одним словом, все характерні властивості чистого металевого калію».
Згодом він отримав цим методом рубідій.
Для металотермічних методів характерно виділення при реакціях значної кількості теплоти. Типовим прикладом металотермічних реакцій є добре вивчені алюмінотермічне реакції. Їх в даний час використовують для отримання дорогих і рідкісних металів: ванадію, молібдену, хрому; а також різних сплавів, особливо з залізом: ферротитана, феррованадия, ферроцірконія і ін.
Цим методом в умовах шкільної лабораторії можна отримати мідь. Відважують 15-20 г окису міді і порошкоподібний алюміній. Кількість алюмінію розраховують за рівнянням реакції:
3СuО + 2А1 = А12O3 + 3Сu
![]() Суміш ретельно перемішують
і поміщають в тигель. Верх шихти засипають тонким шаром запальною сумішшю
перекису барію і порошкоподібного алюмінію).
Суміш ретельно перемішують
і поміщають в тигель. Верх шихти засипають тонким шаром запальною сумішшю
перекису барію і порошкоподібного алюмінію).
Для займання запальною суміші в неї вставляють стрічку магнію, яку підпалюють пальником або лучиною (рис. 31). Реакція відновлення окису міді протікає дуже бурхливо, з виділенням великої кількості теплоти.
Реакційна суміш частково розкидається; тому реакцію проводять
під тягою, прибравши з неї всі предмети. Тигель поміщають на жаровню з піском, поглибивши його в пісок. Реакцію можна проводити і в паперовому пакеті, який повністю занурюють в пісок.
Спокійніше реакція протікає, якщо в реакційну суміш додати 5-10% фториду кальцію.
Окис міді можна відновити також і порошкоподібною залізом, кількість якого розраховують відповідно до рівнянням реакції:
3СuО + 2Fe = Fe2O3 + 3Сu + Q
Експеримент проводять так само, як і при роботі з алюмінієм.
Пірометалургічний метод отримання медй і срібла. Оскільки зміст міді в експлуатованих рудах не перевищує 1,5-2%, їх піддають збагаченню, тобто відокремлюють сполуки міді від температури порожньої породи застосовуючи флотационний метод. Для цього руду розмелюють до найтоншого порошку і змішують її з водою додавши в неї попередньо флотореагенти – складні органічні речовини. Вони покривають дрібні крупинки з’єднань міді і повідомляють їм несмачиваемость. У воду додають ще речовини, створюють піну. Зателі через суспензію пропускають сильний потік повітря. Оскільки частинки (крупинки сполук міді) водою не змочуються, вони прилипають до бульбашок повітря і спливають наверх (рис. 31). Все це проводять у флотаційних апаратах. Піну, яка містить крупинки сполук міді, збирають, фільтрують, відтискують від води і висушують. Так отримують концентрат, з якого виділяють мідь. Залежно від складу руди існує кілька методів її переробки.
Сульфидную руду спочатку ліплять при вільному струмі повітря для видалення частини сірки:
2CuS+ 3О2 = 2CuO+2SО2
Цей випал проводять в механічних печах, схожих по влаштуванню на печі для випалення сірчаного колчедану. Останнім часом для цієї мети стали застосовувати випал в киплячому шарі (див. підручник «Неорганічна хімія» для школи).
Продукти випалу потім переплавляють спільно з флюсами в відбивної печі (рис. 32). При цьому протікають складні хімічні процеси, наприклад:
2CuO + 4CuS = 3Cu2S = SO2
Порожня порода, частина сульфіду і оксидів заліза
![]() переходять в шлак,
а на дні печі Мал. 32. Флотаційне збагачення мідної руди накопичується штейн –
розплав
переходять в шлак,
а на дні печі Мал. 32. Флотаційне збагачення мідної руди накопичується штейн –
розплав
сульфіду міді Cu2S і сульфіду заліза FeS. Штейн зливають з печі і переробляють в конверторі який по влаштуванню схожий на конвертор для переробки стали. Часткове видалення сірки відбувається за рахунок продувки повітря крізь розплавлений штейн:
2Cu2S + 3О2 = 2Cu2О + 2SО2
Сульфід міді і закис міді дають металеву чорнову мідь:
Cu2S + 2Cu2О = SО2 + 6Cu
![]() Вона містить близько 95-98%
міді. При подальшій переплавки на поду відбивної печі (рис. 32) вміст міді може
бути підвищено до 99,7%. Подальша очищення міді
Вона містить близько 95-98%
міді. При подальшій переплавки на поду відбивної печі (рис. 32) вміст міді може
бути підвищено до 99,7%. Подальша очищення міді
проводиться електролізом.
Більш просто переробляють
окисні руди міді, які складаються з
закису міді, окису міді і карбонатів міді (Cu2О, СuО, СuСО3 Сu(ОН)2). Ці руди після збагачення прожарюють з коксом при високій температурі:
2CuO + C = CО2 + 2Cu
Складна переробка срібних руд. Срібло, як правило, входить в невеликих кількостях до складу сірчистих руд, що містять мідь, цинк, свинець та інші кольорові метали. При переробці цих руд і виділяють срібло. Методи виділення срібла різні в залежності від вмісту руди.
![]() Наприклад, при переробці
цинксвинцевих руд після відновлення оксидів вуглецем виходить сплав, який при
охолодженні розділяється на два шари: нижній - свинцевий і верхній - цинковий.
Срібло погано розчиняється в свинці і майже повністю переходить в цинковий шар.
Для відділення срібла сплав цинку з сріблом нагрівають в печах, що нагадують
велику реторту. Цинк випаровується, а срібло залишається на дні посудини.
Надалі його піддають очищенню.
Наприклад, при переробці
цинксвинцевих руд після відновлення оксидів вуглецем виходить сплав, який при
охолодженні розділяється на два шари: нижній - свинцевий і верхній - цинковий.
Срібло погано розчиняється в свинці і майже повністю переходить в цинковий шар.
Для відділення срібла сплав цинку з сріблом нагрівають в печах, що нагадують
велику реторту. Цинк випаровується, а срібло залишається на дні посудини.
Надалі його піддають очищенню.
Цікава історія отримання міді. Уже 5-6 тис. Років до н. е. мідна руда добувалася єгипетськими рабами в Нубії, на Синайському півострові. Рудники, як пише грецький історик Діодор Сицилійський (I ст. до н. е.), були власністю фараонів. На каторжну працю в рудниках відправляли рабів і засуджених, найчастіше разом з сім'ями. У найбільш вузькі штольні на відбиття руди і її винесення
направляли дітей. На поверхню руду доставляли в плетених кошиках або шкіряних мішках. Найдавніша мідеплавильна піч знайдена на Синайському півострові. Вона представляла собою яму, обнесений круглої стіною товщиною в 1 м. Піч мала внизу два піддувала. По складу шлаку встановили що в цій печі виплавляли мідь.


Мал. 36. Промивання золота
Зображення більш досконалої печі було виявлено на грецькій вазі, яка датується VI ст. до н. е. Для поліпшення ливарних властивостей міді греки додавали в руду олов'яний камінь (двоокис олова) і отримували олов'яну бронзу.
Мистецтво отримання міді і її сплавів потім перейшло до римлян. Олов'яну руду римляни доставляли з Англії, яка в той час називалася Кассітерідськими островами. Цікаво відзначити, що мінерал – двоокис олова і по теперішній час називається каситеритом.
Про методи отримання міді в Росії дає уявлення невеликий, але ґрунтовна праця М. В. Ломоносова «Основи металургії» (1763 г.), який зіграв виняткову роль у розвитку металургійного виробництва. Наводимо з цієї книги малюнки шахтної печі (мал. 34) і випалу мідних сульфідних руд (мал. 34). У цій же книзі дано опис «сульфатізірующий випалу». Він полягає в повільному окисленні мідної сульфідної руди до сульфату міді киснем повітря:
CuS + 2О2 = CuSО4
з подальшим вилуговуванням солі водою з метою отримання мідного
купоросу.
У книзі даються вказівки, як використовувати теплоту газів, що відходять, як контролювати процес плавки і навіть як вентилювати шахти від пилу і газів, які «для людського здоров'я шкідливі».
Отримання золота промиванням золотоносної руди. Основна маса золота в даний час видобувається промиванням, як це робилося і багато тисячоліть тому. Метод заснований на великому розходженні в значеннях щільності золота і гірських порід. Щільність природного золота, в залежності від вмісту в ньому домішок срібла і міді, лежить в межах від 15,6 до 18,3. Щільність гірських порід дорівнює в середньому 2,7. При промиванні подрібненої гірської породи сильним струменем води легші частинки породи виносяться водою, а більш важкі частинки золота затримуються (мал. 35).
Так добували золото ще в стародавньому Єгипті в дельті Нілу і по його середній течії. Тоді ж були знайдені і корінні родовища золота в Нубії, при руйнуванні яких велика частина золота попадала в Ніл. Цікаво відзначити походження назви Нубій: Нуба «золото». За часів фараонів Сети І і Рамзеса II майже весь Єгипет і Нубія були розвідані шурфами,
Про масштаби видобутку золота в той час можуть бути такі цифри. За 1500 років до н. е., за фараона Тутмеса III, щорічно добували близько 50 т золота. Це стільки ж, скільки добували золота в Росії до 1917 року. Такий високий рівень видобутку пояснюється виключно жорстокою експлуатацією рабів і високим вмістом золота в золотоносних пісках. Так, в долинах Нілу містилося до 80 г золота на 1 т. гравію і піску.
Великі кількості золота добувалися в стародавньому Римі з допомогою особливого методу, званого ерругією. Детальний опис арругій залишив давньогрецький історик Гай Пліній Старший (23-79 рр. до н. е.), Який на Піренейському півострові був намісником імператора Нерона. Сліди римських ерругій виявлені в Іспанії, Португалії та в інших місцях.
Спочатку через породу, що містить золото, прокладали штольні, «раби, - пише Пліній, – місяцями не бачили денного світла. День і ніч йшла робота. Відпочиваючі сплять і їдять тут же. Відбиту породу по ланцюжку в кошиках раби видавали назовні, працюючи в абсолютній темряві. Пройшовши золотоносні породи, все штольні зупиняли і, починаючи від забою, кінця штольні, послідовно руйнували опорні цілики (стовпи Г. П.). Але от виникає суцільний обвал. Досвідчений майстер, який сидить зовні, викликав умовним стуком рабів». Далі Пліній пише: «Коли підготовлені до розробки ділянки починає валитися, викликаючи грандіозні обвали золотоносної породи, то лунає гуркіт і гул, який вуха людські витримати не можуть ... Вся земля тремтить, з гір зриваються брили скель, а з обрушуються штолень виривається ураган, викидаючи хмари пилу і розтерзані тіла рабів, які не встигли вибігти ... ».
Так проводилися підготовчі роботи, що дозволяють розпушувати величезні маси золотоносних порід. До місця обвалу від річок проривали канали, а іноді підводили невеликі річки. Після руйнування перемички великий потік води розмивали розпушений породу, і мільйони тон її проходили через спеціально підготовлений шлюз, на дні якого закріплювали хмиз. Крупинки золота затримувалися до хмизу. Його висушували, спалювали і з попелу виділяли золото. За одну таку операцію отримували кілька тонн золота. Це була праця тисяч рабів і життя багатьох з них. Рабська праця дозволяв розробляти породи, що містять невелику кількість золота. Зараз розробка таких порід економічно невигідна.
Метод промивання водою застосовується і зараз, але всі роботи механізована Наприклад, для промивання золотоносного піску на наших річках застосовують плавучі драги. Це великий корабель, який за допомогою стрічкового екскаватора дістає з дна річки грунт і тут же його промиває. За годину плавуча драга переробляє десятки тонн грунту.
Розділ VІІ
Хімічні сполуки елементів I групи і їх застосування
Оксиди і перекису лужних металів. Як відомо з курсу хімії середньої школи, при згорянні лужних металів утворюються оксиди. Практично при надлишку кисню виходять не тільки оксиди, а й своєрідні сполуки, так звані перекиси.
Для отримання перекисів в лабораторних умовах метал, наприклад натрій або калій, нагрівають в залізній ложечці і як тільки метал загориться його поміщають в суху скляну банку з повітрям або киснем:
2Na + О2 = Na2О2
2К + О2 = К2О2
Продукт реакції у вигляді світло-жовтого порошку зберігають в сухий пробірці, щільно закритій гумовою пробкою. У промисловості перекис натрію отримують спалюванням парів натрію в повітрі або кисні. Жовтуватий колір крупинок перекису натрію обумовлений домішкою вищої перекису, що має формулу NaО2.
Перекису представляють собою солі слабкої кислоти – перекису водню. У тому неважко переконатися, якщо подіяти на них кислотою:
Na2О2 + H2SО4 = Na2SО4 + Н2О2 Оксиди в цих же умовах дають воду:
Na2О2 + H2SO4 = Na2SО4 + Н2О
Метали і кисень в перекису проявляють свою звичайну валентність:
Na—О
Na2О2 │
Na—О
ерекису використовують в якості найсильніших окислювачів, а також для регенерації повітря в підводних човнах. Як відомо, повітря, що видихається людиною, містить значну кількість вологи і двоокису вуглецю. При пропущенні такого повітря через порошкоподібні перекису відбувається регенерація повітря:
двоокис вуглецю і, частково, вода поглинаються, а кисень виділяється (мал. 37):
2Na2О2+2CО2=2Na2CО3 + О2↑
SNa2О2+2H2О = 4NaOH + О2↑
Окисні властивості перекисів у водному розчині пов'язані з частковим гідролізом, в результаті якого утворюється перекис водню:
Na2О2+2H2О = 2NaOH + H2О2
Перекис водню – речовина нестійка і поступово, особливо в лужних розчинах, розкладається з виділенням атомного кисню, який володіє сильними окисними властивостями:
H2О2=H2О + О
Атомний кисень руйнує фарбувальні органічні речовини, тому розчином перекису водню обесцвечивают перо, солому і т. д.
При згорянні рубідію і цезію і частково калію утворюються перекису більш складного складу:
Rb+О2 = RbО2
Перекису точно теоретичного складу виходять складним шляхом. Лужний метал розчиняють в рідкому, безводному аміаку і до цього розчину доливають безводну перекис водню Нг02:
2Me + H2О2—Me2О2+H2

Мал. 36. Регенерація повітря: поглинання двоокису вуглецю та частково води і виділення кисню.
Оксиди лужних металів – досить рідкісні сполуки. Їх отримують при спільному нагріванні металів з перекису, наприклад:
Na2О3 + 2Na = 2Na2O Ка2О3 + 2К = 2К2О.
Окис літію може бути отримана також при нагріванні карбонату літію при високій температурі в вакуумі.
Оксиди металів підгрупи міді. Пру прожаренні міді на повітрі вона покривається чорним нальотом, що складається з окису міді:
2Cu + O2 = 2CuO
Під шаром окису міді розташований окисел рожевого кольору – закис міді Сіго. Цей же окисел виходить при спільному прожаренні еквівалентних кількостей міді окису міді, взятих у вигляді порошків:
CuO + Cu = Cu2O
Закис міді використовується при влаштуванні випрямлячів змінного струму, званих купроксних. Для їх приготування платівки міді нагрівають до 1020 – 1050°С. При цьому на поверхні утворюється двошаровий окалина, що складається з закису міді окису міді. Окис міді видаляють, витримуючи платівки якийсь час в азотній кислоті:
CuO + 2HNO3 = Cu(NО3)2 + Н2О
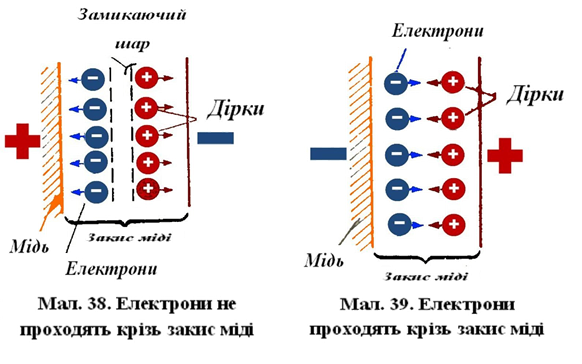
Платівку промивають, висушують і прожарюють при невисокій температурі – і випрямляч готовий. Електрони можуть проходити тільки від міді через закис міді. У зворотному напрямку електрони проходити не можуть. Це пояснюється тим, що закис міді має різної провідністю. У шарі закису міді, який примикає безпосередньо до міді, є надлишок електронів, і електричний струм проходить за рахунок електронів, тобто існує електронна провідність. У зовнішньому шарі закису міді спостерігається нестача електронів, що рівноцінно появі позитивних зарядів. Тому, коли до міді підводять позитивний полюс джерела струму, а до закису міді – негативний, то електрони через систему не проходять (рис. 38). Електрони при такому положенні полюсів рухаються до позитивного електроду, а позитивні заряди – до негативного. Усередині шару закису виникає найтонший шар, позбавлений носіїв електричного струму, – замикаючий шар. Коли ж мідь підключена до негативного полюса, а закис міді до позитивного, то рух електронів і негативних зарядів змінюється на протилежне (мал. 39), і через систему проходить електричний струм. Так працює купроксних випрямляч.
Срібло і золото дають нестійкі оксиди: Ag2О, Аu2О, Au2O3. При нагріванні вони легко розкладаються на метал і кисень. Практичного застосування ці оксиди поки не знаходять.
Велике значення має окис водню – вода. Вона широко поширена в природі і відіграє виняткову роль в промисловості. Наприклад, при отриманні
1 т алюмінію витрачається близько 1500 т води, на виробництво віскозного шовку витрачається близько 1200 т свіжої і 1500 т оборотної води.
Застосування води пов'язане з її деякими особливими властивостями. Вода має велику теплоємність, тому її зручно застосовувати для охолодження. Вода – хороший розчинник, особливо неорганічних речовин. Ця властивість використовується у виробництві найрізноманітніших речовин, а також для їх очищення перекристалізацією. У води велика прихована теплота пароутворення, тому водяна пара технологічно вигідно використовувати для нагріву речовин, так як при його перетворенні у воду виділяється багато теплоти.
Гідроксиди. Луги є речовинами, часто застосовуються в промисловості. Найбільш раннім способом отримання їдкого калі було взаємодія карбонату калію з вапном. Цей спосіб застосовували ще в стародавньому Єгипті. Попіл рослин заливали водою, профільтровивают через полотно і до розчину прілівалц вапняне молоко. При цьому карбонат кальцію випадав в осад, а їдкий калій залишалося в розчині:
К2СО3 + Са (ОН)2 = СаСО3 ↓ + 2КОН
Для отримання лугу в твердому стані розчин фільтрували від карбонату кальцію і випарювали. Так отримували їдке калі і за часів Петра I. Луг у великих кількостях вивозили з Росії в Європу для приготування рідкого мила. Цей метод отримання їдкого калі для виготовлення мила практикувався в селах дореволюційній Росії (зазвичай для цієї мети використовували пічну золу).
В даний час лугу готують електролізом водних розчинів хлоридів. У водних розчинах хлор і метали натрій і калій знаходяться у вигляді іонів: Cl–, Na+, К+. При пропущенні електричного струму іони.хлора і гідроксилу йдуть до електрода, з'єднаного з позитивним джерелом електричного струму, і іони хлору віддають йому один електрон:
С1– — ē = C1
Вирізняється атомний хлор з'єднується в молекули:
С1 + С1 = С12
Іони натрію або калію, а також іони водню під дією струму рухаються до негативного електроду. Однак розрядці на цьому електроді піддаються не іони металів, а іони водню, так як водень розташований в ряді напруг після лужних металів;
H+ + ē = H Атоми утворюють молёкули водню:
Н + Н = Н2
Іони водню утворюються в розчині за рахунок дисоціації води:
Н2О D Н+ + ОН–
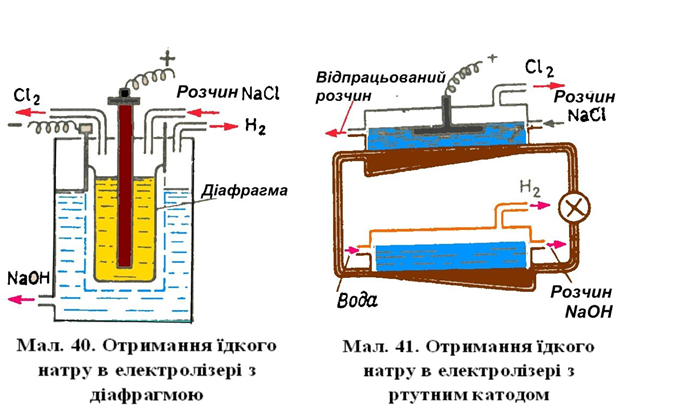
Оскільки близько катода залишаються іони металів і гідроксильні іони, в катодному просторі накопичується розчин лугу. При випаровуванні цього розчину виходить тверда луг.
Отримання їдкого натру або їдкого калі з одновре¬менним отриманням хлору і водню (що йдуть на приготування хлористого водню) проводять в електролізе¬рах двох типів: з діафрагмою і з ртутним катодом.
При диафрагменном методі (рис. 40) анодна і катодного простір відокремлені діафрагмою з азбесту, що перешкоджає взаємодії лугу з хлором. Аноди, на яких виділяється хлор, роблять зі стійкого матеріалу – графіту, катоди – з заліза, стійкого по відношенню до розчину лугу. Розчин кухонної солі безперервно подається в анодне простір, а з катодного випливає розчин лугу з невеликою домішкою кухонної солі. При випаровуванні розчину з нього випадає кухонна сіль. У 50-процентному розчині лугу міститься не більше 0,9% кухонної солі. Розчин випарюють в залізних ємностях, отриману луг переплавляють.
При електролізі кухонної солі з ртутним катодом (мал. 41) на ньому виділяється не водень, а натрій. Це формально суперечить положенню водню і натрію в ряді напруг. Спочатку мав би виділятися водень, але на ртуті водень виділяється при більш негативних потенціалах. Тому іон натрію першим розряджається на ртуті. Частково це пояснюється і доброю розчинність натрію в ртуті. Розчин Натрію в ртуті, натрієва амальгама, з електролізера безперервно перекачується в іншу ванну, званий розкладач. У ньому натрій, що входить до складу амальгами, вступає в реакцію з водою:
2Na + 2Н2О = 2NaOH + Н2
Розчин їдкого натру з разлагателі йде на випарювання, а чиста ртуть знову подається в електролізер. Їдкий натр, одержуваний цим способом, дуже чистий. Недолік зазначеного методу – велика витрата ртуті при влаштуванні установок.
У лабораторних умовах їдкі луги можна готувати взаємодією розчинів сульфатів лужних металів з розчином їдкого барію, наприклад:
K2SО4 + Ba (ОН)2 = 2КОН + BaSО4
Відважують необхідну кількість сульфату відповідного металу, розраховують необхідну кількість їдкого барію і приготовлені з них розчини змішують в нагрітому стані. При цьому сульфат барію випадає в більш крупнокристалічного стані і легше фільтрується. Після відстоювання розчин обережно зливають з осаду на фільтр. Фільтрат відчувають на наявність іонів SО42– і Ва2+. Для цього до окремих проб доливають розчини розчинної солі барію і сульфату калію. Якщо при цьому буде спостерігатися невелике помутніння, то розчин їдкого натру готовий. Якщо ж буде виходити великий осад, то до фільтрату доливають ще трохи сульфату лужного металу або їдкого барію і осад відфільтровують. Для приготування твердого їдкого натру розчин випарюють в залізній чашці. Випарювати розчин в скляному посуді не можна з огляду на її руйнування.
В даний час їдкий натр готують у великих кількостях. Він йде головним чином на виробництво мила. Їдкий натр у вигляді розчину застосовують для знежирювання деталей, при очищенні мінеральних масел, в органічної хімії, наприклад при отриманні фарби алізарин. Нагрівання руд кольорових металів з розчином їдкого натру часто застосовується при їх первинній переробці, зокрема при отриманні окису алюмінію. При дії на боксити їдкого натру окис алюмінію розчиняється і утворюється сіль алюмінієвої кислоти – алюмінат натрію:
А12О3 + 2NaOH = 2NaA1О2 + Н2О
Алюмінат натрію гідролізується, утворюючи гідроокис алюмінію. Розчин фільтрують від домішок і з нього виділяють чисту гідроокис алюмінію, прожарюванням якої отримують окис алюмінію.
В умовах шкільної лабораторії цей досвід можна виконати так. Змішати в колбі 5-6-процентний розчин їдкого натру з глиною, колбу помістити на 1-2 ч в суШильнов шафа при температурі 70-80°С. Потім суміш сильно збовтати і нагрівати її при цій же температурі протягом 1-1,5 год. Після відстоювання рідину обережно злити з відстояною глини на паперовий фільтр. Для виділення гідроокису алюмінію з отриманого розчину алюмінату натрію до розчину долити до нейтральної реакції розбавлену оцтову кислоту:
NaA1О2+ СН3СООН + Н2О = CH3COONa + А1(ОН)3↓
При цьому гідроокис алюмінію випадає в осад. Можна через розчин алюмінату натрію пропустити двоокис вуглецю, що також призведе до утворення гідроксиду алюмінію:
2Na А1О2 + СО2 + ЗН2О = Na2CО3 + 2А1(ОН)3↓
Їдкий натр і їдке калі широко застосовують в лабораторіях як реактивів, а також для очищення повітря від двоокису вуглецю. Їдкий літій, їдкий рубідій і їдкий цезій використовують для отримання різних солей.
Сила лугів збільшується від гідроксиду літію до гідроксиду цезію. Пояснюється це збільшенням радіусів іонів від літію до цезію: міцність зв'язку між іоном металу і гідроксильною групою слабшає, тому гідроокис рубідію дисоціює на іони краще в порівнянні з гідроксидом літію. Треба думати, що їдкий франций FrOH буде найсильнішою лугом.
На противагу лугів гідроксиду елементів підгрупи міді малорозчинні і нестійкі сполуки. Отримують їх дією лугів на розчини відповідних солей, наприклад:
CuCl2 + 2NaOH = Сu(OH)2 + 2NaCl
AgNO3 + KOH = KNО3 + AgОH
Це іонні реакції і протікають вони тому, що про-роззуються погано диссоційовані з'єднання, що випадають в осад:
Сu2+ + 2С1– + 2Na+ + 2ОН– = Сu(ОН)2↓ + 2Na+ + 2С1–
Ag+ + NО3– + К+ + ОН– = К+ + NО3– + AgOH↓
Таким чином, реакції зводяться до приєднання гідроксильних груп до іонів металів:
Cu2+ + 2ОH– = Cu(ОH)2
Ag+ + OH– = AgOH
Мідь, крім гідроксиду міді (II) блакитного кольору, дає ще гідроокис міді (I) білого кольору:
CuCl + NaOH = CuOH + NaCl
Це нестійка сполука, яке легко окислюється до гідроксиду міді (II):
4СuОН + 2Н2О + О2 = 4Сu(ОН)2
Нестійким є і гідроокис срібла AgOH, який легко відщеплює воду:
2AgOH = Ag2O + Н2О
Гідроокис срібла може бути отримана тільки при низьких температурах при взаємодії спиртових розчинів нітрату срібла і лугу.
Золото дає гідроксиди, в яких воно одно- і тривалентне: АuОН і Аu(ОН)3.
Все гідроксиду металів підгрупи міді мають амфотерні властивості. Наприклад, гідроксид міді (II) добре розчиняється не тільки в кислотах, але і в концентрованих розчинах лугів:
Сu(ОН)2 + 2НС1 = СuС12 + 2Н2О
Сu(ОН)2 + 2КОН = К2 [Сu(ОН)4
Таким чином, гідроокис міді (II) може диссоциировать і як підстава:
Cu(ОH)2 D Cu2+ + 2ОH–
і як кислота. Цей тип дисоціації пов'язаний з приєднанням до міді гідроксильних груп води:
Сu(ОН)2 + 2НОН = Н2[Сu(OH)4
Гідриди. При нагріванні в струмі водню лужні метали дають гідриди – сполука з воднем, наприклад LiH, NaH, КН, RbH, CsH. Отримання їх нескладно і в лабораторних умовах.
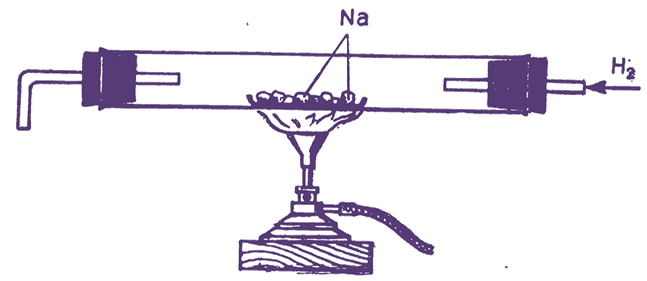
Мал. 42. Отримання гідриду натрію
Невеликі шматочки металу поміщають в скляну трубку (мал. 41), витісняють повітря з трубки воднем, а потім прогрівають в струмі сухого водню при температурі близько 380-400°С. Трубку, де знаходиться метал, можна нагрівати звичайної спиртівкою. Особливо добре йде поглинання водню літієм, але одержуваний гідрид відповідає формулі LiH лише тоді, коли прожарювання закінчують при 700°С. Натрій і інші лужні метали поглинають водень гірше, і в цих умовах виходять гідриди, в яких водню дещо менше, ніж. це відповідає теоретичної формулою мен. Для отримання гідридів, склад яких точно відповідав би формулою мен, метал слід нагріти до випаровування; під час конденсації його парів він з'єднується з воднем і дає гідрид теоретичного складу.
Стійкість гідридів лужних металів зі збільшенням їх атомних мас падає. Найміцніший з них – гідрид літію LiH. Гідрид літію при 680°С навіть можна розплавити.
Гідриди до деякої міри нагадують солі, водень в них має негативний зарядн (саме через це водень часто розміщують в VII групі періодичної системи Д.І.Менделєєва). Солеподібна природа гідридів доводиться їх електролізом. При пропусканні постійного електричного струму через гідриди водень виділяється не на негативному полюсі, а на позитивному.
Отже, в гидридах атоми лужних металів віддають валентні електрони водню.
Гідриди лужних металів, як і самі метали, активно вступають в реакцію з водою:
LiH + Н2О = LiOH + Н2
З сухими газами при звичайній температурі вони майже не реагують.
Гідриди лужних металів, за винятком гідриду літію, майже не знаходять застосування.
Гідрид літію, що включає важкі ізотопи водню, дейтерій – LiD і тритій – LiT, є головною частиною водневих бомб. Як відомо, при з'єднанні протонів і нейтронів, з утворенням ядра атома гелію, присходит зменшення маси і виділення величезних кількості енергії – протікає термоядерна реакція. Однак утворення ядер гелію відбувається тільки при високих температурах і тисках, які в земних умовах можуть виникнути тільки при вибуху атомної бомби. Тому воднева бомба включає як запал атомну бомбу, яка оточена воднем (мал. 43). Краще термоядерна реакція проходить, коли використовується не водень, а його важкі ізотопи - дейтерій і тритій:
12Н13Н24Не01nQ
Але дейтерій і тритій - гази, і, отже, вони займають великий обсяг. З метою зменшення обсягу дейтерій і тритій переводять в гідриди літію.
Мал. 43. Схема будови водневої бомби
Ізотоп тритій – дорога речовина. Вона може отримуватись за рахунок взаємодії ізотопу літію-7 з нейтронами, які утворюються під час вибуху атомної бомби:
37Li01n13H25He

Вибух водневої бомби
Тому для здійснення термоядерної реакції вигідніше брати гідрид літію LiD з невеликою домішкою тритію. Отже, у водневій бомбі використовуються відразу два елементи I групи - літій і водень.
Метали підгрупи міді також дають гідриди із загальною формулою мен. Це нестійкі, легко розкладаються речовини. Практичного застосування вони не знаходять.
Галогеніди. Всі лужні метали утворюють з галогенами солі. При безпосередньому спалюванні лужних металів в атмосфері галогенів виділяється величезна кількість теплоти, особливо при з'єднанні з фтором. Фториди лужних металів – самі екзотермічні з'єднання.
Багато з цих солей, і в першу чергу хлорид натрію, знаходяться в природі у великих кількостях. Солі брому і йоду зустрічаються значно рідше, головним чином в деяких підземних водах і озерах, наприклад в Сакських озерах в Криму. Солі йоду накопичуються в деяких морських водоростях, наприклад в ламінарія. Отримують хлориди лужних металів з природної сировини. Фториди, а іноді броміди і йодиди, отримують з карбонатів при їх розчиненні в галогеноводородних кислотах, наприклад:
Li2CО3 + 2НВr = 2LiBr + Н2О + СО2
Rb2CО3 + 2HI = 2RbI + Н20 + СО2
Броміди і іодіди, особливо для медичних цілей, часто отримують іншим методом, який можна здійснити і в умовах шкільної лабораторії. До порошкоподібної залозу доливають деяка кількість води і додають в нестачі при збовтуванні бром або йод:
Fe + Br2 = FeBr2
Розчин нагрівають і фільтрують від нерастворим заліза. До фільтрату з розрахунку (до слабо-лужної реакції) доливають розчин соответствую¬щего карбонату:
FeBr2 + Na2CО3 = FeCО8 + 2NaBr Карбонат заліза фільтрують і фільтрат випарюють.
З усіх галогенідів найбільше значення має галогенид натрію – хлорид натрію. Він абсолютно необхідний для людського організму, так як входить до складу крові. Щорічно людина в середньому споживає 6 – 7 кг солі. Збіднення організму хлоридом натрію призводить до тяжкого захворювання. У людей, що працюють в жаркому кліматі і випивають велику кількість прісної води, спостерігаються судоми та інші захворювання. Встановлено, що в нежаркому кліматі, при невеликих шой фізичному навантаженні людина може задовольнятися в добу 0,5 г солі. Нормальна щодобовий доза солі, рекомендована лікарями, 10-20 м В гарячих цехах заводів, щоб не сталося знесолення, робітники п'ють підсолену воду. Вона краще втамовує спрагу.
За стародавніми законами Голландії державних злочинців піддавали покаранню - їх годували їжею, в якій майже не було солі, і давали пити прісну воду. Наставало поступове знесолення організму, і людина помирала у страшних муках.
Кухонна сіль є предметом першої необхідності, тому з нею пов'язано багато звичаїв, приказок і переказів.
Коли хочуть сказати, що людину добре знають, то кажуть: «Я з ним пуд солі з'їв». Існує звичай зустрічати почесного гостя хлібом і сіллю. Всім відома старовинна прикмета – розсипана сіль означає сварку, зрада. На знаменитій картині Леонардо да Вінчі «Таємна вечеря» Юда лівою рукою перекидає сільничку з сіллю – відбудеться зрада.
У всіх країнах, в тому числі і в Росії, в минулі століття проблема солі мала велике державне значення. Про це говорять такі назви міст, як Солигалич, Сольвічегодск, Солікамск, Усолье. При Івана Калити Московське князівство для вирішення проблеми солі купило навіть місто Солигалич, поблизу якого добували сіль. Відомо багато документів, підписаних царем Олексієм Михайловичем, які в тій чи іншій мірі пов'язані з «соляної проблемою» на Русі: указ про нагороди відкривачам солі, указ про упіймання і покарання осіб, розголошувати відомості про нестачу солі в скарбниці, і т. д. Сіль в ті далекі часи обкладалася великим податком, продавалася за високою ціною .і простим людям була мало доступна. На цьому грунті виникали «соляні бунти». Наприклад, вільний продаж солі стала в Російській імперії тільки, з 1812 р.
В Україні сіль з давніх-давен добували з води солоного озера Сиваш. Про значення солі в житті українців свідчить назва зоряного скупчення Чумацький шлях напрям якого на небосхилі співпадав з напрямом руху чумацьких возів з сіллю від Сиваша.
Знаходять застосування і інші галогеніди лужних металів. Хлорид літію нижче 28°С кристалізується в залежності від температури в вигляді: LiCl H2О, LiCl 2H2О, LiCl 3H2О. Ця властивість солей літію знайшла застосування для кондиціонування повітря. Певна вологість підтримується в книгосховищах, музеях, в космічних кораблях. Ось для цієї мети і використовуються хлориди і броміди літію. При пропущенні влажногф повітря через хлориди і броміди літію вода приєднання-вується кгалогенідам, і повітря стає суші. Регенерується речовина простим нагріванням. Часткове відщеплення води від галогенідів здійснюється при пропущенні сухого повітря, який зволожується до певного стану.
Цікаво використання малорастворимого фториду літію. З кристалів цієї речовини готують лінзи для деяких оптичних приладів, наприклад для вакуумних спектрографів. Використовується його властивість добре пропускати ультрафіолетові промені. Готують кристали фториду літію його перекристалізацією з хлориду калію. Хлорид калію плавлять, в його розплаві розчиняють фторид літію. Потім розплав повільно охолоджують. Таким методом вирощують кристали фториду літію в кілька сантиметрів в діаметрі.
Розчини хлоридів і бромідів літію замерзають при низькій температурі, тому їх використовують в холодильних установках в якості робочої рідини.
Мідь дає два види галогенідів: СuХ і СuХ2. Одновалентні галогеніди міді виходять при взаємодії металевої міді з розчином галогенида двохвалентної міді, наприклад:
Cu + CuC12 = 2CuC1
Монохлорид міді випадає з розчину у вигляді білого осаду на поверхні міді.
Особливо цікаві нестійкі галогеніди срібла, які раніше дуже широко застосовувались при фотографуванні. При дії світла галогеніди срібла, наприклад бромід срібла AgBr, переходять в активну форму. Надалі, при дії розчину проявника відбувається відновлення срібла до металу:
2AgBr = 2Ag + Bra2
Бром що виділився вступає в реакцію з проявлювачем і желатином. Таким чином, ті ділянки фотопластинки, на які вплинув світло, чорніють внаслідок виділення дрібнодисперсного срібла. Потім пластинку обробляють закріплювачем – тіосульфатом натрію Na2S2О3, який розчиняє неразложившихся бромід срібла. Ббльшая частина одержуваного броміду срібла в даний час витрачається в фотографії.
Сульфати. Сульфати лужних металів добре розчиняються у воді. Сульфат натрію був отриманий у 1658 р І. Глаубером дією сірчаної кислоти на кухонну сіль. З тих пір цю сіль стали називати глауберовою.
З водного розчину при температурі нижче 32,4°С сульфат натрію кристалізується з десятьма молекулами води Na2SО4 10H2O. При більш високій температурі утворюється безводна сіль, яка розчиняється в кристалізаційній воді що відщеплюється.
Приєднання води до безводної солі супроводжується виділенням значної кількості теплоти. При розчиненні кристалогідратів у воді протікає зворотний процес – поглинання теплоти. Це явище іноді використовують для отримання низьких температур. Сульфати калію, заліза і цезію, в протилежність сульфату натрію, кристалізуються в безводному стані. Вони добре розчиняються.
Сульфат натрію і сульфат калію застосовують в про-мисловості при виробництві скла. Сульфат літію – проміжний продукт при переробці природних сполук літію, з нього готують інші солі літію. Цим вичерпується його практичне застосування.
З сульфатів металів підгрупи міді найбільше практичне значення має сульфат міді СuSO4 5Н2О, званий мідним купоросом. Його готують розчиненням міді в концентрованої сірчаної кислоти. Оскільки мідь відноситься до малоактивним металам і розташована в ряді напруг після водню, водень, при цьому не виділяється:
Сu + 2H2SO4 = CuSO4 + SO2 + 2Н2О
Мідний купорос застосовують при електролітичному отриманні міді, в сільському господарстві для боротьби з шкідниками і хворобами рослин, для отримання інших сполук міді.
Карбонати. Карбонати лужних металів є поширеними солями і найбільш часто застосовуються в промисловості. Всі вони, за винятком карбонату літію, добре розчинні у воді, їх розчини мають лужної властивостями. Це пояснюється взаємодією карбонатів з водою (гідролізом), в результаті чого утворюються кислі солі та луг, наприклад:
Na2CO3 + H2O D NaHCO3 + NaOH
К2СО3 + Н2О D КНСО3 + КОН
При приливанні до розчинів карбонатів лужних металів розчину лакмусу він набуває синього забарвлення, а фенолфталеїн – малинового. Пояснюється це гідролізом карбонату, в результаті чого утворюється бікарбонат і їдкий луг:
Na2CО3 + H2О D NaHC О3 + NaOH
СО32– + Н2О D НСО3– + ОН–
Карбонат натрію (сода) при температурі нижче 32°С випадає у вигляді кристалогідрату Na2C О3 10H2O. Вище 32°С відбувається відщеплення кристалізаційної води, в якій сіль Na2CО3 розчиняється. Тому кажуть, що вище 32°С сіль плавиться в своїй кристалізаційної воді. Насправді ж безводний карбонат натрію плавиться при температурі 850°С.
Карбонат натрію отримують аміачним способом. Зрозуміти сутність його можна з простого лабораторного досвіду. Готують теплий насичений розчин кухонної солі в 20-процентному розчині аміаку і через суміш пропускають двоокис вуглецю до випадання осаду бікарбонату натрію. Спочатку утворюється гідрокарбонат амонію:
NH4ОH + CО2 = NH4HCО3
Ця сіль вступає в обмінну реакцію з кухонною сіллю:
NH4HCО3 + NaCl D NaHCО3↓ + NH4Cl
Три солі – хлорид натрію, хлорид амонію і гідрокарбонат амонію добре розчинні у воді, але гідрокарбонат натрію, особливо при кімнатній температурі, розчинний погано і випадає з розчину. Його фільтрують, висушують і прожарюють. Під час прожарювання гідрокарбонат натрію розкладається і утворюється безводна сода, яку називають кальцинованою (обпаленої):
2NaHCO3 = Na2CO3 + CO2↑ + Н2О
У промисловості двоокис вуглецю, що виділяється при прожаренні бікарбонату натрію, знову використовують для насичення аміачного розчину хлориду натрію.
Карбонат натрію – один з найважливіших продуктів хімічної промисловості. В великих кількостях його застосовують при варінні скла і мила, для отримання різних сполук натрію (бура Na2B4О7 10H2O, розчинне скло, фосфати та інші солі). На заводах карбонат натрію застосовують для очищення засмальцьованих і забруднених деталей, для пом'якшення води при фарбуванні і т. д.
Карбонат калію, або, як його називають, поташ К2СО3, готують нейтралізацією едкога калі двоокисом вуглецю, а також з золи рослин. Ця сіль відома людям з глибокої давнини, і її водні розчини, одержувані з попелу рослин, широко використовувалися при пранні білизни, для приготування рідкого мила. Зараз основний споживач поташу – скловарна промисловість.
Карбонати для металів підгрупи міді не характерні і в практиці майже не застосовуються. Деякий значення для отримання міді має лише основний карбонат міді, який зустрічається в природі.
Нітрати. Нітрати лужних металів являють собою безбарвні добре розчинні речовини. Їх називають також селітрами. Отримують нітрати цих металів взаємодією карбонатів або лугів з азотною кислотою. Часто для цієї мети використовують гази азотнокіслотной промисловості, що містять невелику кількість двоокису азоту. Їх направляють в поглинальні вежі, в яких зверху розбризкується розчин їдкого натру або їдкого калі. При цьому обра-ся нітрати і нітрити:
2КОН + 2NО2 = KNО2 + KNO3 + Н2О
2Са(ОH)2 + 4NО2 = Ca(NО2)2 + Ca(NО3)2 + 2H2О
Для перекладу нітритів в нітрати до розчину добавляють азотну кислоту:
3KNО2 + 2HNО3 = 3KNО3 + 2NO↑ + Н2О
Окис азоту змішують з повітрям і яка утворюється двоокис азоту знову направляють на поглинання: 2NО + О2 = 2NО2.
У Чилі, Колумбії, Єгипті зустрічаються поклади нітрату натрію. Особливо великі його поклади в Чилі. Сіль залягає пластами і сильно перемішана з землею. Чилійські поклади нітрату натрію виникли в результаті діяльності величезних скупчень морських птахів які тисячами років залишали свій послід на сухому узбережжі пустелі Атакама. Дощі в цій пустелі рідкісне явище і тому при відсутності дощів накопичилися великі товщі посліду який перетворився на нітрат натрію.
Нітрат калію (калійна селітра) має найбільше практичне значення: це найцінніше добриво, тому що містить два поживних елементів – калій і азот. Крім того, його застосовують для виготовлення димного пороху. Для цього змішують в певних пропорціях сірку, деревне вугілля та калійну селітру і з отриманої маси формують невеликі крупинки. При підпалюванні пороху утворюється велика кількість газів, обсяг яких у багато разів перевершує обсяг пороху:
2KNО3 + 3C + S = K2S + N2↑ + 3CО2↑
Натрієву селітру для цієї мети не застосовують, так як вона притягує вологу, а порох «належить тримати сухим».
Нітрат калію, як і всі нітрати лужних металів, при нагріванні плавиться, і його розплав володіє найсильнішими окисними властивостями внаслідок розкладання:
2KNО3 = 2KNО2 + О2
Тому палаюча сірка або розпечене вугілля продовжує горіти в розплаві солі:
2KNО3 + C = CО2↑ + 2KNО2
2KNО3 + S = SО2↑ + 2KNО2
Горіння відбувається за рахунок кисню, що виділився при розкладанні нітрату калію.
З нітратів металів підгрупи міді найбільше застосування знаходить нітрат срібла. Виходить він при безпосередньому розчиненні срібла в азотній кислоті:
Ag + 2HNО3 = AgNО3 + NО2 + Н2О
Нітрат срібла – безбарвна кристалічна речовина, добре розчинна у воді. Ця речовина внаслідок його руйнівної дії на шкіру та інші тканини раніше називали «пекельним каменем». Нітрат срібла в присутності слідів вологи поступово розкладається з виділенням металевого срібла і азотної кислоти, яка руйнує тканини. Завдяки цим властивостям нітрат срібла застосовують у медицині для видалення бородавок, а іноді його слабкі розчини застосовують Для дезінфекції ран. В цьому випадку дезінфікує металеве срібло, яке вбиває бактерії.
Силікати. З силікатів практичне значення має силікат натрію Na2SiО3, який називають розчинним склом. Отримують його сплавом двоокису кремнію з содою:
Na2CО3 + SiО2 = Na2SiО3 + СО2↑
Чистий силікат натрію плавиться при 1088°С (і при повільному охолодженні застигає в кристалічному вигляді. При наявності інших силікатів, наприклад силікату кальцію CaSiО3, розплавлений силікат натрію застигає в аморфному вигляді, тобто у вигляді скла. Так само як силікати інших лужних металів, він поступово розчиняється в воді, і утворюється в'язкий розчин, який називається рідким склом.
Силікат натрію володіє сильною лужною реакцією і містить певну кількість вільного лугу, ко-торая виникає за рахунок взаємодії солі з водою (гідроліз):
2Na2SiО3 + H2О D 2NaОH + Na2Si2О5
2SiO32– + H2О D Si2О52– + 2ОH–
При цьому виходить діметасілікат натрію - сіль діметакремніевой кислоти
Н2Si2О5, або 2 SiО2 H2О.
Силікат натрію вступає в реакції з багатьма речовинами, зокрема з двоокисом вуглецю і двоокисом кремнію. Від дії двоокису вуглецю розчин силікату натрію поступово виділяє двоокис кремнію в колоїдному стані:
Na2SiО3 + СО2 + nН2O = Na2CO3 + SiO2 nН2O
З двоокисом кремнію вступає в реакцію луг, завжди наявна в розчинах силікату натрію:
2NaОН + SiO2 = Na2SiO3 + Н2О
Якщо змішати розчин силікату натрію з дрібним кварцовим піском, то через деякий час ця суміш затвердіє і перетвориться в міцний камінь. Ці властивості силікату натрію використовують у промисловості і будівельній справі. Його розчином просочують різні прокладки з азбесту або картону в місцях з'єднання труб і гідравлічних систем, При закачуванні рідкого скла в грунт відбувається його зміцнення, що іноді важливо в будівельній справі при зміцненні фундаментів будівель, при будівництві гідротехнічних споруд. Додавання цього розчину в різні обмазки підвищує їх механічну міцність.
Силікат натрію часто додають до деяких сортів господарського мила. При цьому підвищується механічна міцність мила і поліпшуються його миючі властивості. Це пов'язано з тим, що силікат натрію дає в водному розчині кілька високомолекулярних силікатів, які адсорбують бруд, сприяючи її видалення з тканини.
Інші солі лужних металів. Лужні метали утворюють різні солі як з неорганічними, так і з органічними кислотами. Багато з них знаходять застосування не тільки в лабораторії, але також в промисловості і побуті. Найбільш широко відомі перманганат калію і біхромат калію.
Перманганат калію КМnO4 – кристалічна речовина майже чорного кольору, його розчин застосовують в медицині як знезаражувальний засіб. При зіткненні з органічними речовинами відбувається повільне розкладання солі, що супроводжується виділенням атомного кисню:
2КМnO4 = К2МnO4 + МnO2 + 2O2↑
O + О = O2↑
Розчин перманганату калію попереджає виникнення бульбашок на шкірі при опіках. У лабораторії перманганат калію використовують як окислювач і для отримання кисню. Для цього невелику кількість (4-5 г) перманганату калію поміщають в пробірку з газовідвідною трубкою і нагрівають. Утвориться двоокис марганцю в даній реакції служить каталізатором. Тому спочатку розкладання йде повільно, а потім у міру накопичення каталізатора реакція прискорюється. Такі каталітичні реакції, в яких каталізатор виходить під час самої реакції, називаються аутокаталітіческімі.
Отримують перманганат калію сплавом природного двоокису марганцю з їдким калі. При цьому спочатку утворюється манганат калію – сіль не існуючої у вільному стані марганцевистої кислоти Н2МnО4:
2МnО2 + 4КОН + О2 = 2К2МnО4 + 2Н2О Потім манганат калію окислюють, наприклад хлором:
2К2МnO4 + С12 = 2КС1 + 2КМnO4
Перманганат калію через погану розчинність випадає в осад. Цим же методом можна отримати і перманганат натрію, але він добре розчинний, тому його важче виділити з розчину.
Сильними окисними властивостями володіє інша сіль калію – біхромат, або дихромат калію К2Сr2О7. Ця сіль не існуючої у вільному вигляді дихромової (або двухромову) кислоти Н2Сr2О7. У водному розчині біхромат калію частково розкладається з виділенням невеликої кількості хромової кислоти H2СrО4: К2Сr2O7 + Н2О D К2СrO4 + H2СrО4
Сr2O72– + Н2O D 2С2O42– + 2Н+
Тому, незважаючи на відсутність в солі «кислотні»: водню, в її назві є приставка бі-, що означає, що це кисла сіль, а розчини біхроматов викликають кислу реакцію.
Біхромат калію широко застосовують для захисту сталевих, мідних і латунних виробів від корозії. При промиванні біхроматом калію виробів на їх поверхні ^ утворюється тонка, але міцна окисна плівка, яка, оберігає вироби від корозії:
2Fe + К2Сr2O7 + Н2O = Fe2O3 + Сr2O3 + 2КОН
Подібними ж властивостями володіють нітрит калію KNO2 і бензоат натрію С6Н5СОСNа. Водні розчини? цих солей на поверхні сталевих виробів створюють щільну захисну плівку, що складається з окису заліза.
Якісні реакції на іони лужних металів і металів підгрупи міді. Складовою частиною неорганічної хімії є аналітична хімія. Вона дозволяє виявляти наявність тих чи інших іонів або речовин, визначати їх кількості. За допомогою чутливих методів, застосовуваних в аналітичній хімії, можна виявити тисячні, а в ряді випадків навіть мільйонні частки домішок інших речовин. Це має велике практичне значення. Наприклад, для виготовлення напівпровідникових германієвих випрямлячів придатний; германій високої чистоти. В даний час отримано декілька часток міліграма домішок. Безсумнівно, для їх відкриття потрібно застосовувати спеціальні методи.
Розроблено методи і для відкриття елементів першої групи. Іони лужних металів виявити важко. Пояснюється це тим, що багато солі лужних металів добре розчиняються. З солей літію погано розчиняються фторид літію LiF, фосфат літію Li3PO4, карбонат літію Li2CO3 і деякі інші. Тому для відкриття літію до розчину його солей потрібно долити розчин, що містить іони F–, РO43– або СO32–; LiCl + NH4F = LiF↓ + NH4C1
3LiNО3 + Na3PО4 = Li3PО4↓ + 3NaNO3
2LiCl + Na2CO3 = Li2CO3↓ + 2NaCl
Карбонат літію кілька розчинний у воді; тому осад виходить тільки при значній кількості солей літію в розчині. Розчинність карбонату літію з підвищенням температури зменшується. При нагріванні насиченого розчину карбонату літію випадають кристали солі.
Іон натрію можна відкрити за допомогою дігідроантімоната калію (кисла сіль калію і ортосурьмяной кислоти H3SbО4):
NaCl + KH2SbО4 = NaH2SbO4↓ + KC1
'Білий осад дігідроантімоната натрію випадає не одразу, а поступово. Його випадання прискорюється тертям скляної палички об стінки пробірки, при цьому утворюється велика кількість дрібних крупинок скла. Деякі з них схожі за формою на кристали дігідроантімоната натрію. У цьому випадку такі крупинки скла стають центрами кристалізації солі.
Іони натрію можна також відкрити за допомогою речовини, що містить уран, – цінкуранілацетата. При цьому випадає складно побудована, погано розчинна сіль – натрійцінкуранілацетат:
NaCH3COO Zn(СН3СОО)2 3UO3(СН3СОО)2 9Н2О Це зеленувато-жовті кристали (їх розглядають під мікроскопом).
Іон калію, на відміну від іонів натрію, дає більшу кількість нерозчинних солей. Його можна відкрити з допомогою бітартрата натрію – кислого виннокислого натрію:
KCl + NaHC4H4O6 = КНС4Н4О6↓ + NaCl
Раніше цю сіль називали винним каменем, так як вона утворюється на стінках бочок, в яких готують вина з виноградного соку.
Бітартрат калію, так само як і дігідроантімонат натрію, дає перенасичені розчини, тому його випадання також прискорюється при терті скляної палички об стінки пробірки.
Хорошим реактивом на калій є складно побудована сіль – кобальтінітріт натрію Nа3[Со(NO2)6]. Розчин цієї солі можна отримати і в умовах шкільної лабораторії. Для цього зливають розчини нітриту натрію з розчином будь-якої солі кобальту. При Прилив цієї солі до будь-якої солі калію випадає жовтий дрібнокристалічний осад:
Na3[Со(NO2)6] + 2КС1 = K2Na[Со(NO2)6]↓ + 2NaCl
Хороші, але дорогі реактиви на калій – хлороплатинат натрію і платинохлористоводородной кислота. З іонами калію ці речовини дають жовтий мелкокрі-сталліческій осад хлороплатинату калію:
2КС1 + H2PtCl6 = K2PtCl6↓ + 2НС1
![]() Солі лужних металів можна
легко відкрити і за забарвленням полум'я. Цей метод запропонований в XVIII в.
російським вченим Т.Є.Ловіц. Для цієї мети найбільш придатна платинова
зволікання. Замість неї можна скористатися шматочком дроту від спіралі для
електричних плиток. Кінці дроту змочують водою чи розведеною соляною кислотою,
торкаються до досліджуваної солі і вносять в нижню частину пальника або
спиртівки. Полум'я від солей натрію набуває інтенсивну жовте забарвлення, від
солей літію – кармінно-червону, від солей калію – фіолетову, але порівняно
слабке забарвлення. Забарвлення полум'я, що викликається солями калію, краще
розглядати через синє скло, яке затримує жовті промені.
Солі лужних металів можна
легко відкрити і за забарвленням полум'я. Цей метод запропонований в XVIII в.
російським вченим Т.Є.Ловіц. Для цієї мети найбільш придатна платинова
зволікання. Замість неї можна скористатися шматочком дроту від спіралі для
електричних плиток. Кінці дроту змочують водою чи розведеною соляною кислотою,
торкаються до досліджуваної солі і вносять в нижню частину пальника або
спиртівки. Полум'я від солей натрію набуває інтенсивну жовте забарвлення, від
солей літію – кармінно-червону, від солей калію – фіолетову, але порівняно
слабке забарвлення. Забарвлення полум'я, що викликається солями калію, краще
розглядати через синє скло, яке затримує жовті промені.
Метали побічної підгрупи також дають характерні реакції на іони. Іон міді можна відкрити, приплив до розчину її солі розчин аміаку. Поява інтенсивного синьо-блакитного забарвлення пов'язане з утворенням складного іона міді
[Cu(NH3)4]2+:
CuSО4 + 4NH4ОH = [Cu(NH3)4]SО4 + 4H2О
Для відкриття іона срібла досить до розчину долити соляну кислоту або розчин кухонної солі:
AgNО3 + НС1 = AgCl↓ + HNО3
AgNO3 + NaCl = AgCl↓ + NaNО3
Випадання білого творожистого осаду вказує на наявність іона срібла.
З металів побічної підгрупи інтенсивно забарвлює полум'я тільки мідь – зелене забарвлення.
Розділ VIII
Застосування металів I групи
Застосування металів і інших речовин завжди визначається їх фізичними і хімічними властивостями, поширенням в природі. Великий вплив на застосування надає також і вартість речовин.
У наше століття чудових відкриттів, пов'язаних з такими досягненнями, як освоєння космічного простору, використання атомної енергії і створення складних кібернетичних машин, практичне використання знаходять все метали. Тільки рубідій і цезій поки мають досить обмежене застосування через їх високу вартість.
Застосування лужних металів в хімічній промисловості. Найбільш широко в хімічній промисловості застосовують натрій. Це в першу чергу пов’язано з його особливими каталітичними властивостями, що їх виявляють при реакціях конденсації і полімеризації. В даний час в усьому світі натрію отримують близько сотні тисяч т. Варто окремо зупинитися на ролі натрію як каталізатора при отриманні каучуку.
Синтетичний каучук в промисловому масштабі був вперше отриманий за способом академіка С.В.Лебедєва полімеризацією бутадієну. Ця реакція проходить в присутності натрію. Мабуть, натрій приєднується до бутадієну і дає проміжне з'єднання полярного типу:
СН2 = СН — CH = CH2 + 2Na → NaCH2 — СН = СН — CH2Na Це проміжна сполука приєднує молекулу бутадієну:
NaCH2 — СН = СН — CH2Na + СН2 = СН — СН — CH2 → NaCH2 — СН = СН —
СН = СН — СН = СН — CH2Na
Так відбувається подовження вуглецевого ланцюга. В результаті утворюються макромолекули, що містять 1500-4000 еле ментарних ланок. Даний метод часто називають буна-процесом. Ця назва походить від слів бутадієн і натрій.
![]() Велика кількість натрію
витрачається для отримання тетраетилсвинцю (С2Н5) 4РЬ. Ця
сполука має цінні властивості – воно уповільнює швидкість горіння бензину. При
великій швидкості горіння бензину в моторі машини відбувається детонація, тобто
реакція горіння нагадує вибухову реакцію. Це призводить до передчасного зносу
мотора. Для попередження детонації до бензину додають
антидетонатор-тетраетилсвинець.
Велика кількість натрію
витрачається для отримання тетраетилсвинцю (С2Н5) 4РЬ. Ця
сполука має цінні властивості – воно уповільнює швидкість горіння бензину. При
великій швидкості горіння бензину в моторі машини відбувається детонація, тобто
реакція горіння нагадує вибухову реакцію. Це призводить до передчасного зносу
мотора. Для попередження детонації до бензину додають
антидетонатор-тетраетилсвинець.
Ця речовина готують взаємодією хлористого етилу е натрієм; натрій використовують для цієї мети у вигляді сплаву зі свинцем:
4PbNa + 4С2Н6С1 → (С2Н5)4Рb + 3Рb + 4NaCl
Непрореагіровавшій свинець знову використовують для отримання сплаву з натрієм.
У органічної хімії існує велика кількість реакцій, що мають промислове значення, в яких натрій або бере безпосередню участь, або служить каталізатором. Звичайно, і інші лужні метали могли б знайти таке ж застосування, але вони дорожче натрію.
Лужні метали в певних випадках дають різні органічні сполуки. Найпростішими з них є алкоголяти, які легко отримати в умовах шкільної лабораторії. Для цього в пробірку налийте кілька мілілітрів спирту і киньте туди невеликий шматочок (завбільшки з горошину) натрію або калію.
Відбувається виділення водню, і виходить відповідний алкоголят:
2С2Н5ОН + 2Na → 2C2H5ONa + H2↑ При приливанні води алкоголят розкладається:
C2H6ONa + Н2О → С2Н5ОН + NaOH
В даний час відомо велика кількість різних органічних сполук, що містять в своєму складі лужні метали. Багато з них знаходять застосування в різних органічних синтезах.
Застосування лужних металів в металургії. Лужні метали, завдяки їх активності і здатності давати різні сплави, використовують в металургії, хоча і в обмежених кількостях.
Натрій застосовують для розкислення деяких кольорових металів, т. Е. Для видалення з них кисню, а також інших домішок, зокрема сірки, з якої він дає міцні сульфіди. Як раскислитель, незважаючи на велику активність, натрій має ряд недоліків. Він володіє невеликою щільністю і тому плаває на поверхні більш важких металів. З огляду на те що він порівняно легко випаровується, його можна використовувати для розкислення тільки легкоплавких сплавів.
Більш цінними властивостями як раскислитель володіє літій, так як він має більшу спорідненість до кисню і сірки і кипить при більш високій температурі в порівнянні з натрієм - при 1330°С.
Застосовують лужні метали також і для отримання деяких рідкісних металів металотермічним методом. Це застосування засноване на спорідненість даних метал-лов до кисню і хлору.
Раніше широко використовували метод отримання титану з його тетрахлорида за допомогою натрію:
TiCl4 + 4Na = Ti + 4NaCl
Тетрахлорид титану і натрій поміщали в сталевий посудину (бомбу) з щільно кришкою, що загвинчується. Посудина попередньо заповнювали аргоном. При нагріванні протікала бурхлива реакція, в результаті якої і відбувалося відновлення титану. В даний час
![]() замість натрію в якості Мал.
44. Отримання рідкого сплаву натрію і калію відновника беруть магній.
замість натрію в якості Мал.
44. Отримання рідкого сплаву натрію і калію відновника беруть магній.
Лужні метали дають сплави між собою в будь-яких співвідношеннях. Велике практичне значення мають калій-натрієві сплави, так як вони при кімнатній температурі рідкі. Сплав, що містить 23% натрію, плавиться при 12,5°С. Такий легкоплавкий сплав можна отримати в лабораторних умовах. Для цього в пробірку наливають гас і опускають в нього шматочки калію і натрію. Натрію потрібно взяти в два рази менше в порівнянні з калієм. Потім пробірку нагрівають до розплавлення металів. Під шаром гасу такий сплав може довго зберігатися. На повітрі він відразу ж спалахує.
В умовах шкільної лабораторії для збереження рідкий сплав натрію з калієм запаюють в пробірці (мал. 44). Спочатку виготовляють пробірку. З цією метою кінець скляної трубки (1) діаметром 8-10 мм запаюють і відтягнутий гострий кінець (2) деякий час нагрівають, щоб надати йому овальне дно (3). Для вирівнювання дна в пробірці час від часу створюють тиск повітря за допомогою груші. В отриману пробірку поміщають шматочки калію і натрію (4) і пробірку (5) запаюють. Після охолодження пробірку знову нагрівають, тримаючи її в горизонтальному положенні, до отримання рідкого сплаву металів, потім повільно нахиляють, щоб злити сплав в чистий кінець пробірки. При цьому оксиди і гідроксиду залишаються у вигляді білого нальоту на стінках пробірки, і сплав зберігає блискучу поверхню.
Лужні метали можуть давати сплави і з лужноземельними металами, проте в обмежених співвідношеннях. Наприклад, в розплавленому натрію при 700 ° С розчиняється 10% кальцію, але при охолодженні він практично повністю виділяється з натрію. Великого застосування ці сплави в даний час поки не знаходять.
Всі лужні метали добре сплавляються з ртуттю. Ці сплави називають амальгамою. При цьому утворюються певні сполуки. Наприклад, у натрію отримано вісім сполук з ртуттю: NaHg2; NaHg4, Na12Hg13, NaHg, Na3Hg2, Na5Hg2, Na3Hg, Na5Hg.
Подібні сполуки металів один з одним називають інтерметалічними. Звичайні валентності металів в інтерметалічних сполукаї не дотримуются.
Амальгами можна легко приготувати в умовах шкільної лабораторії, проводячи електроліз відповідної солі з ртутним катодом. Вище вже було викладено метод отримання амальгами натрію. Подібним же чином готують амальгами інших металів. Можна отримувати амальгами і шляхом безпосереднього з'єднання ртуті з металами. Для цього наливають невелику кількість ртуті і на неї поміщають шматочок натрію або калію (з горошину). Потім метал обережно (!) притискають товкачем на дно ступки. При цьому чутно потріскування. Якщо взяти натрію або калію більше, то з-під шару ртуті іноді виривається полум'я (реакція супроводжується виділенням значної кількості теплоти).
Амальгаму натрію або калію можна приготувати такоже і під шаром гасу. Для цього в пробірку наливають 5-6 мл гасу і 1-1,5 мл ртуті. Птім пробірку обережно підігрівають до 60-80°С і поміщають в неї невеликі шматочки металу, які притискають до ртуті скляною паличкою. (Від великих шматків металу може спалахнути гас.)
Лужні метали розчиняються і в інших металах. У важкі метали вони, як правило, розчиняються незначно (соті або навіть тисячні частки відсотка).
Незначні добавки лужних металів часто покращують механічні властивості металів. Наприклад, соті частки відсотка літію, додані до алюмінію, підвищують його твердість; 0,4% літію; додані до свинцю, в три рази підвищують його твердість, і в той же час опір на вигин не змінюється. Сплави свинцю з натрієм отримують також шляхом спільного нагрівання металів. З свинцем натрій дає велику кількість різних сполук: Na4Pb, Na2Pb, NaPb, Na2Pb3, Na5Pb2, Na4Pb2, Na15Pb13. Сплави свинцю з натрієм застосовують для отримання тетраетилсвинцю Рb(С2Н5)4, який додають в бензин для попередження детонації в двигунах внутрішнього згорання.
Застосування лужних металів в атомній енергетиці.
Лужні метали використовують в атомній енергетиці для відводу теплоти від атомних реакторів, тобто вони виконують роль теплоносіїв. Схема застосування металів для цієї мети приведена на малюнку 45.
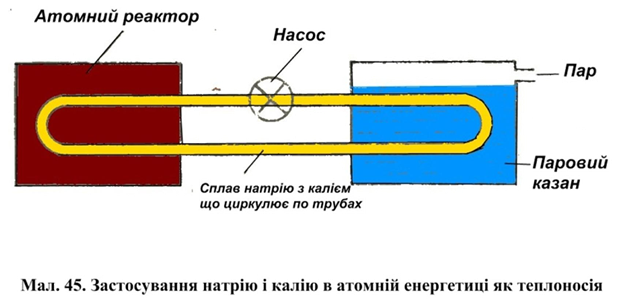
Сплав натрію з калієм, який при звичайній температурі-рідина, циркулює по металевих трубах (найкраще труби виготовляти з цирконію, так як він не поглинає нейтронів, що викликають ланцюгову реакцію поділу ядер урану).
Теплота, що виробляється в реакторі, нагріває сплав натрію з калієм. Такий сплав віддає теплоту паронагрівача. Добутий пар приводить в рух турбіну.
Застосування лужних металів для цієї мети осно-вано на їх властивості. Лужні метали на відміну від води нагріваються до порівняно високих температур (близько 600-700°С). У порівнянні з іншими теплоносіями, наприклад з ртуттю, вони мають більш висо-кою теплоємністю. У той же час з огляду на невелику в'язкості і невеликої щільності енергії на їх циркуляцію витрачається трохи. Цінною перевагою лужних металів служить і те, що вони, на відміну від багатьох металів, майже не поглинають нейтрони і, таким чином, не уповільнюють ланцюгову реакцію поділу ядер урану. Для відводу теплоти від реакторів, звичайно, можна застосовувати і воду. Однак вода, особливо при високих температурах, викликає корозію трубопроводів. Лужні метали в цьому відношенні вигідно відрізняються від води, так як вони не викликають корозії.
Застосування лужних металів в нових джерелах світла і для виготовлення фотоелементів. В даний час для отримання світла використовують головним чином електричні лампи розжарювання з вольфрамової ниткою. Але ці лампи як джерело світла дуже недосконалі, так як в світло перетворюється лише 9,6% електричної енергії. Інша енергія переходить в теплоту і червоне випромінювання, що не вловлює людським оком. Наприклад, в червоне випромінювання переходить до 65% енергії. Вчені багатьох країн світу проводять велику роботу з вивчення нових джерел, світла. (У нашій країні розроблені більш економічні люмінесцентні лампи, які при однаковій потужності споживають енергії в 3-4 рази менше в порівнянні з лампами розжарювання.)
Поряд із зазначеним типом ламп все більше застосування знаходять газорозрядні лампи. У скляному балоні, в якому створений вакуум, знаходиться невелика кількість парів металу, і через них пропускають електричний струм. За рахунок поглинається електричної енергії відбувається перескок електронів зовнішніх оболонок на ще більш віддалені орбіти. Слідом за поглинанням енергії за рахунок перескоку електронів з віддалених від ядра орбіт на ближчі відбувається виділення енергії, головним чином у вигляді світла.
Найбільш часто в газорозрядних лампах використовують пари ртуті і натрію. Ртутні лампи для освітлення не застосовують, так як вони випускають багато фіолетових і ультрафіолетових променів, які надають шкірі людини зеленуватий відтінок, а губам – майже чорний. Натрієві лампи теж поки не знаходять широкого застосування для цілей загального освітлення, так як пари натрію випускають головним чином жовте світло, що також сильно спотворює природні кольори. Інтенсивна жовте забарвлення парів натрію пов'язана з випусканням ними світла з довжинами хвиль 589 000 і 589 600 нм, що лежать в жовтій частині спектра. Поява жовтого світла пояснюється перескоками валентного електрона. Атом натрію має таке розташування електронів:
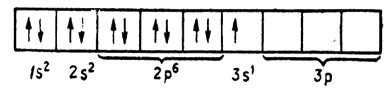
На третьому електронному рівні він має один 5-електрон, підрівень 3 р електронами чи не зайнятий. При нагріванні парів натрію або при їх освітленні відбувається збудження атома, що супроводжується перескоком елек-трону з підрівня 3 s1 на підрівень 3 р1:
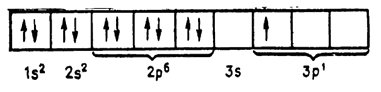
Зворотний перескок електрона на підрівень 3s і супроводжується випусканням жовтого світіння.
Властивість парів натрію давати інтенсивне жовте світіння було використано для створення штучної комети – хмари парів натрію. В свій час цей експеримент провели радянські дослідники – було запущено ракету, яка на висоті 150 000 км над Землею створила хмара пари натрію. За 4 хв ця хмара досягла в поперечнику 600 км і її було видно неозброєним оком. Експеримент був проведений з науковою метою. Для утворення парів натрію в ракеті був використаний термітний запал. В результаті реакції:
Fе2O2 + 2А1= Al2O3 + 2Fe
була досягнута висока температура (майже 3000°С), і натрій, який знаходився
разом з термітом, перейшов в пар.
Натрієві лампи, завдяки великій потужності і економічності, застосовували при освітленні доріг, великих складів поки їх не витіснили більш безпечні світлодіодні лампи.
![]() У лужних металів валентні електрони слабо пов'язані з
ядром і легко відриваються від атомів як при хімічних реакціях, так і під дією
електричного струму, при нагріванні і навіть при освітленні (мал. 46). Цим
лужні метали відрізняються від лужноземельних та інших металів. Особливо
неміцно пов'язаний з отрутаром валентний електрон атома цезію. Ця властивість
знайшла застосування в пристрої спеціальних приладів – фотоелементів. У
фотоелементах пластинка, покрита цезієм, під дією світла весь час випускає електрони,
і в приладі виникає електричний струм. За зовнішнім виглядом фотоелемент
нагадує радіолампу (мал. 47). Він має два висновки, підключені до джерела
електричного струму. Коли на фотоелемент світло не падає, струм через
фотоелемент не проходить. Коли ж на катод, тобто на світлочутливий
У лужних металів валентні електрони слабо пов'язані з
ядром і легко відриваються від атомів як при хімічних реакціях, так і під дією
електричного струму, при нагріванні і навіть при освітленні (мал. 46). Цим
лужні метали відрізняються від лужноземельних та інших металів. Особливо
неміцно пов'язаний з отрутаром валентний електрон атома цезію. Ця властивість
знайшла застосування в пристрої спеціальних приладів – фотоелементів. У
фотоелементах пластинка, покрита цезієм, під дією світла весь час випускає електрони,
і в приладі виникає електричний струм. За зовнішнім виглядом фотоелемент
нагадує радіолампу (мал. 47). Він має два висновки, підключені до джерела
електричного струму. Коли на фотоелемент світло не падає, струм через
фотоелемент не проходить. Коли ж на катод, тобто на світлочутливий
шар, потрапляє світло, з нього вилітають електрони, які під впливом
різниці потенціалів направляються до анода, виготовленому у вигляді невеликого кільця. При цьому в електричному ланцюзі піде потік електронів (мал. 48). Виниклий електричний струм можна посилити і направити його до відповідного регулюючий пристрій.
Наведемо кілька прикладів, які показують використання фотоелементів в сучасному житті людини.
Раніше в метрополітені працювали сотні касирів, які продавали в рік мільярди квитків. Сотні контролерів відривали частину квитка з написом «контроль» і пропускали пасажирів. Зараз ситуація змінилася. Пасажир опускає жетон або монету в отвір автомата і проходить. Роль контролера виконує фотоелемент. Пасажир перетинає вузький пучок світла, що падає на фотоелемент. Це короткочасна відсутність світла реєструє фотоелемент – жетон або монета використана, так як вони призначені для пропуску однієї людини. Але якщо хто-небудь спробує пройти безкоштовно, то фотоелемент це помітить, і в ту ж секунду шлях буде закритий. Тут працює фотореле: фотоелемент, підсилювач виникає електричного струму і електромагнітне реле.
Фотореле – один з найпоширеніших приладів в сучасній автоматиці. Воно дозволяє за допомогою променя світла включати і вимикати різні прилади, машини, регулювати їх роботу. Деякі фотоелементи чутливі до інфрачервоних променів, тому їх використовують в темряві, в тумані для охорони різних об’єктів і для інших цілей. Фотореле дуже точно зазначає момент проходження через фініш мотоцикліста або бігуна .
На каналах, річках завжди є бакени, щоб вказувати в темряві шлях кораблям. На безлічі річок і каналів світу працював багатомільйонний загін бакенників. В даний час на бакенах встановлюють фотоелементи. Увечері, при настанні темряви, коли в фотоелемент перестане надходити світло, автоматично засвічується лампочка.
Мал. 49. Використання фотоелемента при тренуванні в стрільбі
Фотоелемент іноді використовують при тренуванні в стрілянині. Стрілець натискає курок рушниці і ... стріляє світлом. Рушниця посилає вузький пучок світла. В, центрі мішені встановлений невеликий фотоелемент. Якщо світло потрапив в фотоелемент, автоматично загорається на 2-3 сек електрична лампочка, яка реєструє потрапляння в ціль (рис. 49).
Великим досягненням фотоелектроніки було свого часу створення фотоелектронних помножувачів (рис. 50), які посилюють фотострум в кілька тисяч разів. У фотоумножителе не один катод, а кілька. Світло падає на перший катод і вириває кілька електронів. Ці електрони потрапляють на інший катод, що знаходиться під великою напругою. З нього кожен електрон вибиває ще кілька електронів. Цей потік електронів йде до наступного катода і т. д. Кожен електрон вибиває не менше двох нових електронів. Якщо у фотопомножувачі є 10 платівок, то неважко підрахувати, що фотострум посилиться в 512 разів:
1 → 2 → 4 → 8 → 16 → 32 → 64 → 128 →256 → 512
Фотоелементи і фотоелектронні помножувачі – найважливіші прилади в сучасній автоматиці, телемехані-ке і в різних керуючих і регулюючих пристроях.
Побудовано фотоелементи, які бачать в темноті. Особливо вони зручні для автомобілістів. Фари автомобіля закриті фільтром і пропускають тільки невидимі інфрачервоні промені, які і висвітлюють дорогу. Промені відбиваються від предметів і потрапляють в об'єктив цього своєрідного електронного очі (мал. 51). Лінзи об'єктива направляють відбиті промені в перетворювач. Вони проходять через його скляну стінку і потрапляють на цезієві найтоншу пластинку, з якою вибивають електрони. На цій платівці виходить перевернуте невидиме зображення дороги і предметів, що знаходяться перед автомобілем. У місцях найбільшого опромінення ви-Біван більше електронів, в місцях меншого облученія- менше. Електрони, вибиті з поверхні пластинки, летять на протилежну стінку Перетворюва-теля, покриту шаром люмінофора – речовини, що світиться під дією ударяющих електронів. На шарі люмінофору з'являється видиме зображення.
Цезій знайшов ще одне цікаве застосування - в пристрої цезієвого годинника (атомних). Ядра атомів цезію мають магнітний момент, тобто є ніби-то маленькими магнітиками. Магнітні моменти ядер можуть бути паралельними або антипаралельними. При переходах з одного стану в інший випромінюється електромагнітне випромінювання з довжиною хвилі в 3,26 см і частотою в 9 192 631 770 сек–1. Це час не змінюється – цезієві годинник один з найточніших в світі.
Історія застосування металів підгрупи міді. Археологічні знахідки вказують, що метали підгрупи міді досить широко використовувалися людьми для виготовлення прикрас і предметів побуту близько 7- 8 тис. років тому.
Один з найдавніших з відомих сплавів – сплав міді в поселеннях людини знайдений в передгір'ях Копет-Дага.

Мал. 52. «Багдадська батарея» найбільш давнє відоме джерело струму
Його датують V -IV тис. До н. е., т. е. приблизно шестітисячелетней давності.
Коли ми говоримо про дати застосування виробів з міді і її сплавів, то ми в більшості випадків опираємося на даних археологічних розкопок і кожне нове відкриття змінює наші погляди. Так, до недавнього часу вважалося, що історія ери електрики почалася з 1786 р після дослідів Луїджі Гальвані. У той же час археологічні розкопки кажуть, що з електрикою люди ознайомилися багато століть назад. Археологи неподалік від Багдада, а потім на берегах Тигру знайшли глиняні судини заввишки близько 10 см і покриті глазур'ю (мал. 52). Усередині судини виявили мідні циліндри, в які були вставлені залізні стрижні. У судинах було невелика кількість бітуму. Мідні циліндри були сильно роз'їдені. Що це таке? Єдине пояснення подібного «приладу» - гальванічний елемент. Вчені відновили (реконструювали) окремі частини елемента, залили електролітом і отримали електричний струм! Але в той час не було електричних лампочок, електромоторів і т. д. Для чого нашим предкам потрібен був електричний струм? При розкопках, що відносяться до того ж періоду, знайшли срібні вироби, покриті найтоншої позолотою. Не виключено, що ця позолота була отримана електролітичним способом. Так, під час археологічних розкопок виявлено найдавніше застосування міді для пристрою гальванічних елементів і використовуваних для гальванічного покриття виробів золотом.
Мідь поряд з залізом і золотом здавна застосовувалася в якості платіжного засобу. Так, в Іліаді написанио:
«Дітям Атрея, царям Агамемнона і Менелая
Чистого тисячу заходів подарував він вина дорогого,
А решту вина пишнокудрие діти ахейців
Все купували, платячи хто залізом, хто яскравою міддю ».
Порівняно високої досконалості у виготовленні різних виробів з міді та бронзи досягли російські майстри. Уже до кінця XV в. в Росії (Московській державі) в широких масштабах виготовлялися бронзові гармати. З 1479 року в Москві існувала «гарматна хата», а з 1488 року - «гарматний двір», де проводилася виливок бронзових гармат. У 1586 р мас-тером Андрієм Чоховим була відлита знаменита бронзова гармата під назвою Цар-гармата (мал. 53). Вона важить близько 40 т, довжина її - 5,3 м, а калібр (діаметр) жерла - 89 см. У боях ця гармата не брала участь і залишилась як пам'ятник високої майстерності російської зброярів. На території Московського Кремля знаходиться інший унікальний пам'ятник, залишений російськими ливарниками, - Цар-дзвін (рис. 54). Він був відлитий в 1735 р майстрами І. Ф. Моторіним і М. І. Моториним і призначався для дзвіниці церкви Івана Великого. Це дзвін з масою 200 т, висотою - 6,14 м і діаметром - 6,6 м.

Мал. 53. Цар-гармата Мал. 54. Цар-дзвін
Застосування срібла і золота також втрачається в глибокій старовині. Вони вже в давні часи служили виразниками вартості товарів.
Золото стало вживатися у вигляді злитків в якості грошей за 1500 років до н. е. в найбільш розвинених в той час країнах.
Використання золота як мінової вартості зіграло велику позитивну роль у розвитку людського суспільства.
Чому ж найбільш придатним металом для ізготов¬ленія грошей стало золото? Це пояснюється тим, що воно хімічно стійко / не змінюється в часі і для його добування всюди потрібно однакова витрата людської праці.
В середні віки люди багато праці і зусиль вклали, в розробку способів отримання золота з неблагородних металів. З чого тільки не намагалися в той час отримати золото! Наприклад, 1673 р алхімік Йоганн Бехер запропонував добувати золото з річкового піску. Влада Амстердама, де він проживав в той час, виділили йому велику суму грошей, але попередили, що якщо не буде золота, то Бехер буде повішений. Під його керівництвом була побудована величезна піч, водяне колесо і інші споруди. У 1679 р він «отримав» деяка кількість золота. Не чекаючи великої нагороди за свій «винахід», він розсудливо сховався.
Про алхіміків було видано чимало законів. Один з них, виданий в XIV в. в Англії, був такий: «Нікому, хто б він не був, не дозволяється перетворювати прості метали в золото». Охочих порушити цей закон було багато, але порушити його ніхто не зміг.
Алхіміки в пошуках способів отримання дорогоцінних металів зробили багато відкриттів. Ними було відкрито багато нових елементів, розроблені нові технічні прийоми в експерименті, зокрема з розділення сумішей. Відкриття алхіміків підготували перехід до сучасної хімії, яка заперечує можливість перетворення одних елементів в інші при проведенні хімічних реакцій. Мрія алхіміків про перетворення неблагородних металів в золото в даний час в якійсь мірі збулася: зараз в науковосследовательскіх лабораторіях золото можна отримати з ртуті, вольфраму і деяких інших елементів, використовуючи ядерні реакції. Але таке золото в тисячу разів дорожче природного золота, тому отримання його з інших металів має чисто науковий інтерес.
Про рівень розвитку ювелірного мистецтва, грошових відносин ми можемо судити не тільки за історичними документам, але і при вивченні скарбів. Ось найцікавіші знахідки.
Влітку 1965 р долині річки Оки, під Муромом, був розритий великий курган. Він виявився похованням. Виявлена могильна яма, залишки похоронної тризни і останки померлих. Поряд з кам'яними і бронзовими виробами і зброєю було знайдено золоту каблучку оригінальної форми (мал. 55) . Як визначили, поховання було за 2000 років до н. е.
Мал. 55. Золоте кільце 2000 років до н.е. Мал. 56. Новгородський золотий
карбованець 1654

Золоті прикраси стародавньої Болгарії

Мал. 57. Давньогрецька золота прикраса, та давньоримська прикраса із золота та коштовних каменів.

Мал. 58. Срібний глечик і ритон (ріг) скіфських царів
Великий скарб золотих і срібних речей був знайдений в Запорізькій області, в кургані, в 1969 р. Курган відноситься до скіфського періоду, і в ньому, мабуть, був похований один з скіфських царів. Курган представляв насип висотою в 9 ж і був облицьований вапняними плитами. Знайдені речі дають чітке уявлення про високу культуру і про застосування золота, міді та срібла в побуті скіфських царів. На малюнку 58 зображені срібний ритон – ріг для вина із золотою окантовкою і срібний глечик. Вважають, що ці два предмета являли собою атрибути влади скіфського царя.
Застосування металів підгрупи міді в даний час. Приблизно половина виробленої міді в даний час використовується в радіотехнічної та електротехнічної промисловості. Це пов'язано з її хорошою електропровідністю і щодо високу корозійну стійкість. До міді, що йде на виготовлення електричних проводів, часто додають в невеликій кількості кадмій, який не знижує електропровідність міді, але підвищує її міцність на розрив.
Найдавніший сплав міді з цинком – латунь і в даний час проводиться в великих кількостях. Вміст цинку в латуні становить 30-45%. Вона застосовується для виготовлення різної арматури, дотичної з водою (крани, вентилі і т. д.), А також для виробництва різних труб. З латуні прокочують смуги і листи, що йдуть для вироблення найбільш разнооб-різних виробів (дріт, проізведенія'іскусств, предмети побуту і т. д.).
Латунь добре прокочується, штампується і трохи дешевше міді, так як цинк дешевший метал в порівнянні з міддю.
Інші сплави міді називаються бронзами. Найбільш поширена бронза – олов'яна. Вона містить від 5 до 80% олова. Залежно від змісту олова властивості та призначення бронзи змінюються. При змісті олова до 10-13% її колір червонуватожовтий, а більше 27-30% - білий. Підшипникова бронза містить 81-87% міді. Для виготовлення підшипників, різних гальмівних пристроїв, де відбувається ковзання металу, застосовуються бронзи, що містять до 45% свинцю. У вартових та інших точних механізмах, де потрібна висока механічна міцність і корозійна стійкість, застосовується берилієва бронза, що містить 1-2% берилію. Її міцність дорівнює міцності стали.
У побуті і особливо в хімічній промисловості застосовують сплави міді з нікелем, наприклад монель, в якому відношення міді до нікелю одно 2: 1, і мельхіор, в якому це відношення дорівнює 4 : 1. Мельхіор по зовнішньому вигляду схожий на срібло, з нього готують предмети домашнього побуту: ложки, вилки, підноси і т. Д. Монель-метал застосовують для виготовлення монет, різних реакторів для хімічної промисловості, так як цей сплав корозійно стійкий.
Срібло у великих кількостях і по теперішній час йде для виготовлення розмінної монети. Монетну срібло в США містить 90% срібла і 10% міді. Англійське стерлінгове срібло містить 92,5% срібла і 7,5% міді. Недолік срібла, який в даний час відчувається в усьому світі, змушує переходити до виготовлення монет з інших сплавів.
Металеве срібло в невеликих кількостях йде на виготовлення відповідальних частин хімічної апаратури. Срібло стійко по відношенню до розплавленим лугів, і тому з нього роблять тиглі і апаратуру для лужних середовищ. Срібло застосовують для електролітичного сріблення різних металів, так як воно оберігає вироби від корозії, знижує питомий електричний опір контактів.
Срібло володіє сильними бактерицидними властивостями. Це було відомо ще в стародавні часи. Так, наприклад, для лікування ран воїни Олександра Македонського застосовували срібні пластинки, які накладувались на рани. Срібло вбивало мікроби, що сприяло загоєнню ран. Вода, яка стикалася з сріблом, довгий час зберігається свіжою, так як в ній не розвиваються мікроорганізми. Пояснюється це тим, що срібло в невеликому ступені кородує і у вигляді хлориду срібла переходить в розчин. Оскільки ця речовина володіє невеликою розчинністю, в розчині є незначна кількість іонів срібла. Фільтрування води через посріблений кварцовий пісок також очищає воду від бактерій.
З сплавів срібла, крім монетного металу, має значення сплав для пломбування зубів. Він складається з 33% Ag, 52% Hg, 12,5% Sn, 2% Сі і 0,5% Zn. При затвердінні цей сплав трохи розширюється і заповнює порожнину яку пломбують.
Золото, як і багато століть назад, виконує роль міри вартості товарів. Перші золоті монети з'явилися 2500-2600 років назад в західній частині Малої Азії, в державі Лідії. Всього у всьому світі за час існування людства було видобуто близько 100 000 т золота. Це приблизно 5181 мг.
Деяка кількість золота у вигляді сплавів, як і раніше, йде на виготовлення прикрас. Склад сплавів позначається пробою, яка показує число частин золота в 1000 частинах сплаву. Зараз випускають вироби 750, 583, і 375-ї проби. Колишня російська проба показує число золотників золота в 96 золотниках (одному фунті) сплаву. Більшість виробів виготовляли зі сплаву 56-ї проби. Це означає, що в 96 частинах сплаву 56 частин доводиться на чисте золото.
Деяка кількість золота йде на золочення міді та інших металів, а також на виготовлення орденов.Іногда з золота роблять деякі медалі, в тому числі спортивні. В якійсь мірі звичай нагороджувати медалями видатних спортсменів бере свій початок з часів Стародавньої Греції. В «Одіссеї» Гомера вказується, що переможцеві спортивних ігор, влаштованих Ахіллесом, вручали по шматку заліза і золота. Цікава історія однієї золотої Нобелівської медалі, якою був нагороджений відомий фізик Нільс Бор, який створив теорію будови електронних оболонок атома водню. Під час окупації гітлерівцями Данії, де жив Нільс Бор, ця медаль була розчинена в «царській горілці» (суміш соляної і азотної кислот), щоб вона не дісталася фашистам. Після війни хлорид золота був відновлений до металу, з якого знову виготовили медаль. Рассказ про металах першої групи закінчений. Ми розглянули властивості, застосування і отримання металів і їх сполук. З кожним роком будуть відкриватися все нові і нові властивості цих металів, дешевшати способи їх виробництва. В майбутньому видобуток лужних металів і металів підгрупи міді буде збільшуватися, а їх застосування розширюватися.

Золота Нобелівська медаль Нільса Бора


про публікацію авторської розробки
Додати розробку
