Естери: номенклатура, фізичні та хімічні властивості використання
Про матеріал
В цій презентації:
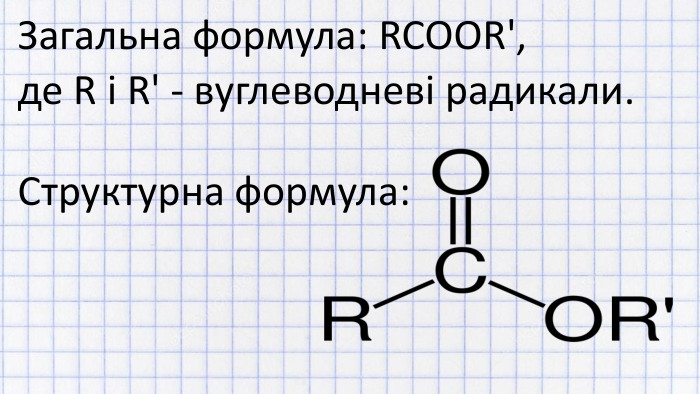
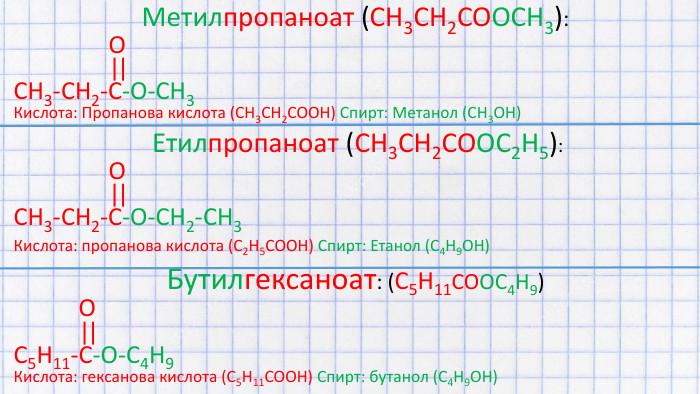
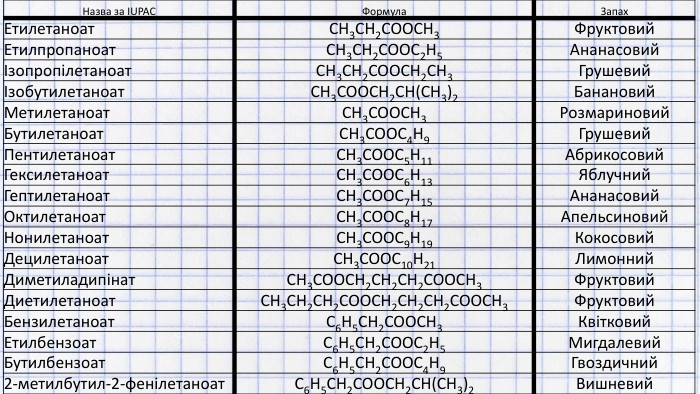
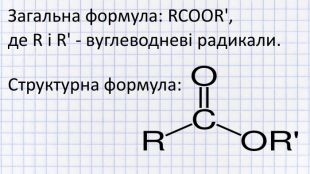
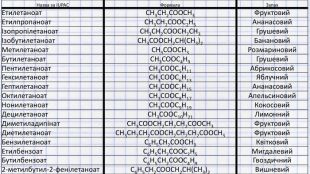
Ознайомимося з будовою та класифікацією естерів. Номенклатурою ІЮПАК і не тільки
Вивчимо їх фізичні та хімічні властивості. зокреме розглянемо гідроліз
Дізнаємося про їх практичне застосування в різних галузях.
Презентація буде корисною для:
Студентів, які вивчають хімію.
Всім, хто цікавиться хімією та наукою.
На основі презентації було зроблено відео
Поклинання на відео: https://www.youtube.com/watch?v=0drl5FMgvao
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
Дякую!


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку