Ферум. Характеристика елемента. Поширення в природі. Біологічна роль. Фізичні й хімічні властивості заліза: взаємодія з неметалами, водою, кислотами, солями
Профільний рівень. 11 клас. Тема 2. Ферум. Залізо
Тема уроку: Ферум. Характеристика елемента. Поширення в природі. Біологічна роль. Фізичні й хімічні властивості заліза: взаємодія з неметалами, водою, кислотами, солями
Мета уроку:
Освітня: сформувати в учнів знання про фізичні й хімічні властивості заліза, сполук Феруму (ІІ) та Феруму (ІІІ), порівняти властивості сполук Феруму(ІІ) і Феруму (ІІІ), закріпити знання про залежність властивостей сполук Феруму від ступеня окиснення атомів, сформувати вміння студентів записувати рівняння реакцій, які характеризують основні хімічні властивості заліза й сполук Феруму, розглянути біологічну роль заліза, його функції в організмі.
Розвиваюча: розвинути критичність, систематичність, послідовність мислення; встановлювати причино- наслідкові зв`язки; сформувати вміння порівнювати, аналізувати, робити висновки, працювати з додатковою науково-популярною літературою, готувати стислі повідомлення, розвивати вміння самостійно працювати з текстом та малюнками підручника.
Виховна: виховувати розуміння цінності природи як першоджерела матеріальних і духовних сил кожної людини; формувати науковий світогляд, здійснювати екологічне, естетичне, патріотичне виховання.
Тип уроку: комбінований
Методи і методичні прийоми: словесні (розповідь, пояснення, бесіда),наочні (демонстрація таблиць, гербаріїв), практичні (робота з таблицями, виконання лабораторної роботи, демонстрації).
Предметні компетентності:
учні складають рівняння реакцій, що підтверджують відновні властивості заліза, характеризують фізичні властивості та застосування заліза, порівнюють фізичні та хімічні властивості алюмінію і заліза, оцінюють біологічне значення Феруму.
Ключові компетентності:
спілкування державною мовою, математична компетентність, основні компетентності у природничих науках і технологіях, інформаційно-цифрова компетентність, екологічна грамотність і здорове життя, уміння вчитися упродовж усього життя.
Внутрішньопредметні і міжпредметні зв’язки: біологія, фізика, географія
Обладнання: реактиви періодична система хімічних елементів, таблиця розчинності, ряд активності металів, солі Феруму (ІІ), (ІІІ), червона кров’яна сіль, жовта кров’яна сіль , роданід амонію , штатив з пробірками , колекція сполук заліза, металева проволока.
Література:
- Навчальна програма для закладів загальної середньої освіти «Хімія 10-11 класи. Профільний рівень» URL:https://mon.gov.ua/ua/osvita/zagalna-serednya-osvita (дата звернення: 09.10.2022)
- Хімія : підруч. для 11 кл. закладів загальної середньої освіти : профіл. рівень. Григорович О.В.- Х.: Ранок, 2018.- 310 с.
Структура уроку:
|
№ етапу |
Етап уроку |
Час (хв.) |
|
1 |
Організаційний момент |
1 |
|
2 |
Перевірка домашнього завдання |
11 |
|
3 |
Мотивація навчальної діяльності, повідомлення теми, мети і завдань |
1 |
|
4 |
Сприйняття і усвідомлення учнями нового матеріалу, осмислення зв’язків та залежностей між елементами виучуваного |
20 |
|
5 |
Узагальнення і систематизація вивченого |
10 |
|
6 |
Підбиття підсумків уроку, аргументація оцінок |
1 |
|
7 |
Повідомлення домашнього завдання |
1 |
Хід уроку
І. Організаційний момент
Привітання. Перевірка присутності та готовності учнів до уроку.
ІІ. Актуалізація опорних знань
- Охарактеризуйте склад атома нукліда Алюмінію-27.
- Назвіть властивості алюмінію, завдяки яким цей метал використовують на практиці.
- Що таке періодична система хімічних елементів? (класифікація хімічних елементів, що встановлює залежність різних властивостей елементів від заряду їхнього атомного ядра).
- Які природні металічні елементи ви можете назвати? (золото, срібло, мідь, ртуть, платина).
- Скільки електронів містить атом Алюмінію, на скількох енергетичних рівнях вони розташовані? (містить 13 елетронів, на трьох енергетичних рівнях).
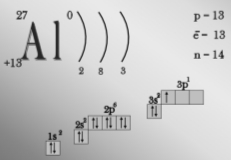
- Що таке амфотерність? (здатність сполук проявляти кислотні й основні властивості. Амфотерними є оксид Al2O3 і гідроксид Al(OH)3.)
- Що таке ртуть? (проста речовина, сріблясто-білий важкий метал, рідкий за кімнатної температури).
ІІІ. Мотивація навчальної діяльності, повідомлення теми, мети і завдань уроку
Давні єгиптяни називали його «вааепера», що означає „той, що народився у небі”. Давні копти називали його «каменем неба». Вироби з нього цінувалися дорожче за золото. Один східний деспот навіть видав указ, яким під страхом смертної кари заборонялося всім, крім нього, носити зроблені з цього металу прикраси. В „Одіссеї” Гомера розповідається, що переможцям спортивних змагань вручали шматок цього металу та шматок золота - найбільші на той час коштовності. Алхіміки вважали його настільки неблагородним металом, що навіть займатися ним не хотіли.
- Що ж це за метал? Які властивості він має? Про це ми дізнаємося на сьогоднішньому занятті.
Метали відомі здавна. Ще зі стародавності люди знали сім хімічних елементів, серед них і метал, який ми починаємо вивчати.
- Яку просту речовину ми швидше за все розуміємо під словом метал? Залізо.
«Залізо не лише основа всього світу, найголовніший метал оточуючої нас природи , але і основа культури та промисловості . воно знаряддя праці й війни. І важко в усій таблиці Менделєєва знайти інший такий елемент . який був би так тісно пов’язаний з минулими , сучасними та майбутніми долями людства » А.Е.Ферсман.
IV. Сприйняття і усвідомлення учнями нового матеріалу, осмислення зв’язків та залежностей між елементами виучуваного
Загальна характеристика хімічного елемента
Ферум — металічний елемент. Він має відносно невелику електронегативність 1,83 (за Полінгом), що характерно для більшості металічних елементів. За будовою електронної оболонки атома він є d-елементом, оскільки в його атомів електронами заповнюється d-підрівень:
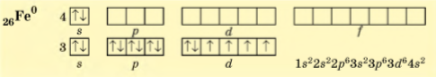
У більшості сполук Ферум виявляє два ступені окиснення. Втрачаючи два електрони зовнішнього енергетичного рівня, його атоми набувають заряд +2:
![]()
У такому стані в йонах Fe2+ на Зd-підрівні міститься шість електронів, але більш стабільним є стан, коли Зd-підрівень буде заповнений наполовину. Для цього йону Fe2+ необхідно віддати один електрон. У такий спосіб утворюються йони Fe3+, які мають стабільнішу електронну конфігурацію:
![]()
Унаслідок цього ступінь окиснення +3 для Феруму стабільніший за +2. Як виняток, Ферум може віддавати шість електронів і виявляти ступінь окиснення +6 . Однак сполуки, у яких містяться Fe+6, трапляються досить рідко. Сполук, у яких ступінь окиснення Феруму +8 , ще не виявлено.
Ферум(ІІ) оксид і ферум(ІІ) гідроксид — основні речовини, а ферум(ІІІ) оксид і ферум(ІІІ) гідроксид — амфотерні. Сполуки Феруму в ступені окиснення +3 виявляють окисні властивості.
Унаслідок цього під час хімічних реакцій атоми Феруму як металічного елемента можуть відщеплювати два, три, чотири або шість електронів і виявляти в сполуках ступені окиснення +2 (FеО), +3 (Fе203), +4 (К2Fе03) і +6 (К2Fе04),
1) Ферум.
2) Fe
3) Ar (Fe) = 56
4) (26, період 4, VІІІ, побічна).
5) (+26, nр=26, n=30, е=26).
6) ІІ, ІІІ
7) Ме
8) Fe - залізо.
Бачити молекулу неозброєним оком – реально, побувати в ній – запросто. Столиця Бельгії надає таку можливість , серед класичних європейських будівель виділяється атомна модель під назвою Атоміум, яка була спроектована до міжнародної виставки , що проходила в Брюсселі (мал.1)

Мал.1 «Атомна модель під назвою Атоміум»
Походження назви, поширення в природі
У чистому природному стані залізо зустрічається лише в небагатьох місцях на Землі , наприклад на заході Гренландії. Чисте залізо іноді знаходять в метеоритах (залізо космічного походження). Протягом останніх 50 років випало 453 метеоритних дощі , які принесли на Землю 672 т метеоритного заліза. Це залізо порівняно легко піддається обробці , й саме з нього людина почала виготовляти найпростіші знаряддя . Але , на жаль, метеорити за замовленням на Землю не падали , а потреба в залізі була постійною.
Набагато частіше залізо зустрічається у вигляді хімічних сполук.
За поширенням у природі Ферум серед металічних елементів посідає друге місце після Алюмінію. Ферум входить до складу майже усіх гірських порід , піску, глини , головним чином оксигеновмісних сполук , які називають залізними рудами.
Це :
бурі залізняки ( основний мінерал – лімоніт 2Fe2O3 *3H2O),
червоні залізняки ( основний мінерал -гематит Fe2O3),
магнітні залізняки ( основний мінерал - Fe3O4),
сидеритові руди ( основний мінерал - FeCO3 ) ,
залізний колчедан , або пірит FeS2
Біологічна роль Феруму
Ферум є біологічно важливим елементом. Він міститься в організмах усіх тварин і в рослин . Ферум входить до складу цитоплазми рослин , бере участь у процесі фотосинтезу. В організмі дорослої людини міститься близько
4 г Феруму. Він накопичується здебільшого в печінці , кістковому мозку, селезінці . Але основна частина Феруму входить до складу гемоглобіну – червоного пігменту крові, який виконує функцію переносу кисню від легень до тканин, а в зворотному напрямку — вуглекислого газу. Тому обов’язково треба вживати харчові продукти, багаті на Ферум: петрушку, печінку, телятину, гречку, курагу тощо.
Фізичні властивості Феруму
- Що називають властивостями речовини? (Ознаки, за якими одна речовина подібна до іншої, чи відрізняється від неї).
- Які види властивостей вам відомі? (Розрізняють властивості фізичні та хімічні)
- Які властивості називають фізичними? (Властивості, які можна побачити неозброєним оком чи виміряти за допомогою приладів).
Демонстрації «Природні сполуки Феруму»
Розгляньте зразок металу заліза і вкажіть його фізичні властивості користуючись алгоритмом :
Агрегатний стан ( тверда речовина );
Колір ( сріблясто – білого кольору або сірий метал
внаслідок швидкого окиснення на вологому
повітрі)
Запах ( без запаху)
Смак ( без смаку)
Металічний блиск ( добре виражений)
Відношення до води ( нерозчинний у воді)
Твердість ( м’який , досить ковкий)
Густина ( більша за воду 7,874г/см3)
Електропровідність ( добра )
Теплопровідність ( добра )
Температура плавлення 15390С , тугоплавкий з феромагнітними властивостями (легко намагнічується і розмагнічується .
Хімічні властивості Феруму
Лабораторний дослід « Якісні реакції на йони Fе2+ , Fе3+ »
Залізо – метал середньої хімічної активності.
У найстійкіших сполуках Ферум виявляє ступені окиснення +2,+3,+6.
1. Повільно окиснюється на вологому повітрі (процес іржавіння). У разі нагрівання взаємодіє з багатьма неметалами (галогенами , киснем, сіркою, фосфором , вуглецем , силіцієм), водою:
2Fе + ЗС12=2FеС13
ЗFе + 2О2=Fе3О 4
Fе + S =FеS
При дуже високій температурі реагує з :
ЗFе + С = Fе3С
4 Fе + 3Si = Fe4Si3
3Fe + 2P = Fe3P4
2.Взаємодіє з водою після зняття оксидної плівки:
У розжареному стані (понад 7000С) взаємодіє з водою (водяною парою)
ЗFе + 4Н20 = Fе304+4Н2
Fе304 (залізна окалина) — змішаний оксид (FеО • Fе203), найстійкіша оксигеновмісна сполука Феруму.
3.Залізо витискує менш активні метали з розчинів їх солей:
Fе + СиS04 = FеS04 + Си ↓
4. Залізо розчинається в розбавлених кислотах:
Fе + 2НС1→ FеС12 + Н2 ↑(без доступу повітря).
Fe + H2SO4 (p) = FeSO4 + H2↑
При доступі повітря йде подальше окиснення:
4FеС12 + 4НС1 + 02 → 4FеС13 + 2Н20
5.Концентровані сульфатна і нітратна кислоти за кімнатної температури пасивують залізо.
У разі взаємодії з розбавленою нітратною кислотою під час нагрівання утворюються сполуки Феруму(Ш), а в результаті дії дуже розбавленої — сполуки Феруму(П):
Fе + 4НNO3 (роз6, гар) = Fе(N03)з + N0 ↑+ 2Н20
5Fе + 12НNO3 (дуже розб, t =10 0-С) = 5Fе(NO3)2 + N2 ↑+ 6Н20
Сполуки Феруму(ІІ) і Феруму(ІІІ): оксиди та гідроксиди,солі
Ферум утворює такі оксиди та гідроксиди:
FеО Fе304 Fе203
Fе(0Н)2 Fе(0Н)3
Посилюються окисні властивостi--------------------------→
Послаблюються основні властивостi --------------------→
Посилення кислотних властивостей сполук Феруму(ІІІ) порівняно із сполуками Феруму(І І) пояснюється збільшенням ковалентності зв’язку Fe –O та із підвищенням ступеня окиснення Феруму.
Добування. Ферум(І І) оксид одержують термічним розкладанням ферум(П) оксалату та ферум ( І І ) гідроксиду без доступу повітря:
FеС2О4 = Fе О + СО + СО2
Fе(ОН)2 = FеО + Н2О
Ферум(Ш) оксид утворюється внаслідок розкладання Fе(ОН)3 на повітрі:
2Fе(ОН)3 = Fе2О3 + ЗН2О
Fе3О4 можна одержати у разі нагрівання (800 °С) заліза з водяною парою, а також із Fе2О3:
ЗFе + 4Н2О(пара) = Fе3О4 + 4Н2
13000C
6Fе2О3 ------→ 4Fе3О4 + О2
Із наведених прикладів видно, що для добування оксидів Феруму використовують непрямі способи . Вони ж лежать і в основі одержання гідроксидів Феруму:
FеSО4 + 2КОН = Fе(ОН)2 ↓ + К2SО4 (в атмосфері N2)
Fе2(SО4)3 + 6КОН = 2Fе(ОН)3 ↓ + ЗК2SО4
Усі оксиди і гідроксиди Феруму нерозчинні у воді.
Хімічні властивості сполук Феруму
Оксиди і гідроксиди Феруму обох ступенів окиснення мають амфотерні властивості. У сполук Феруму(ІІ) вони дуже слабко виражені , тому ферум(ІІ) оксид і ферум(ІІ) гідроксид виявляють переважно основні властивості:
FеО виявляє головним чином основні властивості , тому взаємодіє тільки з розчинами кислот:
FеО + Н2SО4 = FеSО4 + H2O
![]() Ферум(П) гідроксид виявляє , якщо він свіжодобутий і під час кип’ятіння , амфотерні властивості, але переважно основні:
Ферум(П) гідроксид виявляє , якщо він свіжодобутий і під час кип’ятіння , амфотерні властивості, але переважно основні:
Fе(ОН)2 + 2НС1(роз6) = FеС12 + 2Н20
Реагує з концентрованим розчином лугу утворюючи Натрій тетрагідроксиферат(ІІ):
Fе(ОН)2 +2NаОН(kon ω=50%) → Nа2[Fе(ОН)4]
Fе2О3 і Fе(ОН)3 — амфотерні сполуки, тому взаємодіють як з кислотами, так і лугами:
Fе2О3 + ЗН2SО4(роз6) = Fе2(SО4)3 + ЗН2О
Fе2О3 + 2NаОН —cnікания → 2NаFеО2 + Н2О
натрій метаферит(Ш)
Fе(ОН)3 + ЗНС1 = FеС13 + ЗН20
Fе(ОН)2 — сильний відновник , бо спроможний окиснюватися навіть на повітрі:
4Fе(ОН)2 + О2 + 2Н2О = 4Fе(ОН)3
Fе(ОН)3 виявляє окисно-відновні властивості лише за наявності сильних відновників або окисників:
2Fе(ОН)3 + ЗН2 = 2Fе + 6Н2О — окисні властивості
2Fе(ОН)3 + ЗВг2 + 10КОН = 2К2FеО4 + 6КВг + 8Н20
калій ферат(УІ)
Гідроксиди Феруму(ІІ) і (ІІІ) під час нагрівання розкладаються:
2Fe(OH)3 = Fe2O3 + 3H2O
Fe(OH)2 = FeO + H2O
Подвійний (змішаний) оксид під час взаємодії з кислотами утворює суміш двох солей – Феруму(ІІ) і Феруму(ІІІ):
Fe3O4 + 8HCl = 2FeCl3 + FeCl2 + 4H2O
Fe3O4 + 4H2SO4 = Fe2(SO4)3 + FeSO4 + 4H2O
Якісні реакції на йони Fе2+ , Fе3+
Реакції йонів Fe2+
1. Амоній гідроксид з йонами Fе2+ без доступу повітря утворює
білий осад ферум(П) гідроксиду, який розчиняється в кислотах
і не розчиняється в лугах (за кімнатної температури):
FeSО4 + 2NН4ОН → Fе(ОН)2 ↓ + (NH4)2SО4
осад білого кольору.
2. Йони Fе2+ з червоною кров'яною сіллю К3[Fе(СN)6] утворюють
погано розчинну у воді сіль темно-синього кольору, яка має
назву «турнбулева синь»:
ЗFеSО4 + 2К3[Fе(СN)6] = Fе3[Fе(СN)6]2 ↓ + ЗК2SО4
червона турнбулева синь
кров'яна сіль
Розчини солей Феруму(П) забарвлені в блідо-зелений колір.
Реакції йонів Fe3+
1. Амоній гідроксид з йонами Fе3+ утворює червоно-бурий осад
ферум(Ш) гідроксиду, який розчиняється в кислотах:
FеС13 + 3NH4ОН → Fе(ОН)3 ↓ + ЗNН4С1
буро-червоний осад).
2.Йони Fе3+ із жовтою кров'яною сіллю утворюють осад
берлінської лазурі:
4FеС13 + ЗК4[Fе(СN)6] = Fе4[Fе(СN6]3 ↓ + 12КС1
жовта кров'яна сіль берлінська лазурь
3. Амоній роданід (тіоціанат) з йонами Fе3+ утворює розчин
криваво-червоного кольору:
FеС13 + ЗКSСМ = Fе(SСN)з + ЗКС1
Лабораторний дослід «Якісні реакції на виявлення йонів Fe2+ , Fe3+ »
Мета : провести якісні реакції на виявлення йонів Fe2+ , Fe3+ в розчині.
Обладнання : штатив з пробірками .
Реактиви : розчини ферум (ІІ) і ферум (ІІІ) сульфатів або хлоридів, розчини червоної та жовтої кров’яної солі, роданіду амонію.
Завдання : виконайте роботу і оформіть звіт , заповніть таблицю.
Правила техніки безпеки
- Робоче місце має бути звільнене від сторонніх речей.
- Перед початком досліду уважно читай етикетку , щоб правильно вибрати реактив.
3. Відкривши посудину з реактивом , потрібно класти пробку догори дном.
4.Надлишок взятого реактиву не можна зливати ( висипати ) назад у посуд; розчини кислот, лугів брати краплями ; тверді речовини чи розчини солей – щоб ледь покрили дно пробірки.
5.Реактив наливати за правилом , щоб розчин не потрапив на етикетку .
6.Посудину , з якої взяли реактив, слід відразу ж закрити пробкою і поставити на місце.
7.Жодні реактиви не можна пробувати на смак.
8.Після роботи відпрацьовані реактиви можна зливати у раковину тільки після їх повної нейтралізації.
9.Після роботи вимийте посуд, приберіть робоче місце , ретельно вимийте руки.
10.У разі потрапляння їдких речовин на руки чи одяг негайно змийте їх великою кількістю води , нейтралізуйте та знову змийте водою.
11.Категорично забороняється проводити досліди , не зазначені в роботі , та самостійно зливати і змішувати реактиви.
|
Хід роботи
|
Спостереження, рівняння реакції |
|
1. Реакція Fe2+ з червоною кров’яною сіллю . Налийте в пробірку 0,5мл розчину солі ферум сульфату, долийте кілька крапель розчину червоної кров’яної солі. |
Спостереження : __________________________ __________________________________________ Рівняння хімічної реакції в молекулярній , повній та скороченій йонній формах : _________________________________________ ___________________________________________ ___________________________________________ |
|
2. Реакція Fe3+ з жовтою кров’яною сіллю . Налийте в пробірку 0,5мл розчину солі ферум (ІІІ) хлориду, долийте кілька крапель розчину жовтої кров’яної солі. |
Спостереження : __________________________ __________________________________________ Рівняння хімічної реакції в молекулярній , повній та скороченій йонній формах : _________________________________________ ___________________________________________ ___________________________________________ |
|
3. Реакція Fe3+ з амоній роданідом . Налийте в пробірку 0,5мл розчину солі ферум (ІІІ) хлориду, долийте кілька крапель розчину амоній роданіду |
Спостереження : __________________________ __________________________________________ Рівняння хімічної реакції в молекулярній , повній та скороченій йонній формах : _________________________________________ ___________________________________________ ___________________________________________ |
Зробіть висновок :
Йони Fe2+ , Fe3+ в розчині виявляють шляхом проведення відповідної якісної реакції .
Якісною реакцією на йони Fe2+ є ____________________________________________________________________________________________________________________________________
Якісною реакцією на йони Fe3+ є
V. Узагальнення і систематизація знань
- Якою є будова атома заліза?
- Якою є поширеність заліза в природі?
- Як одержують залізо з його руд? Вкажіть види залізних руд.
- Опишіть фізичні властивості заліза
- Допишіть хімічні реакції, розставте в них коефіцієнти:
1. Fe + Cl2 =… 2. Fe + Br2 =…
Розставте коефіцієнти в рівняннях реакцій:
1. Fe + О2 =Fe3 О4
2. Fe + НСl =FeСl 3 + Н2
3. Fe2 О3 + Аl =Аl2 О3 + Fe
7). Обчисліть масову частку Феруму в його оксидах: FeО, Fe2О3, Fe3О4
Закінчити речення очікувань:
1. Я знаю, що Ферум у періодичній системі розташований у ______ періоді, ________групі ________________ підгрупи.
2. Я знаю, що валентність Феруму _________, може бути _________ та ________.
3. Я знаю, що Ферум утворює _____ просту речовину - _______________ .
4. Я знаю, що відносна атомна маса Феруму та відносна молекулярна маса заліза чисельно співпадають і дорівнюють _________________ .
5. Я знаю, що за агрегатним станом залізо __________ речовина, яка не має __________, __________ та __________ .
6. Я знаю, що залізо _________ у воді, добре проводить _________ та ______
7. Я знаю, що залізо притягується _________ .
8. Я знаю, що залізо – хімічно ___ речовина, реагує з простими речовинами, такими як: __________ та __________.
Напишіть рівняння реакцій, за допомогою яких
можна здійснити такі перетворення:
Fе → FеС12 → Fе(ОН)2 →Fе(ОН)3 →Fe2O3→ Fe → FeS
Які з цих реакцій та чому є окисно-відновними?
Підбиття підсумків уроку
VI. Інтерактивна гра « Мікрофон» закінчи речення.
« Сьогодні на уроці я повторив…»
« Сьогодні на уроці я зрозумів…»
« Сьогодні на уроці я дізнався…»
« Сьогодні на уроці я навчився…»
VII. Повідомлення домашнього завдання
Параграф 60-61, закінчити розв`язок завдань


про публікацію авторської розробки
Додати розробку
