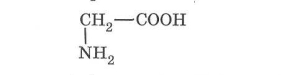Робочий зошит "Біоорганічна хімія"
КЗ ЛОР «САМБІРСЬКИЙ ФАХОВИЙ МЕДИЧНИЙ КОЛЕДЖ»
ЦИКЛОВА КОМІСІЯ ХІМІЧНИХ ДИСЦИПЛІН

ДО ПРАКТИЧНИХ ТА ЛАБОРАТОРНИХ ЗАНЯТЬ
З ДИСЦИПЛІНИ
“БІООРГАНІЧНА ХІМІЯ”
Студент(а)(ки)__________________________________
прізвище, ім’я, по батькові
групи__________________________
ОПП «Сестринська справа»
Перелік тем практичних занять та самостійної роботи
|
№ |
Тема |
Кількість годин |
|
|
1 |
Будова, класифікація та номенклатура біоорганічних сполук |
2 |
|
|
|
Хімічний зв’язок в органічних молекулах та взаємний вплив атомів (показати схематично перерозподіл електронної густини в молекулах і, відповідно, реакційну здатність сполук) |
|
2 |
|
2 |
Реакційна здатність вуглеводнів |
2 |
|
|
|
Орієнтувальна дія замісників у монозаміщених бензенах (виконання вправ) |
|
2 |
|
3 |
Спирти, феноли, аміни |
2 |
|
|
4 |
Карбонільні сполуки. Карбонові кислоти |
2 |
|
|
|
Функціональні похідні карбонових кислот (скласти схему взаємоперетворень) |
|
2 |
|
5 |
Аміноспирти, гідрокси- та оксокислоти |
2 |
|
|
6 |
Протеїногенні амінокислоти, пептиди, білки |
2 |
|
|
|
Структурна організація білків (зобразити первинну, вторинну, третинну, четвертинну структури білків) |
|
2 |
|
7 |
Моносахариди |
2 |
|
|
8 |
Дисахариди |
2 |
|
|
9 |
Полісахариди |
2 |
|
|
10 |
Модульний контроль |
2 |
|
|
|
Всього |
20 |
8 |
“Хімік дає життя медикаменту,
а лікар підтримує його перші кроки”
Мета даного посібника – допомогти студентам опанувати програмний матеріал, правильно виконати лабораторні досліди з дисципліни «Біоорганічна хімія» курсу “Медична хімія”.
Медична хімія як навчальна дисципліна:
- ґрунтується на вивченні студентами медичної біології, біофізики, морфологічних дисциплін та інтегрується з цими дисциплінами;
- закладає основи вивчення студентами молекулярної біології, генетики, фізіології, патології, загальної та спеціальної фармакології, токсикології та пропедевтики клінічних дисциплін;
- закладає основи клінічної діагностики найпоширеніших захворювань, моніторингу перебігу захворювання, контролю за ефективністю застосування лікарських засобів та заходів, спрямованих на запобігання виникненню та розвитку патологічних процесів.
Лабораторні заняття передбачають:
- лабораторні дослідження з виявлення певних класів біоорганічних сполук;
- проведення якісних реакцій та оцінювання показників під час лабораторного дослідження розчинів;
- вирішення проблемних завдань, які мають експериментальне або клініко-біохімічне значення.
Після вивчення дисципліни студенти повинні знати:
- основні типи хімічної рівноваги для формування цілісного фізико-хімічного підходу до вивчення процесів життєдіяльності організму;
- основні правила замісникової номенклатури ІЮПАК для побудови назв біоорганічних сполук;
- відповідність структури біоорганічних сполук фізіологічним функціям, які вони виконують в організмі людини;
- реакційну здатність вуглеводів, ліпідів, амінокислот, що забезпечує їхні функціональні властивості та метаболічні перетворення в організмі;
- особливості будови та перетворень в організмі біоорганічних сполук — основи їхньої фармакологічної дії як лікарських засобів;
- правила техніки безпеки, охорони праці, професійної безпеки під час виконання лабораторних робіт.
Студенти повинні вміти:
- робити висновки й аналізувати взаємозв’язок між будовою, конфігурацією та конформацією біоорганічних сполук;
- пояснювати залежність біологічної активності від просторової будови речовини;
- інтерпретувати особливості будови ά-амінокислот як основи біополімерів — білків, що є структурними компонентами всіх тканин організму;
- інтерпретувати особливості будови та перетворень в організмі гомополісахаридів як харчових речовин — джерел енергії для процесів життєдіяльності;
- аналізувати принципи методів виявлення та визначення моносахаридів у крові, сечі, слині;
- пояснювати залежність реакційної здатності гетероциклічних сполук від їхньої будови, що сприяє їх біосинтезу в організмі та лабораторному синтезу, з метою одержання лікарських засобів;
- аналізувати значення мононуклеотидів для побудови нуклеїнових кислот і дії нуклеотидних коферментів;
- дотримуватися правил техніки безпеки, охорони праці, професійної безпеки під час виконання лабораторних робіт.
Методика та засоби стандартизованого оцінювання навчальної діяльності студентів
Методика проведення контрольних заходів (поточний контроль):
здійснюється на кожному практичному(лабораторному) занятті відповідно конкретним цілям, а також під час індивідуальної роботи викладача зі студентом для тих тем, які студент опрацьовує самостійно і вони не входять до структури лабораторного заняття. Рекомендується застосувати види об'єктивного (стандартизованого) контролю теоретичної та практичної підготовки студентів.
Критерії оцінювання поточної навчальної діяльності:
Оцінку "відмінно" одержує студент, який приймав активну участь в обговоренні найбільш складних питань з теми заняття, дав не менше 91% правильних відповідей на тестові завдання, без помилок відповів на письмові завдання, виконав лабораторну роботу та оформив її.
Оцінку "добре" одержує студент, який приймав участь в обговоренні найбільш складних питань з теми, дав не менше 71% правильних відповідей на тестові завдання, припустивя окремих незначних помилок у відповідях на письмові завдання, виконав лабораторну роботу та оформив її.
Оцінку "задовільно" одержує студент, який не приймав участь в обговоренні найбільш складних питань з теми, дав не менше 60% правильних відповідей на тестові завдання, припустився значних помилок у відповідях на письмові завдання, виконав лабораторну роботу та оформив її.
Оцінку "незадовільно" одержує студент, який приймав участь в обговоренні питань з теми, дав менше 60% правильних відповідей на тестові завдання, припустився грубих помилок у відповідях на письмові завдання або взагалі не дав відповіді на них, не виконав лабораторну роботу та не оформив її.
Критерії оцінювання підсумкового модульного контролю:
Модульний контроль складається з теоретичної та практичної частин.
Теоретична частина включає завдання трьох рівнів складності: перший рівень складається з 30 тестових завдань, кожне завдання оцінюється 2 балами, другий рівень складається з 6 завдань, кожне завдання оцінюється 5 балами, третій рівень складається з одного завдання, яке оцінюється 10 балами. Максимальна кількість балів за теоретичну частину – 100 балів.
Практична частина включає завдання , які глибше і повніше відтворюють знання будови, хімічних властивостей органічних сполук, дають можливість відтворити техніку виконання дослідів та застосувати знання якісних реакцій на практиці. Максимальна кількість балів за практичну частину – 100 балів.
Максимальна кількість, яку може набрати студент за модульний контроль, вираховується середньою кількістю балів теоретичної та практичної частин:
91 – 100 балів – оцінка відмінно
90 – 71 бал – оцінка добре
70 – 60 балів – оцінка задовільно
59 - 35 балів – оцінка незадовільно з можливістю перездати
34 - 1 бал – оцінка незадовільно з обов’язковим повторним курсом
Оцінку " відмінно" одержує студент, який дав не менше 91 % правильних відповідей на тестові завдання модульного контролю, без помилок відповів на письмові завдання, виконав практичну частину і обґрунтував одержані результати, тобто всебічно і глибоко засвоїв навчально-програмний матеріал; в повному об'ємі володіє теоретичними знаннями та практичними навиками, без помилок вирішує ситуаційні задачі.
Оцінку "добре" одержує студент, який дав не менше 71% правильних відповідей на тестові завдання, припустився окремих незначних помилок у відповідях на письмові завдання, виконав практичну частину, але не повно обґрунтував одержані дані.
Оцінку "задовільно" одержує студент, який дав не менше 60% правильних відповідей на тестові завдання, припустився значних помилок у відповідях на письмові завдання, виконав практичну частину з помилками .
Оцінку "незадовільно" одержує студент, який дав менше 60% правильних відповідей на тестові завдання, припустився грубих помилок у відповідях на письмові завдання або взагалі не дав відповіді на них, не виконав практичну частину та не може правильно інтерпретувати її результати.
ПРАВИЛА ТЕХНІКИ БЕЗПЕКИ
ПРИ РОБОТІ У ЛАБОРАТОРІЇ МЕДИЧНОЇ ХІМІЇ
ЗАГАЛЬНІ ВИМОГИ:
- Працюйте в лабораторії хімії обов’язково в халаті.
- Будьте максимально обережні під час виконання будь-яких практичних робіт, пам’ятаючи, що неохайність, неуважність, недостатня необізнаність із властивостями речовин, з якими проводиться робота, може спричинити нещасний випадок.
- Виконуйте тільки ті хімічні досліди, які погоджено з викладачем, під його наглядом або наглядом лаборанта.
- До роботи у лабораторії допускаються студенти, які пройшли інструктаж з техніки безпеки і отримали допуск до занять.
- Лабораторний стіл тримайте у чистоті і порядку, щоб на ньому не було зайвих предметів. Сумки прибирайте у столи.
- Особливу увагу приділяйте чистоті лабораторного посуду.
- Акуратно поводьтесь зі скляним посудом. Залишки розбитої посуди прибирайте за допомогою совка і щітки.
- Всі роботи, пов’язані з виділенням отруйних речовин, летких і з неприємним запахом речовин, проводьте у витяжній шафі.
- Не виконуйте додаткових дослідів без дозволу викладача.
- Обережно користуйтесь газовими пальниками. При появі запаху газу негайно закрийте всі крани і припиніть всі роботи з вогнем.
- Під час нагрівання розчинів у пробірці користуйтесь пробіркотримачем. Уважно стежте за тим, щоб отвір пробірки був спрямований у бік від обличчя працюючого і не в сторону сусіда, бо рідина через перегрівання може вибризнути з пробірки.
- Під час нагрівааня рідин стежте, щоб не перегрівалися стінки посудини над рідиною (особливо, коли рідини мало), бо при попаданні крапель рідини на перегріте скло посудина може тріснути.
- Щоб уникнути перегрівання, ніколи не нагрівайте пробірку лише знизу, а прогрівайте всю пробірку, весь її вміст.
- Не заглядайте в пробірку, в якій нагрівається рідина, і не нахиляйтеся над посудиною, в яку наливається будь-яка рідина (особливо їдка), бо непомітні бризки можуть потрапити в очі.
- Осад після досліду не залишайте надовго, а відразу розчиніть у відповідному реактиві і вимийте посуд.
- Якщо в процесі аналізу осад або розчин потрібно залишити хоча б на короткий час, то на посудині, в якій він знаходиться, слід зробити відповідний напис.
- Після закінчення роботи приберіть своє робоче місце, перекрийте подачу газу, виключіть воду, електронагрівні прилади і обов’язково ретельно вимийте руки.
- Не кладіть свої сніданки на лабораторні столи і ніколи не вживайте їжу в лабораторії.
ВИМОГИ БЕЗПЕКИ При користуванні реактивами:
- Розчини і тверді речовини для проведення дослідів беріть в такій кількості і такої концентрації, як вказано в методичній вказівці.
Якщо немає вказано дозування реактивів для даного досліду, то їх необхідно брати у найменшій кількості: 5-7 крапель розчину і один мікрошпатель твердої речовини.
- Всі склянки з розчинами і сухими речовинами тримайте закритими, відкривайте їх тільки під час використання.
- Уважно читайте етикетку на посудині з тією речовиною, яку берете для досліду. Відкриваючи корок, не кладіть його на лабораторний стіл боком, а поставте догори.
- Не плутайт корки від склянок , а також піпетки для взяття реактивів.
- Досліджувані розчини наливайте у пробірки тільки за допомогою піпеток. При користуванні піпетками слідкуйте за тим, щоб кінчик піпетки не торкався внутрішніх стінок пробірки. У разі забруднення піпетки слід промити її дистильованою водою.
- Надлишок реактиву не висипайте і не виливайте назад у склянку,з якої він був взятий, тому що таким чином можна забруднити її вміст.
- Реактиви загального користування не відносьте на робочі місця; зберігайте порядок у розкладанні як реактивів загального користування , так і реактивів у штативах індивідуального користування.
- Розсипані і розлиті реактиви необхідно зразу прибрати, а стіл вимити і протерти.
- Неможна пробувати речовини на смак, адже всі реактиви певною мірою є отруйні.
- Нюхайте будь-які речовини з обережністю, не нахиляйтеся над посудиною і не вдихайте повними грудьми, а спрямовуйте до себе пару чи газ рухами руки.
- Залишки солей Аргентуму, Меркурію, а також концентрованих кислот і лугів виливайте у спеціальні ємкості, котрі знаходяться у витяжній шафі.
При роботі з їдкими речовинами потрібно зберігати наступні міри застереження:
- Роботу з великою кількістю кислот і лугів проводьте у захисних окулярах.
- Розчини кислот і лугів готуйте у тонкостінному посуді; кислоту вливайте у воду малими порціями при перемішування.
- При розведенні кислот їх доливайте у воду, а не навпаки.
- Розлиту кислоту або луг засипте піском, а потім приберіть совком з щіткою. Забруднене місце нейтралізуйте розчином соди, якщо розлита кислота, або слабким розчином оцтової кислоти, якщо розлитий луг.
- Користуючись кристалічними лугами, не стряхуйте їх, щоб пилеподібні часточки лугу не попадали на руки та одяг; не беріть гранули руками , а тільки шпателем або пінцетом. Розсипаний луг зразу приберіть, а стіл вимийте і витріть.
- Забороняється виливати в каналізацію розчини кислот і лугів без нейтралізації.
У разі нещасного випадку негайно звертайтеся до викладача!
ПЕРША ДОПОМОГА ПРИ ОТРУЄННЯХ
Отруєння сірководнем
Ознаки отруєння: запаморочення, головні болі, нудота, загальна слабкість. У деяких випадках може настати раптова смерть унаслідок ураження дихальних шляхів.
Перша допомога: слід забезпечити постраждалому доступ свіжого повітря, дати вдихати кисень з додаванням вуглекислоти з об’ємною часткою 5-7%.
Можна дати вдихати нашатирний спирт, дати валідол, напоїти міцним солодким чаєм.
Отруєння сірчистим газом (сульфур(IV)оксидом)
Ознаки отруєння: подразнення слизових оболонок, кашель і чхання.
Перша допомога: потерпілого вивести на свіже повітря, дати вдихати з ватки нашатирний спирт з етанолом, застосовувати інгаляцію розчином соди з масовою часткою натрій гідрогенкарбонату 2%.
Отруєння оксидами Нітрогену
Ознаки отруєння: оксиди Нітрогену діють, насамперед, на слизові оболонки та дихальні шляхи, потім викликають подразнення очей, сухість у горлі, кашель, іноді нудоту і блювоту. Отруєння оксидами Нітрогену є особливо небезпечним для осіб, що страждають на захворювання серця.
Перша допомога: потерпілому дати дихати чистим киснем. У зв’язку з можливістю набряку легень і порушення кровообігу йому слід уникати будь-яких рухів, потрібний повний спокій. Не можна допускати охолодження тіла.
Отруєння амоніаком
Ознаки отруєння: подразнення слизових оболонок, сльозотеча і запалення очей, сильний кашель, жар у горлі. Крім того, у потерпілого з’являються нудота і задишка.
Перша допомога: при отруєнні через вживання рідини з амоніаком дати потерпілому випити велику кількість води з додаванням оцтової кислоти, викликати блювання, дати молоко, яєчний білок;
при отруєнні внаслідок вдихання амоніаку вивести потерпілого на свіже повітря, дати вдихати з ватки пари розведеної оцтової кислоти.
Отруєння карбон(ІІ) оксидом (чадним газом)
Ознаки отруєння: запаморочення голови, головний біль, слабкість, блювання, шум у вухах, судоми та непритомність.
Перша допомога: негайно вивести потерпілого на свіже повітря, звільнити від одягу, який заважає диханню, давати вдихати кисень,(чистий або з додаванням вуглекислого газу (СО2) з об’ємною часткою 5%), потерпілого тримати у теплі, зігрівають грілками або теплими компресами, прикладеними до рук та ніг. Уразі необхідності роблять штучне дихання до прибуття лікаря.
Отруєння хлором
Ознаки отруєння: подразнюються верхні дихальні шляхи, у разі тривалої дії хлору кашель посилюється й може завершитися спазмом окремих ділянок дихальних шляхів, після чого припиняється дихання; навіть при короткочасній дії хлору треба остерігатися гострого набряку легень.
Перша допомога: негайно вивести потерпілого на свіже повітря, звільнити від одягу, який заважає диханню .Дати дихати киснем або вдихати з ватки нашатирний спирт з етанолом, можна дати випити суспензію магній оксиду(10 г на склянку води). Прикласти до рук і ніг теплі компреси.
Отруєння органічними рідинами
У разі потрапляння в організм через стравохід отруйних органічних рідин: ацетону, формаліну, метанолу, аніліну та ін. – необхідно викликати блювання, а потім дати потерпілому молоко і яєчний білок. Викликати лікаря.
При отруєннях в інших випадках необхідно:
При отруєнні сульфатною кислотою дати потерпілому проковтнути шматочок льоду і покласти лід на живіт, прополоскати рот розчином калій перманганату з масовою часткою за речовиною 2%, дати молоко, яєчний білок, розчин крохмалю.
ПЕРША ДОПОМОГА ПРИ ОПІКАХ
Опіки концентрованими кислотами
При попаданні концентрованих кислот на руки і обличчя пошкоджену ділянку негайно промити протягом 10-15 хвилин проточною водою, а потім прикласти ватний тампон, змочений 2% розчином натрій гідрогенкарбонату, обполоснути водою і накласти марлеву пов’язку з риванолом чи фурациліном.
При опіках порожнини рота кислотами після промивання проточною водою необхідно кілька раз прополоскати рот розчином натрій гідрогенкарбонату.
При попаданні крапель кислоти в очі промити їх проточною водою протягом 15 хвилин, а потім 2% розчином натрій гідрогенкарбонату.
Після надання допомоги потерпілого скерувати на консультацію у медичний заклад.
Опіки концентрованими лугами
При попаданні розчинів лугів на руки і обличчя пошкоджену ділянку негайно промити протягом 10-15 хвилин проточною водою, а потім прикласти ватний тампон, змочений 2% розчином оцтової кислоти, обполоснути водою і накласти марлеву пов’язку з риванолом чи фурациліном.
При опіках порожнини рота лугами після промивання проточною водою необхідно кілька раз прополоскати рот розчином оцтової кислоти.
При попаданні крапель кислоти в очі промити їх проточною водою протягом 15-20 хвилин, а потім 2% розчином борної кислоти.
Термічні опіки
При термічних опіках першого ступеня уражене місце обробляють етиловим спиртом, після чого накладають суху стерильну пов’язку або чисту тканину і звертаються до дерматолога.
У жодному разі не можна проколювати міхур, змочувати місця опіків водою, припікати їх розчинами калій перманганату, брильянтового зеленого, розчином йоду, застосовувати „народні „ засоби, різні олії, вазелін, оскільки вони тільки посилюють опіки, сповільнюють загоювання ран. При важких опіках необхідно негайно відправити потерпілого до лікарні.
З правилами техніки безпеки ознайомлений (а) _________________________________________(підпис)
МЕТОДИЧНІ РЕКОМЕНДАЦІЇ
ДО ПОЗААУДИТОРНОЇ САМОСТІЙНОЇ РОБОТИ № 1 п
ТЕМА № 1: Класифікація, номенклатура та ізомерія органічних сполук
Питання для самостійної роботи:
“Хімічний зв’язок в органічних молекулах та взаємний вплив атомів”-2 год.
І. Навчальна мета:
- знати типи хімічних зв’язків;
- знати типи гібридизації;
- знати характеристики ковалентного зв’язку;
- знати типи і суть електронних ефектів;
- вміти пояснювати і схематично зображати взаємний вплив атомів у молекулах.
ІІ. План вивчення теми або питання (самостійної роботи).
- Хімічний зв’язок у біоорганічних молекулах:
Рекомендована література:
Музиченко В.П., Луцевич Д.Д., Яворська Л.П. Медична хімія \ За ред. Б.С.Зіменковського –К.: Медицина, 2010., с.. 346-348
- Електронні ефекти. Вза’ємний вплив атомів у молекулах.
Рекомендована література:
Музиченко В.П., Луцевич Д.Д., Яворська Л.П. Медична хімія \ За ред. Б.С.Зіменковського –К.: Медицина, 2010., с.348-349.
ІІІ. Завдання:
- опрацювати навчальний матеріал;
- показати схематично перерозділ електоронної густини в молекулах і відповідно, реакційну здатність сполук на прикладі:
|
1-хлоропропану |
|
|
1,3- бутадієну |
|
|
бензену |
|
- дати усно відповіді на запитання.
Питання для самоконтролю
1. Дайте визначення I і II-зв’язкам. На прикладі пропену покажіть їх будову. Вкажіть види гібридизації наявних у цій молекулі атомів Карбону.
2. Які зв’язки називаються полярними, неполярними?
3. Як проявляється індукційний ефект?
4. Як проявляється мезомерний ефект?
5. Як впливає перерозподіл електронної густини в молекулах на реакційну здатність сполук?
Рекомендована література
Музиченко В.П., Луцевич Д.Д., Яворська Л.П. Медична хімія \ За ред. Б.С.Зіменковського –К.: Медицина, 2010., с.346-349.
Практичне заняття №1
І.ТЕМА: КЛАСИФІКАЦІЯ, НОМЕНКЛАТУРА ТА ІЗОМЕРІЯ ОРГАНІЧНИХ СПОЛУК
Актуальність. Органічні речовини характеризуються великою різноманітністю. Для того, щоб грунтовно засвоїти курс біоорганічної хімії, їх потрібно систематизувати. Належність сполуки до того чи іншого класу дає можливість передбачити її хімічну поведінку, оскільки хімічні властивості є наслідком будови, а останні визначають галузі застосування. зокрема в медицині:
![]()
![]() Будова властивості застосування в медицині
Будова властивості застосування в медицині
органічної речовини (фізичні і хімічні)
Більшість біоорганічних сполук мають хіральну просторову будову, тому вивчення студентами основ стереохімії має важливе значення для пояснення фізіологічної активності різних біомолекул.
ІІ. МЕТА :
Знати :
- Основні вимоги техніки безпеки при роботі в хімічній лабораторії.
- Префікси, суфікси та закінчення, які застосовують в назвах біоорганічних сполук, що мають функціональні групи, за міжнародною замісниковою номенклатурою (ІЮПАК);
- Конфігурації молекул ;
- Способи зображення просторової будови молекул біоорганічних сполук; Конформації молекул. Стереоізомерія.
Вміти :
- Складати формули біоорганічних сполук за замісниковою номенклатурою ІЮПАК.
- Моделювати просторову та конформаційну будову молекул органічних сполук.
Практичні навички:
- складати формули біоорганічних сполук за замісниковою номенклатурою ІUPАC;
- моделювати просторову та конформаційну будову молекул органічних сполук;
- визначати природу хімічних зв’язків у молекулі;
- визначати види індуктивного та мезомерного ефектів у молекулах органічних сполук.
ІІІ. КОНТРОЛЬ БАЗОВИХ ЗНАНЬ З ТЕМИ :
- Біоорганічна хімія та об’єкти її вивчення.
- Класифікація органічних сполук за карбоновим скелетом та за функціональними групами.
- Основні функціональні групи.
- Назвоутворення органічних сполук за систематичною номенклатурою. Радикал, замісник, функціональна група, родоначальна структура. Моно-, полі- та гетерофункціональність.
- Типи формул в органічній хімії – молекулярні, структурні (повні і скорочені), просторові.
-
Структурна та просторова ізомерія органічних речовин. Зв'язок просторової
будови з біологічною активністю.
IV. ОБЛАДНАННЯ : таблиці, схеми, роздатковий матеріал.
V. ХІД САМОСТІЙНОЇ РОБОТИ СТУДЕНТІВ
Робота №1 КЛАСИФІКАЦІЯ І НОМЕНКЛАТУРА ОРГАНІЧНИХ СПОЛУК
- Наведіть приклади радикалів, функціональних груп, ізомерів, гомологів, моно-, полі- та гетерофункціональниї сполук.
- Вкажіть, які з наведених нижче сполук належать до аліфатичних, які — до карбоциклічних, а які - гетероциклічних:
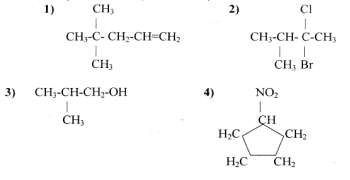
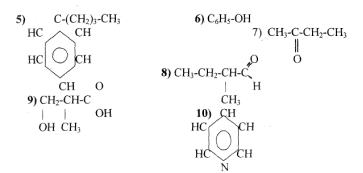
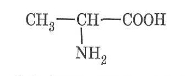
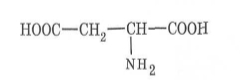
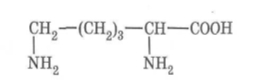
Виберіть серед наведених у вправі 2 формули сполук, які є: насичені, ненасичені, аліциклічні, ароматичні, альдегіди, спирти, аміни, галогенопохідні вуглеводнів, кетони, карбонові кислоти, нітросполуки, вуглеводні.
- Назвіть за систематичною номенклатурою такі сполуки:

4. Напишіть структурні формули біологічно активних сполук, що беруть участь у процесах метаболізму:
|
а) валін (2-аміно-З-метилбутанова
|
|
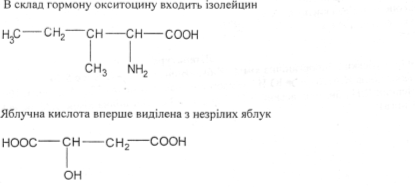
|
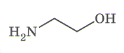
б) коламін (2-аміноетанол) - біогенний амін, входить до складу фосфоліпідів, є метаболітом амінокислоти серину; із коламіну in vivo утворюється нейромедіатор ацетилхолін);
|
|
|
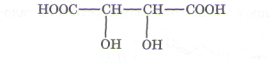
в) лимонна кислота (2-гідрокси-1,2,3-пропантрикарбонова кислота) - в організмі бере участь у циклі трикарбонових кислот (цикл Кребса).
|
|
5. Напишіть структурні формули таких лікарських препаратів:
|
а) ПАСК (п-аміносаліцилова кислота або 4-аміно-2-гідроксибензойна кислота) - застосовується для лікування туберкульозу;
|
|
|
б) ментол (2-ізопропіл-5- метилциклогексанол-1) - застосовується як заспокійливий засіб, а також засіб проти нежиті;
|
|
|
в) нітрогліцерин (тринітрат пропантріолу- 1,2,3) - застосовується при стенокардії.
|
|
РОБОТА № 2. ІЗОМЕРІЯ В БІООРГАНІЧНИХ СПОЛУКАХ
6. Напишіть структурні формули всіх можливих ізомерів складу С5Н10О і назвіть їх. До яких класів органічних сполук належать групи ізомерів ?
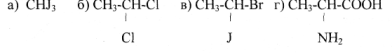
7. Які з наведених сполук є хіральними?
8. Зобразіть за допомогою проекцій Фішера будову енантіомерів молочної кислоти
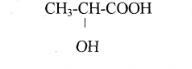
Віднесіть їх до відповідних D- і L-стереохімічних рядів.
9. Зобразіть за допомогою проекційних формул Фішера всі можливі стереоізомери тетрози (альдегідоспирту) такої будови:
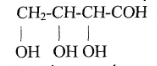
Вкажіть, котрі з них є енантіомерами і діастереомерами.
VI. ВИСНОВКИ ПРО ПРОВЕДЕНУ РОБОТУ: ____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
VII. ПИТАННЯ ДЛЯ САМОКОНТРОЛЮ :
- Назвіть основні способи зображення органічних молекул.
- Назвіть основні переваги структурних формул порівняно з молекулярними (брутто) формулами.
- Назвіть класи органічних сполук та відповідні їм функціональні групи.
- Назвіть основні номенклатурні системи органічних сполук.
- Дайте визначення понять: «ізомерія», «структурні ізомери», стереоізомери». «конформаційні ізомери», «геометричні ізомери» та «оптичні ізомери».
VIII. ДОМАШНЄ ЗАВДАННЯ :
1. Вивчити тему: « Реакційна здатність вуглеводнів»
2. Ознайомитись з методичними рекомендаціями для студентів до лабораторного заняття № 2
3. Опрацювати методичні рекомендації до позааудиторної самостійної роботи № 2п.
Рекомендована література:
Музиченко В.П., Луцевич Д.Д., Яворська Л.П. Медична хімія / За ред. Б.С. Зіменковського. — К.: Медицина, 2010. , с. 353 - 376.
МЕТОДИЧНІ РЕКОМЕНДАЦІЇ
ДО ПОЗААУДИТОРНОЇ САМОСТІЙНОЇ РОБОТИ № 2 п
ТЕМА № 2: Реакційна здатність вуглеводнів
Питання для самостійної роботи:
“Орієнтувальна дія замісників у монозаміщених бензенах” –2год.
І. Навчальна мета:
- знати будову і властивості аренів;
- знати орієнтуючу дію замісників І і ІІ роду;
- вміти розв’язувати ситуаційні задачі щодо даної теми.
ІІ. План вивчення теми або питання (самостійної роботи).
- Замісники І роду.
Рекомендована література:
Музиченко В.П., Луцевич Д.Д., Яворська Л.П. Медична хімія \ За ред. Б.С.Зіменковського –К.: Медицина, 2010., с.362
- Замісники ІІ роду.
Рекомендована література:
Музиченко В.П., Луцевич Д.Д., Яворська Л.П. Медична хімія \ За ред. Б.С.Зіменковського –К.: Медицина, 2010., с.362-363
ІІІ. Завдання:
- опрацювати навчальний матеріал;
- виконати вправи;
- дати усно відповіді на запитання;
Вправа №1. Закінчіть рівняння реакцій. Опишіть орієнтуючу дію замісників:
 СН3
СН3
+ HNO3 →
 SO3Н
SO3Н
+ H2SO4 →
 NO2
NO2
+ HNO3 →
Вправа №2. Здійсніть перетворення:
|
бензенсульфо
|
|
|
тринітротолуен |
|
|
|
|
|
|
1,3,5 - трисульфобензен
|
бромобензен
|
4 - хлоротолуен
|
|
|
|
|
|
|
|
|
Х
|
|
|
_____________________________________________________________________
______________________________________________________________________
_____________________________________________________________________
______________________________________________________________________
_____________________________________________________________________
______________________________________________________________________
__________________________________________________________
Питання для самоконтролю
- Які хімічні властивості характерні ароматичним вуглеводням?
- Які атоми і групи атомів відносяться до замісників І роду?
- Які атоми і групи атомів відносяться до замісників ІІ роду?
- Який вплив на реакційну здатність бензенового кільця виявляють замісники І роду?
- Який вплив на реакційну здатність бензенового кільця виявляють замісники ІІ роду?
Рекомендована література
Музиченко В.П., Луцевич Д.Д., Яворська Л.П. Медична хімія \ За ред. Б.С.Зіменковського –К.: Медицина, 2010., с.362-363.
Лабораторне заняття № 2
І.ТЕМА: РЕАКЦІЙНА ЗДАТНІСТЬ ВУГЛЕВОДНІВ
Актуальність. Насичені, ненасичені та ароматичні вуглеводні не є продуктами метаболізму в організмі, проте більшість з них знаходять застосування в медицині та фармації. Вони служать цінною сировиною для синтезу багатьох лікарських препаратів, а також в хімічній промисловості для добування пластмас, каучуків, барвників, вибухових речовин, бензину, гасу, розчинників тощо.
ІІ. МЕТА :
Знати :
- Основні вимоги техніки безпеки при роботі в хімічній лабораторії.
- механізм реакцій радикального заміщення біля насиченого атома Карбону (SR).
- механізм реакцій електрофільного приєднання до ненасичених сполук (АЕ).
- механізм реакцій електрофільне заміщення в ароматичних сполуках (SЕ).
- вплив замісників на реакційну здатність аренів.
Вміти :
- прогнозувати і пояснювати механізми реакцій, характерних для різних типів вуглеводнів.
- експериментально визначати ненасиченість органічних сполук .
ПРАКТИЧНІ НАВИЧКИ:
- Прогнозувати і пояснювати механізми реакцій, характерних для різних типів вуглеводнів.
- Експериментально визначати ненасиченість органічних сполук
- Дотримуватися правил техніки безпеки під час роботи з бромом, гексаном, бензеном, легкозаймистими речовинами, з концентрованою сульфатною кислотою.
ІІІ. КОНТРОЛЬ БАЗОВИХ ЗНАНЬ З ТЕМИ :
- Алкани, їх будова, номенклатура, ізомерія та медико-біологічне значення.
- Механізм реакцій вільнорадикального заміщення (SR) в алканаx.
- Поняття про ланцюгові процеси.
- Алкени, алкадієни, їх будова, номенклатура, ізомерія та медико-біологічне значення.
- Правило Марковнікова.
- Ідентифікація подвійного вуглець-вуглецевого зв’язку в молекулах органічних сполук.
- Реакції ненасичених вуглеводнів ( гідрування, галогенування, гідрогалогенування, гідратація та окиснення за Вагнером) як основа деяких перетворень у біологічних системах.
- Арени, їх будова, номенклатура, ізомерія та медико-біологічне значення.
- Орієнтуюча дія замісників у бензольному ядрі. Замісники І і ІІ-го роду.
IV. ОБЛАДНАННЯ : таблиці, схеми, роздатковий матеріал, газовідвідна трубка, пальник, пробірки, кварцова лампа, лакмусовий папірець, повітряний холодильник.
РЕАКТИВИ: концентрована сульфатна кислота, етиловий спирт, алюміній оксид, 2% -ий водний розчин калій перманганату, гексан, розчину брому в тетрахлорометані, амоніак, концентрована нітратна кислота, толуен, амонію нітрат, бензин, залізні ошурки.
ВКАЗІВКИ З ТЕХНІКИ БЕЗПЕКИ:
Дотримуйтесь обережності при роботі з бромом, гексаном, бензеном, легкозаймистими речовинами, з концентрованою сульфатною кислотою
V. ХІД САМОСТІЙНОЇ РОБОТИ СТУДЕНТІВ:
РОБОТА № 1. АЛКАНИ. РЕАКЦІЇ ВІЛЬНОРАДИКАЛЬНОГО ЗАМІЩЕННЯ
Дослід 1. Бромування алканів
Виконання досліду: У 2 сухі пробірки помістіть по 1 мл гексану і додайте краплями рівну кількість 5 % -вого розчину брому в тетрахлорометані до появи жовтого забарвлення і перемішайте. Одну з пробірок накрийте ковпаком з чорного паперу або поставте у темне місце, другу – піддайте впливу джерела УФ-світла (кварцова лампа). Через 5 хв порівняйте забарвлення розчинів в обох пробірках.
Виділення бромоводню в ході реакції виявіть за допомогою внесення в пробірку палички, змоченої амоніаком, а також лакмусового папірця, змоченого водою.
Запитання і завдання:
Охарактеризуйте забарвлення розчинів в обох пробірках. Що спостерігаєте при внесенні палички, змоченої амоніаком, та лакмусового папірця, змоченого водою. Напишіть рівняння відповідних реакцій..
|
Рівняння реакції |
Спостереження |
Висновки |
|
|
|
|
|
|
|
|
|
|
|
|
РОБОТА № 2. АЛКЕНИ І АЛКАДІЄНИ. РЕАКЦІЇ ЕЛЕКТРОФІЛЬНОГО ПРИЄДНАННЯ
Дослід 2. Одержання і властивості етилену
Виконання досліду: В суху пробірку помістіть 8-10 крапель концентрованої сульфатної кислоти, 5 крапель етилового спирту і кілька крупинок алюміній оксиду. Пробірку закрийте корком з газовідвідною трубкою і обережно нагрійте в полум’ї пальника до початку рівномірного виділення газу з реакційної суміші. Кінець газовідвідної трубки по черзі опустіть у попередньо підготовлені пробірки, що містять водний розчин калій перманганату і розчин брому в тетрахлоретані.
Продовжуючи нагрівання, швидко підпаліть газоподібний етилен біля кінця газовідвідної трубки . Внесіть у полум’я фарфорову пластинку.
Запитання і завдання:
Який газ виділяється при нагріванні? Що відбувається з розчином калій перманганату та розчином брому? Яким полум’ям горить етилен і що спостерігається на внесеній у полум’я фарфоровій пластинці? Про що це свідчить. Напишіть рівняння відповідних реакцій.
|
Рівняння реакції |
Спостереження |
Висновки |
|
|
|
|
|
|
|
|
|
|
|
|
РОБОТА №3 . АРЕНИ. РЕАКЦІЇ ЕЛЕКТРОФІЛЬНОГО ЗАМІЩЕННЯ
Увага! Досліди виконують у витяжній шафі
Дослід 3. Нітрування ароматичних вуглеводнів
А) Нітрування толуену
Виконання досліду: У суху пробірку помістіть 3 краплі концентрованої сульфатної кислоти, 2 краплі концентрованої нітратної кислоти і 2 краплі толуену. Вміст пробірки нагрійте у полум’ї пальника, а потім вилийте у пробірку з 10 краплями води. Наявність продуктів нітрування встановіть за характерним запахом, який нагадує запах гіркого мигдалю.
Запитання і завдання:
Напишіть рівняння відповідних реакцій.
|
Рівняння реакції |
Спостереження |
Висновки |
|
|
|
|
Б) Одержання м-динітробензену (реакція Степанова)
Виконання досліду: У суху пробірку на висоту близько 5 мм помістіть амонію нітрат і 1 мл концентрованої сульфатної кислоти . Реакційна суміш розігрівається! Бульте обережні! Після охолодження розчину в пробірку при інтенсивному перемішуванні додайте 4 краплі бензену, Іноді для розчинення бензену потрібне незначне нагрівання. Отриманий розчин вилийте у склянку з 10 мл холодної води.
Запитання і завдання:
Що спостерігаєте? Напишіть рівняння відповідної реакції.
|
Рівняння реакції |
Спостереження |
Висновки |
|
|
|
|
Дослід 4. Бромування ароматичних вуглеводнів
Виконання досліду: У дві сухі пробірки окремо помістіть 10 крапель бензену і 10 крапель толуену. Потім у кожну з них додайте по 10 крапель розчину брому в тетрахлорметані і залізні ошурки (на кінчику шпателя). Пробірки закрийте корками з повітряними холодильниками і нагрійте на водяній бані. Піднесіть до отвору пробірки червоний лакмусовий папірець, змочений водою.
Запитання і завдання:
Як змінюється забарвлення розчину брому? Що відбувається із червоним лакмусовим папірцем? Поясніть спостережувані явища. Напишіть рівняння відповідних реакцій.
|
Рівняння реакції |
Спостереження |
Висновки |
|
|
|
|
Дослід 5. Окиснення бічних ланцюгів гомологів бензену
Виконання досліду: У пробірку помістіть 1 краплю 1% -вого розчину калій перманганату, 5 крапель води, 1 краплю 5% -вого розчину сульфатної кислоти і краплю толуену. Вміст пробірки енергійно струсіть і нагрійте в полум’ї пальника.
Запитання і завдання:
Як змінюється забарвлення розчину калій перманганату? Поясніть спостережувані явища. Напишіть рівняння відповідних реакцій.
|
Рівняння реакції |
Спостереження |
Висновки |
|
|
|
|
Завдання 1.
Одним з проміжних продуктів в циклі трикарбонових кислот (цикл Кребса) є цис-аконітова кислота:
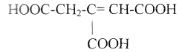
Фермент аконітаза каталізує гідратацію цис-аконітової кислоти двома способами: за правилом Марковнікова з утворенням лимонної кислоти і проти правила Марковнікова з утворенням ізолимонної кислоти. Наведіть схеми цих процесів.
_________________________________________________________
_________________________________________________________
Завдання 2. Здійсніть перетворенння:
![]()
![]()
![]() а) Етан етен ацетилен
а) Етан етен ацетилен
![]()
![]()
![]() метилбензен тринітротолуол
метилбензен тринітротолуол
![]() хлорбензен
хлорбензен
![]()
![]()
![]() бензен гексахлорциклогексан
бензен гексахлорциклогексан
![]() етилбензен
етилбензен
Зазначте умови проходження реакцій.
__________________________________________________________
__________________________________________________________
__________________________________________________________
__________________________________________________________
__________________________________________________________
__________________________________________________________
__________________________________________________________
VI. ВИСНОВКИ ПРО ПРОВЕДЕНУ РОБОТУ
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
VII. ПИТАННЯ ДЛЯ САМОКОНТРОЛЮ :
- За якиим механізмом перебігає реакція бромування алканів? Напишіть рівняння бромування гексану.
_______________________________________________________________
- Якими якісними реакціями можна довести наявність кратних вуглець-вуглецевих зв’язків у ряді ненасичених вуглеводнів?
- Чому знебарвлення розчину калій перманганату ацетиленом, на відміну від етилену , відбувається повільніше? Напишіть рівняння відповідної реакції
_______________________________________________________________
- Напишіть рівняння реакції хлорування ацетилену.
_______________________________________________________________
- Порівняйте умови проведення бромування аренів, що дозволяють ввести атом галогену в ароматичне кільце й у бічний ланцюг. Напишіть відповідні рівняння реакцій і наведіть механізм.
______________________________________________________________________________________________________________________________
- Порівняйте відношення до дії окисників бензену і його гомологів. Напишіть відповідні рівняння реакцій. Чому бензен, незважаючи на високий ступінь ненасиченості, не знебарвлює бромну воду і розчин калій перманганату?
______________________________________________________________________________________________________________________________
VIII. ДОМАШНЄ ЗАВДАННЯ :
1. Вивчити тему: «Спирти, феноли, аміни»
2. Ознайомитись з методичними рекомендаціями для студентів до лабораторного заняття №3
Рекомендована література:
Музиченко В.П., Луцевич Д.Д., Яворська Л.П. Медична хімія / За ред. Б.С. Зіменковського. — К.: Медицина, 2010. , с. 366-374.
Лабораторне заняття № 3
І.ТЕМА: СПИТРИ. ФЕНОЛИ. АМІНИ
Актуальність. Вивчення реакційної здатності спиртів, фенолів та амінів дасть можливість прогнозувати перетворення цих сполук в організмі людини, а також синтезувати лікарські сполуки із заданими властивостями.
ІІ. МЕТА :
Знати :
- Визначення, класифікацію спиртів, фенолів, амінів;
- Хімічні властивості спиртів(кислотні, реакції нуклеофільного заміщення, окиснення);
- Особливості хімічних властивостей багатоатомних спиртів;
- Хімічні властивості фенолів, амінів (кислотні і основні);
- Медико-біологічне значення спиртів, фенолів, амінів.
Вміти :
- На основі знання будови спиртів, фенолів, амінів, пояснювати їх реакційну здатність;
- Записувати відповідні рівняння реакцій;
Практичні навички:
- визначати кислотність та основність біоорганічних сполук на прикладах спиртів, фенолів та амінів;
- дотримуватися правил техніки безпеки під час роботи з легкозаймистими речовинами, з концентрованою сульфатною кислотою, фенолом, амінами, спиртами.
ІІІ. КОНТРОЛЬ БАЗОВИХ ЗНАНЬ З ТЕМИ :
- Загальна формула спиртів, фенолів, амінів.
- Класифікація спиртів, фенолів, амінів.
- Хімічні властивості спиртів(кислотні, реакції нуклеофільного заміщення, окиснення).
- Особливості хімічних властивостей багатоатомних спиртів.
- Хімічні властивості фенолів, амінів (кислотні і основні);
- Медико-біологічне значення спиртів, фенолів, амінів.
Завдання 1. Напишіть рівняння хімічних реакцій, за допомогою яких можна здійснити таке перетворення:
1 – хлоробутан → 1 – бутанол → бутиловий естер ацетатної кислоти;
__________________________________________________________
__________________________________________________________
______________________________________________________________________
Завдання 2. Напишіть схеми взаємодії пропілового спирту із запропонованими реагентами: Nа, HBr, CH3COOH. Назвіть продукти.
__________________________________________________________
__________________________________________________________
______________________________________________________________________
Завдання 3. Напишіть схеми і назвіть продукти взаємодії втор-бутилового спирту і гліцерину з оцтовою кислотою. Як називається ця реакція? Які умови реакції? До якого класу органічних сполук відносяться продукти реакції.
__________________________________________________________
__________________________________________________________
Завдання 4. Напишіть рівняння хімічних реакцій, за допомогою яких можна здійснити таке перетворення:
фенол → натрій фенолят → Х → 2,4,6– трибромофенол
__________________________________________________________
__________________________________________________________
______________________________________________________________________
IV. ОБЛАДНАННЯ : таблиці, схеми, роздатковий матеріал, штатив з пробірками, скляні палички, піпетки, пальник.
РЕАКТИВИ : етанол, металічний натрій, фенолфталеїн, сульфатна кислота конц., натрій хлорид, натрій ацетат, натрій гідроксид, купрум (ІІ) сульфат, гліцерил, фенол, хлорид на кислота, метиламін, анілін.
V. ХІД САМОСТІЙНОЇ РОБОТИ СТУДЕНТІВ
РОБОТА № 1. ВИВЧЕННЯ ХІМІЧНИХ ВЛАСТИВОСТЕЙ СПИРТІВ
Дослід 1. Одежання і гідроліз нарій етилату (кислотні властивості спиртів)
Виконання досліду: У суху пробірку помістіть 3 краплі етанолу і шматочок попередньо віджатого на фільтрувальному папері металічного натрію:
2С2Н5ОН + Na → 2С2Н5ОNa + Н2
Білий осад натрій етилату розчиніть у 2-4 краплях етанолу і додайте 1 краплю фенолфталеїну. Після внесення в пробірку 1-2 крапель води з'являється малинове забарвлення, яке вказує на лужне середовище отриманого розчину:
С2Н5ОNa + Н2О → С2Н5ОН + NaОН
Дослід 2. Взаємодія спиртів з галогеноводневими кислотами (реакції нуклеофільного заміщення)
Виконання досліду: У пробірку помістіть на висоту 1 см натрію хлорид, 6 крапель етанолу і 4 краплі концентрованої сульфатної кислоти. Вміст пробірки нагрійте у полум'ї пальника, не допускаючи бурхливого виділення хлороводню:
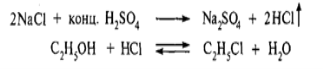
Періодично отвір пробірки підносьте до полум'я пальника. Етил-хлорид, що виділяється, загоряється, утворюючи кільце зеленого кольору (характерно для нижчих алкілгалогенідів). Слід пам'ятати, що утворення етилхлориду починається не відразу.
Дослід 3. Одержання естеру
Виконання досліду: У суху пробірку помістіть на висоту 2 мм безводний натрію ацетат, 3 краплі етанолу і 2 краплі концентрованої сульфатної кислоти. Вміст пробірки обережно нагрійте у полум'ї пальника. Відчуватиметься характерний приємний освіжаючий запах етилового естеру оцтової кислоти:
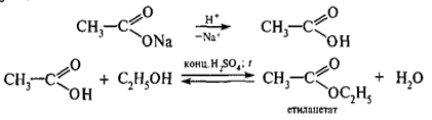
Ця реакція використовується для ідентифікації спиртів і карбонових кислот.
Дослід 4. Окиснення спиртів
А. Окиснення етанолу хромовою сумішшю в кислому середовищі.
Виконання досліду: У пробірку помістіть 2 краплі етанолу, 1 краплю 10%-вого розчину сульфатної кислоти і 2 краплі 5 %-вого розчину калію дихромату.
Вміст пробірки нагрійте у полум'ї пальника і через кілька секунд спостерігайте перехід оранжевого забарвлення розчину в синьо-зелене, що зумовлено зміною ступеня окиснення хрому:
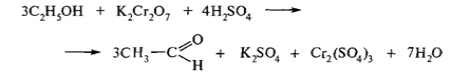
Відчуватиметься характерний запах оцтового альдегіду, що нагадує запах антонівських яблук. Ця реакція може бути використана для відкриття етилового спирту.
Б. Окиснення етанолу калію перманганатом.
Виконання досліду: У пробірку помістіть 2 краплі етанолу, 2 краплі 5 %-вого розчину калію перманганату і 3 краплі 10 %-вого розчину сульфатної кислоти. Спостерігайте знебарвлення рожево-фіолетового кольору розчину і вже при слабкому нагріванні відчувається запах оцтового альдегіду, який нагадує запах антонівських яблук:
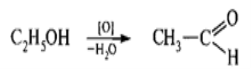
Первинні спирти за цих умов окиснюються переважно до альдегідів, вторинні до кетонів, а третинні –в жорстких умовах утворюють суміш продуктів розчеплення.
Дослід 5. Взаємодія гліцеролу з купрум (ІІ) гідроксидом у лужному середовищі
Виконання досліду: В пробірку помістіть 2 краплі 2% розчину купрум (ІІ) сульфату і 5 крапель 10 % розчину натрій гідроксиду. Утворюється голубий сирнистий осад купрум (ІІ) гідроксиду. Додайте 3 краплі гліцеролу і струсіть вміст пробірки. Осад купрум (ІІ) гідроксиду переходить у розчин, який набуває інтенсивного синьоо забарвлення.
CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4
голубий голубий
розчин осад
![]() H
H
![]()
![]() H2C—ОН H2C―O :O― CH2
H2C—ОН H2C―O :O― CH2
![]()
![]()
![]()
![]()
![]() Cu
Cu
![]() 2HC—ОН + Cu(OH)2 → HC―O: O― CH + 2 H2O
2HC—ОН + Cu(OH)2 → HC―O: O― CH + 2 H2O
![]()
![]()
![]() голубий H
голубий H
H2C—ОН осад H2C―OH HO― CH2
синій розчин
гліцерин Купрум гліцерат
Завдання і запитання.
- Який структурний фрагмент повинен міститись в молекулах спиртів, які розчиняють купрум (ІІ) гідроксид ?
- Чи можна використати цю реакцію у випадку необхідності розрізнити розчини гліцеролу і етанолу ?
РОБОТА № 2. ВИВЧЕННЯ КИСЛОТНИХ ВЛАСТИВОСТЕЙ ФЕНОЛІВ
Дослід 6 . Одержання натрій феноляту та розклад його кислотою
Виконання досліду: У пробірку вмістіть 5 крапель води і 1 краплю фенолу. До емульсії додайте 3 краплі 10% розчину натрій гідроксиду. Фенол розчиняється у натрій гідроксиді.
До одержаного розчину додайте декілька крапель 10% розчину хлоридної кислоти. Розчин у пробірці мутніє внаслідок виділення вільного фенолу, який обмежено розчинний у воді і тому утворює емульсію.
Завдання і запитання.
- Напишіть рівняння реакції взаємодії фенолу з натрій гідроксидом. Яка властивість фенолу проявляється в цій реакції ?
- Чому фенол на відміну від етанолу здатен взаємодіяти з лугами ?
- Напишіть схему реакції взаємодії натрій феноляту з хлоридною кислотою.
|
Рівняння реакції |
Спостереження |
Висновки |
|
|
|
|
|
|
|
|
РОБОТА № 3. ВИВЧЕННЯ ОСНОВНИХ ВЛАСТИВОСТЕЙ АМІНІВ (досліди проводять у витяжній шафі!)
Дослід 7 .Визначення реакції середовища
Виконання досліду: На універсальний індикаторний папір нанесіть окремо по 1 краплі розчинів метиламіну та аніліну і порівняйте їх основність.
|
Рівняння реакції |
Спостереження |
Висновки |
|
|
|
|
Дослід 8 .Взаємодія з Купрум (ІІ) сульфатом
Виконання досліду: У пробірку помістіть 10 крапель 5% розчину Купрум (ІІ) сульфату і додайте покрапельно 25% розчин метиламіну. Спостерігайте утворення блакитного осаду, що потім розчиняється від надлишку аміну.
2[СН3NH3+]OH- + CuSO4→ Cu(OH)2 + [(СН3NH3+)2]SO42-
|
Рівняння реакції |
Спостереження |
Висновки |
|
|
|
|
IV. ВИСНОВКИ ПРО ПРОВЕДЕНУ РОБОТУ
___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
V. ПИТАННЯ ДЛЯ САМОКОНТРОЛЮ:
- Як пояснити, що спирти проявляють кислотні властивості, хоча самі не є кислотами?
- Які продукти реакції окиснення етанолу?
- Як хімічним способом відрізнити гліцерол від етанолу?
- Як впливає на властивості спирту вміст у його молекулі кількох гідроксильних груп?
- Чим зумовлені кислотні властивості фенолу? Чому вони у нього сильніше виражені, ніж у етанолу?
Задача 1. Закінчіть рівняння реакцій. Назвіть вихідні реагенти та продукти реакцій:
|
NH3 а) Н3С — NH2 + СH3 —І →
|
в) + 3Br2 → |
Oб) Н3С – NH2 + Н3С – СH2 – C – Cl→
|
г) + H2SO4 → |
VI. ДОМАШНЄ ЗАВДАННЯ:
1. Вивчити теми: “ Карбонільні сполуки. Карбонові кислоти ”.
2. Ознайомитися з методичними рекомендаціями для студентів до лабораторного заняття № 4.
3. Опрацювати методичні рекомендації до позааудиторної самостійної роботи № 3п.
Рекомендована література :
Музиченко В.П., Луцевич Д.Д., Яворська Л.П. Медична хімія / За ред. Б.С. Зіменковського. — К.: Медицина, 2010. , с.377-394 .
МЕТОДИЧНІ РЕКОМЕНДАЦІЇ
ДО ПОЗААУДИТОРНОЇ САМОСТІЙНОЇ РОБОТИ № 3 п
ТЕМА № 4: Карбонільні сполуки. Карбонові кислоти
Питання для самостійної роботи: “Функціональні похідні карбонових кислот” –2год.
І. Навчальна мета:
- знати будоау карбонових кислот;
- знати функціональні групи;
- знати механізм реакцій SN монокарбонових кислот;
- знати будову функціональних похідних карбонових кислот;
- вміти розв’язувати ситуаційні задачі щодо даної теми.
ІІ. План вивчення теми або питання (самостійної роботи).
- Реакції нуклефільного заміщення у монокарбонових кислот.
Функціональні похідні карбонових кислот.
а) Реакції етерифікації.
Рекомендована література:
Музиченко В.П., Луцевич Д.Д., Яворська Л.П. Медична хімія \ За ред. Б.С.Зіменковського –К.: Медицина, 2010., с.389.
б) Утворення амідів кислот.
Рекомендована література:
Музиченко В.П., Луцевич Д.Д., Яворська Л.П. Медична хімія \ За ред. Б.С.Зіменковського –К.: Медицина, 2010., с.389.
в) Утворення ангідридів.
Рекомендована література:
Музиченко В.П., Луцевич Д.Д., Яворська Л.П. Медична хімія \ За ред. Б.С.Зіменковського –К.: Медицина, 2010., с.390.
г) Утворення галоген ангідридів кислот.
Рекомендована література:
Музиченко В.П., Луцевич Д.Д., Яворська Л.П. Медична хімія \ За ред. Б.С.Зіменковського –К.: Медицина, 2010., с.390-391.
ІІІ. Завдання:
-орпацювати навчальний матеріал;
-скласти схему взаємоперетворень (завдання 1)
-дати усно відповіді на запитання.
Завдання 1.

_____________________________________________________________________
______________________________________________________________________
_____________________________________________________________________
______________________________________________________________________
_____________________________________________________________________
______________________________________________________________________
_____________________________________________________________________
______________________________________________________________________
Питання для самоконтролю
1. Які реакції називають реакціями нуклеофільного заміщення?
- В чому полягає суть реакції естерифікації? Наведіть приклад.
- В чому полягає суть реакції взаємодії карбонових кислот з амоніаком, пентахлоридом фосфору? Наведіть приклади.
- Охарактеризуйте функціональні похідні карбонових кислот.
Рекомендована література
Музиченко В.П., Луцевич Д.Д., Яворська Л.П. Медична хімія \ За ред. Б.С.Зіменковського –К.: Медицина, 2010., с. 389-391.
Лабораторне заняття № 4
І.ТЕМА: КАРБОНІЛЬНІ СПОЛУКИ. КАРБОНОВІ КИСЛОТИ
Актуальність. Велика кількість біологічно активних речовин таких, як білки, жири, вуглеводи, простагландини, статеві гормони та ін. містять в своїй структурі карбонільну групу, яка зумовлює високу реакційну здатність
цих сполук. Серед біологічно важливих реакцій карбонільних сполук слід
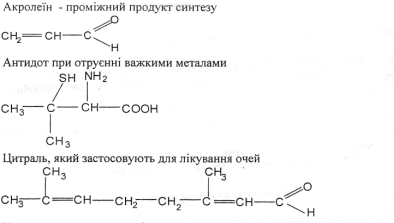
відзначити альдольну конденсацію, в результаті якої синтезується гексоза, яка при подальшій поліконденсації перетворюється на полісахариди. Синтез лимонної кислоти в організмі здійснюється теж шляхом альдольної конденсації. За рахунок карбонільної групи утворюються напівацеталі і ацеталі, які мають важливе значення в хімії вуглеводів. Іміни або основи Шиффа (продукти взаємодії карбонільних сполук і первинних амінів утворюються у ряді важливих біохімічних трансформацій амінокислот, зокрема при декарбоксилюванні і окисному дезамінуванні. Карбонільні сполуки та їх похідні є не тільки біологічно важливими речовинами, але й лікарськими засобами, оскільки альдегідна група зумовлює наркотичну і дезинфікуючу дії (формалін, уротропін, хлоралгідрат і ін.)
Велика кількість карбонових кислот бере участь в процесах метаболізму. До складу ліпідів входять залишки пальмітинової, стеаринової, олеїнової, лінолевої, ліноленової та ін. кислот. Особливе значення мають поліненасичені кислоти (лінолева, ліноленова і ін.), які в організмі не синтезуються, а надходять тільки з іжею. Вони виконують в організмі роль вітаміну F. Ці кислоти сприяють зниженню вмісту холестерину в крові та стимулюють його обмін в печінці. Карбонові кислоти є учасниками циклу трикарбонових кислот, який забезпечує потреби організму в енергії. Цілий ряд кислот та їх похідних використовують у фармацевтичному синтезі: ізовалеріанова кислота - компонент валідолу; натрієва сіль бензойної кислоти має відхаркувальну дію; суміш етилових ефірів олеїнової та лінолевої кислот входить до складу препарату "Лінетол", що застосовуєгься при лікуванні гіпертонії та атеросклерозу, а також при опіках і променевій хворобі.
ІІ. МЕТА :
Знати :
- Класифікація, номенклатура та ізомерія та медико-біологічне значення альдегідів та кетонів
- Фізичні та хімічні властивості альдегідів та кетонів
- Карбонові кислоти, їх будова, класифікація, номенклатура, ізомерія та медико-біологічне значення.
Вміти :
- На основі електронної будови карбонільної групи і її впливу на сусідні атоми, пояснювати і передбачати напрямок біологічно важливих реакцій альдегідів і кетонів.
- Володіти методами ідентифікації альдегідів і кетонів (ацетон), що мають важливе значення у клінічних дослідження.
- Моделювати будову і прогнозувати реакційну здатність карбонових кислот.
ПРАКТИЧНІ НАВИЧКИ:
- пояснювати і передбачати напрям біологічно важливих реакцій альдегідів і кетонів на основі електронної будови карбонільної групи та її впливу на сусідні атоми;
- володіти методами ідентифікації альдегідів і кетонів (ацетон), що мають велике значення в клінічних дослідженнях;
- моделювати будову карбонових кислот;
- прогнозувати реакційну здатність карбонових кислот;
ІІІ. КОНТРОЛЬ БАЗОВИХ ЗНАНЬ З ТЕМИ :
1. Класифікація, номенклатура та ізомерія та медико-біологічне значення альдегідів та кетонів
2. Електронна будова карбонільної групи. Реакційні центри в молекулах альдегідів і кетонів.
3. Фізичні та хімічні властивості альдегідів та кетонів.
4. Реакції нуклеофільного приєднання АN до карбонільної групи. Його механізм.
5. Реакція утворення напівацеталей, її механізм. Роль кислотного каталізу.
6. Реакція альдольної конденсації, її механізм. Роль лужного каталізу
7. Галоформна реакція альдегідів і кетонів та її значення.
8. Карбонові кислоти, їх будова, класифікація, номенклатура, ізомерія та медико-біологічне значення.
9. Кислотність карбонових кислот і її залежність від природи вуглеводневого радикалу та електронних ефектів замісників.
10. Хімічні властивості насичених одноосновних карбонових кислот:
- утворення солей;
- реакції нуклеофільного заміщення ;
- утворення естерів, амідів, галогенангідридів і ангідридів кислот;
- окиснення і відновлення.
IV. ОБЛАДНАННЯ : таблиці, схеми, роздатковий матеріал, мікроскоп
РЕАКТИВИ: 1% розчин аргентум нітрату; 10% розчин натрій гідроксиду, 2% розчин амоніаку, оцтовий альдегід, 2% розчин купрум сульфату, 10% спиртовий розчин калій гідроксиду, розчин бензальдегіду, розчин йоду в калій йодиді, ацетон, етанол, концентрована сульфатна кислота, 10% розчин сульфатної кислоти, натрій гідрокарбонат, оцтова кислота, 2нр-н НС1.
Індикатори: метиловий червоний, синій лакмусовий папірець.
V. ХІД САМОСТІЙНОЇ РОБОТИ СТУДЕНТІВ
РОБОТА № 1. ВЛАСТИВОСТІ КАРБОНІЛЬНИХ СПОЛУК
Дослід 1. Якісне виявлення альдегідної групи реактивом Толленса (реакція «срібного дзеркала»)
Виконання досліду: У чисто вимиту пробірку помістіть по 1 краплі 1% -вого розчину аргентуму нітрату і 10% -вого розчину натрій гідроксиду. Спостерігайте виділення бурого осаду аргентум оксиду.
Потім у пробірку при постійному струшуванні додайте краплями 2% -вий водний розчин амоніаку до повного розчинення осаду (необхідно уникати надлишку амоніаку, тому що знижується чутливість реагенту).
Реактив Толленса [Ag(NH3)2]OH готують безпосередньо перед проведенням досліду. При зберіганні реактив Толленса розкладається з утворенням чорного осаду – вибухонебезпечного аргентуму нітриту Ag3N.
До отриманого прозорого розчину реактиву Толленса додайте 2 краплі оцтового альдегіду.
|
Рівняння реакції |
Спостереження |
Висновки |
|
|
|
|
|
|
|
|
Дослід 2. Якісне виявлення альдегідної групи реактивом Троммера
Виконання досліду: У дві пробірки помістіть по 5 крапель 10%-вого розчину натрій гідроксиду, води і по 1 краплі 2% -вого розчину курум(ІІ) сульфату. Спостерігайте утворення синього осаду купрум(ІІ) гідроксиду.
Потім в одну з пробірок додайте 3 краплі 40% розчину формальдегіду, в другу – 3 краплі 40%-вого розчину формальдегіду. Вміст пробірок збовтайте і нагрійте до початку кипіння.
|
Рівняння реакції |
Спостереження |
Висновки |
|
|
|
|
|
|
|
|
Дослід 3. Реакція окиснення-відновлення бензальдегіду (реакція Канніццаро)
Виконання досліду: У пробірку помістіть 5 крапель 10%-вого спиртового розчину калій гідроксиду і додайте 2 краплі бензальдегіду. Суміш розігрівається і швидко твердне внаслідок утворення в спиртовому розчині калію бензоату.
|
Рівняння реакції |
Спостереження |
Висновки |
|
|
|
|
Дослід 4. Йодоформна проба, її використання в аналітичних цілях.
Виконання досліду: В пробірку помістіть 1 краплю розчину йоду в калію йодиді і додайте краплями 10%-вий розчин натрію гідроксиду (до знебарвлення розчину).Після додавання в пробірку 1 краплі ацетону спостерігайте утворення жовтуватого осаду йодоформу і відчувають характерний запах .
Йодоформна проба позитивна для оцтового альдегіду і метилкетонів. Цю реакцію називають пробою Лібена і використовують для відкриття ацетону в сечі.
|
Рівняння реакції |
Спостереження |
Висновки |
|
|
|
|
РОБОТА № 2. ВЛАСТИВОСТІ КАРБОНОВИХ КИСЛОТ
Дослід 5. Кислотні властивості карбонових кислот (реакція нейтралізації)
Виконання досліду: В пробірку внесіть щіпку стеаринової кислоти та 2-3 мл води і перемішайте.
Кислота у воді не розчиняється. Додайте декілька крапель розчину лугу і спостерігайте розчинення кислоти. Напишіть рівняння реакції.
|
Рівняння реакції |
Спостереження |
Висновки |
|
|
|
|
Дослід 6. Кислотні властивості карбонових кислот (взаємодія з солями)
Виконання досліду: В пробірку внесіть щіпку соди і додайте краплями розчин оцтової кислоти.
Спостерігайте виділення газу. Напишіть рівняння реакції.
|
Рівняння реакції |
Спостереження |
Висновки |
|
|
|
|
Дослід 7. Реакція естерифікації. Гідроліз складних ефірів.
Виконання досліду: У пробірку помістіть 2 мл етанолу, 2 мл льодяної оцтової кислоти і 0,5 мл концентрованої сульфатної кислоти. Вміст пробірки струсіть і на 10 хв помістіть в гарячу (60-70ºС) водяну баню, не допускаючи кипіння рідини в пробірці. Після охолодження розчину в пробірку долийте 2 мл води. Спостерігайте появу естерового шару в пробірці і відчувайте специфічний запах етилацетату. Межа розділення шарів естеру і води чіткіше помітна при обережному погойдуванні пробірки . Відзначте зміну об’єму естерового шару в пробірці після додавання 3 мл насиченого розчину натрій гідроксиду.Гідроліз значною мірою прискорюється лугом, який зв’язує карбонову кислоту, що утворюється, роблячи при цьому гідроліз незворотнім.
|
Рівняння реакції |
Спостереження |
Висновки |
|
|
|
|
|
|
|
|
VI. ВИСНОВКИ ПРО ПРОВЕДЕНУ РОБОТУ
___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
VII. ПИТАННЯ ДЛЯ САМОКОНТРОЛЮ :
1.За допомогою яких реакцій можна відрізнити альдегіди від кетонів?
2. Яким чином можна змістити рівновагу реакції естерифікації в бік утворення естеру?
3. Наведіть схеми і механізм кислотного та лужного гідролізу етилацетату. Яка з цих реакцій необоротна і чому?
Завдання 1. Який з двох альдегідів: 2-метил-2-етилбутаналь чи 2-метилбутаналь вступає в реакцію альдольної конденсації і чому? Складіть рівняння відповідної реакції.
_________________________________________________________________
Завдання 2. Напишіть схеми одержання функціональних похідних пропіонової кислоти: солі, хлорангідриду, складного ефіру, аміду, ангідриду. Назвіть продукти реакцій.
_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Завдання 3. Бензилбензоат С6Н5СООСН2С6Н5 - засіб, що застосовують проти корости. Напишіть рівняння реакцій одержання цієї сполуки і її гідролітичного розщеплення в кислому середовищі.
___________________________________________________________________________________________________________________________________________________________________________________________________
VIII. ДОМАШНЄ ЗАВДАННЯ :
1. Вивчити тему: «Аміноспирти, гідрокси- та оксокислоти»
2. Ознайомитися з методичними рекомендаціями для студентів до лабораторного заняття № 5
Рекомендована література:
Музиченко В.П., Луцевич Д.Д., Яворська Л.П. Медична хімія / За ред. Б.С. Зіменковського. — К.: Медицина, 2010. , с. 405-413.
Лабораторне заняття № 5
І.ТЕМА: АМІНОСПИРТИ, ГІДРОКСИ- ТА ОКСОКИСЛОТИ
Актуальність. Гетерофункціональними є сполуки, які мають щонайменше 2 різні функціональні групи. Похідні карбонових кислот є важливими складовими продуктів метаболізму. Знання властивостей, шляхів перетворень аміноспиртів, гідроксі-, оксокислот необхідно для розуміння процесів, що відбуваються в організмі.
ІІ. МЕТА :
Знати :
- Класифікацію, номенклатуру, ізомерію та медико-біологічне значення гетерофункціональних сполук.
- Особливості будови і властивостей аміноспиртів, гідрокси- та амінокислот, кетокислот та фенолокислот
- Кетонові тіла, діагностичне значення, їх визначення при цукровому діабеті.
- Фенолокислоти та їх похідні. Використання саліцилової кислоти та її похідних у медицині (метилсаліцилат, салол, аспірин, саліцилати натрію) у вигляді лікарських засобів
Вміти :
- визначати функціональні групи, проводити реакції характерні для гетерофункціональних сполук.
ПРАКТИЧНІ НАВИЧКИ:
- прогнозувати хімічну поведінку гетерофункціональних сполук у реакціях, що лежать в основі біохімічних перетворень у живих організмах;
- мати уявлення про будову найважливіших метаболітів і лікарських препаратів, що належать до групи гетерофункціональних аліфатичних сполук;
- зображувати структурні формули відомих лікарських препаратів з ряду гетерофункціональних ароматичних сполук;
ІІІ. КОНТРОЛЬ БАЗОВИХ ЗНАНЬ З ТЕМИ :
1. Аміноспирти (коламін, холін) та амінофеноли (адреналін, норадреналін), їх будова та біологічне значення.
2. Гідрокси-, оксокислоти, їх будова, класифікація, номенклатура, ізомерія та біологічне значення.
3. Фенолокислоти та їх похідні. Використання саліцилової кислоти та її похідних у медицині (метилсаліцилат, салол, аспірин, саліцилати натрію) у вигляді лікарських засобів.
4. Стереоізомерія гідроксикислот. Оптична активність.
5. Двоїста реакційна здатність гідрокси-, оксокислот.
6. Специфічні реакції α, β, γ -гідроксикислот.
7. Представники гідроксикислот (гліколева, молочна, β-гідрокси-масляна, яблучна, лимонна, винна), іх значення.
8. Представники альдегідо і кетокислот (гліоксалева, піровиноградна, а-кетоглутарова, ацетооцтова), їх значення. Група "кетонових тіл".
IV. ОБЛАДНАННЯ : таблиці, схеми, роздатковий матеріал.
РЕАКТИВИ: 15% розчин винної кислоти, 5% розчин калій гідроксиду, розчин купрум сульфату, 10% розчин натрій гідроксиду, оцтова та амінооцтова кислоти, кристали саліцилової кислоти, розчин ферум(ІІІ) хлориду, 96% етанол, 1% р-н амінооцтової кислоти, нінгідрин (0,1% р-н в ацетоні), розчин білка, 20% р-н нітратної кислоти, цистеїн, 5% р-н плюмбуму ацетату.
Індикатори: синій лакмусовий папірець, метиловий червоний.
V. ХІД САМОСТІЙНОЇ РОБОТИ СТУДЕНТІВ:
РОБОТА №1. БУДОВА ТА НОМЕНКЛАТУРА ГЕТЕРОФУНКЦІОНАЛЬНИХ СПОЛУК
Завдання 1. Вкажіть функціональні групи та структурні компоненти, що входять до складу таких біогенних амінів:
|
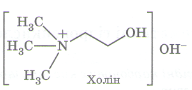
Холін або (2-гідроксіетил)-триметиламоній гідроксид є важливим продуктом метаболізму, входить до складу багатьох фосфоліпідів і є структурним фрагментом низки лікарських препаратів. |
|
|
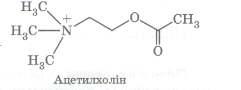
Ацетилхолін — естер холіну і оцтової кислоти. Це один із найважливіших нейромедіаторів (речовин, що беруть участь у передаванні нервових імпульсів). |
|
|
Норадреналін в організмі виконує роль нейромедіатора. |
|
|
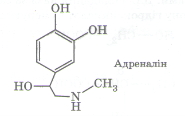
Адреналін – нейромедіатор, що у стресових ситуаціях у значних кількостях виділяється в кров'яне русло і викликає почуття тривоги, страху. Тому його називають гормоном страху. Адреналін впливає на роботу серцевого м'яза, звужує судини та підвищує артеріальний тиск.
|
|
Завдання 2. Назвіть за систематичною номенклатурою такі сполуки:
|
1. Коламін - важливий продукт метаболізму, структурний компонент норадреналіну та адреналіну
|
|
|
2. Винна кислота |
|
|
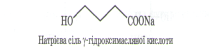
3. Натрієва сіль γ - гідроксимасляної кислоти (ГОМК) - засіб для неінгаляційного наркозу, а також як снодійна речовина:
|
|
4. Щавлевооцтова та α-кетоглутарова кислоти є метаболітами, які беруть участь у циклі Кребса.
|
|
Завдання 3. Напишіть структурні формули відомих лікарських препаратів з ряду гетерофункціональних ароматичних сполук:
|
|
|
2. Натрій саліцилат – препарат для лікування ревматизму |
|
|
3. Метилсаліцилат(метиловий естер саліцилової кислоти) – засіб для лікування ревматизму суглобів
|
|
|
4. Аспірин (ацетилсаліцилова кислота, саліциловий естер етанової кислоти) - жарознижуючий і болезаспокійливий засіб
|
|
|
5. Фенілсаліцилат, салол (феніловий естер саліцилової кислоти) - дезинфікуючий засіб при деяких кишкових захворюваннях, інфекціях сечовивідних шляхів.
|
|
|
6. Парааміносаліцилат натрію (ПАСК)(4-аміно-2-гідроксибензоат натрію) – препарат для лікування інфільтративно-осередкових форм фіброзно-кавернозного туберкульозу легень, серозно-гнійного і гнійного перитоніту, туберкульозу гортані, кишок, лімфатичних вузлів, кісток і суглобів
|
|
РОБОТА №2 . ВИВЧЕННЯ ВЛАСТИВОСТЕЙ ГІДРОКСИ, ОКСИКИСЛОТ
Завдання 4. Напишіть схему утворення так званих кетонових (ацетонових) тіл.
_________________________________________________________
_________________________________________________________
Дослід 1. Утворення кислих та середніх солей (калій тартрату і гідрогентартрату)
Виконання досліду: В пробірку внесіть 5 крапель 15% розчину тартрату (винної кислоти), додайте 2 краплі 5% розчину калій гідроксиду і струсіть. Поступово починає виділятись білий кристалічний осад малорозчинної у воді кислої калієвої солі винної кислоти (калій гідрогентартрату). Якщо осад не випадає, то охолодіть пробірку під струменем води і потріть внутрішню стінку пробірки скляною паличкою. Додайте ще – 4-5 крапель 5% розчину калій гідроксиду. Кристалічний осад поступово розчиняється, так як утворюється добре розчинна у воді середня калієва сіль винної кислоти (калій тартрат). Пробірку з розчином залишіть для наступного досліду
Завдання і запитання :
1. Напишіть рівняння реакцій утворення калій тартрату і гідрогентартрату.
2. Опишіть зовнішній ефект.
3. Наявність яких функціональних груп у винній кислоті доводиться за допомогою цих реакцій ? Зробіть висновки.
|
Рівняння реакції |
Спостереження |
Висновки |
|
|
|
|
Дослід 2 Доказ наявності гідроксильних груп у винній кислоті
Виконання досліду: В пробірку внесіть 2 краплі 2% розчину СuSO4 і 2 краплі 10% розчину NаОН. Випадає голубий осад купрум(ІІ) гідроксиду. До осаду, що утворився, додайте розчин калій тартрату з попереднього досліду. Осад купрум(ІІ) гідроксиду розчиняється з утворенням яскраво-синього розчину.
Завдання і запитання :
1.Опишіть зовнішній ефект.
2.Напишіть рівняння реакцій.
3. Наявність якого структурного фрагменту у винній кислоті доводить ця реакція. Зробіть висновки.
4. Як називається синій розчин, який утворився в результаті реакцій? З якою метою він застосовується ?
|
Рівняння реакції |
Спостереження |
Висновки |
|
|
|
|
|
|
|
|
Дослід 3. Якісна реакція на цитрат - іон
Виконання досліду: У пробірку помістіть декілька кристаликів лимонної кислоти і розчиніть її у декількох краплях дистильованої води. Розчин нейтралізуйте за лакмусовим індикатором 10% розчином амоніаку і додайте до нього 1-2 краплі 5% розчину кальцій хлориду. Розчин перекип’ятіть 2-3 хв. Випадає осад.
Завдання і запитання :
- У якому вигляді знаходиться лимонна кислота у момент нейтральної реакції середовища за лакмусовим індикатором ? Напишіть схему відповідної реакції.
- Напишіть схему реакції утворення кальцій цитрату.
|
Рівняння реакції |
Спостереження |
Висновки |
|
|
|
|
|
|
|
|
VI. ВИСНОВКИ ПРО ПРОВЕДЕНУ РОБОТУ
___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
VII. ПИТАННЯ ДЛЯ САМОКОНТРОЛЮ:
1. Представте будову біогенних амінів - коламіну, холіну, норадреналіну, адреналіну. При декарбоксилюванні якої кислоти утворюється коламін? Складіть схему реакції.
______________________________________________________________
2. Напишіть схеми утворення молочної кислоти в організмі людини.
______________________________________________________________________________________________________________________________
- Складіть схеми характерних реакцій, що відбуваються при нагріванні α-гідроксипропіонової, α-гідроксимасляної, β-гідроксимасляних кислот. Назвіть продукти реакцій.
_____________________________________________________________________________________________________________________________________________________________________________________________
- Які сполуки входять до групи "кетонових тіл"? При яких порушеннях в організмі проводиться їх визначення у біологічних рідинах (сечі, крові)? Напишіть схему таутомерної рівноваги для ацетооцтової кислоти.
____________________________________________________________________________________________________________________
VIII. ДОМАШНЄ ЗАВДАННЯ :
1. Вивчити тему: «Протеїногенні амінокислоти»
2. Ознайомитися з методичними рекомендаціями для студентів до лабораторного заняття № 6
3. Опрацювати методичні рекомендації до позааудиторної самостійної роботи № 4п.
Рекомендована література:
Музиченко В.П., Луцевич Д.Д., Яворська Л.П. Медична хімія / За ред. Б.С. Зіменковського. — К.: Медицина, 2010. , с.413-432.
МЕТОДИЧНІ РЕКОМЕНДАЦІЇ
ДО ПОЗААУДИТОРНОЇ САМОСТІЙНОЇ РОБОТИ № 4п
ТЕМА № 6: Протеїногенні амінокислоти, пептиди, білки
Питання для самостійної роботи:
“Стрктурна організація білків”-2 год.
І. Навчальна мета:
-знати будову білків;
-знати рівні організації будови білків;
-вміти записувати первинну структуру пептидів;
-вміти розв’язувати ситуаційні задачі щодо даної теми.
ІІ. План вивчення теми або питання (самостійної роботи).
- Первинна структура білків.
Рекомендована література:
Музиченко В.П., Луцевич Д.Д., Яворська Л.П. Медична хімія \ За ред. Б.С.Зіменковського –К.: Медицина, 2010., с..426
- Вторинна структура білків
Рекомендована література:
Музиченко В.П., Луцевич Д.Д., Яворська Л.П. Медична хімія \ За ред. Б.С.Зіменковського –К.: Медицина, 2010., с..426-427
- Третинна структура білків.
Рекомендована література:
Музиченко В.П., Луцевич Д.Д., Яворська Л.П. Медична хімія \ За ред. Б.С.Зіменковського –К.: Медицина, 2010., с.427-428
- Четвертинна структура білків
Рекомендована література:
Музиченко В.П., Луцевич Д.Д., Яворська Л.П. Медична хімія \ За ред. Б.С.Зіменковського –К.: Медицина, 2010., с..428-429.
ІІІ. Завдання:
-опрацювати навчальний матеріал;
-зобразити первинну, вторинну, третинну, четвертинну структуру білків;
|
Первинна структура
|
Вторинна структура
|
|
Третинна структура
|
Четвертинна структура
|
-дати усно відповіді на запитання.
Питання для самоконтролю:
1. В чому полягає суть реакції утворення пептидів?
2. Що відображає первинна структура білків?
3. Які фактори стабілізують вторинну, третинну і четвертинну структури білка?
4. Які білки мають четвертинну структуру? Наведіть приклади.
Рекомендована література
Музиченко В.П., Луцевич Д.Д., Яворська Л.П. Медична хімія \ За ред. Б.С.Зіменковського –К.: Медицина, 2010., с.426-429.
Лабораторне заняття № 6
І.ТЕМА: ПРОТЕЇНОГЕННІ АМІНОКИСЛОТИ, ПЕПТИДИ, БІЛКИ
Актуальність. Білки - складні високомолекулярні сполуки біологічного походження. Вони виконують ряд важливих функцій: структурну (45-50% сухої маси людини припадає на білки); гормональну (більшість гормонів є білками); каталітичну ( ферменти головним чином мають білкову природу); захисну (імунні процеси в організмі проходять завдяки антитілам білкової природи); транспортну (поживні речовини та кисень переносяться сполуками білкової природи); механічну ( робота м'язів, легенів, шлунку тощо здійснюється за допомогою білкових тіл); енергетичну (білки є джерелом енергії: при окисненні 1 г білка всередньому виділяється 17,2 кДж енергії).
Біологічне значення має група пептидів головного мозку нейропептидів. Вони впливають на процеси запам'ятовування, регулюють сон, проявляють знеболюючу дію. Багато пептидів є гормонами. Так у гіпофізі містяться гормони окситоцин і вазопресин, які за будовою є нонапептидами; окситоцин стимулює мускулатуру матки, вазопресин контролює водний обмін в організмі, підвищує вміст цукру в крові. Гормон інсулін виробляється підшлунковою залозою і контролює метаболізм цукрів в організмі. Останнім часом об'єктом підвищеної уваги стають олігопептиди - енкефаліни і ендорфіни, які виробляються організмом і є знеболюючими засобами.
Багато захворювань виникає в результаті порушення метаболізму природних амінокислот: фенілкетонурія ( або фенілпіровиноградна олігофренія) - дефект обміну фенілаланіну; алкаптонурія, кретинізм та тирозиназний альбінізм - тирозину; хвороба кленового сиропу - порушення декарбоксилування лейцину, ізолейцину і валіну . Причиною багатьох спадкових захворювань є порушення амінокислотної послідовності у білкових молекулах (гемоглобінопатії та серповидноклітинна анемія зокрема, мукополісахаридози, ліпідози і ін.)
ІІ. МЕТА :
Знати :
- Будову, властивості і біологічну роль протеїногенних амінокислот, пептидів, білків.
Вміти :
- визначати функціональні групи, проводити реакції характерні для амінокислот;
- вміти пояснювати амфотерні властивості амінокислот;
- проводити якісні реакції на амінокислоти;
- пояснювати роль амінокислот, білків у біологічних системах.
ПРАКТИЧНІ НАВИЧКИ:
- володіти методиками ідентифікації амінокислот і встановлення наявності пептидних зв’язків у білках;
- дотримуватися правил техніки безпеки під час роботи з формаліном, карбоновими кислотами, концентрованими нітратною, сульфатною кислотами та лугами, газонагрівними приладами.
ІІІ. КОНТРОЛЬ БАЗОВИХ ЗНАНЬ З ТЕМИ :
1. Амінокислоти, їх будова, класифікація, номенклатура, ізомерія та біологічне значення.
2. Стереоізомерія амінокислот. Оптична активність.
3. Двоїста реакційна здатність амінокислот.
4. Специфічні реакції амінокислот.
5. Класифікація, номенклатура та будова а-амінокислот, що входять до складу білків. Незамінні α-амінокислоти.
6. Поняття про структуру білка. α -Спіраль та β-складчаста структура. Роль водневих зв"язків у стабілізації просторової структури.
7. Нековалентні зв'язки, що формують третинну та четвертинну структури.
8. Якісні реакції на а-амінокислоти і білки.
IV. ОБЛАДНАННЯ : таблиці, схеми, роздатковий матеріал.
РЕАКТИВИ: розчин купрум сульфату, 10% розчин натрій гідроксиду, 1% р-н амінооцтової кислоти, нінгідрин (0,1% р-н в ацетоні), розчин білка, 20% р-н нітратної кислоти, цистеїн, 5% р-н плюмбуму ацетату.
Індикатори: синій лакмусовий папірець, метиловий червоний.
V. ХІД САМОСТІЙНОЇ РОБОТИ СТУДЕНТІВ:
РОБОТА №1. БУДОВА ТА НОМЕНКЛАТУРА АМІНОКИСЛОТ
Завдання 1. Вкажіть функціональні групи та назвіть за систематичною номенклатурою такі сполуки:
1. α – Амінокислоти, що входять до складу білків:
|
|
|
Гліцин
|
Аланін
|
|
Аспарагінова кислота
|
Лізин
|
|
2. γ-аміномасляна кислота (ГАМК). Вона є нейромедіатором і бере участь в обмінних процесах кори головного мозку. Під назвою гамалон, або аміналон, її застосовують як лікарський препарат у неврології та психіатрії: |
|
РОБОТА № 2. ВИВЧЕННЯ ВЛАСТИВОСТЕЙ АМІНОКИСЛОТ, ПЕПТИДІВ, БІЛКІВ
|
Завдання 2. На прикладі лейцину складіть схеми можливих реакцій дезамінування in vivo та in vitro. |
|
|
Завдання 3. Наведіть схему декарбоксилування гістидину. Назвіть продукти, що утворюються. Дайте визначення біогенним амінам.
|
|
|
Завдання 4. Зобразіть будову трипептиду з послідовністю Глі-Вал-Іле. Позначте N- і С- кінцеві молекули.
|
|
РОБОТА № 3. ЯКІСНІ РЕАКЦІЇ НА ПРОТЕЇНОГЕННІ АМІНОКИСЛОТИ ТА БІЛКИ
Дослід № 1. Реакція гліцину з нінгідрином
Виконання досліду: До 2 мл амінооцтової кислоти додайте 2-3 краплі 0,1% р-ну нінгідрину в ацетоні. Реакційну суміш в пробірці добре перемішайте і поставте в гарячу водяну баню. Які зміни відбулися в пробірці?
__________________________________________________________
Дослід № 2. Біуретова реакція
Виконання досліду: До 2-3 мл р-ну білка додайте стільки ж 10% р-ну гідроксиду натрію та декілька крапель 0,5% р-ну купруму сульфату. Спостерігайте утворення продукту фіолетового кольору.
Цю реакцію використовують у клінічній практиці для виявлення білків у біологічних рідинах.
__________________________________________________________
Дослід № 3. Ксантопротеїнова реакція білків
Виконання досліду: Цю реакцію дають білки, до складу яких входять амінокислоти з бензольним кільцем (тирозин, фенілаланін).
До 2 мл досліджуваного розчину білка додайте 0,5 мл 20% р-ну нітратної кислоти та кип"ятіть протягом ЗО с. Утворюється жовтий осад. У разі додавання до розчину 2-3 мл 20% натрію гідроксиду жовте забарвлення переходить в оранжеве.
__________________________________________________________
Дослід № 4. Реакція на амінокислоти, що містять сірку (реакція Фоля)
Виконання досліду: У пробірку помістіть 5-6 крапель розчину цистеїну, додайте 4-5 крапель 10% розчину їдкого натру та обережно нагрійте протягом 2 хв. Після охолодження додайте 1 краплю 5% р-ну плюмбум ацетату. Рідина забарвлюється у темно-коричневий колір (випадає чорний осад).
__________________________________________________________
VI. ВИСНОВКИ ПРО ПРОВЕДЕНУ РОБОТУ
___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
VII. ПИТАННЯ ДЛЯ САМОКОНТРОЛЮ
- Кислотно-основні властивості α -амінокислот.
- Амфотерність, утворення цвіттер-іонів. Реакційна здатність α -амінокислот як біфункціональних сполук.
- Реакція поліконденсації для α - амінокислот.
- Реакція трансамінування та її біологічне значення.
Завдання 1. Напишіть схеми реакцій амінокислоти Ала з: а) розведеним розчином гідроксиду натрію при кімнатній температурі; б) соляною кислотою.
________________________________________________________________________________________________________________________________
Завдання 2. Зобразіть будову трипептиду з послідовністю Вал- Фен-Лей. Позначте N- і С- кінцеві молекули.
________________________________________________________________
Завдання 3. Наведіть схему декарбоксилування триптофану. Назвіть продукти, що утворюються. Дайте визначення біогенним амінам.
_______________________________________________________________
VIII. ДОМАШНЄ ЗАВДАННЯ :
1. Вивчити тему: «Моносахариди»
2. Ознайомитися з методичними рекомендаціями для студентів до лабораторного заняття № 7
Рекомендована література:
Музиченко В.П., Луцевич Д.Д., Яворська Л.П. Медична хімія / За ред. Б.С. Зіменковського. — К.: Медицина, 2010. , с.433-442.
Лабораторне заняття № 7
І.ТЕМА: МОНОСАХАРИДИ
Актуальність. Вуглеводи - важливий клас природних органічних сполук. Вони забезпечують життєдіяльність всіх живих організмів, виконують різноманітні функції.
Найбільш поширений моносахарид глюкоза виконує роль зв'язуючої ланки між енергетичними і пластичними функціями вуглеводів, оскільки з неї можуть утворюватись всі інші моносахариди, і навпаки. Крім того, моносахариди використовують як лікарські засоби.
ІІ. МЕТА :
Знати :
- Визначення, класифікацію вуглеводів
- Види ізомерії моносахаридів;
- Фізичні властивості моносахаридів;
- Хімічні властивості моносахаридів;
- Якісні реакції моносахаридів;
- Медико-біологічне значення моносахаридів.
Вміти :
- На основі знання будови моносахаридів, пояснювати їх реакційну здатність;
- Володіти препаративними методами ідентифікації моносахаридів;
ПРАКТИЧНІ НАВИЧКИ:
- пояснювати будову моносахаридів;
- володіти препаративними методами ідентифікації моносахаридів;
- дотримуватися правил техніки безпеки та охорони праці під час роботи з концентрованою хлоридною кислотою, лугами, газонагрівними приладами.
ІІІ. КОНТРОЛЬ БАЗОВИХ ЗНАНЬ З ТЕМИ :
- Як класифікують вуглеводи?
- Які сполуки називають моносахаридами?
- Як класифікують моносахариди?
- Які види ізомерії властиві моносахаридам? Таутомерні форми моносахаридів. Мутаротація.
- Утворення глікозидів, їх роль в побудові оліго- та полісахаридів, нуклеозидів, нуклеотидів та нуклеїнових кислот.
- Охарактеризуйте окисно-відновні властивості моносахаридів: одержання багатоатомних спиртів, глікарових, гліконових і глюкуронових кислот.
- Аскорбінова кислота як похідне гексоз, біологічна роль вітаміну С.
- Окремі представники моносахаридів (глюкоза, манноза, галактоза, фруктоза, ксилоза,
рибоза, 2-дезоксирибоза), їх будова, реакційна здатність і біологічна роль.
IV. ОБЛАДНАННЯ : таблиці, схеми, роздатковий матеріал, штатив з пробірками, скляні палички, предметні скельця, піпетки, хімічна склянка або колба, азбестова сітка, пальник.
РЕАКТИВИ : розчини – глюкози, фруктози; натрій гідроксиду; купрум (ІІ) сульфату; аргентум нітрату; 10% розчин амоніаку; реактив Селіванова (0,01 г резорцину в суміші 10 мл води і 10 мл концентрованої хлороводневої кислоти);
V. ХІД САМОСТІЙНОЇ РОБОТИ СТУДЕНТІВ
РОБОТА № 1. ВИВЧЕННЯ ВИДІВ ІЗОМЕРІЇ ТА БУДОВИ МОНОСАХАРИДІВ
Завдання 1. Напишіть формули, якими можна виразити склад глюкози. Які її ізомери вам відомі ?
РОБОТА № 2. ХІМІЧНІ РЕАКЦІЇ МОНОСАХАРИДІВ
Завдання 2. Напишіть рівняння хімічних реакцій взаємодії:
|
а) рибози з воднем в присутності нікелевого каталізатора; |
|
|
б) глюкози з етиловим спиртом; |
|
|
в) глюкози з фосфатною кислотою;
|
|
Дослід 1. Доказ наявності гідроксильних груп у глюкозі
Виконання досліду. В пробірку внесіть 1-2 краплі 0,2н розчину CuSO4, 3-4 краплі 0,1н розчину NaOH. Утворюється осад купрум гідроксиду голубого кольору. Потім додайте 1-2 краплі розчину глюкози. Факт розчиненя осаду купрум гідроксиду вказу на наявність декількох гідроксильних груп у молекулі глюкози.

Одержаний розчин збережіть до наступного досліду.
Завдання і запитання :
- Чому осад, який утворився розчиняється ?
- Який структурний фрагмент у молекулі глюкози зумовлює її участь у розчиненні осаду ?
Дослід 2. Якісні реакції на виявлення глюкози:
а) проба Троммера
Виконання досліду. До отриманого в попередньому досліді синього розчину додайте кілька крапель води. Пробірку тримайте похило і обережно нагрівайте верхню частину. Спостерігайте перехід синього забарвлення розчину в зелене, а потім його знебарвлення. Одночасно з’являється жовтий осад купрум (І) гідроксиду, що перетворюється в червоно – коричневий осад купрум (І) оксиду.
Завдання і запитання :
- Напишіть схему реакції, яка відповідає утворенню осаду.
- Чому осад, який утворився розчиняється ?
- Який структурний фрагмент у молекулі глюкози зумовлює її участь у розчиненні осаду ?
- Напишіть схему реакції взаємодії купрум (ІІ) гідроксиду з глюкозою.
- Які окисно – відновні властивості проявляє глюкоза у даній реакції?
|
Рівняння реакції |
Спостереження |
Висновки |
|
|
|
|
|
|
|
|
б) проба Толленса
Виконання досліду. У добре вимиту пробірку помістіть 1 краплю 5% розчину аргентум (І) нітрату, додайте декілька крапель 10% розчину аміаку до розчинення утвореного осаду аргентум оксиду. Додайте 1 краплю 0,5 % розчину глюкози і трішки нагрійте над полум’ям пальника до початку побуріння розчину. Далі реакція йде без нагрівання, і металічне срібло випадає або у вигляді чорного осаду, або осаджується на стінках пробірки у вигляді дзеркального нальоту.
Завдання і запитання :
- Напишіть схему реакції утворення реактиву Толленса та взаємодії глюкози з диаміноаргентум гідроксидом.
- Які властивості проявляє глюкоза в даній реакції і за рахунок якої функціональної групи ? Для яких класів органічних сполук характерна ця реакція ?
|
Рівняння реакції |
Спостереження |
Висновки |
|
|
|
|
|
|
|
|
Дослід 3. Реакція Селіванова на фруктозу
Виконання досліду. В пробірку внесіть 2-3 краплі реактиву Селіванова (0,01 г резорцину в суміші 10 мл води і 10 мл концентрованої хлороводневої кислоти), добавте 2 краплі 0,5% розчину фруктози. Нагрійте до початку кипіння.
У пробірці спостерігатиметься швидка поява червоного забарвлення розчину. При подальшому нагріванні до кипіння забарвлений розчин каламутніє і виділяється осад.
У ході реакції при нагріванні гексоз із хлороводневою кислотою утворюється 5-гідроксиметилфурфурол, який конденсується з резорцином з утворенням забарвленого продукту складу С12Н10О4.
Кетози в умовах досліду перетворюються в 5-гідроксиметилфурфурол у 15—20 разів швидше, ніж альдози, що й зумовлює швидкість появи забарвлення і його інтенсивність у розчинах фруктози і сахарози. Альдогексози в цих умовах лише при тривалому кип'ятінні набувають слабо – рожевого забарвлення.
Реакція Селіванова дозволяє виявити в суміші цукрів кетогексози як у вільному, так і у зв'язаному стані (дисахариди).
VI. ВИСНОВКИ ПРО ПРОВЕДЕНУ РОБОТУ
___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
VII. ПИТАННЯ ДЛЯ САМОКОНТРОЛЮ :
- Які сполуки називають вуглеводами? Наведіть їх класифікацію.
- Що таке моносахариди? їх класифікація та номенклатура.
- Якими факторами зумовлена ізомерія моносахаридів? Моносахариди D- і L-рядів.
- Таутомерія моносахаридів. Піранозні тафуранозні форми; α- і ß-аномери. Мутаротація моносахаридів.
- Схарактеризуйте хімічні властивості моносахаридів в оксоформі - реакції окиснення та відновлення.
- Хімічні властивості моносахаридів у циклічній формі - утворення глікозидів, етерів, естерів та їх гідроліз.
- Схарактеризуйте будову та властивості окремих представників моноз.
8. Які з наведених функціональних груп входять до складу глюкози ?
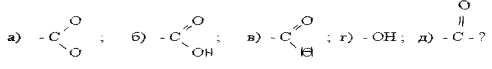
9. Які з наведених вуглеводів належать до моносахаридів ;
а) крохмаль; 6) рибоза; в) глюкоза, г) фруктоза?
Який з вказаних моносахаридів є стереоізомером глюкози ?
VIII. ДОМАШНЄ ЗАВДАННЯ :
1. Вивчити тему: «Дисахариди»
2. Ознайомитися з методичними рекомендаціями для студентів до лабораторно заняття № 8
Рекомендована література:
Музиченко В.П., Луцевич Д.Д., Яворська Л.П. Медична хімія / За ред. Б.С. Зіменковського. — К.: Медицина, 2010. , с.442-444.
Лабораторне заняття № 8
І.ТЕМА: ДИСАХАРИДИ
Актуальність. Складні вуглеводи являються важливими біологічно-активними сполуками. Вони класифікуються на олігосахариди і полісахариди (гомо- і гетерополісахариди). Біологічна активність складних вуглеводів сприяє використанню їх в фармацевтичній практиці. Наприклад, дисахарид лактоза використовується в якості наповнювача при виготовленні порошків та пігулок, а також як харчування для немовлят, сахароза – для виготовлення сиропів, мікстур. Інтерпретування будови та хімічних властивостей важливе при контролі якості вуглеводів, які використовуються як лікарські засоби.
ІІ. МЕТА :
Знати :
- Визначення, класифікацію дисахаридів;
- Види ізомерії дисахаридів;
- Фізичні властивості дисахаридів;
- Хімічні властивості дисахаридів;
- Якісні реакції дисахаридів;
- Медико-біологічне значення вуглеводів.
Вміти :
- На основі знання будови дисахаридів, пояснювати їх реакційну здатність;
ПРАКТИЧНІ НАВИЧКИ:
- пояснювати роль олігосахаридів у біологічних системах на основі знання будови і властивостей ;
- володіти препаративними методиками ідентифікації деяких олігосахаридів;
- дотримуватися правил техніки безпеки та охорони праці під час роботи з концентрованою хлоридною кислотою, лугами, газонагрівними приладами.
ІІІ. КОНТРОЛЬ БАЗОВИХ ЗНАНЬ З ТЕМИ :
- Як класифікують вуглеводи?
- Які сполуки називають дисахаридами?
- Як класифікують дисахариди?
- Які види ізомерії властиві дисахаридам?
- Олігосахариди, їх класифікація, Дисахариди – найпростіші представники олігосахаридів.
- Класифікація дисахаридів за здатністю до окисно-відновних реакцій.
- Два типи зв'язків між залишками моносахаридів та їх вплив на реакційну здатність дисахаридів.
- Відновлюючі дисахариди (мальтоза, целобіоза, лактоза); їх склад і конформаційна будова.
- Невідновлюючі дисахариди, їх будова.
IV. ОБЛАДНАННЯ : таблиці, схеми, роздатковий матеріал, штатив з пробірками, скляні палички, піпетки, хімічна склянка або колба, азбестова сітка, пальник.
РЕАКТИВИ : сахароза, лактоза; натрій гідроксид, хлорид на кислота; Купрум (ІІ) сульфат; резорцин .
V. ХІД САМОСТІЙНОЇ РОБОТИ СТУДЕНТІВ
РОБОТА № 1. СТРУКТУРА ВІДНОВНИХ (МАЛЬТОЗИ, ЛАКТОЗИ, ЦЕЛОБІОЗИ) І НЕВІДНОВНИХ (САХАРОЗИ) ДИСАХАРИДІВ
Завдання 1. Напишіть схеми утворення:
а) мальтози, б) лактози, в) целобіози, г) сахарози
з відповідних моносахаридів.
|
|
|
|
|
|
|
|
Завдання 2. Напишіть схему цикло – оксотаутомерії для мальтози. Чи властивий такий вид ізомерії для сахарози? Відповідь обґрунтуйте, виходячи з будови дисахаридів.
|
|
РОБОТА № 2. ДОСЛІДЖЕННЯ ВЛАСТИВОСТЕЙ ДИСАХАРИДІВ
Дослід 1. Взаємодія сахарози з розчином Фелінга (відсутність відновлюючої здатності у сахарози)
Виконання досліду. У пробірку помістіть 1 краплю 1 %-ного розчину сахарози, 4 краплі 10 %-ного розчину натрію гідроксиду і 1 краплю 2 %-ного розчину міді (II) сульфату. Яскраво-блакитний осад міді (II) гідроксиду, що виділився, розчиняється при наступному взбовтуванні пробірки. Утворюється прозорий синій розчин комплексної солі Купруму (II) з сахарозою. Вміст пробірки нагрійте. Ніяких видимих змін в пробірці не відбуватимуться, оскільки сахароза не має відновлюючої здатності.
Запитання і завдання:
1. Що спостерігаєте?
2. Запишіть рівняння реакцій.
3.Зробіть висновок.
|
Рівняння реакції |
Спостереження |
Висновки |
|
|
|
|
Дослід 2. Кислотний гідроліз сахарози
Виконання досліду. У пробірку помістіть 2 краплі 1%-вого розчину сахарози, 2 краплі 2 Н розчину хлороводневої кислоти, 6 крапель дистильованої води. Пробірку встановіть у киплячу водяну баню і нагрівайте упродовж 15-20 хв. до повного гідролізу сахарози. Після цього гідролізований розчин порівну розлийте у дві пробірки.
У першу пробірку з гідролізованою сахарозою додайте 4-5 крапель лугу (до лужної реакції на лакмус), 3-4 краплі води і 1-2 краплі 0,2Н розчину сульфату міді. Полум’ям пальника нагрівайте верхню частину синього розчину до появи оранжевого забарвлення, що свідчить про утворення глюкози.
До другої пробірки з гідролізованою сахарозою додайте кілька кристалів резорцину, 2 краплі концентрованої хлороводневої кислоти і нагрівайте до появи червоного забарвлення, що свідчить про утворення фруктози.
Запитання і завдання:
1.Що спостерігаєте?
2. Запишіть рівняння реакцій.
3.Зробіть висновок.
|
Рівняння реакції |
Спостереження |
Висновки |
|
|
|
|
|
|
|
|
|
|
|
|
Дослід 3. Відновні властивості лактози
Виконання досліду. У пробірку помістіть 2 краплі 1%-вого розчину лактози, 6 крапель 2Н розчину лугу, 1-2 краплі 0,2 Н розчину сульфату міді (II). Яскраво-блакитний осад міді (II) гідроксиду, що виділився, розчиняється при встряхуванні пробірки. Утворюється прозорий синій розчин комплексної солі міді (II) з лактозою. Потім в пробірку підлийте 2 мл води, збовтайте і обережно нагрівайте верхню частину розчину. Спостерігайте утворення осаду, забарвлення якого змінюється від жовтого до червоно-коричневого.


VI. ВИСНОВКИ ПРО ПРОВЕДЕНУ РОБОТУ
___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
VII. ПИТАННЯ ДЛЯ САМОКОНТРОЛЮ :
1. Що таке відновні і невідновні дисахариди? Наведіть приклади. Як будуть реагувати такі дисахариди з йодистим метилом, метанолом в присутності HCl. Наведіть схеми відповідних реакцій.
2. Напишіть схеми реакцій гідролізу сахарози, мальтози, лактози. Дайте повну назву цим дисахаридам.
3. Наведіть таутомерні перетворення лактози. Напишіть схему таких реакцій:
лактоза ![]() ?
? ![]() ?
? ![]() ?
? ![]() ?
?
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
сахароза ![]() ?
? ![]() ?
? ![]() С6Н12О3
С6Н12О3
_____________________________________________________________________________________________________________________________________________________________________________________________
4. Чи можна пробою Троммера відрізнити: 1) сахарозу від продуктів її гідролізу; 2) лактозу від продуктів її гідролізу; 3) лактозу від сахарози? Напишіть відповідні рівняння реакцій.
_________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
5. Які властивості зближують дисахариди з моносахаридами?
6. Чому мальтоза відновлює розчин Фелінга та аміачний розчин оксиду срібла (I), а сахароза-ні?
7. Яка причина розчинення гідроксиду міді (II) в розчині сахарози?
8. Які продукти утворюються при гідролізі мальтози й галактози?
VIII. ДОМАШНЄ ЗАВДАННЯ :
1. Вивчити тему: «Полісахариди»
2. Ознайомитися з методичними рекомендаціями для студентів до лабораторного заняття № 9
Рекомендована література:
Музиченко В.П., Луцевич Д.Д., Яворська Л.П. Медична хімія / За ред. Б.С. Зіменковського. — К.: Медицина, 2010. , с.445-447.
Лабораторне заняття № 9
І.ТЕМА: ПОЛІСАХАРИДИ
Актуальність. Складні вуглеводи являються важливими біологічно-активними сполуками. Вони класифікуються на олігосахариди і полісахариди (гомо- і гетерополісахариди).
Вони забезпечують життєдіяльність всіх живих організмів, виконують різноманітні функції. Оліго- та полісахариди регулюють клітинний осмотичний тиск, входять до складу кісткової тканини, міжклітинної речовини сполучної тканини, шкіри, запобігають зсіданню крові ( гепарин) тощо. Встановлено участь глікопротеїдів у багатьох захворюваннях, зокрема вони впливають на вибір місця метастазування ракових клітин.
Біологічна активність складних вуглеводів сприяє використанню їх в фармацевтичній практиці. Гомополісахарид крохмаль, котрий є основним джерелом вуглеводів у харчовому раціоні людини, в фармації використовується для виготовлення присипок і паст. Велике значення мають гетерополісахариди , які забезпечують міцність та пружність органів, еластичність їх сполук. Хондроітинсульфати входять до складу шкіри, хрящів, гіалуронова кислота - скловидного тіла ока. Вони являються основою багатьох лікарських препаратів ( хондропротекторів, антикоагулянтів та ін.). Інтерпретування будови та хімічних властивостей важливе при контролі якості вуглеводів, які використовуються як лікарські засоби.
ІІ. МЕТА :
Знати :
- Визначення, класифікацію полісахаридів;
- Фізичні властивості полісахаридів;
- Хімічні властивості полісахаридів;
- Якісні реакції полісахаридів;
- Медико-біологічне значення вуглеводів.
Вміти :
- Вміти інтерпретувати будову та хімічні властивості складних вуглеводів для подальшого вивчення їх біологічних та фармацевтичних функцій.
- Классифікувати за будовою ди- та полісахаридів.
- Складати назви дисахаридів.
- Складати рівняння реакцій що підтверджують хімічні властивості складних вуглеводів.
- Проводити та інтерпретувати реакції ідентифікації.
ПРАКТИЧНІ НАВИЧКИ:
- пояснювати роль полісахаридів у біологічних системах на основі знання будови і властивостей ;
- володіти препаративними методиками ідентифікації деяких полісахаридів;
- дотримуватися правил техніки безпеки та охорони праці під час роботи з кислотами, лугами, газонагрівними приладами.
ІІІ. КОНТРОЛЬ БАЗОВИХ ЗНАНЬ З ТЕМИ :
- Як класифікують вуглеводи?
- Які сполуки називають полісахаридами?
- Будова і класифікація полісахаридів.
- Крохмаль, як представник гомополісахариджів, його будова і гідроліз, біологічна роль та застосування.
- Фракції крохмалю - амілоза та амілопектин, схема їх будови.
- Якісна реакція на крохмаль.
- Медико-біологічне і фармацевтичне значення полісахаридів та їх функціональних похідних.
IV. ОБЛАДНАННЯ : таблиці, схеми, роздатковий матеріал, штатив з пробірками, скляні палички, піпетки, хімічна склянка або колба, азбестова сітка, пальник.
РЕАКТИВИ : крохмальний клейстер, спиртовий розчин йоду, натрій гідроксид, сульфатна кислота; Купрум (ІІ) сульфат.
V. ХІД САМОСТІЙНОЇ РОБОТИ СТУДЕНТІВ:
РОБОТА № 1. ДОСЛІДЖЕННЯ СТРУКТУРИ ТА ВЛАСТИВОСТЕЙ КРОХМАЛЮ
|
Завдання 1. Напишіть схеми будови фракцій крохмалю - амілози та амілопектину. |
|
Дослід 1. Якісна реакція на крохмаль
Виконання досліду. До 5-6 крапель крохмального клейстеру додайте краплю спиртового розчину йоду.
Запитання і завдання:
Що спостерігаєте? Зробіть висновок.
_____________________________________________________________
Дослід 2. Кислотний гідроліз крохмалю
Виконання досліду. Налийте у склянку 6 мл крохмального клейстеру, 1мл розчину сульфатної кислоти і нагрівайте на слабкому полум'ї, поставивши склянку на азбестову сітку. Нагрівайте обережно, щоб не відбулося обвуглювання. Поступово мутний розчин крохмалю стає прозорим. Щоб визначити, чи відбувся гідроліз крохмалю, візьміть пробу через 3-4 хвилини. Для цього піпеткою відберіть 3-5 крапель розчину (гідролізату) у пробірку, вистудіть і додайте краплю розчину йоду. Якщо одержали розчин жовтого кольору, гідроліз крохмалю закінчений; при відсутності такого забарвлення, продовжуйте нагрівати і знов візьміть пробу через 2-3 хвилини.
Склянку зніміть з азбестової сітки і проведіть дослід, який підтверджує, що в гідролізаті міститься розчин глюкози. Для цього піпеткою відберіть 2-3 краплі гідролізату у пробірку, додайте краплю розчину солі купруму і декілька крапель розчину натрій гідроксиду до появи синього забарвлення розчину. Розчин дещо нагріти.
Завдання і запитання :
- Напишіть схему гідролізу крохмалю.
- Які продукти утворюються при гідролізі крохмалю ?
|
Рівняння реакції |
Спостереження |
Висновки |
|
|
|
|
Дослід 3. Ферментативний гідроліз крохмалю
Виконання досліду. Під дією травного ферменту амілази (птіаліну) відбувається гідроліз крохмалю. Внесіть у пробірку 5 крапель крохмального клейстеру і такий же об'єм власної слини. Суміш ретельно перемішайте. Через 2-3 хвилини візьміть піпеткою краплю розчину, помістіть її на предметне скельце і додайте краплю розчину йоду. Відсутність синього забарвлення вказує на те, що крохмаль перетравлений слиною .
Завдання і запитання : 1. Порівняйте умови кислотного і ферментативного гідролізу крохмалю. Зробіть висновок.
____________________________________________________________________________________________________________________
VI. ВИСНОВКИ ПРО ПРОВЕДЕНУ РОБОТУ
___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
VII. ПИТАННЯ ДЛЯ САМОКОНТРОЛЮ :
- Вкажіть, чим відрізняється будова крохмалю від будови клітковини?
- При гідролізі якого полісахариду утворюється мальтоза, як проміжний продукт?
- Чому вищі полісахариди (поліози) можна розглядати як поліглюкозиди?
- Що спільне в будові крохмалю, глікогену, декстрину, клітковини?
- Яке застосування в медицині знаходять полісахариди?
Тести
- Які вуглеводи належать до полісахаридів:
- Глюкоза, фруктоза.
- Сахароза, мальтоза.
- Крохмаль, целюлоза.
- Крохмаль, целобіоза.
-
Будову макромолекули виражають:
- (-C6H10O5-)n.
- C12H22O11.
- C6H12O6.
- C6H10O5.
-
Макромолекули крохмалю складаються:
- Глюкоза з відкритим ланцюгом.
- Залишки α-глюкози.
- Залишки β-глюкози.
- Залишки фруктози.
-
Молекули крохмалю мають структуру:
- Тільки лінійну.
- Тільки розгалужену.
- Лінійну і розгалужену.
- Строго впорядковану.
-
Який моносахарид є кінцевим продуктом гідролізу крохмалю:
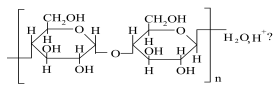
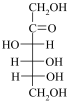
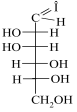
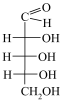
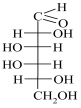
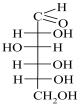
А. Галактоза В. Фруктоза С. Маноза D. Рибоза Е. Глюкоза
6. Глікоген в тваринних організмах являється структурним і функціональним аналогом рослинного крохмалю. Зазначте які продукті утворюються при гідролізі глікогену:
А. α, D - глюкопираноза
В. β, D - глюкопираноза
С. α, D – галактопираноза
D. β, D - галактопираноза
E. α, D - фруктофуранозу
7. Важливе практичне значення мають похідні целюлози. Назвіть продукт повного нітрування целюлози:
А. Динітрат
В. Нітрат
С. Тринітрат
D.Тетранітрат
E.Пентанітрат
VIII. ДОМАШНЄ ЗАВДАННЯ :
1. Підготуватись до модульного контролю з розділу «Біоорганічна хімія»
Рекомендована література:
Музиченко В.П., Луцевич Д.Д., Яворська Л.П. Медична хімія / За ред. Б.С. Зіменковського. — К.: Медицина, 2010. , с.339-447.
ЛАБОРАТОРНЕ ЗАНЯТТЯ № 10
Тема: МОДУЛЬНИЙ КОНТРОЛЬ
Зміст модуля:
Розділ І. Біоорганічна хімія як наука. Класифікація, будова та реакційна здатність біоорганічних сполук
Предмет і значення біоорганічної хімії.
Види науково обґрунтованих класифікацій та номенклатури біоорганічних сполук, що враховують будову карбонового ланцюга та наявність у молекулі функціональних груп. Префікси, суфікси та закінчення, які застосовують у назвах біоорганічних сполук, що мають функціональні групи, за міжнародною номенклатурою IUPAC.
Ізомерія органічних сполук.
Загальна характеристика хімічних реакцій біоорганічних сполук. Класифікація реакцій за механізмом. Характеристика нуклеофілів та електрофілів.
Розділ ІІ. Реакційна здатність вуглеводнів та їхніх похідних
Будова та ізомерія алканів. Реакції радикального заміщення біля насиченого атома Карбону (SR).
Будова та ізомерія алкенів, алкадієнів. Реакції електрофільного приєднання у ненасичених вуглеводнях (AЕ).
Будова аренів. Реакції електрофільного заміщення в ароматичних сполуках (SE). Вплив замісників на реакційну здатність аренів.
Медико-біологічне значення вуглеводнів.
Розділ ІІІ. Біологічно важливі карбонільні сполуки. Карбонові кислоти.
Якісні реакції на виявлення альдегідної групи (Толленса та Троммера). Реакція диспропорціонування (дисмутації, Канніццаро). Галоформні реакції. Йодоформна проба, її використання в аналітичних цілях.
Дослідження хімічних властивостей карбонових кислот (кислотні, реакції нуклеофільного заміщення).
Аміноспирти. Біологічно важливі сполуки (коламін, холін, норадреналін, адреналін).
Гідрокси- та амінокислоти, особливості будови. Дослідження хімічних властивостей. Медико-біологічне значення.
Оксокислоти. Біологічно важливі сполуки. Кетонові тіла.
Будова протеїногенних амінокислот і дослідження їхніх хімічних властивостей.
Амінокислотний склад пептидів. Структурна організація білків.
Якісні реакції на протеїногенні амінокислоти та білки.
Дотримання правил техніки безпеки під час роботи з формаліном, карбоновими кислотами, концентрованими нітратною, сульфатною кислотами та лугами, газонагрівними приладами.
Розділ ІV. Вуглеводи (цукри)
Класифікація вуглеводів.
Моносахариди. Таутомерні форми моносахаридів. Мутаротація. Хімічні властивості. Утворення глікозидів, їхня роль у побудові оліго- та полісахаридів. Окремі представники моносахаридів.
Дисахариди. Два типи зв’язків між залишками моносахаридів та їхній вплив на реакційну здатність дисахаридів: відновні та невідновні дисахариди.
Полісахариди. Будова, біологічна роль та застосування крохмалю. Схема будови амілози та амілопектину.
Рекомендована література:
Музиченко В.П., Луцевич Д.Д., Яворська Л.П. Медична хімія / За ред. Б.С. Зіменковського. — К.: Медицина, 2010. , с. 339-447
Примітка: На модульний контроль виноситься база тестових завдань у трьох варіантах та практичні завдання для кожного студента.
Перелік практичних навичок
- Складати формули органічних сполук за замісниковою номенклатурою IUPAC.
- Моделювати просторову будову молекул органічних сполук.
- Прогнозувати і пояснювати механізми реакцій, характерних для різних типів вуглеводнів.
- Визначати експериментально ненасиченість органічних сполук.
- Пояснювати і передбачати напрям біологічно важливих реакцій альдегідів і кетонів на основі електронної будови карбонільної групи та її впливу на сусідні атоми
- Володіти методами ідентифікації альдегідів і кетонів (ацетон), що мають велике значення в клінічних дослідженнях.
- Моделювати будову і прогнозувати реакційну здатність карбонових кислот.
- Визначати експериментально наявність карбоксильної групи в молекулах органічних сполук.
- Прогнозувати хімічну поведінку гетерофункціональних сполук у реакціях, що лежать в основі біохімічних перетворень у живих організмах.
- Мати уявлення про будову найважливіших метаболітів і лікарських препаратів, що належать до групи гетерофункціональних аліфатичних сполук.
- Пояснювати реакційну здатність моносахаридів на основі знання їх будови.
- Володіти препаративними методами ідентифікації моносахаридів.
- Пояснювати роль оліго- та полісахаридів у біологічних системах на основі знання їх будови і властивостей.
- Володіти препаративними методами ідентифікації деяких оліго- та полісахаридів.
Перелік пИТАНЬ До ДИФЕРЕНЦІЙОВАНОГО ЗАЛІКУ
- Класифікаційні ознаки органічних сполук: будова карбонового скелета і природа функціональної групи.
- Структурна ізомерія.
- Просторова ізомерія.
- Алкани, їх будова, номенклатура та медико-біологічне значення.
- Галогенування алканів як приклад реакцій радикального заміщення.
- Будова алкенів, алкадієнів. Реакції електрофільного приєднання.
- Будова аренів, номенклатура, медико-біологічне значення.
- Реакції електрофільного заміщення в ароматичних сполуках.
- Орієнтувальна дія замісників у бензеновому ядрі.
- Одноатомні спирти, їх будова, номенклатура та властивості.
- Багатоатомні спирти, їх будова та властивості.
- Альдегіди і кетони, їх номенклатура та хімічні властивості.
- Класифікація карбонових кислот.
- Монокарбонові кислоти, їх номенклатура та хімічні властивості.
- Представники дикарбонових та ароматичних кислот.
- Вищі жирні кислоти як представники нейтральних ліпідів.
- Прості омилювані ліпіди, їх будова.
- Складні омилювані ліпіди (фосфоліпіди), їх будова.
- Аміноспирти та похідні аміноспиртів, їх будова та медико-біологічне значення.
- Гідроксикислоти, їх будова, номенклатура та медико-біологічне значення.
- Специфічні властивості гідроксикислот.
- Амінокислоти, їх будова, номенклатура та медико-біологічне значення.
- Специфічні властивості амінокислот.
- Оксокислоти, їх будова, номенклатура та властивості.
- Кетонові тіла, схема утворення їх в організмі.
- Класифікація вуглеводів.
- Стереохімічні (D-, L-) ряди моносахаридів. Проекційні формули Фішера.
- Циклічні напівацеталі моносахаридів (піранози). Формули Хеуорса.
- Циклічні напівацеталі моносахаридів (фуранози). Формули Хеуорса.
- Реакційна здатність моносахаридів.
- Дисахариди — найпростіші представники олігосахаридів, їх відновна здатність (мальтоза, целобіоза, лактоза).
- Невідновні дисахариди (сахароза).
- Крохмаль як представник гомополісахаридів, його будова і гідроліз.
- Амінокислотний склад пептидів і білків.
- Структурна організація білків.
- Якісні реакції на α-амінокислоти.
СПИСОК РЕКОМЕНДОВАНОЇ ЛІТЕРАТУРИ
Основна
Губський Ю.І. Біоорганічна хімія. — Вінниця: Нова Книга, 2005. — 464 с.: іл.
Мороз А.С., Луцевич Д.Д., Яворська Л.П. Медична хімія. — Вінниця: Нова Книга, 2006. — 776 с.
Музиченко В.П. Медична хімія: підручник / В.П. Музиченко, Д.Д. Луцевич, Л.П. Яворська; за ред. акад. АН ВШ України Б.С. Зіменковського. — К.: ВСВ “Медицина”, 2010. — 496 с.
Додаткова
Галяс В.Л., Колотницький А.Г. Фізична і колоїдна хімія. — Львів, 2003. — 453 с.
Стрельцов О.А., Мельничук Д.О., Снітинський В.В. Фізична і колоїдна хімія. — Львів: Ліга-Прес, 2003. — 443 с.
Черних В.П. та ін. Органічна хімія: У 3 кн. / В.П. Черних, Б.С. Зименковський, І.С. Гриценко. — Кн. 1. Основи будови органічних сполук: підручник для фарм. вузів і факультетів. — Х.: Вид-во “Основа” при Харк. ун-ті, 1993. — 167 с.: іл.
Черних В.П. та ін. Органічна хімія: У 3 кн. / В.П. Черних, Б.С. Зименковський, І.С. Гриценко. Кн. 2. — Вуглеводні та їх функціональні похідні: підручник для студ. фарм. вузів і фак. — Х.: Основа, 1996. — 480 с.
Черних В.П. та ін. Органічна хімія: У 3 кн. / В.П. Черних, Б.С. Зименковський, І.С. Гриценко: підручник для вищ. фармацевтичних закладів освіти. — Кн. 3. Гетероциклічні та природні сполуки. — Х.: Основа, 1997. — 256 с.
1


про публікацію авторської розробки
Додати розробку