Формування комунікативних компетенцій на уроках хімії методами інтерактивного навчання
Відділ освіти Підволочиської районної
державної адміністрації
Районний методичний кабінет
«Формування комунікативних компетенцій на уроках хімії методами інтерактивного навчання»
з досвіду роботи
вчителя хімії
Остап’ївської
ЗОШ І-ІІІ ступенів
Максимів
Мирослави Михайлівни
Підволочиськ 2015
Відділ освіти Підволочиської районної
державної адміністрації
Районний методичний кабінет
«Формування комунікативних компетенцій на уроках хімії методами інтерактивного навчання»
з досвіду роботи
вчителя хімії
Остап’ївської ЗОШ І-ІІІ ступенів
Максимів Мирослави Михайлівни
Автор: Максимів М.М. вчитель хімії Остап’ївської ЗОШ І-ІІІ ступенів
Рецензент: Козачук Л.М. методист райметодкабінету Підволочиської райдержадміністрації.
Брошура містить короткий опис досвіду роботи вчителя хімії Максимів Мирослави Михайлівни,розробки уроків, позакласних заходів та методичні матеріали з проблеми «Формування комунікативних компетенцій на уроках хімії методами інтерактивного навчання».
Адресується вчителям хімії та учням школи.
Затверджено до друку постановою науково-методичної ради районного методичного кабінету відділу освіти Підволочиської райдержадміністрації.
Зміст
- ПЕРЕДМОВА 6.
- Формування комунікативної компетенції на уроках хімії методами інтерактивного навчання 7.
- Інтерактивні вправи на уроках та позакласних заходах з хімії 16.
- Урок у 8 класі «Поширення солей в природі та їх практичне значення» 28.
- Урок у 10 класі «Узагальнення й систематизація знань про природні джерела вуглеводнів» 44.
- Виховний захід з хімії „Хімія – наука чарівниця”
(вечір з хімії для 6-7 класів) 50.
- Пізнавальна гра «Чи знаєш ти мікро- імікроелементи
організму людини?» 54
- Зразки варіантів перевірки і контролю знань для
учнів 7 класу 62
- Література 71.
ПЕРЕДМОВА
Сучасна шкільна освіта в Україні спрямована на надання учневі необхідних знань, вироблення вмінь і навичок. За період навчання він має засвоїти багато фактичного матеріалу. Натомість школа сьогодні недостатньо навчає школярів приймати рішення, використовувати інформаційні та комунікаційні технології, критично мислити, вирішувати конфлікти, орієнтуватись на ринку праці тощо. Зміст освіти сьогодні недостатньо відповідає потребам суспільства та ринку праці, не спрямований на набуття необхідних життєвих компетентностей. Ті зміни, що відбувались в освіті за останні 10 років, поглибили переобтяження навчальних програм і підручників фактичним матеріалом. Це стосується і предмету хімії. Великий обсяг матеріалу в підручнику розсіює увагу, заважає виділити основне, відбиває бажання вчитися. Ми використовуємо зошити для лабораторних і практичних робіт з друкованою основою, які з одного боку економлять час на уроці, а з іншого обмежують здатність формулювати власну думку, нав’язують стандартне мислення. Застаріле мультимедійне обладнання і недостатня його кількість в школі не дає можливості іти в ногу з часом.
Звичайно ж виправити глобальний крен в освіті у будь-який бік мені, як вчителю середньої школи, не під силу, та розбудити в кожній дитині творчий початок, навчити працювати самостійно, допомогти зрозуміти та знайти себе, зробити перші кроки у творчості – до цього я прагну, наскільки дозволяють мені власні сили й можливості.
Формування комунікативної компетенції на уроках хімії методами інтерактивного навчання
Одним зі шляхів оновлення змісту освіти й узгодження його із сучасними потребами, інтеграцією до європейського та світового просторів є орієнтація на формування компетентностей та створення ефективних механізмів їх упровадження. Серед ключових компетентностей важливими є комунікативні. Широкі можливості для їх формування має вчитель у процесі викладання хімії в загальноосвітній школі. Проблема, над якою працюю: «Формування комунікативної компетенції на уроках хімії методами інтерактивного навчання»
Сучасна шкільна освіта в Україні спрямована на засвоєння й оволодівання учнями необхідними знаннями, вміннями та навичками. За період навчання в школі учні повинні засвоїти значну кількість фактичного матеріалу.
Як відзначено в Концепції загальної середньої освіти, «освіта ХХІ століття – це освіта для людини. Її стержень - розвивальна, культурологічна домінанта, виховання відповідальної особистості, яка здатна до самоосвіти й саморозвитку, вміє використовувати набуті знання й уміння для творчого розв’язання проблем, критично мислити , опрацьовувати різноманітну інформацію, прагне змінити на краще своє життя і життя своєї країни».
Тому навчальний процес має бути спрямований не на механічне засвоєння учнем суми знань, а на засвоєння знань з творчим підходом, умінням самостійно одержувати потрібну інформацію й передавати її оточуючим.
Тому компетентність ґрунтується на знаннях, здібностях, цінностях, досвіді, отриманих у процесі навчання. Однією з компетентностей, що формується в учнів на сучасному етапі навчання, є комунікативна компетентність.
Комунікативна компетентність передбачає:
- залучення школярів до активної мовної діяльності;
- мистецтво спілкування в процесі свідомого освоєння основ наук, у повсякденному вдосконаленні своєї зовнішньої та внутрішньої культури;
- прагнення грамотно спілкуватися, тобто легко і швидко встановлювати контакти з людьми.
Нова програма цілком змінила роль учителя й учня на уроці. Вона передбачає співпрацю і співтворчість учителя й учня. Учитель тепер виступає не в ролі того, хто надає учневі інформацію та інструкції, а як повноцінний учасник комунікативного процесу , партнер в співбесіді, помічник в оволодінні методами комунікації.
Учень при цьому:
- може висловлювати свою думку;
- уміє аргументовано обстоювати свою думку;
- може написати реферат, доповідь, тези з різних тем;
- уміє ставити запитання вчителям і учням;
- відповідає на запитання вчителя й учнів;
- визнає свої помилки, уникає категоричності, дотримується культури дискусії.
Учитель:
- використовує дискусії;
- навчає правильно ставити запитання і відповідати на них;
- стежить за культурою мови учнів;
- пропонує різноманітні письмові роботи у формі листів товаришам, віршів, звітів, творів тощо;
- створює проблемні ситуації.
На своїх уроках я залучаю учнів до співпраці, використовуючи системи «учень-учень», «учень-вчитель», «учитель-учень-наука».
Співпраця на уроці-це:
- використання комунікативних форм роботи учнів;
- залучення учнів до асистування на уроці;
- взаємне рецензування відповідей на уроках.
- спільна підготовка вчителя й учня до уроку;
- уникнення вчителем виставлення учням поганих оцінок.
Яким же чином я сприяю формуванню комунікативної компетентності в учнів на уроках хімії?
Наприклад, на початку уроку на етапі його мотивації, в організаційному моменті комунікативний метод має характер реального спілкування між учителем та учнем як комунікативними партнерами, під час якого може здійснюватися обмін новою, цікавою інформацією, досвідом розв’язання різноманітних проблем. Це створює емоційне піднесення, сприяє залученню всіх учнів до спілкування, як через розмову, так і через активне слухання, стимулює особистісно орієнтовану комунікацію.
![]() Атмосфера уроку, завдання, що рекомендуються, обрані режими й форми роботи мають стимулювати учнів до розширення мовного кругозору, накопичення комунікативного досвіду. Учень тепер може висловлювати свою думку під час уроку, визначати проблеми для обговорення або творчого розуміння завдання, пропонувати питання для рольових і ділових ігор, має можливість вибирати завдання дослідного матеріалу. За цих умов учень певною мірою відповідає за свої успіхи й невдачі. У цьому полягає співтворчість між учителем і учнями. Такий метод не залишає учнів байдужними, є двигуном до активізації мовно-розумової діяльності, сприяє встановленню атмосфери довіри й співпраці на уроці. За такого методу використовується принцип інтерактивності.
Атмосфера уроку, завдання, що рекомендуються, обрані режими й форми роботи мають стимулювати учнів до розширення мовного кругозору, накопичення комунікативного досвіду. Учень тепер може висловлювати свою думку під час уроку, визначати проблеми для обговорення або творчого розуміння завдання, пропонувати питання для рольових і ділових ігор, має можливість вибирати завдання дослідного матеріалу. За цих умов учень певною мірою відповідає за свої успіхи й невдачі. У цьому полягає співтворчість між учителем і учнями. Такий метод не залишає учнів байдужними, є двигуном до активізації мовно-розумової діяльності, сприяє встановленню атмосфери довіри й співпраці на уроці. За такого методу використовується принцип інтерактивності.
Інтерактивність— це вміння передавати й одержувати інформацію, що є цікавою для обох сторін. Однак вона передбачає не лише висловлювання власних думок і міркувань, але й сприйняття й розуміння думок інших людей. Учні вчаться слухати інших, обмінюватися знаннями. Учасники дискусії, диспуту, розмови створюють власні інтерпретації знання фактів, визначень, понять, законів. Це вміння формується під час інсценувань, розв'язань загальних завдань, створення проблемних ситуацій, постановки питань, виконання логічних завдань. За інтерактивного спілкування учні можуть використати свої мовні здатності — усе, що вони вивчили в класі або одержали в ході процесу обміну на уроці. Тобто інтерактивний характер спілкування передбачає активне використання всіх компонентів уроку, ситуаційне спілкування, постійну новизну елементів навчального процесу, сумірність навчальних і комунікативних дій, спрямованих на встановлення й підтримку відносин між учнем і вчителем через обмін особистісно значущою інформацією, і співробітництво в парах, групах, командах.
Для того щоб інтерактивність у процесі навчання була повною, і вчителеві, і учням необхідно поважати унікальність думки інших, стимулювати відповіді кожного.
Тільки-но учні починають відчувати, що їх поважають і цінують, вони починають активно демонструвати свої здібності, висловлювати свої пропозиції, брати участь у різноманітних формах і видах діяльності, стимулюючи свою творчість і творчість учителя. Учитель, у свою чергу, повинен приймати всі види учнівських ідей і бути поблажливим до помилок учнів.
Таке загальне навчання передбачає поділ відповідальності за навчання між усіма учасниками навчального процесу.
Які ж види завдань, вправ формують комунікативну компетентність учнів? Існує кілька класифікацій вправ і завдань, що базуються на певних категоріях.
Так, за кількістю учасників виокремлюють індивідуальні, парні та групові завдання, за формою виконання — усні й письмові, за ступенем комунікативності — некомунікативні, умовно-комунікативні, комунікативні.
Р. Елліс бере за основу характер операцій, які учні здійснюють з навчальним матеріалом. За його алгоритмом наведу приклади з власного досвіду:
І. Мозковий штурм.
II. Класифікація матеріалу за певним принципом:
• Що об'єднує речовини, формули яких NaОН, Са(ОН)2, КОН,Mg(OH)2?
• У чому полягають відмінності міжзапропонованими речовинами:НNO3, НС1, Н2S, Н2S04, НІ?
III. Співвідношення або розпізнавання певного матеріалу на базіаналізу й порівняння.
• Установіть відповідність:
|
Формули речовини |
Клас речовини |
|
MgCl2 |
Кислота |
|
MgO |
Основа |
|
HCl |
Сіль |
|
Mg(OH)2 |
Оксид |
Порівняйте властивості металів натрій і калій. Що спільного? Що відмінного у властивостях?
- Фенолфталеїн змінив у розчині речовини забарвлення на малинове. Яку речовину аналізували?
IV. Розв'язання логічних задач, ребусів, відгадування загадок, відповіді на запитання вікторини.
- Як з допомогою одного реактиву розпізнати гліцерин і оцтовий альдегід?
- Вікторина «Подорож Періодичною системою хімічних елементів Д. І. Менделєєва».
V. Розв'язання певних питань з допомогою хімічних диктантів, анкетування, тестових завдань.
• Хімічні диктанти за темами, наприклад:
- «Знаки хімічних елементів».
- «Складання хімічних формул за валентністю».
- «Типи хімічного зв'язку».
• Тестові завдання за темами з використанням збірників тестових завдань з хімії для 8—9 і 10—11 класів.
Завдання можна поділити на три великі групи:
І. Мозковий штурм.
1. Проблемні завдання на встановлення зв'язків між окремими поняттями, речовинами, окремими елементами.
- Що спільного між оцтовою кислотою й оцтовим альдегідом у будові молекули?
- Як з кальцій карбіду одержати оцтову кислоту?
- Що спільного між усіма класами вуглеводнів?
2. Завдання на інтерпретацію, пояснення.
• За малюнком визначте правильність методу збирання амоніаку.
![]() II. Вправи на організацію та реорганізацію матеріалу.
II. Вправи на організацію та реорганізацію матеріалу.
1. Порівняння, класифікація.
• Що зайве в переліку: ручка, олівець, стілець, целюлоза?
2. Звертання уваги на відмінності.
• У чому полягає різниця між етиловим спиртом і етиленгліколем?
3. Об'єднання.
• Чого більше в переліку — гомологів чи ізомерів?
III. Завдання складного характеру,що поєднують різні види діяльності.
- Проведення дискусії, диспутів.
- Проведення опитування, анкетування.
- Дослідження, практичні, демонстраційні роботи.
Сьогодні в учителя з'являється нова освітня позиція: йдеться про розвиток ключових компетентностей учня, про компетентнісний підхід, що дає можливість вийти за межі конкретних знань, умінь і навичок.
У процесі навчання хімії реалізуються різні форми й методи, однак недостатньо використовується така перспективна форма, як ігрова, що дозволяє ефективно підвищувати якість підготовки учнів. Це і є основною проблемою, над якою я працюю.
Основним моментом, на який слід звертати увагу під час створення й використання навчальних ігор, є привертання уваги учнів до змісту гри, а отже, і до навчального матеріалу. Гра привчає учня мислити, виокремлювати головне, узагальнювати, розвиває його пам'ять, здібності. Для виконання цих навчально-виховних завдань під час навчання хімії з успіхом можуть бути використані тематичні ігри.
Залежно від загального напряму й типу дидактичних ігор з їх допомогою можна формувати не лише окремі знання, але і взаємозв'язки між елементами знань, навчати учнів порівнювати й диференціювати хімічні речовини й процеси. Засвоєння знань під час гри часто не вимагає довільної уваги, що дозволяє уникнути перевтоми учнів. Дидактичні ігри з хімії можна класифікувати за різними ознаками. їх можна поділити на індивідуальні, парні, групові. Залежно від застосовуваних засобів і загальної спрямованості ігор їх можна поділити на такі типи: ігри-вправи, настільні ігри, ігри-ролі та ігри-моделювання. Наведу деякі хімічні ігри, застосовувані мною на уроках.
I . Ігри - вправи
Гра «Хрестики - нулики». Застосовую цю гру під час вивчення й узагальнення навчального матеріалу з хімії, систематизації знань. Наприклад, під час вивчення теми «Речовина, тіло, матеріал» учні з інтересом самостійно складають різні виграшні комбінації цієї гри. Такі завдання даю учням і в процесі пояснення, і в процесі закріплення теми.
А під час вивчення теми «Основні класи неорганічних сполук» елементи цієї гри ускладнюються. Учні повинні враховувати також хімічні властивості основних класів неорганічних сполук та їх класифікацію.
Складання й розв'язання кросвордів на різну хімічну тематику з інтересом сприймається учнями. Вони із задоволенням розгадують їх і складають самі.
Гра «Віриш — не віриш». Учні ставлять одне одному заздалегідь підготовлені запитання. І самі ж повинні правильно відповісти.
Наприклад:
- Чи вірите ви, що кисень і водень— прості речовини? (Так, тому що й кисень і водень складаються з атомів одного хімічного елемента)
- Чи вірите ви, що молекули — це дрібні, хімічні неподільні частинки? (Ні, тому що молекули складаються з атомів)
II. Ігри-ролі
Наприклад, гра «Учитель — учень».
«Учитель», який виконує свою роль, ставить питання учневі. У цій грі оцінюється вміння учнів ставити питання і правильно на них відповідати. Крім цього, учні самостійно оцінюють свої знання, причому досить об'єктивно. Прикладом групової гри служить «Веселий КВК». У ньому зазвичай беруть участь від восьми до десяти учнів. Інші учні-вболівальники є суддями. От приблизний перелік конкурсів для проведення цієї гри:
- Придумати хімічну назву команди.
- Розминка.
- Конкурс капітанів «Ти мені — я тобі».
Конкурс «Що б це значило?»
Це гумористичний конкурс для всієї команди. Потрібно мімікою зобразити якесь хімічне явище або визначення. А друга команда повинна упізнати, про що йдеться.
5)Розгадування хімічних головоломок і т. ін.
Варіанти завдань можуть бути різними. Всі завдання, ігри, форми їх проведення залежать від класу й рівня підготовки учнів. Наприклад, у старших класах проводжу гру «Хто хоче стати мільйонером?», «Слабкаланка». Причому учні самостійно виявляють ініціативу, удома складають запитання із зазначеної теми, пропонують форму проведення тієї чи іншої гри.
Справді, бажання грати, прагнення до діяльності, що грунтується на здатностях уяви, властиві будь-якому учневі. Це потрібно враховувати в процесі навчання.
Момент змагання викликає підвищений інтерес до досліджуваних питань, а результати гри є своєрідним внутрішнім зворотним зв'язком. Моє завдання й полягає в тому, щоб зацікавити учнів наукою хімією, прищепити навички творчої та самостійної роботи. А ефективність уроку хімії цілком залежить від розмаїтості форм роботи, містячи в собі елементи дидактичної гри й цікавості. Успішному проведенню уроку сприяють позитивні емоції та інтерес, створюваний ігровими ситуаціями й духом колективного змагання. Отже, хімічні ігри є дієвим засобом розвитку інтересу до предмета.
Компетентний фахівець, компетентна людина — це дуже гарна перспектива.
Отже, компетентність пов'язана із загальною здатністю людини оперувати в певній ситуації набутими знаннями і практичним досвідом.
Тому сьогодні перед сучасною педагогічною наукою постала проблема, як підвищити інтерес учнів до процесу навчання. Одна з причин утрати інтересу — це непридатність низки традиційно застосовуваних прийомів навчання до сучасного контингенту учнів, адже в нашої молоді значно розвинене почуття самосвідомості та власної гідності, вона багато про що має уявлення, тому заняття, що базуються на авторитарному тиску, наказах, указівках тощо, викликають лише роздратування й нудьгу — вони неприйнятні.
Це й спонукало вчителів, і мене в тому числі, шукати нові методи й засоби навчання, що сприяють розвитку інтересу до предмета, втілюють у собі ідеї високої взаємної вимогливості й поваги, спираються на зрослу самостійність, творчу діяльність учнів і, зрештою, значно розширюють і збагачують методичний арсенал учителя, оскільки відомо, що сталість — ворог інтересу.
Тому реформа системи освіти в Україні має глобальне значення для підготовки компетентних фахівців, здатних змінити своє життя й життя своєї країни на краще.
ІНТЕРАКТИВНІ ВПРАВИ
НА УРОКАХ ТА ПОЗАКЛАСНИХ ЗАХОДАХ З ХІМІЇ
Особливості сучасного етапу розвитку освіти в Україні потребують упровадження нових форм та методів навчання і виховання, що забезпечують розвиток особистості учня. Розв'язанню цієї проблеми сприяє впровадження інтерактивних технологій навчання на уроках хімії. Саме такі технології ефективніше, ніж інші педагогічні технології, сприяють інтелектуальному, соціальному й духовному розвитку учня. Пригадаємо слова О. Герцена: «Нове потрібно створювати в поті чола свого, а старе саме продовжує існувати і твердо триматися на милицях звички».
Традиційні форми та методи навчання і виховання дійсно продовжують існувати, але треба дивитися далі. Інтерактивне навчання — це певний різновид активного навчання, це спеціальна форма організації пізнавальної діяльності, мета якої — створити комфортні умови навчання, за яких кожен учень відчув би свою інтелектуальну спроможність пізнавати нове.
Готуючись до уроків, я завжди ретельно продумую кожний етап уроку, підбираю відповідний до теми матеріал, наочність, цікаві форми роботи. Для уроку вибираю такі інтерактивні вправи, які б дали учневі «ключ» до освоєння теми. Пропоную вашій увазі саме такі різноманітні вправи, які можуть бути корисними для підготовки до уроків та позакласних заходів учителів хімії.
Вправа 1 «Незакінчене речення»
Під час вивчення глюкози учні закінчують речення.
- Глюкоза являє собою...
- Глюкоза поширюється в природі...
- Глюкоза має хімічні властивості, характерні для...
- У молекулі глюкози міститься альдегідна група, тому для глюкози характерна...
- Глюкоза реагує з купрум(ІІ) гідроксидом, утворюючи комплексну сполуку, забарвлену в...
- Глюкоза належить до....
- Широко застосовують глюкозу в...
Вправа 2 «Мікрофон»
Вправа подібна до попередньої, але проводиться з допомогою уявного мікрофона. Учні висловлюють свою думку, відповідають на запитання, тримаючи в руках уявний мікрофон.
- Що таке валентність?
- Що таке атом?
- Що таке проста речовина?
- Назвати елементи, що мають змінну валентність.
- Чому дорівнює валентність Гідрогену?
- Як кількісно визначається валентність?
Вправа 3 «Коректор»
У вправі навмисно зроблено помилки, які учні мають знайти й виправити.
- Крохмаль —це суміш трьох речовин.
- Крохмаль — це білий аморфний порошок, добре розчинний у холодній воді.
- Якщо до охолодженого крохмального клейстеру додати розчин іоду, то з'являється жовте забарвлення.
- (С6НІ0О5) — структурна формула крохмалю.
- Крохмаль — це природний полімер, що складається з багаторазово повторюваних структурних ланок С6НІ206.
Вправа 4 «Третій зайвий»
а) СН4, С2Н4, С2Н6.
б) СН3ОН, С2Н5ОН, С2Н6.
в) С3Н6, С5Н10,С5НІ2.
Вправа 5 «Ланцюжок»
Учні ланцюжком виходять до дошки, розв'язуючи різноманітні завдання. Наприклад, вивчаючи валентність, учні визначають валентність у сполуках, написаних на дошці вчителем:
NH3, Mg3N2, N2O5, PCl5, P2O5, CaO, CO2, SO2,
Na2O, CrCl3, ZnCl2.
Вправа 6 «Хімічна естафета»
На дошці вчитель пише два ланцюги перетворень, об'єднує учнів у дві команди, які змагаються між собою за звання найкращого. Учні, як і в попередній вправі, змінюючи один одного, виходять до дошки розв'язувати ланцюг перетворень. їм необхідно здійснити перетворення, вказати умови перебігу процесів і назвати речовини:
- S → SO2 → SO3 → К2SO4 →ВаSO4
- А1 → А12O3→ А1С13→А1(OН)3→А12(SO4)3
Вправа 7 «Хрестики-нулики»
Під час вивчення теми «Основні класи неорганічних сполук» учням пропоную таку вправу: визначити виграшні варіанти, вказати оксиди, які мають амфотерні властивості:
|
ZnO |
MgO |
ВеО |
|
К2O |
А12 O3 |
СаО |
|
SO2 |
Li2O |
Сr203 |
Такі завдання легко вигадують і самі учні
Вправа 8 «Вірю — не вірю» або «Так — ні»
1) Чи вірите ви, що кисень і водень — прості речовини? (Так,тому що кисень і водень складаються з атомів одного хімічного елемента)
2) Чи вірите ви. що молекули — це дрібні, хімічно неподільні частинки? (Ні, тому що молекули складаються з атомів)
- Чи вірите ви, що окиснення альдегідів амоніаковим розчином оксиду Аргентуму називається реакцією «срібного дзеркала»? (Так)
- Чи вірите ви, то рідина з різким запахом зеленого листя, яку отримують з ацетилену реакцією Кучерова,— це оцтовий альдегід? (Так)
- Чи вірите ви, що трьохатомний спирт — це етиленгліколь? (Ні,трьохатомний спирт — це гліцерин, молекула якого містить три гідроксильні групи —ОН)
Вправа 9 «Розірвана шпаргалка»
Учител ь. Ця вправа проста, але дуже корисна. Вона допоможе вам не розгубитися на екзамені. Адже не секрет, що ви пишете шпаргалки, а вчитель, якщо знайде їх, розриває. І якщо у вас є якісь знання, ви навіть з розірваної шпаргалки можете скласти правильну відповідь.
Вправа 10 «Цікаві задачі»
Задачі кота Хімікуса
Вас відправляють у космос. Необхідно взяти із собою речовину, яка була б у космосі джерелом теплоти, води та кисню. Що ж ви візьмете із собою? (Гідроген пероксид)
Вправа 11 «Хімія +»
У вправі використовують зв'язок хімії з іншими науками: географією. Я пропоную вправу, яка ілюструє зв'язок хімії з літературою.
«Хімія + література»
- У романі «Війна світів» Г. Веллс розповідає про війну, розв'язану космічними прибульцями — марсіанами — на Землі. На руїнах своєї колишньої цивілізації земляни несподівано знаходять чорну речовину — смертельну отруту, яка виявилася хімічною сполукою Аргону. Якої неточності припустився письменник? (Аргон — інертний газ)
- Ж. Верн у своєму творі «Таємничий острів» писав: «Наливши кленовий сік у великі глиняні посудини, його поставили на вогонь і піддали випаровуванню. Тільки-но рідина почала густіти, починали розмішувати ЇЇ дерев'яною лопаткою... Сік клена перетворився на густий сироп. Цей сироп вилили в глиняні посудини різноманітної форми. На наступний день сироп застиг. Це був справжній... злегка жовтуватий, майже прозорий і дуже смачний». Про що йде мова? (Сахароза)
- Як пов'язані між собою видатний поет Олександр Блок та не менш видатний хімік Дмитро Менделєєв? (Блок був одружений з дочкою Дмитра Менделєєва Любов'ю і саме їй присвятив більшість своїх віршів про кохання)
Вправа 12 «Потайний сундучок»
У цій коробці знаходиться надзвичайна речовина. Колись ЇЇ вважали милістю божою, символом миру, наприклад, у східних країнах. Але, з іншого боку, скільки всього живого загубила ця речовина. Через неї навіть море може стати мертвим. Особисто я схиляю голову перед цією речовиною. Без неї неможливо обійтися в металургії, вона використовується у виготовленні кераміки. Без неї не було б шкіряного взуття. За цією речовиною їздили козаки до Криму. (Сіль)
Вправа 13 «Вставити слово»
І. Молекули перебувають у постійному безперервному .
2. Між ними існує взаємне___та відштовхування.
- Швидкість руху молекул залежить від стану речовини.
- Молекули, у свою чергу, складаються з , що, подібнодо молекул, перебувають у безперервному та характеризуються певними розмірами, масою та властивостями.
- Властивості атомів одного й того самого елемента й відрізняються від властивостей атомів інших хімічних елементів.
- Молекули простих речовин складаються з атомів, а молекули складних речовин складаються з атомів.
- Під час фізичних явищ молекули залишаються, тобто зберігаються, а під час хімічних , з ними відбуваються якісні та кількісні зміни.
Вправа 14 «Ти — мені, я — тобі»
Учні ставлять один одному запитання, які приготували заздалегідь.
- Який метал найтвердіший? (Хром)
- Який метал найважчий? (Осмій)
- Скільки легенд і традицій береже його історія! Із нього можна витягти павутину завдовжки 2,4 км. а зі шматочка розміром із сірникову головку одержати лист площею 50 м2. Через нього знищено плем'я інків. Про який метал ідеться? (Золото)
- Який метал найдорожчий? (Каліфорній — 10 доларів США за 0,001 мг)
- Який метал найбільш тугоплавкий?
(Ванадій, / = 3420 °С)
Вправа 15 «Хто швидше й більше»
Протягом декількох хвилин кожна група учнів повинна відповісти на максимальну кількість запитань. Якщо група дає неправильну відповідь або відповіді зовсім немає, то відповісти можуть учні другої групи й отримати додаткові бали.
- Єдиний рідкий метал. (Ртуть)
- Найпоширеніший метал на Землі. (Залізо)
- Які метали мають магнітні властивості? (Залізо, нікель, кобальт)Дуже поширений елемент-метал, який входить до складу коштовного каміння. (Алюміній)
- Елемент, який надає листю зеленого кольору. [Магній)
- Який метал хворіє на чуму? (Олово)
7. Метал, що прокатаний у тонкий листок. (Фольга)
- Метал батарейок. (Цинк)
- Які елементи потрібні для зберігання зубної емалі? (Кальцій, Флуор)
- Метал, який вбиває нечисту силу. (Срібло)
11.Метал, що робить скло кришталем. (Свинець)
12.Який метал називають рідким сріблом? (Ртуть)
13.Що таке сусальне золото? (Сплав олова й сірки)
14.Елемент, що надає крові червоного забарвлення. (Ферум)
15.Крилатий метал. (Алюміній)
Вправа 16 «Знайди сполуку»
На окремих аркушах записано десять хімічних рівнянь. Учням кожної групи необхідно розставити коефіцієнти в поданих схемах хімічних реакцій (у роботі повинен брати участь кожен член групи), знайти суму всіх коефіцієнтів , яка дорівнює порядковому номеру елемента в періодичній системі Д. І. Менделєєва, та визначити цей елемент.
Са + N2=Са3N2
А1 + N2 = АlN
(NН4)2SO4 + ВаСІ2 = NН4С1 + ВаSO4
Сu+ НNО3 = Сu(NO3)2 + Н2O+ NO
NO2 + Н2О+O2 = НNO3
NO + O2 = NO2
Р + Са = Са3Р2
Р + S = Р2S3
Вправа 17 «Чи знаєте ви, що...»
Учні по колу продовжують речення, які підготували заздалегідь.
І. Чи знаєте ви, що звична для нас наука хімія має свій конкретний рік народження — 1661? Саме того року ірландський хімік Роберт Бойль (1627—1691) у книзі «Хімік-скептик» сміливо й переконливо, як для того часу, сформулював предмет хімії. За його визначенням, хімія — це дослідження складу різних речовин та пошук нових хімічних елементів.
- Чи знаєте ви, що доведено, що за двісті років до нашої ери в Олександрії Єгипетській уже існувала Академія наук, де «священному мистецтву хімії» було відведено особливий будинок? А на теренах сучасної України хімія почала розвиватися завдяки таким галузям, як металургія, кераміка, скловаріння, фармація і парфумерія, а також розвитку ринку барвників, техніки фарбування, використання біохімічних процесів, тобто ферментативного бродіння для одержання сиру, кефіру, вина, тіста, пива тощо.
- Чи знаєте ви, що першими професійними хіміками як у світі, так і в Україні були аптекарі-провізори та фармацевти? Саме вони проводили хімічні процеси, метою яких було приготування ліків. Перша аптека на території сучасної України була відкрита у Львові 1270 року при храмі Іоана Хрестителя та проіснувала до 1480 року.
- Чи знаєте ви, що середня тривалість життя приблизно чотирьохсот найбільш відомих хіміків світу перевищує 73 роки? Більше того, серед хіміків напрочуд багато довгожителів. Наприклад, майже 103 роки прожив засновник хімії жирів, автор цілої низки синтетичних барвників, французький хімік Мішель Шеврель (1786-1889). 31 серпня 1886 року він відзначав свій сотий день народження. З цієї нагоди відбулося урочисте засідання Французької академії наук, на якому йому вручили сто троянд — білих, жовтих, червоних, помаранчевих... Тим самим було відзначено заслуги Шевреля в галузі створення барвників. Стіни залу, де відбувалося вшанування ювіляра, було задрапіровано тканинами, пофарбованими в соковиті та яскраві кольори за його методиками.
Вправа 18 «Показуха»
Учні повинні без слів показати якесь явище, дійство, а решта має вгадати.
Цю вправу можна назвати «Пантоміма».
Вправа 19 «Знайди пару»
Пропонуються два стовпчики або рядки слів або формул, що стосуються теми, яка вивчається. Учні повинні встановити між ними зв'язки, знайшовши пари.
Оксиди СаО
Кислоти Са(ОН)2
Основи СаСO3
Солі Н2СO3
Вправа 20 «Вгадай мене»
На столі вчителя лежить декілька карток. На дошці пишеться слово (поняття). Учні повинні з купи карток вибрати ті, що пов'язані з написаним на дошці. Потім учитель пише на дошці інше слово, викликає наступних учнів, які виконують такс ж завдання.
Вправа 21 «Квітка»
Учитель малює на дошці квітку (середину й декілька пелюсток). У серединці записує основне поняття. На пелюстках квітки вчитель буде писати прояви характеристики цього поняття, запропоновані учнями. Наприклад, у серединці — значення води в народному господарстві, а на пелюстках — застосування води. Квітку можна замінювати будь-якою фігурою, сходинками тощо.
Вправа 22 «Цікаві квадрати»
Перед вами квадрати. Заповніть порожні квадрати формулами речовин, які в результаті взаємодії дадуть сіль. Напишіть рівняння відповідних реакцій.

Вправа 23 «Асоціації»
Учитель називає учням основне поняття або явища. Учні пропонують інформацію, що асоціюється з цим основним поняттям
Вправа 24 «Перевір себе»
Закінчити рівняння хімічних реакцій:
МgO + СO2 →
НF + SiO2→
СаО + SO2→
Na2СО3+SiO2→
Наприкінці виконання цього завдання вчитель пропонує правильні відповіді, учні перевіряють самих себе.
Вправа 25 «Графічний диктант»
Якщо твердження правильне щодо С02, учні ставлять знак «л» (так), а якщо ні — знак «_» (ні).
- Валентність Карбону — II.
- Ступінь окиснення — +4.
- Отруйний.
- Зв'язується з гемоглобіном крові.
- Відновлює метали з оксидів.
- Кислотний оксид.
- Використовується як сухий лід.
- Одержують із карбонатів.
- Легший за повітря.
- Реагує з активними металами.
- Несолетворний.
_л_ _ллл_л_
Вправа 26 «Хімічні розваги»
Учитель пропонує учням головоломку, ребуси тощо.

![]()
![]()

Вправа 27 «Хімічні загадки»
- На воді мокне, у воді сохне. (Віск)
- Горить стовпчик, а вугілля немає. (Свічка)
- У воді росте, у воді кохається, у воду впаде — води злякається. (Сіль)
- Я вода і на воді плаваю. (Крига)
- Вбиваємо його молотом, а воно сміється золотом. (Залізо)
Вправа 28 «Мозаїка»
Учні за бажанням об'єднуються в групи по чотири-п'ять осіб і працюють над отриманими завданнями — складання з окремих слів речення, що стосується насичених вуглеводнів.
Зразок
Речення: «Метан — найпростіший представник алканів».
Фрагмент завдання до слова «метан»:
- назва радикалу СН3- (1-ша буква) — метил;
- назва речовини С2Н6 (1-ша буква) — етан;
- назва речовини С8НІ8 (3-тя буква) — октан;
- загальна назва насичених вуглеводнів (1-ша буква) — алкани;
- усі зв'язки в молекулах алканів... (4-та буква) — одинарні.
Вправа 29«Пасьянс»
Учням роздаються заздалегідь виготовлені картки, з яких необхідно скласти формули кислот, основ, солей, оксидів
Вправа 30 «Кросворд»
Складання й розв'язання кросвордів на різну хімічну тематику з інтересом сприймається учнями. Вони із задоволенням розгадують їх і складають самі. Наприклад, якщо вписати
відповідні назви у вертикальні стовпці, у виділеному горизонтальному рядку утвориться назва найпоширенішого елемента на Землі.
- Проста речовина, утворена елементом Гідрогеном.
- Речовина, що прискорює хімічну реакцію, але сама при цьому не витрачається.
- Речовини, до складу яких входять два елементи, один з яких Оксиген.
- Реакції взаємодії речовин з киснем.
- Реакції окиснення з виділенням теплоти і світла.
- Промисловий спосіб одержання кисню з води.
- Продукт розпаду перманганату.
Тема: Поширення солей в природі та їх практичне значення.
Мета:навчальна:
- систематизувати знання учнів про хімічні властивості класів неорганічних сполук на прикладі хімічних властивостей солей;
- пояснювати причини різноманітності речовин,
- встановлювати залежність між складом, властивостями та застосуванням речовин.
- удосконалювати вміння та навички складати хімічні формули, писати рівняння хімічних реакцій;
- удосконалювати навички роботи в колективі й індивідуально; дати учням підґрунтя для само- та взаємооцінювання.
- розглянути галузі застосування солей з урахуванням їх хімічних властивостей;
розвиваюча:
- розвивати пізнавальні здібності, логічне мислення учнів,вміння висловлювати свої думки;
- розвивати пам’ять, увагу, спостережливість та логічне мислення;
- розвивати уміння аналізувати та використовувати набуті знання ужитті;
- формуватисамоосвітню, інформативну, соціальну й творчу компетентності;
- розвивати розумові та інтелектуальні здібності;
- розвивати навички самостійної роботи, самоаналізу своєї діяльності на уроці.
виховна:
- підвищувати пізнавальну активність учнів і мотивацію навчання
Базові поняття та терміни:
- Солі – кристалічні тверді речовини, які можна розглядати як продукти повного чи часткового заміщення йонів гідрогену кислоти металом або гідроксид-іонів основ (чи амфотерних гідроксидів) – кислотними залишками.
- Середні солі – продукти повного заміщення гідрогену кислоти на метал або металоподібну групу атомів.
- Кислі солі – це продукти неповного заміщення гідрогену багатоосновної кислоти металом.
- Основні солі – продукти неповного заміщення гідроксид-іонів основи чи амфотерного оксиду кислотними залишками.
Міжпредметні зв’язки:
географія,геологія,історія,біологія,українська мова та література.
Обладнання:
Періодична система хімічних елементів Д. І. Менделєєва, таблиця розчинності, електрохімічний ряд напруг металів;комп’ютер,географічна карта.
Тип уроку
Урок поглиблення й систематизації знань.
Методи і методичні прийоми:
індивідуальна робота, фронтальне опитування,повідомлення учнів, гра, групова робота.
Концепція уроку:
- розібратися у виявленні та узагальнити знання про фізичні властивості середніх солей, пояснити учням як вони поширюються у природи та яке практичне значення для людей вони мають.
ХІД УРОКУ
І. Організаційний етап.
Поетичне вітання.
Пролунав уже дзвінок,
Починається урок.
Сьогодні він у нас незвичайний
Тож повернімося обличчям до гостей
І лагідно скажемо: «Добрий день!»
Пошук емоційного контакту.
- Доброго дня. Доброго вам здоров’я.
Мобілізація уваги учнів.
- Любі діти! У наш клас завітали гості щирі. Привітаймо їх у добрий час
посмішкою і миром.
Ми вам раді, люди добрі,
І вітаєм щиро вас,
І запрошуєм ласкаво
На урок у восьмий клас.
Доброго здоров’я вам, люди.
Хай сьогодні радісно вам буде,
Хай мозок повниться знаннями
І цікаво буде з нами.
Психологічний настрій.
- Друзі! Подивіться у вікно. На дворі зима, найулюбленіша пора року більшості людей і, особливо, дітей . Цієї пори так не хочеться поспішати, метушитися, робити повсякденні справи. Тягне на вулицю, на свіже повітря.
В такі хвилини важливо, щоб святковий настрій завітав у серця тих, з ким ми спілкуємося. Тоді люди зрозуміють один одного: батьки – дітей, діти – батьків, вчителі – учнів, учні – вчителів…
Святковий настрій стане у пригоді кожному з нас і на нашому уроці.
Тепло, сонце, посмішка краще всього пасують людям і природі. Бажаю вам частіше всміхатися, радіти життю, і тоді все у нас буде добре. Сподіваюся, що ви всміхалися і коли виконували домашнєзавдання з хімії, тож на уроці отримаєте тільки хороші оцінки
ІІ. Перевіркадомашньогозавдання.
Картка-сигнал! (Перевіримодомашнєзавдання!)
- Що було задано додому?
- Чи всі виконали домашнє завдання?
- Які були труднощі під час його виконання?
ІІІ. Актуалізаціяопорнихзнань.
Фронтальне опитування
- Які класи неорганічних сполук вам відомі?
- Дайте визначення солям, кислотам, оксидам і основам.
- Згадаємо правила складання формул солей.
- Пригадати хімічні властивості солей.
Завдання на взаємоперевірку
- Завершити рівняння хімічних реакцій:
Мg + 2 НС1= Mg Cl2 + H2
NaOH+HCl=NaCl + H2O
K2CO3 + Ba Cl2 = Ba CO3 + 2 KCl
2NaOH + Mg SO4 = Mg(OH)2 + Na2SO4
- Здійснити перетворення:
Р → Р2O5→ Н3РO4→ Са3(РO4)2→ СаSO4.
- 4P + 5O2 = 2P2O5
- P2O5 +3 H2O =2 Н3РO4
- 2Н3РO4 +3Ca(OH)2 = Са3(РO4)2+6H2O
- Са3(РO4)2 +3H2SO4 = 3СаSO4 +2H3PO4
- Півострів «Солі»
«Знайдіть пару» — із запропонованих карток складіть формули солей і назвіть їх.
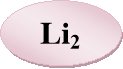



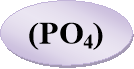
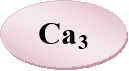
- Розшифруйте казку.
Запишіть зміст казки за допомогою формул і
рівняння хімічної реакції, назвіть тип реакції.
«Товаришували Хлоридна Кислота і Луг — Натрій Гідроксид. Одного разу Хлоридна Кислота запросила в гості товариша. Луг надягнув своє фенолфталеїнове вбрання і став увесь малиновий. День був сонячний. Кислота вирішила показати товаришеві свій красивий сад. Вийшли вони в сад, але що це? Усі квіти, кущі й дерева засохли, хочуть пити й просять допомоги.
- Давай допоможемо їм,— сказала Кислота й задумалася.— Але як?
- Я знаю, як їм допомогти! — вигукнув Луг.— Об'єднаймо мою гідроксогрупу та твій Гідроген.
- Із задоволенням,— погодилася Кислота.
Луг обійняв подругу. Зникли Кислота і Луг. Потекла вода по коренях рослин. Усе ожило навколо, зазеленіло, зацвіло. Усі подякували двом друзям».
- HCl, NaOH.
- NaOH+ фенолфталеїн = малиновий колір
- NaOH+ HCl = NaCl + H2O(реакція нейтралізації).
- «Павутинка» (додаткове завдання).
Необхідно з'єднати між собою назву солі й формулу.
Натрій карбонат NаСІ
Алюміній фосфат А1С13
Кальцій сульфат СаSO4
Натрій хлорид Nа2СO3
Алюміній хлорид А1РO4
Натрій нітрат NaNO3
ІІ. Мотивація навчальної діяльності.
Їх смак нам звичний і приємний.
В них білий колір, зрідка темний.
В природі завжди їх доволі.
Ну, як ви думаєте: що це?
Учитель. Чумацький шлях — це космічна система, яка складається із зірок, пилу й газів.
Чумацький шлях стали називати так з появою чумацької промисловості. Основну частину зірок Чумацького шляху видно восени. У цю пору він перетинає небо в напрямку із заходу на схід. Приблизно в цьому напрямку на території Запорізької й Херсонської областей тече річка Дніпро. Пересуваючись зі сходу на захід, щоби не заблукати, чумаки орієнтувалися вночі на цю світлу доріжку.
Питання до учнів
І.Мета, заради якої чумаки здійснювали настільки тривалий шлях.
- Про яку сіль йдеться? (Кам'яна, кухонна)
- Чому в давнину сіль мала ціну, більшу за золото?
- Перелічіть назви відомих вам кислот
ІІІ. Вивчення нового матеріалу
(оголошення теми та мети уроку)
Тема: Поширення солей в природі та їх практичне значення.
(учні записують в зошиті).
І на сьогоднішньому уроці ми поговоримо про солі ,їх розмаїтість , розглянемо галузі застосування солей з урахуванням їх хімічних властивостей; закріпимо вміння давати назви солям і складати формули солей за їх назвами;перевіримо наскільки ви вмієте працювати з науковою літературою і глянемо на результати вашої роботи в групах.
Отже, найпоширенішими солями є хлориди, сульфати, карбонати й нітрати.
Робота в мікрогрупах
У класі виділено чотири групи, які самостійно працювали над завданнями:
- перша група — «Нітрати»;
- друга група — «Карбонати»;
- третя група — «Сульфати»;
- четверта група — «Хлориди».
Завдання першої групи «Нітрати»
1. Скласти розповіді про застосування солей.
Нітрати є безбарвними кристалічними речовинами. Добре розчинні у воді. Нітрати лужних і лужноземельних металів називають селітрою. Серед нітратів найпоширенішими є натрій нітрат, арґентум нітрат, калій нітрат.
Натрій нітрат (NaNO3) називають натрієвою, або чилійською селітрою. Великі поклади натрій нітрату, знайдені в Чилі, очевидно, утворилися за рахунок біохімічного розкладання органічних решток. Натрій нітрат застосовують як добриво, окисник у вибухових речовинах, ракетному паливі, піротехнічних сполуках. Він застосовується у виробництві скла й солей Натрію, у тому числі нітриту, який є консервантом харчових продуктів. Натрій нітрат застосовують для готування ковбас, шинки, деяких сортів сиру й риби. Він відновлюється мікроорганізмами до натрій нітриту, який перешкоджає окисненню м'яса й сприяє збереженню рожевого кольору м'ясних виробів, поліпшує смак сирів, облагороджує їх запах.
Арґентум нітрат (АgNO3). Арґентум нітрат використовують для виготовлення дзеркал, а в медицині (ляпісний олівець) — для припікання ранок, як діюча речовина в гомеопатії. Уперше ляпіс застосували лікарі Ян Баптист ванГельмонт (1579-1644) і Франциск де ла Бої Сильвій (1614-1672), які навчилися одержувати арґентум нітрат взаємодією металу з нітратної кислотою. Вони виявили, що дотик до кристалів отриманою срібною сіллю призводить до появи на шкірі чорних плям, а в разі тривалого контакту — глибоких опіків. Пекельний камінь — це не чистий арґентум нітрат, а його сплав з калій нітратом, іноді відлитий у вигляді паличок — ляпісного олівця. Ляпіс чинить припікальну дію й застосовується здавна. Лікувальна дія арґентум нітрату полягає в пригніченні життєдіяльності мікроорганізмів; у невеликих концентраціях він діє як протизапальний і в'язкий засіб, а концентровані розчини, як і кристали АgNO3, припікають живі тканини.
Калій нітрат (КNO3) — калієва селітра. Безбарвний кристалічний порошок, без запаху. Калій нітрат — це дуже поширений компонент різних видів пороху. Чорний порох — сірий або чорно-сірий порошок, який являє собою суміш 75% калій нітрату, 15% вугілля й10 % сірки. Калій нітрат — азотне добриво, багате на Калій, необхідний для росту деяких рослин. У стародавності для одержання калій нітрату слугували селітряниці — купи із суміші гною з вапняком, будівельним сміттям і т. п. із прошарками із соломи або хмизу.
(Презентація «Солі нітратної кислоти)
- З допомогою кольорових прапорців позначити на географічній карті основні поклади солей. Рівне, Черкаси, Дніпродзержинськ.
- Дати назви речовинам:
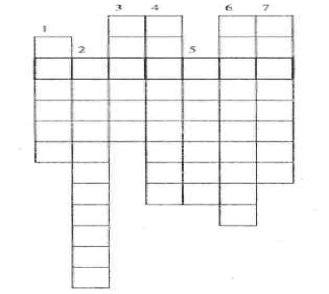
А1NO3, Са(NO3)2, КNO3, LiNO3.
Підсумок роботи: скласти схему «Застосування нітратів».
Завдання другої групи «Карбонати»
1. Проаналізувати текст. Скласти розповідь про застосування солей.
Серед карбонатів найпоширенішими є натрій карбонат, калій карбонат, кальцій карбонат.
Натрій карбонат (Nа2СO3) або сода. Входить до складу сумішей для виробництва скла, мийних засобів. Реагент для збільшення лужності середовища, поліпшення якості глин для глинистих бурових розчинів. Використовується для усунення твердості води під час її підготовки до застосування (наприклад, у казанах), для очищення природного газу від гідроген сульфіду. У хімічній промисловості харчову соду (бікарбонат) застосовують для виробництва барвників, пінопластів та інших органічних продуктів, фтористих реактивів, товарів побутової хімії, наповнювачів у вогнегасниках. У легкій промисловості — у виробництві підошовних гум і штучних шкір, шкіряному виробництві (дублення й нейтралізація шкір), текстильній промисловості (обробка шовкових і бавовняних тканин). У харчовій промисловості — хлібопеченні, виробництві кондитерських виробів, готуванні напоїв.
Калій карбонат (К2СO3). Калій карбонат, або калій вуглекислий застосовують у всіляких галузях промисловості. Найбільше поширення він одержав:
- у будівництві як добавка, що забезпечує захист від впливу морозів;
- хімічній промисловості у виробництві мийних речовин, а також реагентів різного призначення (наприклад, фотосправа);
- текстильній промисловості як компонент технологічного процесу фарбування;
- скляній промисловості в процесах виготовлення тугоплавкого й кришталевого скла;
- сільському господарстві як добриво.
Кальцій карбонат (СаСO3). У природі трапляється у складі вапняку, крейди, мармуру.
Є сировиною для виробництва негашеного вапна СаО, використовується в металургії. Застосовується в буравленні як обважнювач і наповнювач бурових розчинів. Очищений від сторонніх домішок, кальцій карбонат широко використовується в паперовій і харчовій промисловості, під час виробництва пластмас, фарб, гуми, продукції побутової хімії, у будівництві.
Виробники паперу використовують кальцій карбонат одночасно як відбілювач, наповнювач (заміняючи ним дорогі волокна й барвники), а також розкиснювач. Виробники скляного посуду, пляшок, скловолокна використовують кальцій карбонат у величезних кількостях як джерело Кальцію — одного з основних елементів, необхідних для виробництва скла. Виробники пластмаси — одні з основних споживачів кальцій карбонату (понад 50 % усього споживання). Використовуваний як наповнювач і барвник, кальцій карбонат необхідний для виробництва полівінілхлориду, поліефірних волокон (кримплен, лавсан і т. п.), поліолефінів. Вироби з цих видів пластмас можна знайти в себе вдома — це труби, сантехніка, кахельна плитка, черепиця, лінолеум, килимові покриття і т. п. Кальцій карбонат становить порядку 20% барвного пігменту, використовуваного під час виробництва фарб.
Будівництво — ще один з основних споживачів СаС03. Шпаклівки, різні герметики — усі вони містять його в значних кількостях. СаС03 є найважливішою складовою частиною виробництва продукції побутової хімії (засобів для чищення сантехніки, кремів для взуття), товарів особистої гігієни (наприклад, зубної пасти), а також харчової та медичної промисловості.
Кальцій карбонат також широко використовується в очисних системах, як засіб боротьби із забрудненням навколишнього середовища, з його допомогою відновлюють кислотно-лужний баланс ґрунту
(Презентація «Солі карбонатної кислоти)
- З допомогою кольорових прапорців позначити на географічній карті основні поклади солей. Крим, Карпати, Донбас, Львівська область.
- Дати назви речовинам:
А12(СО3)3, СаСО3, К2СО3, Lі2СO3.
Підсумок роботи: заповнити схему «Застосування карбонатів»
Завдання третьої групи «Сульфати»
1. Проаналізувати текст. Скласти розповідь про застосування солей.
Серед сульфатів найпоширенішими є кальцій сульфат, натрій сульфат, барій сульфат.
Кальцій сульфат (СаSO4). Кальцій сульфат у природі часто трапляється у складі мінералу гіпсу (СаSO4 ·2Н2O). За температури приблизно 150 °С переходить у так званий алебастр (2СаSO4 ·Н2O), який широко використовується в будівництві, входить до складу швидкотвердіючих в'язких засобів для ізоляції зон поглинань. У разі додавання до бурових розчинів у складі ангідриту (СаSO4) або гіпсу (СаSO4 2Н20) надає стійкості глинистим породам, які розбуравлюються. Алебастр також використовується для відливу різних художніх виробів. У медицині з алебастру роблять гіпсові пов'язки, використовувані в разі перелому кісток.
Натрій сульфат (Nа2SO4) трапляється в природі в безводному вигляді (тенардит) й у складі декагідрату (мірабіліт, глауберова сіль). Він входить до складу астрахоніту, вантгоффіт, глауберитуNа2Са(SO4)2. Найбільші запаси натрій сульфату — у країнах СНД, а також у , Чилі, Іспанії. Тривалий час його мало використовували. Тепер ця речовина — основа паперової промисловості, тому що Ка2SO4 є головним реагентом у сульфатному варінні целюлози для приготування коричневого обгорткового паперу й гофрованого картону. Деревні ошурки переробляють у гарячому лужному розчині натрій сульфату. Він розчиняє лігнін (компонент деревини, який з'єднує волокна) і звільняє волокна целюлози, які потім відправляють на машини для виготовлення паперу. Розчин, який залишився, випарюють, поки він не набуде здатності горіти, даючи пару для заводу й тепло для випарювання. Розплавлені сульфат і гідроксид Натрію стійкі до дії полум'я й можуть бути використані повторно. Менша частина натрій сульфату застосовується під час виробництва скла й мийних засобів. Nа2SO4 використовують у виробництві соди й скла. З водяних розчинів кристалізується десятиводний гідрат Ка2SO4 10Н2О, що має назву глауберова сіль. Глауберову сіль застосовують у медицині як проносне.
Барій сульфат (ВаSO4) — безбарвна речовина, яка не розчиняється у воді й кислотах. Його використовують у медицині під час рентгенівських досліджень шлунково-кишкового тракту, тому що йони Барію поглинають рентгенівське випромінювання. Також використовують як компонент для піротехнічної промисловості, оскільки йони Барію забарвлюють полум'я в зелений колір.
(Презентація «Солі карбонатної кислоти)
- З допомогою кольорових прапорців позначити на географічній карті основні поклади солей. Карпати, Разданське.
- Дати назви речовинам:
А12(SO4)3, СаSO4, К2SO4, Li2SO4.
Підсумок роботи: заповнити схему «Застосування сульфатів».
Завдання четвертої групи «Хлориди»
1. Проаналізувати текст. Скласти розповідь прозастосування солей.
Серед хлоридів найпоширенішими є натрій хлорид, калій хлорид, ферум(III) хлорид.
Натрій хлорид (NаСl). Про широту використання цієї солі свідчить той факт, що світовий видобуток цієї речовини становить 200 млн т. Цю сіль широко застосовують у харчовій промисловості, вона є сировиною для одержання хлору, хлоридної кислоти, натрій гідроксиду, соди (Nа2С03). ЇЇ використовують у нафтовій промисловості, наприклад, як добавку в бурові розчини для попередження утворення каверн під час буравлення свердловин, як регулятор термінів схоплювання цементних сполук, що тампонують, для зниження температури замерзання (антифриз) бурових і цементних розчинів. Розчини натрій хлориду широко використовують у медичній практиці як допоміжну речовину — для розчинення лікарських препаратів. NaСІ — необхідна приправа до їжі, використовується для консервування харчових продуктів.
Калій хлорид (КСl). Є поширеним калійним добривом.
Крім збільшення врожайності, калійні добрива підвищують якісні характеристики вирощуваної продукції: це проявляється в підвищенні опірності рослин до захворювань, підвищенні стійкості плодів під час зберігання й транспортування, а також поліпшенні їх смакових і естетичних якостей.
Феру(III) хлорид (FеС13). У поєднанні з лугом використовується для очищення води від гідроген сульфіду, під час буравлення свердловин водою, як добавка до цементів з метою підвищення їх стійкості до сірководню, для очищення води від зважених частинок, у хімічних лабораторіях (як реактив), текстильній промисловості (як просочення під час фарбування тканин).
(Презентація «Солі карбонатної кислоти)
- З допомогою кольорових прапорців позначити на географічній карті основні поклади солей. Крим, озеро Сиваш, Одеська область.
- Дати назви речовинам:
А1С13, СаС12, КС1, LіСl.
Підсумок роботи: заповнити схему «Застосування хлоридів»
IV. Систематизація знань.
Заповнення таблиці
|
Група солей |
Назва солі |
Формула солі |
Родовище |
Застосування |
|
|
|
|
|
|
Розв’язання задачі.
Задача. Відоме прислів'я говорить: «Людину впізнаєш, коли з'їш із нею пуд солі». Відомо, що добова потреба людини в натрій хлориді становить 0,215 моль. Скільки часу людям необхідно прожити разом, щоби довідатися один про одного? (Один пуд дорівнює 16,38 кг.) (1300 днів або 3,6 роки).
V. Домашнє зав дання.
- Опрацювати параграф
- Виконати завдання №
- Повторити : Розрахунки за хімічними рівняннями маси, об'єму, кількості речовини реагентів і продуктів реакції
- Придумати хімічні казки, ребуси, загадкипро основні класи неорганічних сполук, їх фізичні та хімічні властивості.
Узагальнення й систематизація знань про
природні джерела вуглеводнів (11 клас)
Мета:
- завершити формування знань про клас органічних сполук «Вуглеводні»;
- поглибити знання учнів про джерела вуглеводнів, способи переробки нафти, кам’яного вугілля та основні наукові принципи хімічного виробництва;
- розглянути питання охорони навколишнього середовища від забруднення під час переробки вуглеводневої сировини та використання продуктів її переробки, розглянути причини забруднення навколишнього середовища, встановити наслідки забруднення нафтою та нафтопродуктами;
- узагальнити й закріпити знання учнів за темою, підкреслити важливість екологічного аспекту в одержанні й застосуванні палива;
- розвивати вміння порівнювати, аналізувати, робити висновки;
- прищеплювати любов до природи та формувати переконання в необхідності компетентного екологічного захисту довкілля.
Тип уроку: узагальнення й систематизації знань.
Форми роботи: фронтальна, індивідуальна, групова.
Обладнання:
Хід уроку.
І. Актуалізація опорних знань
Фронтальне опитування:
- Назвати головні природні джерела вуглеводнів.(Найважливішими джерелами вуглеводнів є природні і попутні нафтові гази, нафта, кам'яне вугілля)
- Чим відрізняються супутні нафтові гази від природнього? ( Основним компонентом природного газу є метан. У ньому міститься також етан, пропан, бутан. Існує така закономірність: чим більша відносна молекулярна маса вуглеводню, тим менше його міститься в природному газі. Попутні нафтові гази знаходяться в природі над нафтою або розчинені в ній під тиском. В попутних газах міститься менше метану, ніж у природному газі, але в них значно більше його гомологів.)
- Що таке процес крекінгу нафти ? (Крекінгом називається процес розщеплення вуглеводнів, які містяться у нафті, в результаті чого утворюються вуглеводні з меншою кількістю атомів вуглецю в молекулі. Процес крекінгу відбувається з розривом вуглецевих ланцюгів і утворенням простіших насичених і ненасичених вуглеводнів. Термічний крекінг - розщеплення молекул вуглеводнів відбувається при порівняно високій температурі (470—550 °С). Процес відбувається повільно, утворюються вуглеводні з нерозгалуженим ланцюгом атомів вуглецю. Каталітичний крекінг-Розщеплення молекул вуглеводнів відбувається в присутності каталізаторів і при більш низькій температурі (450—500 °С). Порівняно з термічним крекінгом процес відбувається значно швидше; при цьому відбувається не тільки розщеплення молекул вуглеводнів, а й їх ізомеризація, тобто утворюються вуглеводні з розгалуженим ланцюгом атомів вуглецю.)
- Що таке процес процесу перегонки нафти ?(Продукти з нафти і їх застосування. Із нафти виділяють різноманітні продукти, які мають велике практичне значення. Спочатку з неї видаляють розчинені газоподібні вуглеводні (переважно метан). Після відгонки летких вуглеводнів нафту нагрівають. Першими переходять в пароподібний стан і відганяються вуглеводні з невеликою кількістю атомів вуглецю в молекулі, які мають відносно низьку температуру кипіння. З підвищенням температури суміші переганяються вуглеводні з більш високою температурою кипіння. Так можна зібрати окремі суміші (фракції) нафти.. Основні фракції нафти такі:
- газолінова фракція бензинів: газолін (від 40 до 70 °С), бензин (від 70 до 120 °С) — авіаційний, автомобільний
- Лігроїнова фракція, Лігроїн застосовується як пальне для тракторів.
- Гасова фракція Гас після очищення використовується як пальне для тракторів, реактивних літаків і ракет.
- У наступній фракції дістають газойль— дизельне пальне.
-
Залишок після перегонки нафти — мазут . Мазут також розділяють на фракції: солярові масла — дизельне пальне, мастила (автотракторне, авіаційне, індустріальне та ін.), вазелін (основа для косметичних засобів і ліків). парафін (для виробництва сірників, свічок та ін.). гудрон. застосовують у шляховому будівництві.)
- Що таке ароматизація нафти?( Піролізом називається розкладання органічних речовин без доступу повітря при високій температурі. піроліз нафти — один з найважливіших способів добування ароматичних вуглеводнів, то його часто називають ароматизацією нафти.)
- Охарактеризувати процес коксування кам’яного вугілля.(Одним із основних способів добування вуглеводнів (в тому числі й ароматичних) є коксування (піроліз) вугілля . Подібним методом на коксохімічному виробництві з кам'яного вугілля добувають ті самі чотири основних продукти кокс, кам'яновугільна смола, коксовий газ, аміак та ароматичні вуглеводні (бензол).
Робота в малих групах:
1 група: розглянути колекцію «Нафта. нафтопродукти». Назвати продукти переробки нафти одержані під час перегонки і крекінгу. Назвати галузі застосування бензину, лігроїну, гасу, газойлю та мазуту.
2 група: розглянути колекцію «Продукти коксування кам’яного вугілля». Назвати основні продукти, що отримують під час коксування кам’яного вугілля. Де використовують кокс, аміачну воду, кам’яновугільну смолу?
ІІ.Мотивація навчальної діяльності.
У долі природи – доля людини.
Ми з’ясували, що вуглеводнева сировина і продукти її переробки мають важливе значення у життєдіяльності людини, тому відмовитися від їх використання неможливо. Але, разом з тим, при їх добування та використанні відбувається значне забруднення навколишнього середовища. Тому на сьогоднішньому уроці ми з’ясуємо, причини та наслідки забруднення, та заходи, які зможуть його зменшити.
ІІІ. Узагальнення й систематизація знань
Повідомлення учнів.
-
Охорона навколишнього середовища від забруднень при переробці кам'яного вугілля та природнього газу та використання продуктів його переробки( Слайд1)
- Кам’яне вугілля, як і нафта, не індивідуальна речовина. До його складу входять вільний вуглець (до 10%), органічні речовини, що містять Карбон, Гідроген, Оксиген, Сульфур, Нітроген, мінеральні речовини (вони залишаються у вигляді шлаку після спалювання вугілля). ( Слайд2)
- Унаслідок нагрівання до 10000 ° С без доступу повітря вугілля перетворюється на кокс. Цей продукт на 96-98 % складається з вуглецю. Основна галузь його застосування – металургія( Слайд3)
- Продукти переробки кам’яного вугілля ( Слайд4)
- Застосування( Слайд5)
- Природний газ - суміш газів, що утворилася в надрах землі при анаеробному розкладанні органічних речовин.
- Природний газ відноситься до корисних копалини. Природний газ в умовах пластів знаходиться в газоподібному стані - у вигляді окремих скупчень або у вигляді газової шапки нафтогазових родовищ, або в розчиненому поляганні в нафті чи воді. За нормальних умов природний газ знаходиться лише в газоподібному стані.( Слайд 6)
- Природний газ знаходиться в землі на глибині від 1000 метрів до декількох кілометрів. Найглибшою свердловиною недалеко від міста Новий Уренгой отриманий приплив газу з глибини більше 6000 метрів. У надрах газ знаходиться в мікроскопічних порожнечах (порах). Пори сполучені між собою мікроскопічними каналами – тріщинами.
- Газ добувають з надр землі за допомогою свердловин. Свердловини прагнуть розмістити рівномірно по всій території родовища. Це робиться для рівномірного падіння тиску пласта в покладі. Інакше можливі перетікання газу між областями родовища, а також передчасне обводнення покладу.
- Газ виходить з надр унаслідок того, що в пласті знаходиться під тиском, що багато разів перевищує атмосферне. Таким чином, рушійною силою є різниця тисків в пласті і системі збору.( Слайд 7)
- У екологічному відношенні природний газ є найчистішим виглядом мінерального палива. При згоранні його утворюється значно менша кількість шкідливих речовин в порівнянні з іншими видами палива. Проте спалювання людством величезної кількості різних видів палива, у тому числі природного газу, за останні півстоліття привело до деякого незначного збільшення вмісту вуглекислого газу в атмосфері, який є парниковим газом. Деякі учені на цій підставі роблять вивід про небезпеку виникнення парникового ефекту і як наслідок - різкого потепління клімату. ( Слайд ( Слайд3)8)
- Ще не так давно ми раділи новим здобуткам індустріалізації. Густий чорний дим над заводськими трубами або повалені бульдозером дерева під новий будівельний майданчик сприймалися як символи технічного прогресу, а перші хімічні та металургійні промислові гіганти викликали ейфорію. Прозріння наступило в останні 25-30 років. І тепер фабричний дим – це вже забруднювач атмосфери, шкідливі токсичні викиди продукції хімічної промисловості становлять глобальні проблему, яка потребує негайного вирішення. ( Слайд 9)
- З метою охорони навколишнього середовища здійснюються такі заходи:
- Створення заповідних територій;
- Регламентація використання природних ресурсів;
- Захист природного середовища (водоохоронні заходи, рекультивація земель, регулювання поверхневого стоку, скорочення об’єму стічних вод і їх очищення);
- Незалежна екологічна експертиза проектів і оцінка впливу господарської діяльності на оточуюче середовище;
- Моніторинг стану природного середовища (від регіонального до глобального моніторингу біосфери).( Слайд 10)
- Охорона навколишнього середовища від забруднень під час переробки вуглеводневої сировини та використанні її продуктів переробки
( Слайд 1)
- Життя людини повсякденно пов’язане зі спалюванням горючих речовин у побуті, на транспорті, у промисловості.Крім користі застосування нафтопродуктів, вугілля і природного газу створює ряд проблем, негативних для розвитку цивілізації та загалом для виживання людства. ( Слайд 2)
- Ще не так давно ми раділи новим здобуткам індустріалізації.
- Прозріння наступило в останні 25-30 років. І тепер фабричний дим - це вже забруднювач атмосфери, шкідливі токсичні викиди продукції хімічної промисловості становлять глобальну проблему, яка потребує негайного вирішення. ( Слайд 3)
- Поглинання і випромінювання енергії діоксидом карбону та іншими речовинами спричинює парниковий ефект. Отже, можна сказати, що ми живемо в умовах парникового ефекту, і це відповідає нормальному стану атмосфери, комфорту для нас. Проте посилення цього ефекту може мати згубні наслідки, а саме – глобальне підвищення температури й у зв’язку з цим – зміну клімату. ( Слайд 4)
- Протягом останніх 100 років у результаті техногенної діяльності людини вміст вуглекислого газу в атмосфері невпинно зростає. Крім парникового ефекту в результаті переробки і використання горючих корисних копалин атмосфера забруднюється шкідливими речовинамив. Усі ці речовини спричинюють фотохімічних смог, кислотні дощі тощо. ( Слайд 5)
-
Фотохімічний смог утворюється в результаті реакцій, що відбуваються під впливом сонячного світла (фотохімічні реакції). При цьому, крім наявних у повітрі зарубників, додатково утворюється діоксид нітрогену та озон. Останній реагує з вуглеводнями, що виділяються в повітря від неповного згоряння пального. У результаті утворюються сполуки, безпечні для здоров’я людей і шкідливі для довкілля ( Слайд 6)
- Яким чином можна позбутися шкідливих забрудників, що утворюються в результаті використання палива і пального?
- Можна ощадливо використовувати ці продукти, тим самим зменшуючи кількість шкідливих викидів.
- Можна вилучати з палива сірку ще до його використання.
- Створювати технологічні умови повного згоряння вугілля в котельнях, на теплоелектростанціях та бензину у двигунах автомобілів.
- Можна уловлювати відходи після згоряння палива за допомогою фільтрів.
- Можна замінити джерела енергії: замість енергії палива використовувати енергію сонця, вітру, води, ядерну та геотермальну енергію. ( Слайд 7)
- Екологічні наслідки нафтового забруднення ( Слайд 8)
- Локальне забруднення ґрунтів можливе коли забруднювачами є нафта, нафтопродукти, газові викиди. Істотне джерело забруднення ґрунтів — хімічні засоби захисту рослин, меліоранти і мінеральні добрива, що містять важкі метали та інші токсичні речовини. Найнебезпечнішими для ґрунтового покриву є стічні води хімічної промисловості, що містять цинк, хром, ртутні сполуки, свинець, фтор, формальдегіди, метанол, бутан, меланін та інші речовини. Стоки коксохімічних заводів містять феноли, роданіди, різні масла. ( Слайд 9)
- Збережім нашу планету! ( Слайд 10)
- Охорона навколишнього середовища від забруднень при переробці нафти та використання продуктів її переробки ( Слайд1)
- Вуглеводнева сировина - це нафта, природний газ, газовий конденсат, кам’яне вугілля, що є товарною продукцією.( Слайд2)
- За фізичними властивостями нафта – це густа оліїста рідина зі специфічним запахом, темно-бурого чи чорного кольору, легша за воду і нерозчинна в ній. Нафта різних родовищ відрізняється за складом, густиною, кольором, запахом тощо. Нафта не є індивідуальною речовиною, це суміш близько 1000 різних речовин, серед яких переважають рідкі насичені вуглеводні, в ній також містяться домішки сульфуро-, нітрогено-, оксигеновмісних органічних сполук, водний розчин неорганічних солей. ( Слайд 3)
- Нафту видобувають з надр Землі через свердловини. Іноді під час буріння вона спершу викидається на поверхню під тиском, потім до свердловини закачують повітря, вуглекислий газ чи воду, які витискують нафту. З районів видобутку до місць переробки нафту перевозять сушею (в залізничних цистернах), морем чи рікою (у танкерах) або перекачують нафтопроводами.( Слайд 4)
-
Мета переробки нафти - виробництво нафтопродуктів, перш за все, різних палив (автомобільних, авіаційних, котельних) і сировини для подальшої хімічної переробки.
- Процес переробки нафти можна розділити на 3 основних етапу:
- Розділення нафтової сировини на фракції, що розрізняються по інтервалах температур кипіння (первинна переробка);
- Переробка отриманих фракцій шляхом хімічних перетворень вуглеводнів, що містяться в них, і виробітку компонентів товарних нафтопродуктів (вторинна переробка);
- Змішення компонентів із залученням, при необхідності, різних присадок, із здобуттям товарних нафтопродуктів із заданими показниками якості (товарне виробництво). ( Слайд 5)
- Нафтопродукти широко використовуються як паливо в котельнях для обігріву житлових будинків, промислових підприємств, громадських установ та інших приміщень.( Слайд 6)
- Для заправки літаків використовується авіаційний бензин – більшої якості, ніж автомобільний( Слайд 7)
- Сільськогосподарська техніка в основному теж працює на дизельному паливі, яке одержують із нафтопродуктів( Слайд 8)
- Основними забруднювачами атмосфери є промислові підприємства( Слайд 9)
- Локальне забруднення ґрунтів можливе коли забруднювачами є нафта, нафтопродукти, газові викиди. Істотне джерело забруднення ґрунтів - хімічні засоби захисту рослин, меліоранти і мінеральні добрива, що мітять важкі метали та інші токсичні речовини. Найнебезпечнішими для ґрунтового покриву є стічні води хімічної промисловості, що містять цинк, хром, ртутні сполуки, свинець, фтор, формальдегіди, метанол, бутан, меланін та інші речовини. ( Слайд 11)
- Екологічні наслідки нафтового забруднення( Слайд 12)
На основі цих повідомлень учні разом з учителем встановлюють
причини забруднення середовища:
- Витік нафти під час перевезення її морськими суднами та іншими видами транспортування;
- Надходження нафтопродуктів зі стічними водами підприємств у водойми.
- Під час очистки танкерів, їх завантажування та розвантаження;
- Неправильне спалювання палива.
З’ясовуються наслідки забруднення нафтопродуктами:
- Отруєння живих організмів;
- Серйозне порушення фізіологічної активності;
- Огортання тіла нафтопродуктами
- Небезпечні для організму зміни, зумовлені проникненням вуглеводнів;
- Зміни біологічних особливостей середовища життя;
- Небезпечні для морського середовища ароматичні вуглеводні. Мікроскопічний їх вміст у дорослих організмах призводить до їх смерті вже через кілька годин.
Способи очищення від забруднення нафтою та нафтопродуктами:
- На нафтопереробних заводах будуються очисні споруди, де нафтопродукти руйнуються мікроорганізмами;
- Створення безвідходних технологічних процесів;
- Фотоокисне та хімічне окиснення.
Способи боротьби із забрудненням навколишнього середовища:
- Передбачення замкнених циклів водопостачання;
- Використання нових видів палива, які не забруднюють довкілля;
- Створення лісових зон навколо великих міст;
- Використання нових видів енергії, що поліпшують екологічні умови.
IV. Підбиття підсумків уроку
V. Домашнє завдання
Повторити матеріал параграфа, опрацювати на запитання до нього.
Підготуватися до контролю навчальних досягнень з теми.
Виховний захід з хімії
„Хімія – наука чарівниця”
(вечір з хімії для 6-7 класів)
Мета:
розкрити таємниці навколишнього різноманітного й загадкового світу;
виховувати любов до предмета, бажання здобувати знання.
Обладнання: хімічний посуд, набори реактивів.
Хід заходу
1-й учень. Нас хімія — наука-чарівниця —
Бере в свої долоні, мов цариця.
І каже: все вам дам, аби природі
Ви мною не завдали шкоди.
2-й учень. Зайдеш у кабінет хімічний,
Навколо пластмаси органічні
І речовини різні металічні,
І Менделєєв у таблиці вічний.
3-й учень. Про одяг також слід нам пригадати.
Все до лиця — нема чого сказати.
І верх, і низ — без хімії ні кроку,
Усі ми тут гарнесенькі нівроку.
Це все вона — чудесниця-наука,
Хоча для когось і велика скука.
1-й учень. А без продуктів, їжі як нам буть?
Білки і вуглеводи всім життя дають,
Якби ж сальця ще на додачу,
То завжди б мали ми удачу.
2-й учень. Хоч хімія наука і не нова,
Вона дає таку пораду—
Нам працювати з нею треба знову,
Тоді наш вчитель буде радий!
Учитель. Навколишній світ різноманітний і загадковий. Наша наука-чарівниця розкриває свої таємниці. У світ хімічних перетворень ми з вами й помандруємо. Учні старших класів підготували для вас досліди з цікавої хімії.
Вони презентуватимуть усілякі чудеса й розкриють таємницю кожного з них.
Дослід 1. «Запали вогнище без сірників»
У туристичному поході треба розпалити вогнище.
Запалю я вогнище,
Без вогню, без сірників,
А про це видовище
Потім розповім.
Готуємо суміш із 2—3 г КМп04 та концентрованого розчину Н2S04.
Чашку із сумішшю кладемо на керамічну підставку, навколо чашки насипаємо тирсу (так, щоб вона не торкалася суміші), залишивши вільний доступ до неї. Змочуємо спиртом невеликий шматочок вати і стискаємо його між пальцями. Спирт капає на суміш і запалює тирсу.
Дослід 2. « Примерзання склянки»
Наливаємо в тонкостінну склянку 200 мл води і ставимо її на мокру дощечку. До розчину додаємо 120 г амоній нітрат й перемішуємо скляною паличкою.
Склянка примерзає.
Дослід 3. «Вулкан»
Я — маг і можу зробити діючий вулкан у склянці.
На металевому листі ступку заповнюємо амоній дихроматом. Усередину «кратера» вкладаємо вату, змочену спиртом, і підпалюємо її.
Дослід 4. «Операція без скальпелю»
Операція без болю,
Буде лиш багато крові.
Під час операції
Потрібна стерилізація.
Змочуємо вату «йодом» (розчином FеСІ3), скальпель «дезінфікуємо» розчином калій роданіду. Під час їх взаємодії утворюється ферум(Ш) роданід червоного кольору, схожий на кров.
Дослід 5. «Неопалима хустина»
Ця хустинка не проста, а чарівна.
Буде полум'я горіти, а хустинка не згорить.
Добре змочуємо хустинку водою, потім ацетоном, після чого «солимо» сполукою Літію або Стронцію. Закріплюємо хустинку на кінці щипців і підпалюємо.
Конкурс « Пантоміма»
3-й учень. Техніка безпеки — це не жарти!
Правила поводження пам'ятати варто,
Під час практичної роботи
І в побуті, щоб не було турботи,
Як працювати з кислотою,
Штативом, склом та лугом...
І хімія тоді завжди
Буде вашим другом!
Завдання. Покажіть, що може статися внаслідок неправильного:
а) визначення запаху речовини (1 учень);
б) користування кислотами.
Дослід 6. «Аркуш чистого паперу» На чистому аркуші зробимо напис лугом. Опісля побризкаємо його фенолфталеїном і напис проявиться. На папері можна прочитати «Привіт друзям».
Дослід 7. «Як горить перо жар-птиці» У чашці для випарювання розчиняємо солі Натрію, Калію, Купруму, Стронцію. Доливаємо спирт і підпалюємо його. Полум'я забарвлюється в різні кольори.
Учитель. За допомогою цих дослідів можна довести, що можливості хімії справді великі й знання цього предмета, його законів допомагають творити дива.
1-й учень.
У житті щоденнім хімія — наш друг,
Допомагає в кухні й на городі.
Куди не глянь — є хімія навколо:
У побуті і у природі.
2-й учень.
І на завершення програми
Ми, друзі, вам сказати хочемо:
Якщо ви ще не переконалися досі,
Що хімія — наука із наук,
Велична, таємнича, загадкова,
В користуванні нам дає
Мільйони речовин чудових!
Пізнавальна гра
«Чи знаєш ти мікро- і мікроелементи
організму людини?»
Цілі:
- показати роль мікро- і макроелементів в організмі людини;
- розвивати вміння і навички визначення хімічних елементів за їхньою електронною формулою.
ХІД ГРИ
Заздалегідь підготовлені картки (розмір 8x30 см) із зображенням електронних формул атомів хімічних елементів.
Учитель знайомить учнів з роллю й дією кожного хімічного елемента в організмі людини, потім демонструє картку з електронною формулою елемента й пропонує назвати його, наводить харчові джерела, що містять мікро- і макроелементи.
«Хранитель спокою»
В організмі дорослої людини міститься близько 25 г цього хімічного елемента — головним чином у кістках у вигляді фосфатів і гідрогенкарбонатів. Поряд з калієм є основним внутрішньоклітинним елементом.
Дія в організмі:
- є основним антистресовим мікроелементом;
- бере участь у передачі генетичної інформації під час розподілу клітин;
- бере участь у передачі нервових імпульсів до роботи м'язів;
- знижує артеріальний тиск і нормалізує серцевий ритм.
Кому необхідний:
- усім, хто часто нервує;
- усім, хто страждає від підвищеного артеріального тиску;
• усім, хто страждає від безсоння.
Його електронна формула:
1s2 2s2 2p6 2s2
Харчові джерела: пшеничні висівки, насіння соняшника, горіхи, родзинки, сушені абрикоси, зелені листові овочі, квасоля, неочищений рис, соя.
«Хранитель тонусу»
Основний елемент кожної живої клітини. Його солі необхідні для нормального обміну речовин у тканинах; для роботи серця, нирок, мозку, печінки, для підтримання м'язового тонусу й артеріального тиску.
Дія в організмі:
- разом з N3 підтримує водно-електролітний баланс;
- контролює скорочення м'язів, у тому числі м'язів серця;
підтримує артеріальний тиск у нормі;
- перешкоджає накопиченню в організмі радіоактивного Цезію-137.
Кому необхідний: усім, у кого:
- м'язова слабкість, судоми, стомлюваність;
- підвищений артеріальний тиск, аритмія серця;
- дратівливість, втрата апетиту, розлад сну;
- гастрит, виразка шлунка й дванадцятипалої кишки;
• сухість шкіри.
Електронна формула:
1s22s22р63s23р64s1
Харчові джерела: сушені абрикоси, диня, квасоля, родзинки, камбала, сардини, соя, кабачки, помідори, банани, молоко, печінка, цитрусові.
«Міцний горішок»
У 1972 році цей елемент було включено до списку життєво необхідних для людини. Він міститься у кожній клітині організму, входить до складу нігтів, волосся, шкіри, очей, печінки. Зберігається в м'язовій тканині, у білих і червоних кров'яних клітинах.
Дія в організмі:
- входить до складу активних центрів близько 200 ферментів, утому числі й ферменту, який розщеплює алкоголь;
- необхідний для відновлення шкіри, волосся і нігтів, у разі загоєння ран, бере участь у синтезі білків;
- за нестачі — діти відстають у рості й розумовому розвитку, організм утрачає здатність засвоювати вітамін А, який надходить із їжею, через що виникає «куряча сліпота».
Кому необхідний:
- у разі шкірних захворювань — екзема, фурункульоз, вугровий висип, погане загоєння ран;
- випадання й повільний ріст волосся;
- уповільнений ріст і розвиток дітей;
- збільшення потягу до алкоголю; зниження апетиту, погіршення пам'яті, депресії;
- затримка розумового розвитку дітей;
- зниження вироблення інсуліну підшлунковою залозою спортсменам — для підвищення фізичної витривалості.
Електронна формула:
1s22s22p63s23p6 3d104s2
Харчові джерела: харчові дріжджі, овес, зародки пшениці, цибуля, чорниця, насіння гарбуза, соняшника, гриби, сир, соя, краби, м'ясо, яєчний жовток.
«Найчарівніша й найпривабливіша»
У 1925 році дослідження вчених показали, що цей елемент, як і Ферум, необхідний для утворення гемоглобіну. Сьогодні вважається життєво важливим мікроелементом для організму людини.
Дія в організмі:
- цей елемент робить жінку «найчарівнішою й найпривабливішою» (ще в
стародавності з нього носили прикраси);
- бере участь у синтезі еритроцитів, гормонів щитовидної залози;
- попереджає розвиток артритів, викривлення хребта;
- відіграє важливу роль в утворенні пігменту шкіри;
- сприяє проведенню нервового імпульсу, попереджаючи розсіяний склероз.
Кому необхідний:
- дітям зі сколіозом, порушенням постави;
- людям, які страждають від артритів, артрозів;
- дітям із ДЦП;
- людям, які хворіють на розсіяний склероз;
- у разі порушення функції щитовидної залози;
- у разі осередкового випадіння волосся;
- у разі хронічної стомлюваності, депресії;
у разі серцево-судинних захворювань.
Електронна формула:
1s22s22p63s23p63dI04s1
Харчові джерела: огірки, плоди шипшини, свиняча печінка, пшеничні зародки, горіх, птиця, какао, яйця, пивні дріжджі, гриби, зелень.
«Винищувач раку»
Має величезне значення для здоров'я людини. Входить до складу більшості гормонів і ферментів, пов'язаний з усіма органами й системами організму людини.
Дія в організмі:
- у результаті нестачі цього елемента небезпека виникнення раку зростає катастрофічно;
- він захищає ядро й органели клітини від ушкодження їхніми вільними радикалами;
- захищає нервові клітини від ушкоджень;
- виводить важкі метали з організму, запобігаючи руйнуванню печінки;
- захищає клітини від впливу радіації;
- запобігає раковим захворюванням легенів, кишечнику.
Кому необхідний:
- у разі захворювань серця й судин, нирок;
- у разі пухлинних захворювань;
- у разі захворювань нервової системи, суглобів, кісток;
- для зменшення стомлюваності, у разі депресії;
- для підвищення імунітету;
- у разі отруєння важкими металами.
Електронна формула:
1s22s22p63s23p63d'°4s24p4
Харчові джерела: кокос, морська риба, фісташки, пшеничні висівки, свиняче сало, білі гриби, часник, яйця, соя, печінка.
«Хранитель оптимізму»
За нестачі цього елемента в організмі розвивається неврастенія зі схильністю до депресії. Він допомагає людині бути оптимістом.
Дія в організмі:
- необхідний для побудови кісток і сполучної тканини, для синтезу ДНК;
- є каталізатором засвоєння Са в організмі;
- активізує клітини протипухлинного імунітету;
- за його нестачі в дітей виникає затримка психомовного розвитку;
- необхідний для нормального вироблення інсуліну в підшлунковій залозі.
Кому необхідний:
- дітям із затримкою психомовного розвитку;
- дорослим — у разі неврастенії, дратівливості;
- усім — у разі нежиті, бронхіальної астми;
- у разі цукрового діабету;
- у разі шкірних захворювань, для зміцнення кісток і суглобів.
Електронна формула:
1s225s22p63s2Зр63d54s2
Харчові джерела: цільне зерно й крупи, буряк, хліб, чорна смородина, фрукти, чай, зелені овочі, боби.
«Хранитель сполучної тканини»
Уперше виявлений у золі тваринних тканин ще в 1848 році, однак внесений до списку життєво важливих елементів тільки в 1972 році.
Дія в організмі:
- входить до складу колагену — основного білка сполучної тканини;
- основна його роль — участь у хімічній реакції, яка надає сполучній тканині міцності та пружності;
- допомагає виводити з організму чужорідні речовини.
Кому необхідний:
- у разі хвороб кісток, зв'язок, хрящів, артрозів;
- у разі ураження судин — ранній атеросклероз;
- у разі сухої шкіри, появи вугрів;
- у разі ламкості й поганого росту нігтів;
у разі захворювань легенів і верхніх дихальних шляхів. Електронна формула:
1s22s22p63s23p2
Харчові джерела: овес, буряк, соя, родзинки, неполірований рис, цільна пшениця, бобові, топінамбур.
«Хранитель щитовидної залози»
Ще за 3000 років до нашої ери в давньому Китаї для лікування захворювань щитовидної залози застосовували спалені морські губки й водорості; цей елемент став другим, після Феруму, визнаним життєво необхідним для людини. 40 % цього елемента міститься в щитовидній залозі.
Дія в організмі:
- єдиний мікроелемент, що бере участь в утворенні гормону щитовидної залози;
- справляє виражену дію на обмін білків, жирів, вуглеводів і водно-сольову рівновагу;
- перешкоджає накопиченню в організмі радіоактивного Іоду-131.
Кому необхідний:
- усім, хто страждає захворюваннями щитовидної залози;
- жителям районів, де спостерігається дефіцит цього елемента у воді, грунті (у дітей може розвинутися слабоумство й кретинізм, глухонімота, параліч).
Електронна формула:
1s22s22p63s23p64s24p64dІ05s25p5
Харчові джерела: морська риба, печінка тріски, морська капуста (ламінарія), креветки, риба, мідії, кальмари.
«Будівельник гемоглобіну»
Займає четверте місце в земній корі серед елементів. Необхідний для життєдіяльності як рослинного, так і тваринного організму. Без нього зовсім неможливе нормальне функціонування кровоносної системи.
Дія в організмі:
- необхідний для синтезу червоних клітин крові — еритроцитів і гемоглобіну;
- важлива роль у процесі вироблення енергії в м'язах;
- сприяє знешкодженню шкідливих речовин у печінці; є складовою частиною ферментів;
- перешкоджає накопиченню в організмі радіоактивного Плутонію.
Кому необхідний: у кого:
- ферумдефіцитна анемія (слабкість, задишка, нестерпність холоду, запалення язика);
- спотворений апетит — потяг до крейди, золи землі, клейстеру;
- зниження опірності до застуди, інфекцій;
- запаморочення, головний біль, зниження пам'яті;
- зниження витривалості й сили м'язів.
- Електронна формула:
1s22s22p63s23p63d64s2
Харчові джерела: м'ясо червоне (яловичина), нирки й печінка, гриби, бобові, пивні дріжджі, какао, соя, морква, морська риба, яйця, житній хліб, насіння гарбуза, зелень.
« Супутник кальцію»
Цей елемент разом з кальцієм відіграє важливу роль у формуванні кісткової тканини.
Дія в організмі:
- важливий для побудови кісток і міцності зубів;
- бере участь в обміні речовин
у клітині;
• необхідний для роботи головного мозку, серцевого та скелетного м'язів.
Кому необхідний:
- у разі загальної слабкості й стомлюваності;
- у разі болю в м'язах, в області серця;
- у разі порушення функції печінки;
- у разі розвитку остеопорозу.
Електронна формула:
1s22s22p63s23p3
Харчові джерела: жовток яйця, квасоля, горох, крупа: гречана, вівсяна, пшенична, сир, риба.
«Зодчий кісток»
Цей хімічний елемент називають зодчим кісток, він становить майже 2 % від ваги тіла, 99 % його міститься у кістках і зубах. Дія в організмі:
- відіграє важливу структурну та пластичну роль в організмі;
- найважливіший компонент системи зсідання крові;
- він необхідний для проведення нервового імпульсу й скорочення м'язів;
- сприяє виведенню з організму солей важких металів і радіонуклідів;
- перешкоджає накопиченню Плюмбуму в кістковій тканині.
Кому необхідний:
- у разі депресії;
- у разі підвищення тиску;
- у разі профілактики раку товстої кишки;
- у разі хвороб зубів;
- у разі судом ніг і їхньої втоми;
- у разі артритів.
Електронна формула:
1s22s22p63s23p64s2
Харчові джерела: молочні продукти, сир, сир, горіхи, петрушка, капуста, риба, квасоля.
Зразки варіантів перевірки і контролю знань для учнів 7 класу
Хімія як природнича наука є частиною духовної і матеріальної культури людства, а хімічна освіта – невідокремною складовою загальної культури особистості, яка живе, навчається, працює, творить в умовах використання високих технологій, змушена протистояти екологічним ризикам, зазнає різнобічних упливів інформації. Хімічні знання створюють підґрунтя реалістичного ставлення до навколишнього світу, в якому значне місце посідає взаємодія людини і речовини, сприяють розкриттю таємниць живого через пізнання процесів життєдіяльності організмів на молекулярному рівні.
Ефективна організація навчання передбачає систематичний контроль якості засвоєння матеріалу школярами. Контроль якості знань і вмінь конкретного учня доцільно здійснювати на кожному уроці.
Сучасний учитель повинен віддавати перевагу тим формам і прийомам роботи, які сприяють розвитку творчого мислення учнів та більш глибокому засвоєнню навчального матеріалу.
Ефективним засобом контролю знань учнів є багатоваріантні завдання, які значно збільшують відсоток самостійної роботи, створюють умови для застосування особистісного розвивального підходу в процесі навчання. Головне для вчителя — навчити школярів працювати самостійно, наполегливо, систематично.
Вступ. Початкові поняття хімії
Варіант 1
Закінчіть визначення:
Молекула – це електронейтральна…
Чиста речовина складається з частинок…
Суміш – це сукупність різних…
Матеріалами називають речовини, які…
-
У наведеному переліку: вапно, пенал, папір, зошит, парта, деревина, термометр, ртуть, підкова, нафта, крейда переважають:
а) тіла; б) речовини; в) тіл і речовин порівну. - Суміші поділяються на:
а) однорідні, б) неоднорідні, в) різнорідні.
-
У яких випадках для розділення сумішей потрібне розчинення у воді з наступним фільтруванням:
а) порошку заліза і сірки;
б) кухонної солі і піску;
в) бензину і води;
г) порошку крейди і цукру.
- Як правильно запалювати спиртівку? Як не можна цього робити?
-
Якими способами можна розділити однорідну суміш:
а) випаровуванням; б) фільтруванням;
в) хроматографією? - Випишіть у дві колонки тіла та речовини: лінійка, грудочка цукру, кухонна сіль, олія, залізо, парта.
- Наука про речовини, їхні властивості будову і взаємні перетворення:
![]() а) фізика; б) біологія; в) хімія г) географія.
а) фізика; б) біологія; в) хімія г) географія.
8.Те, з чого складається фізичне тіло:
а) речовини; б) тіло; в) залізо; г) молекула.
Вступ. Початкові поняття хімії
Варіант 2
Закінчіть визначення:
Хімія – це наука про…
Фізичні тіла – це предмети…
Речовина – це те, з чого…
Атом – це найменша хімічно…
-
У наведеному переліку: молоко, ґрунт, мідь, повітря, цукор, сірка, річкова вода переважають:
а) чисті речовини; б) суміші. - Які тіла виготовлені з одної речовини: мідний дріт, пробірка, хімічна склянка, залізна пластина, колба.
- У яких випадках для розділення сумішей потрібне розчинення у воді з наступним фільтруванням:
а) порошку заліза і сірки; б) кухонної солі і піску;
в) бензину і води;
г) порошку крейди і цукру.
- Як правильно погасити спиртівку? Як не можна цього робити?
-
Якими способами можна розділити неоднорідну суміш:
а) відстоюванням; б) кристалізацією;
в) фільтруванням?
- Випишіть у дві колонки тіла та речовини: зошит, сода, ручка, оцет, склянка, золото, чорнило.
- Суміші бувають:
а) однорідні і неоднорідні б) однорідні та чисті;
в) неоднорідні та рідкі.
8.Виберіть спосіб, з допомогою якого можна розділити суміш, що складається із солі та заліза:
а) відстоювання; б) фільтрування;
в) дія магнітом; г) випаровування
Початкові поняття хімії
ВАРІАНТ І
Завдання 1 З переліку виписати назви речовин
підкова ,цвях, спирт, обручка, кисень,лінійка, цукор, сніжинка, золото, мідь.
Завдання 2.Знайти відповідність назв і символів.
K Сульфур
Ca Купрум
![]() Cu Карбон
Cu Карбон
C Кальцій
S Калій
Завдання 3.Дати визначення поняттям:
Атом
Хімічний елемент
Завдання 4. З переліку виписати окремо чисті речовини :
молоко, дистильована вода, повітря, срібло, сметана, мідь, розчин спирту, графіт.
Завдання 5. Напишіть назви хімічних елементів:
O, N, Ca, K, Mg, S, Al, Au, Cl, Fe, Si, Br.
Завдання 6. Напишіть символи таких хімічних елементів:
Гелій, Літій, Оксисен, Бор, Натрій, Алюміній, Барій, Силіцій, Флуор, Карбон, Кальцій, Гідроген.
Завдання 7. Скласти формули речовин, які складаються з :
- 2 атомів Калію і 1 атому Оксигену
- 3 атомів Оксигену
- 1 атому Ферум
Початкові поняття хімії
ВАРІАНТ ІІ
Завдання 1. З переліку виписати окремо назви тіл
підкова ,цвях, спирт, обручка, кисень,лінійка, цукор, сніжинка, золото, мідь.
Завдання 2 Знайти відповідність назв і символів.
Ba Натрій
Br Фосфор
Na Барій
![]() Cl Бром
Cl Бром
P Хлор
Завдання 3. . Дати визначення того поняттям:
Молекула
Йон.
Завдання 4. З переліку виписати окремо суміші
молоко, дистильована вода, повітря, срібло, сметана, мідь, розчин спирту, графіт.
Завдання 5. Напишіть назви хімічних елементів:
Na, C, P, S, Cl, Li, Ag, H, B, Ca, Zn, Cu.
Завдання 6. Напишіть символи таких хімічних елементів:
Силіцій, Алюміній, Флуор, Гідроген,Калій, Натрій, Аурум, Сульфур, Хром,Ферум, Нітроген,Цинк.
Завдання 7. Скласти формули речовин, які складаються з :
- 6 атомів Карбону, 12 атомів Гідрогену і 6 атомів Оксигену
- 1 атому Сульфуру і 3 атомів Оксигену
- 1 атому Алюмінію
КОНТРОЛЬНА РОБОТА З ТЕМИ
«Початкові хімічні поняття»
учня 7 класу________________________
Максимальна оцінка за правильно виконану роботу — 12 балів.
Час на виконання роботи — З0 хв.
Завдання 1-6 — тестові, кожне завдання оцінюється по 1 балів;
завдання 7-8 — оцінюються в 1,5 бал;
завдання 9-10 — оцінюються у 1,5 бали;
Варіант 1
1. Наука про речовини, їхні властивості будову і взаємні перетворення:
![]() а) фізика; б) біологія;
а) фізика; б) біологія;
в) хімія г) географія.
2. Те, з чого складається фізичне тіло:
а) речовини;
б) тіло;
в) залізо;
г) молекула.
3. Виберіть ряд, в якому перелічені тільки назви речовин:
а) залізо, гума, срібло, вода;
б) м'яч, іграшка, гума, шина;
в) вода, лід, ванна, пара.
4. Укажіть ряд хімічних елементів, у яких може бути валентність II:
а) О, АІ, Н, Мg, S;
б) О, Са, Fe, Мg, S;
в) 0,АІ, Р, С, S .
5. Визначте валентність елементів у сполуці Р205:
а) Фосфор — V, Оксиген — II;
б) Фосфор — II, Оксиген — V.
6.Випаровуванням можна розділити суміші:
а)розчинених одна в одній речовин з різною густиною;
б) рідини і розчиненої в ній твердої речовини;
в)рідини і нерозчинені в ній тверді речовини;
7. Запишіть з допомогою відповідних хімічних символів чи формул:
а) 3 атоми Сульфуру; б) 12 молекул азоту;
в) 4 атоми Гідрогену; г) 3 молекули кисню.
8 . Що означають такі позначення:
O2, 2O2, Сo2, 2Н20, Н2,2Н, 2Н2?
9 . Напишіть формули речовин, молекули яких складаються:
а) з трьох атомів Феруму і чотирьох атомів Оксигену;
б) з двох атомів Калію та атома Сульфуру;
в) з атома Кальцію і двох атомів Хлору;
г) з двох атомів Фосфору і п'яти атомів Оксигену.
10. Визначте валентність атомів елементів у сполуках з Гідрогеном.
РН3, СН4, Н20, НС1, NН3.
КОНТРОЛЬНА РОБОТА З ТЕМИ
«Початкові хімічні поняття»
учня 7 класу_________________________
Максимальна оцінка за правильно виконану роботу — 12 балів.
Час на виконання роботи — З0 хв.
Завдання 1-6 — тестові, кожне завдання оцінюється по 1 балів;
завдання 7-8 — оцінюються в 1,5 бал;
завдання 9-10 — оцінюються у 1,5 бали.
Варіант 2
1. Валентність — це:
а) цифра над знаком хімічного елемента;
б) властивість атомів утворювати певну кількість хімічних зв'язків
в) кількість атомів Гідрогену, що може приєднати до себе хімічний елемент.
2.Валентність позначається:
а) над знаком хімічного елемента римськими цифрами;
б) над знаком хімічного елемента арабськими цифрами;
в) справа біля знаку хімічного елемента римськими цифрами;
г) справа біля знаку хімічного елемента арабськими цифрами.
3. Виберіть ряд, в якому перелічені елементи, що мають тільки постійну валентність:
а) Оксиген, Гідроген, Алюміній, Натрій;
б) Оксиген, Гідроген, Ферум, Натрій;
в) Оксиген, Гідроген, Ферум, Сульфур.
4. Агрегатні стани, в яких може перебувати речовина вода
а) рідкий, пароподібний, твердий;
б) рідкий, твердий, газоподібний;
в) газоподібний, м'який, рідкий.
5. Суміші бувають:
а) однорідні і неоднорідні;
б) однорідні та чисті;
в) неоднорідні та рідкі.
6.Виберіть спосіб, з допомогою якого можна розділити суміш, що складається із солі та заліза:
а) відстоювання б) фільтрування;
в) дія магнітом; г) випаровування.
7. Запишіть з допомогою відповідних хімічних символів чи формул:
а) 5 атомів Фосфору;
б) 3 молекули водню;
г) 2 атоми Карбону;
д) 10 молекул флуору.
8. Що означають такі позначення:
2Na, С, СO2, Сu, ЗСu, СuО, Na20?
9. Напишіть формули речовин, молекули яких складаються:
а) з двох атомів Алюмінію та трьох атомів Оксигену;
б) з атома Магнію та двох атомів Хлору;
в) з атома Мангану та двох атомів Оксигену;
г) з атома Феруму і трьох атомів Хлору.
10. Визначте валентність атомів елементів у сполуках з Оксигеном. Р205, Li20, К20, С1207, N20.
Література:
1.Л.Є. Богданова. Інтерактивні технології навчання на уроках хімії. - X.: «Основа», 2004р.
2.Рожнятовська, В. Зоц. Сучасні технології ч 2. Київ.: «Редакції загально педагогічних газет» , 2004р.
3.К.М. Задорожній. Відкриті та нестандартні уроки хімії у 8 класі -X.,: «Основа», 2004р.
4.Задорожний К.М. Активні форми та методи навчання хімії [Текст] / К.М. Задорожний. – Х.: Видавнича група «Основа», 2008. – 141 с. – (Бібліотека журналу «Хімія». Вип. 12 (72)).
5.Задорожний К.М. Сучасні методики викладання хімії в школі [Текст] / К.М. Задорожний. – Х.: Видавнича група «Основа», 2009. – 127 с.– (Бібліотека журналу «Хімія». Вип. 12 (84)).
6. Задорожний К.М. Бінарні уроки та зв’язок із іншими предметами під час викладання хімії [Текст] / К.М. Задорожний. – Х.: Видавнича група «Основа», 2008. – 109 с. – (Бібліотека журналу «Хімія». Вип. 5(65)).
7.Г.О. Сиротинко Сучасний урок: Інтерактивні технології навчання - X.: «Основа», 2003 р
8. Г.Мальченко, О. Каретникова. Я готуюсь до уроку хімії 9 клас Випуск 2. - К.: «Редакції загально педагогічних газет», 2004р.
9. Г.Мальченко, О.Каретникова. Інтерактивне навчання на уроках хімії.- К.: «Редакції загально педагогічних газет», 2004р.
10. В.Д.Шарко Сучасний урок /посібник для вчителів і студентів/ .-К., 2006р.
11.Ф. А. Деркач "Хімія", - науково-методичнийпосібник. – Київ, 2008.
12.Л. Б. Цвєткова «Неорганічна хімія» – 2-ге видання, виправлене і доповнене. – Львів, 2006.
Хімія - це справжня чарівниця,
І в житті не раз вона згодиться,
Про цей світ все може пояснити,
Допоможе в ньому краще жити.
Чому молоко прокисло?
Чому річку льодом стисло?
Чому листя пожовтіло,
Мідь з вогнем горшки побила?
І від горя почорніла?
Їй до всього пильне діло,
Вона вправна й дуже сміла
Має безліч слуг вона,
Не буває й день сама.
Ну, наприклад , кличе Воду,
Позира на її вроду, й мовить:
» Треба працювати – кислоту видобувати!»
І вода мерщій біжить
Та шука кристали білі
Ті, що небезпечні в ділі,
Бризне, хлюпнеться вода,
Є нітратна кислота.
І скарбницю вона має,
Срібло,злото там складає,
Ключі надійно заховає,
Творить дивнії діла
Хімія у нас така!
(Учениця 10 класу Сташків Марія)
1


про публікацію авторської розробки
Додати розробку
