Хімічні властивості кисню: взаємодія з простими речовинами . Реакція сполучення.
План-конспект
Хімічні властивості кисню: взаємодія з простими речовинами (вуглець, водень, сірка, магній, залізо, мідь). Реакція сполучення.
Цілі уроку:
1. Навчальні (дидактичні):
- ознайомити учнів з хімічними властивостями кисню на прикладі його взаємодії з вуглецем, сіркою, фосфором, залізом і магнієм;
- забезпечити умови для засвоєння учнями понять: реакція окислення, реакція горіння, дати уявлення про реакцію сполучення, про оксиди як складні речовини;
- закріпити і розширити знання учнів про хімічні реакції, уміння складати рівняння хімічних реакцій, давати назви отриманим речовинам - оксидам.
2. Розвиваючі: сприяти формуванню
- умінь виділяти загальні і суттєві ознаки і властивості;
- умінь побачити проблему і знайти шляхи її вирішення;
- умінь застосовувати отримані знання на практиці і оцінювати результати виконаних дій;
- продовжити розвиток самостійності, уміння працювати в колективі.
3. Виховні:
- сприяти формуванню пізнавальної зацікавленості предметом;
- сприяти в ході уроку формуванню комунікативної та інформаційної компетенції.
4. Практичні:
- виконання демонстраційних дослідів;
- вміння працювати з лабораторним обладнанням та реактивами;
- дотримання правил т/б.
Обладнання та реактиви: прилад для одержання кисню, порошок сірки, вуглинка, фосфор, залізний дріт, стружка магнію, ложка для спалювання речовин, спиртівка.
Засоби наочності: ПСХЕ, демонстраційний експеримент, використання електронних ресурсів learningapps.org, використання відеофрагментів.
Технічні засоби наочності: телевізор, комп'ютер, Інтернет.
Дидактичні та методичні матеріали:
1. Лашевська А.А. Хімія: 7 кл.: Підручник для загальноосвітніх навчальних закладів. – К.: Генеза, 2007. – 200с.: іл.
2. Попель П.П., Крикля Л.С. Хімія: 7 кл.: Підручник для загальноосвітніх навчальних закладів. – К.: Видавничий центр « Академія». 2008.
3. Індивідуальні картки з завданнями.
Перелік он-лайн сервісів, які використані на уроці:
1. learningapps.org: https://learningapps.org/watch?v=pmcz5m8n519
2. Microsoft PowerPoint : презентація.
3. YouTube : https://www.youtube.com/watch?v=xKys6ugZ_Yk ( для домашнього перегляду); https://www.youtube.com/watch?v=8HvWHkDLDqM (для фізхвилинки)
Структура уроку
І. Організаційно - мотиваційний етап (5 хв.)
ІІ. Актуалізація опорних знань (3 хв.)
ІІІ. Мотивація навчальної діяльності. (5 хв.)
ІV. Цілепокладання і планування навчальної діяльності. (7 хв.)
V. Вивчення нового матеріалу(15 хв.)
VI. Закріплення матеріалу(10 хв.)
VIII. Домашнє завдання.( 2 хв.)
Хід уроку
І. Організаційно - мотиваційний етап
Привітання. Перевірка присутності учнів: кількість за списком _________,
кількість присутніх на уроці ___________, відсутніх ___________. Перевірка готовності учнів до уроку.
Стратегія « Асоціативний кущ»
Записати всі слова ( фрази), які спадають на думку.
 (слайд 2)
(слайд 2) 
Учитель. На попередньому уроці ми з вами вивчали поняття про оксиди, окиснення( горіння, повільне окиснення, дихання) умови виникнення та умови горіння.
Визначте умови виникнення та умови горіння.
tº замерзання;
доступ повітря;
зниження tº;
гасіння пожежі.
Дайте відповідь. Дикі кури Австралії відкладають свої яйця в гніздах, які вони будуть, згрібаючи в купу пріле листя, траву і землю. Час від часу самець засовує свій дзьоб у купу, після чого частково розкидає або навпаки підгортає її. Який процес відбувається в гнізді?
Завдання на картках


Виступ учня з презентацією на тему: «Горіння й повільне окиснення у довкіллі».
II. Актуалізація опорних знань
Дидактична гра « Так чи ні»
( З усіх правильних відповідей прочитайте слово, яке позначає певну групу речовин ).
|
Питання(твердження) |
Так |
Ні |
|
1.Відносна атомна маса Оксигену 32. (Ні) |
м |
к |
|
2.Кисень-метал. (Ні) |
о |
а |
|
3.Молекула кисню складається з двох атомів Оксигену.(Так) |
т |
и |
|
4.Кисень безбарвний навіть у рідкому та твердому стані. |
л |
А |
|
5.Для дихання потрібний Оксиген? |
о |
Л |
|
6.Під час горіння речовин витрачається кисень. (Ні) |
і |
Е |
|
7. Кисень добре розчиняється у воді. (Ні) |
д |
З |
|
8. Одержати кисень у лабораторії можна, розкладаючи деякі складні речовини, що містять Оксиген.(Так) |
а |
Е |
|
9.Чистий кисень легший за повітря, тому завжди підіймається вгору. (Ні) |
ч |
Т |
|
10.Фотосинтез –основне джерело одержання кисню в природі.( Так) |
о |
І |
|
11.Валентність Оксигену в сполуках І. (Ні) |
с |
Р |
|
12. Речовини, які прискорюють хімічну реакцію, називаються інгібіторами. (Ні) |
Н |
И |
Відповідь: катарізатори (дати визначення).
IІІ. Мотивація навчальної діяльності.
Технологія « Мікрофон» (слайд 3) 
Які властивості речовин називаються хімічними? (Здатність реагувати з іншими речовинами, а також схильність до розкладу)
Як можна довести наявність кисню? ( За допомогою тліючої скіпки)
Які способи одержання кисню в промисловості вам відомі? ( Перегонка рідкого повітря, електролітичним методом)
Що необхідно для горіння речовин?( Доступ кисню, нагрівання до температури займання)
Розповідь учителя з елементами бесіди.
Кисень є однією з найактивніших речовин. З уроків природознавства та з теми минулого уроку ви знаєте, що кисень підтримує…(горіння й дихання).
У чистому кисні речовини горять…(краще).
Якби давали нагороди неметалічних елементів за його активність, то кисень посів би почесне друге місце, поступаючись своєю активністю лише флуору.
Взаємодія більшості речовин з киснем супроводжується виділенням великої кількості тепла і світла, а такі реакції називають реакціями…(окиснення, горіння).
Реакція окиснення – реакції взаємодії речовин з киснем.
Горіння – швидкий процес окиснення речовин, що супроводжується виділенням великої кількості теплоти і, здебільшого, світла. Кисень вступає в хімічну взаємодію з простими та складними речовинами.
Які ви знаєте прості речовини? Метали й неметали.
Покажіть , будь ласка, де розміщенні метали й неметали у таблиці Менделєєва.
ІV. Цілепокладання і планування навчальної діяльності.
Поетична хвилинка (слайд 4) 
Я живу і не тужу,
З ким зустрінуся – дружу.
Ми удвох з моїм сусідом
Називаємось оксидом.
Друзями моїми стали
І метали, й неметали
Феєрверк влаштую вмить,
Бо в мене усе горить.
Робота учнів з підручником:
Вчитель: Легше працювати, об’єднавши зусилля.
Технологія «Броунівський рух»
(Навчаюсь-учусь») (слайд 5)
 Клас ділиться на групи. Учні класу опрацьовують матеріал підручника (с. 116-118, Лашевська Г. А.) кисень
Клас ділиться на групи. Учні класу опрацьовують матеріал підручника (с. 116-118, Лашевська Г. А.) кисень
Перша група визначає як узаємодіє кисень
з вуглецем та сіркою, друга – із фосфором та залізом, третя – із магнієм, а четверта – з міддю. Потім необхідно ознайомити зі своєю інформацією інших однокласників і передати її іншим у доступній формі.
Мета учнів:
• дізнатися хімічні властивості кисню;
Питання. За допомогою чого ми будемо ілюструвати хімічні властивості? (рівняння реакцій), тобто:
• вміти записати рівняння хімічних реакцій;
• вміти назвати отримані речовини.
V. Вивчення нового матеріалу
Розповідь вчителя ( з доповідями учнів). Кисень є однією з найактивніших речовин. З уроків природознавства ви знаєте, що кисень підтримує горіння й дихання. У чистому кисні речовини горять краще. А зараз ми розглянемо процес взаємодії кисню з деякими простими речовинами:
а) взаємодія з вуглецем (слайд 6) 
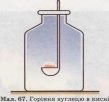
Перегляд відеофрагменту . Обговорення: у ложку для спалювання речовин кладемо вугілля і вносимо його у полум’я спиртівки. Що спостерігаємо? Вугілля розігрівається,але не загоряється. Це свідчить про те,що кисень,який є у повітрі з вугіллям взаємодіє повільно. А зараз внесемо ложку з вугіллям у склянку з чистим киснем. Вугілля швидко згоряє. Отже,в результаті реакції утворюється вуглекислий газ. А переконатися в цьому можна за допомогою тліючої скіпки – вона тухне. Чому скіпка затухла? ( відповіді учнів) С +О2 =СО2 – карбон (IV) оксид
б) взаємодія з сіркою (слайд 7) 
Перегляд відеофрагменту . Обговорення: У ложку для спалювання кладемо кусочок сірки і спалюємо на повітрі та у чистому кисні. У першому випадку процес проходить повільніше.У результаті реакції спостерігаємо синє полум’я.
S+ O2= SO2 – сульфур (IV) оксид

в) взаємодія з воднем (слайд 8) 
Перегляд відеофрагменту . Обговорення: 2Н2 + О2 =2 Н2О – гідроген оксид або вода
г) взаємодія з магнієм (слайд 9) 
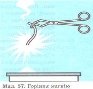
Перегляд відеофрагменту . Обговорення: Магнієву стрічку закріплюємо у щипцях і вносимо у полум’я.
Що спостерігаємо? ( відповіді учнів) 2Мg +O2= 2MgO – магній оксид
д) взаємодія з залізом
Перегляд відеофрагменту . Обговорення: Залізну стрічку нагріваємо і вносимо у склянку з чистим киснем. Спостерігаємо яскраві іскри. Але на повітрі залізо не горить. При складанні рівняння необхідно враховувати валентність Феруму (II), (III)
2 Fe + O2=2FeO 4Fe +3O2=2Fe2O3 Отже,3 Fe +2 O2= Fe3O4

Реакцію горіння заліза можна спостерігати на будівництві під час різання та зварювання металів.

е) взаємодія з міддю
Перегляд відеофрагменту . Обговорення: Мідний дріт на повітрі майже не горить, але коли ми його внесемо у посудину з чистим киснем,реакція відбувається і спостерігаємо процес горіння. 2Cu+ O2=2CuO - купрум (II) оксид
Подивіться уважно на записані рівняння хімічних реакцій і скажіть,що у них є спільного? (відповіді учнів) Отже,при взаємодії простих речовин з киснем утворюються бінарні сполуки – оксиди.
Оксиди-це складні речовини до складу яких входить два елементи,один з яких – Оксиген з валентністю II. (слайд 8)
ExOу
Назва оксиду= назва елемента( валентність) + «оксид»
А ще всі хімічні реакції належать до одного типу –реакції сполучення. А ще,всі хімічні реакції належать до одного типу – реакції сполучення.
Реакції сполучення – це реакції між двома простими речовинми, в результаті яких утворюється одна нова складна речовина.
(слайд 12) 
A + B = AB.
Приклади реакцій сполучення( для пояснення на дошці).
2SO2 + O2 = 2SO3;
2CO + O2 = 2CO2.
S + O2 = SO2;
2Mg + O2 = 2MgO;
C + O2 = CO2.
Запитання для бесіди:
1. Що називають хімічним реакціями?
2. Які типи хімічних реакцій вам відомі?
3. Що називають реакціями розкладу?
4. Наведіть приклад реакцій розкладу
5. Які речовини називають реагентами?
6. Які речовини називають продуктами реакції?
Фізкультхвилинка( повторюємо рухи за героями відео під музику)
VI. Закріплення матеріалу.
- Закінчіть рівняння реакцій( робота біля дошки):
(слайд 13 ) 
а) 4 NH3 + 3 O2 → 2 N2 + 6H2O ;
б) 4 NH3 + 5 O2 → 4 NO + 6H2O ;
в) 4 NO2 + 2 H2O + O2 → 4 HNO3;
г) 2 AgNO3 = 2 Ag + 2 NO2 + O2 ;
д) 2 PH3 + 3 O2 = Р2О3 + 3Н2О ;
е) P2O3 + O2 = Р2О5 ;
є) С + О2 → СО2 .
2. Укажіть оксиди й назвіть їх: BaO, CaS, NaCl, Na2O, CO, H2SO4, AgCl, NO2, H3PO4, ZnO. (слайд 14) 
3. Напишіть рівняння хімічних реакцій отримання наведених оксидів із простих речовин: MgO, Al2O3, P2O5, K2O.
Відповідь: 2Mg + O2 = 2MgO; 4Al + 3O2 = 2Al2O3; 4P + 5O2 = 2P2O5; 4K + O2 = 2K2O.
4. Обчисліть об’єм кисню, наявного в кабінеті, де навчаються першокласники, після трьох уроків. Площа класу — 50 м2, протягом кожного уроку учні разом з учителем витрачають 10 л кисню. Як можна поповнити запас кисню в класі? (слайд 15) 
Відповідь: у класі залишиться 47 л кисню; поповнити цей запас можна, провітрюючи клас на кожній перерві.
5. Складіть рівняння реакцій, що відповідають таким схемам:
( схема на дошці)
![]()
![]() CuO Fe3O4
CuO Fe3O4
![]()
![]() 1) HgO → O2 2) H2O2 → O2
1) HgO → O2 2) H2O2 → O2
SO2 P2O5
Відповідь: 1) 2HgO = 2Hg + O2; 2Cu + O2 = 2CuO; S + O2 = SO2;
2) 2H2O2 → 2H2O + O2; 3Fe + 2O2 = Fe3O4; 4P + 5O2 = 2P2O5.
VII. Підведення підсумків. (слайд 16)

Прийом « Підіб’ємо підсумки»
На уроці я …
- дізнався…
- зрозумів…
- навчився…
Рефлексія
1.Отже, якою була мета нашого сьогоднішнього уроку?
2.На вашу думку, ви впоралися з поставленими завданнями?
3. Що необхідно зробити для повного засвоєння теми? ( вивчити домашнє завдання).
VIII. Домашнє завдання: (слайд 17)  перегляд відео( з практичною частиною) на повторення: https://www.youtube.com/watch?v=xKys6ugZ_Yk;
перегляд відео( з практичною частиною) на повторення: https://www.youtube.com/watch?v=xKys6ugZ_Yk;  тренувальні вправи до теми (тести):
тренувальні вправи до теми (тести):  або https://learningapps.org/watch?v=pmcz5m8n519, параграф 21 № 17, 18
або https://learningapps.org/watch?v=pmcz5m8n519, параграф 21 № 17, 18


про публікацію авторської розробки
Додати розробку
