Урок хімії з використанням мультимедійної дошки "Схема хімічної реакції. Хімічні рівняння."
Урок хімії з використанням мультимедійної дошки.
Використання інтерактивної дошки на уроках відкриває можливість художнього самовираження як для педагога,так і для учня. У багатьох дітей є комп'ютери, а також доступ в Інтернет, що значно підвищує їхню працездатність у сфері ІТ. Відтепер вони можуть цілком виявити свої здібності на уроці, гідно конкуруючи, навчаючи і навіть у чомусь допомагаючи своєму вчителеві.
Найголовніша перевага інтерактивної дошки - її естетична й динамічна структура, що відповідає запитам молодого покоління. Використання інтерактивної дошки на уроці стає додатковим фактором організації уваги учня й у силу наявності якісного візуального ряду - підвищення рівня засвоєння навчального матеріалу з будь-якої шкільної освітньої програми.
Можна стисло, для ознайомлення, окреслити сценарії використання інтерактивної дошки:
- Створення ефективного віртуального, але з максимумом наближеного до реальності середовища навчання, проектуючи для цього різноманітне навчальне програмне забезпечення.
- Активна підтримка уваги учнів протягом усього навчального часу, що досягається включенням кожного учня у процес опрацювання матеріалу навчальної теми.
- Організація групової та фронтальної контрольно-оцінювальної діяльності учнів тощо.
За допомогою електронної інтерактивної дошки приємно працювати: у класі атмосфера жвавого спілкування й обміну думками, а це істотно допомагає працювати учням з новим матеріалом уроку. Більше не потрібно витрачати безліч нервів і часу, щоб цілком заволодіти увагою учнів на всіх уроках. У мене є прекрасна можливість спілкуватися з учнями класу, не відходячи від дошки, продовжуючи працювати з матеріалом, а не бігати щоразу від дошки до комп'ютера. Комп'ютер, котрий вимагав зосередженості та відволікав від пояснення теми уроку, більше не відокремлює мене від класу. Учитель дійсно стає носієм нової для учнів інформації. Не важко уявити й реакцію учнів на можливість роботи на уроці з електронною інтерактивною дошкою: ентузіазм, здивування, а в підсумку захоплення уроком, учителем, предметом і взагалі навчанням. Ще б пак, ну кого, скажіть, залишать байдужими майже фантастичні речі: від звичайного дотику до дошки зображення змінюється за вашим бажанням. Перевага нової технології перед буденною шкільною практикою роботи очевидна.
Електронна інтерактивна дошка дозволяє й суттєво прискорити темп уроку, успішно просуватись навчальною темою та втягнути в навчальний процес увесь клас. Будь-який учень, і з високими навчальними можливостями, і учні, які традиційно вважалися «слабкими», з появою інтерактивної дошки почали виявляти неабияку активність на уроках. А відповіді учнів у класі перед електронною інтерактивною дошкою дозволяють учителю налагодити стійкий зворотний зв'язок. Вони самі часто-густо напрошуються на відповідь і перевірку знань, щоб зайвий раз попрацювати з дошкою.
Завдяки поєднанню комп’ютера і інтерактивної дошки, ми отримуємо унікальну можливість об’єднати переваги комп’ютера з традиційними формами навчання. Таким чином, інтерактивна дошка навіть при використанні тільки найпростішого встановленого програмного забезпечення дозволяє підготувати та провести уроки на якісно новому рівні.
Для прикладу приводжу розробку уроку хімії у 7 класі з використанням мультимедійної дошки.
Тема уроку: Схема хімічної реакції. Хімічні рівняння.
Цілі уроку:
- Поглибити і розширити знання учнів про хімічні реакції, сформувати поняття про хімічне рівняння як про умовний запис хімічної реакції, вдосконалити вміння і навички складання рівнянь хімічних реакцій, добір коефіцієнтів, згідно закону збереження маси речовин, читанні хімічних рівнянь.
- Розвивати в учнів логічне мислення.
- розвивальні: формувати системність мислення, розвивати вміння пра-цювати з підручником та дидактичним матеріалом;
- виховні: виховувати дисциплінованість, уважність; здійснювати міжпредметні (математика) та внутрішньопредметні (закон збереження маси речовини) зв'язки.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва,
мультимедійна дошка, проектор,моделі атомів для складання молекул.
Базові поняття та терміни: атом, молекула, речовина, хімічна реакція, закон збереження маси, рівняння хімічних реакцій.
Метод уроку Інформаційно – розвиваючий.
Тип уроку Урок засвоєння нових знань і умінь.
Хід уроку
І. Організаційний момент.
ІІ. Перевірка домашнього завдання, актуалізація і корекція опорних знань.
1. Ким і коли було відкрито закон збереження маси речовин?
2. Сформулюй закон збереження маси речовин і його значення для розвитку хімії?
Для розвитку пізнавальної активності учнів на уроці хімії використовую гру.
Конкурс – гра № 1«Знайди хімічних родичів»
 Мета: перевірити знання учнів з класифікації речовин і хімічних елементів.
Мета: перевірити знання учнів з класифікації речовин і хімічних елементів.
Пропонується перелік хімічних елементів і речовин:
Na, H2, O2, CH4, KCl, H2O, S, N2, Ca, P.
Визначте серед них: а) метали; б) неметали; в) прості речовини; г) складні речовини.
Гра № 2«Третій зайвий»
Серед кожної трійки речовин знайти речовину, яка відрізняється від інших:
а) Na, S, K
б) N2, H2O, H2
в) Na2O, NaOH, O2
г) Ba, O, H.
Визначте серед них: а) метали; б) неметали; в) прості речовини; г) складні речовини.
Гра «Дешифрувальник»
Що означають записи в картках? Охарактеризувати якісний та кількісний склад речовин.
На картках формули 4-х речовин: CO2, HPO3, 3K2SiO3, 2FeCl2.
Конкурс № 3«Реставрація»
 Необхідно реставрувати формули, написані на дошці:
Необхідно реставрувати формули, написані на дошці:
Al2O?, K?O, ZnO2, Ca2Cl, Ca1O, SO?, HCl1, Al1Cl3.
Знайдіть помилки в хімічних формулах, розставте правильно індекси, використовуючи знання про валентності.
Молодці! Чудово впоралися із завданнями. Початок гарний. А тепер переходимо до вивчення нового матеріалу.
ІІІ. Повідомлення теми, мети уроку, мотивація навчальної діяльності.
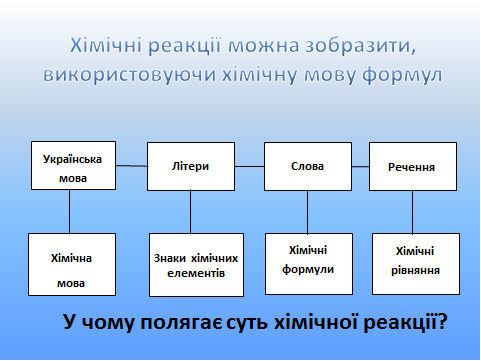
Раніше, описуючи хімічну реакцію, ми звертали увагу на якісну сторону цього процесу, тобто на те, у що перетворюються речовини. Але не менш важливою є кількісна характеристика хімічної реакції.
Хімічні елементи позначають хімічними символами, склад речовин записують за допомогою хімічних формул, хімічні реакції виражають за допомогою хімічних рівнянь, тобто так само, як з букв складаються слова, із слів — речення.
Питання. У чому полягає суть хімічної реакції?
Під час хімічних реакцій молекули вихідних речовин руйнуються до атомів. Молекули нових речовин утворюються з тих же атомів, з яких складалися молекули вихідних речовин. Оскільки кожен атом має певну масу й атоми під час хімічних реакцій зберігаються, то загальні маси речовин до і після реакції теж будуть однаковими.
Для того щоб вміти користуватися хімічною мовою, тобто, мовою формул, необхідно навчитися складати хімічні рівняння.
А тепер відкрийте будь-ласка зошити і запишіть число й тему уроку: «Рівняння хімічних реакцій». Учні формулюють мету уроку, яка записується на дошці. (Ми повинні навчитися записувати ті процеси, які відбуваються в результаті хімічних реакцій)
VI. Вивчення нового матеріалу
- Сутність хімічної реакції та її схема.
Розповідь учителя
Перша вправа
Складемо, наприклад, рівняння реакції утворення води Н2О – основна речовина життя. Вода складається з атомів Оксигену та Гідрогену.
Отже, для її добування необхідні прості речовини, одна з яких складається з атомів Оксигену (кисень О2), а друга — з атомів Гідрогену (водень Н2).
- За допомогою моделей молекул кисню і водню сконструюйте модель молекули води, тобто змоделюйте хімічну реакцію кисню з воднем, в якій утворюється вода.
Скільки атомів і молекул нам знадобилося, щоб зібрати молекулу води? (одна молекула водню і один атом Оксигену).
 Залишилися у нас «зайві» атоми? (один атом Оксигену).
Залишилися у нас «зайві» атоми? (один атом Оксигену).
Але за законом збереження маси речовин,зайвих атомів бути не може, його теж необхідно використати,як? (можна зібрати ще одну молекулу води).
Що нам для цього потрібно? (ще два атома Гідрогену або одна молекула водню) (учні збирають ще одну модель молекули води).
Тепер змоделюємо цей же процес на дошці.
А тепер цей процес потрібно грамотно написати за допомогою хімічного рівняння.
Як і в математичних рівняннях, у рівняннях хімічних реакцій є ліва частина (де записуються формули вихідних речовин) і права частина, де записуються формули продуктів реакції).Між ними пишемо стрілку.
 Н2 + O2 →Н2О
Н2 + O2 →Н2О
- Словничок:
Речовини, що вступають у реакцію, називаються реагентами.
Речовини, що утворюються в результаті реакції, називаються продуктами реакції.
- Запам’ятай:
Для простих речовин немолекулярної будови кількість атомів у молекулі не вказують.
Формули простих речовин неметалів,які складаються з двох атомів:
Н2; О2; N2; F2; Cl2; Br2; I2
2. Рівняння хімічних реакцій.
Чи можна з точки зору математики назвати наш запис рівнянням?Чому?
Це ще не є рівнянням реакції - це схема реакції. Для того, щоб схема перетворилася на рівняння, необхідно зрівняти число атомів кожного елемента в лівій і правій частинах.
Число атомів зрівнюють за допомогою коефіцієнтів.
- Пригадай:
Індекси - цифри,які позначають кількість атомів.
Коефіцієнти –цифри, які вказують кількість молекул або окремо взятих атомів
Скільки молекул водню нам знадобилося? (дві).
А скільки молекул кисню? (одна).
Скільки молекул води у нас вийшло? (дві).
2 Н2 + O2 →2 Н2О
Тепер в обох частинах рівняння число атомів Гідрогену та Оксигену однакове. Щоб підкреслити, що коефіцієнти розставлені, стрілку між реагентами і продуктами в рівнянні можна замінити знаком « = ». Тепер число атомів усіх елементів однакове, отже, коефіцієнти розставлені правильно.
Перегляд фрагменту мультфільму « Хімічне рівняння» англійською мовою
Що ми називаємо хімічним рівнянням?
Хімічним рівнянням називають умовний запис хімічної реакції за допомогою хімічних формул речовин і коефіцієнтів перед ними.
(запис у зошит)
Фізкультхвилинка: «Хімічне моделювання» - перегрупування атомів.
Уявіть, що ви атоми, які рухаючись під музику плавають у повітряному океані. Під мою команду створіть образ речовин, які входять до складу повітря, ставши в середину кола.
Створіть молекулу: кисню, азоту, вуглекислого газу, водню, води .
Друга вправа.Перегляд відеофрагменту «Горіння магнію»

Моделювання на дошці.Запис схеми.Запис рівняння.
- Запам’ятай:
1. Коефіцієнт велика цифра, яка ставиться перед формулою речовини.
2. Коефіцієнт належить всім хімічним елементам, які утворюють речовину.
3. Не можна ставити коефіцієнт всередину формули відповідної речовини.
4. Під час підбору коефіцієнтів перевіряють кількість атомів кожного елемента.
5. Коефіцієнт 1, як і індекс 1, не записується.
6. Оксиген завжди зрівнюють останнім.
7. Якщо кількість атомів елементів у лівій частині відповідає кількості атомів елементів у правій частині заміни знак → у схемі рівняння на знак =.
Пам’ятка на столах,вклеїти у зошит
VII. Узагальнення та закріплення знань учнів
Робота біля дошки
Написати рівняння реакцій і розставити коефіцієнти.
1. Сa+ О2 → СaО
2. АgВг →Аg+ Вг2
3. Al + S → Al2S3;
4. Mg + O2 → MgO;
5. Fe + O2 → Fe3O4;
6. Hg + O2 →HgO
7. Cr + Cl2 → CrCl3
Картка2.Склади схеми хімічних реакцій за участю двох простих речовин, в результаті яких утворилося одна складна речовина, формула якої:
NaH; СН4; Р2О5.

VIII. Підбиття підсумків уроку.
IX. Рефлексія
- Де в майбутньому ви зможете використовувати набуті знання і вміння?
- (На столі вчителя стоять три великих скляних склянки).
- Діти, у вас у всіх є кольорові кульки. Якщо вам сподобалося на уроці, то киньте в перший стакан зелену кульку, якщо не дуже, то киньте в другий стакан жовту кульку, ну а якщо зовсім не сподобалося, то киньте в третій стакан червону кульку.
Ви добре справились з поставленими задачами. Хімія вам дуже вдячна.
X. Домашнє завдання
1. Опрацювати § 16 підручника.
2. Виконати завдання 140 (усно), № 141, 143 (письмово) на с.125


про публікацію авторської розробки
Додати розробку
