Хімічні властивості насичених одноосновних карбонових кислот. Реакція естерифікації.
Тема. Хімічні властивості насичених одноосновних карбонових кислот. Реакція естерифікації.
Ціль загальноосвітня: ознайомити учнів із хімічними властивостями насичених карбонових кислот на прикладі оцтової кислоти та інших кислот;
Ціль розвиваюча: розвивати навички складати рівняння реакцій , що характеризують хімічні властивості насичених одноосновних карбонових кислот, доводити дослідним шляхом їхні кислотні властивості; порівняти хімічні властивості мінеральних та карбонових кислот (знайти спільні та відмінні риси); навчити учнів виявляти органічні кислоти у продуктах харчування.
Ціль виховна: виховувати почуття взаємодопомоги, інтерес до предмета.
Обладнання та реактиви: пробірки, хімічна склянка, скляні палички – 5 шт, універсальний індикаторний папір, сік лимона та яблука, квашеної капусти, молоко, сметана.
Для демонстрації: пробірки, хлоридна кислота, оцтова кислота, магній, розчини індикаторів метилоранж та фенолфталеїн, крейда, кальцій оксид, натрій гідроксид.
Тип уроку: урок-дослідження.
Хід уроку
І. Організаційний момент
Щоб наш урок був результативним, давайте налаштуємось на успіх.
Будьте уважними.
Активно пізнавайте і аналізуйте почуте на уроці.
Самостійно встановлюйте зв’язки відомого і невідомого.
Учіться досліджувати і відчувати радість відкриття, досягати мети.
Реалізуйте свої знання у повсякденному житті.
Епіграфом нашого уроку будуть слова Йогана Гете «Справжній учень той, який вчиться відкривати невідоме за допомогою відомого, цим самим він наближається до свого вчителя.»
ІІ. Перевірка виконання домашнього завдання
Розпочнемо із перевірки домашнього завдання, який ми проведемо у вигляді гри.
Гра «Що зайве».
Серед запропонованих органічних сполук знайти зайвий, який не належить до даного гомологічного ряду, назвати речовини.
Алкани Спирти Карбонові кислоти
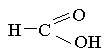
С2Н6 С3Н8
С4Н8 СН3ОН С2Н6
СН3СООН С4Н9ОН С15Н31 СООН
С2Н2 С2Н5ОН С17Н35 СООН
«Чарівний куб» (вчитель кидає куб з 6 гранями на вибір , дає 6 питань на дошці, яка грань випадає, такий номер запитання відповідає учень)
Питання на дошці:
- Яку кислоту використовують для консервування та маринування? (Оцтову кислоту)
- Яку кислоту містять молочнокислі продукти? (Молочну кислоту)
- Про утворення якої кислоти свідчать прогірклий смак і специфічний запах масла? (Масляної кислоти)
- Як по-іншому називається метанова кислота? (Мурашина кислота)
- Чому болять ікри ніг після тривалого бігу? (У м’язах утворюється молочна кислота)
- Яка кислота міститься в бурштині? (Бурштинова кислота)
ІІІ. Мотивація навчальної діяльності
Пропоную наш урок провести в незвичній формі: урок-дослідження. Уявимо, що наша школа – це науково – дослідницький інститут хімії, а наш кабінет– це лабораторія, яка працює під девізом:
« Зробимо усе, що можемо, застосуємо те, що знаємо, знаходячись там, де ми є».
Щоб розпочати роботу лабораторії давайте ознайомимося з правилами поведінки.
Бути:
- Позитивними: ТУТ І ЗАРАЗ.
- Точними. Точність – увічливість королів.
- Толерантними. Толерантність – це повага, у першу чергу, до самого себе.
- Зібраними, оскільки найдорогоцінніше, що є в нас, - це час.
А також треба мати наукову тему та об’єкт дослідження.
Кожен з вас повинен включатися у роботу при вивченні нового матеріалу і усі записи занотовувати у своїх журналах лабораторних досліджень, які знаходяться у вас на столах.
Проблемне питання, яке повстало перед інститутом хімії.
- Як ви вважаєте, чи існує різка відмінність між хімічними властивостями мінеральних та карбонових кислот?
До закінчення уроку нам потрібно знайти вирішення даної проблеми. Давайте порівняємо хімічні властивості мінеральних та карбонових кислот на прикладі хлоридної та оцтової кислоти. На основі вивченого матеріалу ми зробимо узагальнення.
Отже, тема нашого уроку «Хімічні властивості насичених одноосновних карбонових кислот. Реакція естерифікації»
Давайте разом окреслимо основні завдання уроку.
- Дослідити хімічні властивості насичених одноосновних карбонових кислот.
- Навчитися виявляти органічні кислоти у продуктах харчування.
- Порівняти хімічні властивості мінеральних та органічних карбонових кислот: знайти спільні властивості та специфічні, характерні тільки для карбонових кислот.
- Дізнатися про специфічні хімічні властивості карбонових кислот.
V. Актуалізація опорних знань
Мозковий штурм
Щоб розв’язати дану проблему, давайте пригадаємо.
- Які сполуки називаються мінеральні кислоти?
- Наведіть приклади відомих вам кислот, які ми використовуємо у побуті.
- За допомогою яких сполук можна виявити мінеральні кислоти?
- Які хімічні властивості характерні для мінеральних кислот?
- Які сполуки називаються насичені одноосновні карбонові кислоти?
- Яка функціональна група міститься у карбонових кислотах?
VІ. Вивчення нового матеріалу
Вправа «Кошик»
Сьогодні ми продовжуємо вивчення речовин, яких можна назвати «Знайомі незнайомці» Для цього перед вами кошик у якому набір продуктів: лимон, мандарин, кефір, яблуко, апельсин.
- Як ви думаєте, що об'єднує ось ці смачні продукти?
Правильно, в них є кислоти - фруктові з класу органічних карбонових кислот.
- А які асоціації виникають у вас при згадуванні слова «кислота»? ( «кислі», «їдкі», «рідкі», «небезпечні», «неїстівні».)
З кислотами людині приходиться стикатися все життя. Багато кислот містить наша їжа. Фрукти, овочі, молочні продукти, ліки містять цілий букет кислот: яблучну, щавлеву, лимонну, молочну, оцтову та інші.
- Чи можна виявити лимонну, молочну, яблучну кислоти у розчині або у продуктах харчування? Яким способом?
Проведемо лабораторний дослід № 1 та спробуємо виявити органічні кислоти у харчових продуктах. Але вивчення хімії неможливе без дотримання правил техніки безпеки, тому перед початком роботи пригадаємо правила, які слід дотримуватись при роботі.
ІНСТРУКТАЖ З БЖД
Учні називають правила техніки безпеки під час роботи з кислотами.
Свої спостереження та висновки занотовуємо у своїх журналах лабораторних досліджень.
Лабораторний дослід № 1
Тема. Виявлення органічних кислот у харчових продуктах
Мета. Навчитися визначати органічні кислоти у продуктах харчування.
Хід роботи
У чотири пробірки налийте по черзі сік лимона та сік яблука, сік квашеної капусти, молоко. У порцелянову чашку покладіть чайну ложку сметани. На універсальний індикаторний папір скляною паличкою нанесіть по черзі краплю соку лимона, яблучного соку, сік квашеної капусти, молоко та сметану. Запишіть спостереження у таблицю. Кожного разу використовуйте чисті та сухі скляні палички.
|
Індикатор |
Забарвлення індикатора у нейтральному середовищі |
Забарвлення індикатора у продуктах харчування |
||||
|
сік лимона |
сік яблука |
сік квашеної капусти |
молоко |
сметана |
||
|
універсальний індикаторний папір |
|
|
|
|
|
|
|
рН розчину |
|
|
|
|
|
|
- Чи усі досліджувані продукти містили органічні кислоти?
Висновок: У свіжому молоці колір індикатора не зміниться (нейтральне середовище), у кислому – зміниться, завдяки наявній молочній кислоті (кисле середовище).
1. Електролітична дисоціація (Вплив кислот на індикатори).
Ми пригадали, що кислоти можна виявити за допомогою речовин-визначників або індикаторів.
- Які ще індикатори можна використовувати для визначення кислот? ( метилоранж або лакмус).
- Чому індикатор фенофталеїн не використовують? ( бо він не змінює свого кольору)
- Поміркуйте, чи можна виявити органічні кислоти, використовуючи індикатори? (відповіді учнів).
Давайте перевіримо за допомогою експериментальних досліджень.
Демонстрація 1. «Дія кислот на індикатора».
У дві пробірки наливаю 1 мл розчину хлоридної та оцтової кислоти й додаю декілька крапель індикатору метилового оранжевого.
- Якого кольору став розчин хлоридної та оцтової кислоти. Про що це свідчить?
- Які частинки завжди утворюються при дисоціації мінеральних чи органічних кислот?(катіон Гідрогену та аніон кислотного залишку)
Оцтова кислота є слабкою кислотою, тому змінює забарвлення індикатора частково.
СН3СООН ↔ СН3СОО- + Н+
На основі проведених експериментальних досліджень робимо висновок: колір індикатора у розчинах кислот однаковий, тому що зумовлений наявністю однакових частинок у розчині – катіонів Гідрогену, а різна інтенсивність кольору пояснюється неоднаковою кількістю частинок, що утворюються під час дисоціації. Оцтова кислота – слабкий електроліт – інтенсивність забарвлення індикатора слабка. Поява карбоксильної групи привела до появи властивостей слабкого електроліту.
Ви пригадали, що мінеральні кислоти взаємодіють з металами, основними оксидами, основами та солями.
Давайте перевіримо експериментальним шляхом чи взаємодіятиме оцтова кислота з цими ж речовинами.
2. Взаємодія з активними металами (до водню).
Демонстрація 2. У дві пробірки наливаю розчини оцтової і хлоридної кислот. В обидві пробірки додаю магнієвий порошок. Порівняємо швидкість взаємодії цих кислот з магнієм та продукти реакції.
2СН3СООН + Mg → (СН3СОО)2Mg + H2
- До якого типу належить дана реакція? (замащення)
Висновок: швидше з магнієм реагує хлоридна кислота, тому що вона сильніший електроліт. Під час проведених реакцій утворюються аналогічні продукти реакції: виділяється водень та утворюється сіль.
3. Взаємодія з основними та амфотерними оксидами.
Демонстрація 3. У пробірку наливаю розчини хлоридної та оцтової кислот. Додаю трохи порошку купрум(ІІ) оксиду. Порівнюємо швидкість взаємодії цих кислот з купрум(ІІ) оксидом та продукти реакції.
- До якого типу хімічних реакцій віднесемо такі реакції? (реакції обміну)
- Чи завжди проходять до кінця реакції обміну? ( Якщо утворюється вода, випадає осад, виділяється газ)
Висновок: швидше з купрум(ІІ) оксидом реагує хлоридна кислота, тому що вона сильніший електроліт. Слід зазначити, під час проведених реакцій утворюються аналогічні продукти реакції: виділяється вода та утворюється сіль.
2СН3СООН + CиO → (СН3СОО)2Cи + H2O
4. Взаємодія з лугами та амфотерними гідроксидами.
Демонстрація 4. У пробірку наливаю розчин лугу NaOH й додаю декілька крапель фенолфталеїну. Розділяю на дві пробірки, по краплях додаю розчин хлоридної та оцтової кислоти до кожної пробірки до знебарвлення розчину. Порівнюємо швидкість взаємодії цих кислот з лугом та продукти реакції.
- Як називають реакцію взаємодію кислоти з основами? (нейтралізація)
СН3СООН + NaOH → СН3СООNa + H2O
Висновок: Слід зазначити, під час проведених реакцій нейтралізації утворюються аналогічні продукти реакції: виділяється вода та утворюється сіль.
5. Взаємодія з солями слабких кислот.
Демонстрація 5. У пробірки додаю шматочки крейди, доливаю розчини хлоридної та оцтової кислоти.
2СН3СООН + СaСO3 → (СН3СОО)2Сa + H2O + СО2
Висновок: Слід зазначити, під час проведених реакцій утворюються аналогічні продукти реакції: виділяється вуглекислий газ, вода та утворюється сіль.
На відміну від оцтової кислоти, хлоридна кислота реагує із більшою кількістю солей за умови утворення осаду.
- На вашу думку, чи можливі якісь специфічні хімічні властивості для карбонових кислот? (Так)
- Якою функціональною групою вони повинні бути зумовлені? (СООН)
6.Специфічні реакції
- Реакції відновлення
Карбоновим кислотам властиві реакції, які не характерні для мінеральних кислот.
Так, вони взаємодіють з воднем при нагріванні в присутності каталізаторів, утворюючи спирти:
СН3COOH (оцтова кислота) + 2Н2 → CH3CН2OН (етанол) + Н2О
- Горіння.
Як і більшість органічних сполук, карбонові кислоти дуже добре горять, причому чим більший вуглеводневий радикал, тим більша ймовірність протікання реакції горіння з виділенням сажі (вільного вуглецю):
СН3СООН + 2О2 → 2H2O + 2СО2
СІ7Н35СООН + 8О2 → 18H2O + 17С
- Реакції естерифікації
Якщо до оцтової кислоти додати етиловий спирт й трохи сульфатної кислоти, то при нагріванні з’являється приємний запах оцтово–етилового естеру.
Карбонові кислоти завдяки наявності карбоксильної групи здатні взаємодіяти зі спиртами. Під час їх взаємодії гідроксильна група відривається із легкістю, а на її місце стає залишок спирту. Так відбувається реакція етерифікації.
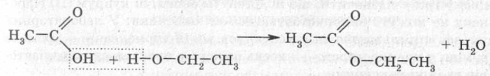
етилетаноат (етиловий естер оцтової кислоти)
Реакція етерифікації – реакція між карбоновою кислотою та спиртом з утворенням естеру та води.
Висновок: реакція етерифікації характерна тільки для карбонових кислот завдяки наявності карбоксильної групи.
Повертаємось до проблемного питання, яке було поставлено на початку уроку:
- Як ви вважаєте. Чи існує різка відмінність між хімічними властивостями мінеральних та карбонових кислот? (відповідь учнів)
|
Хімічні властивості |
|
|
Спільні властивості |
Специфічні властивості |
|
|
Підсумок: карбонові кислоти виявляють спільні хімічні властивості з неорганічними кислотами: дисоціація, взаємодія з металами, основними оксидами, лугами, солями летких кислот, а також мають специфічні властивості, характерні для органічних кислот.
VІІ. Підведення підсумків уроку.
Вправа «Головоломка»
Допоможіть відтворити можливі рівняння реакцій:
А) С3Н7СООН + …→ (С3Н7СОО)2Zn + …
Б) … + Ва(ОН)2 → (С2Н5СОО)2Ва + …
Інтерактивна справа «Слідство ведуть хіміки»
З якими з перелічених речовин буде реагувати оцтова кислота? Запишіть рівняння реакцій:
Ca , Cu, CH3OH, Na2CO3, Na2SO4
Тестовий контроль (виконується письмово за варіантами)
|
1.Вкажіть функціональну групу карбонових кислот: А) –СОН Б) –СООН В) –ОН Г) –NН2 2. Вкажіть загальну формулу насичених одноосновних карбонових кислот: А) СnН2n-1ОН Б) СnН2n+1ОН В) СnН2nО Г) СnН2nО2
3. Вкажіть метал, який заміщує Гідроген у карбоксильній групі кислот 4.Вкажіть речовину, яку можна використовувати для виявлення етанової кислоти: А) CuO Б) CuSO4 В) лакмус Г) Cu(ОН)2 5. Вкажіть формулу стеаринової кислоти: А) C2H5COOH Б) C17H35COOH В) C15H31COOH Г) C3H7COH 6. Вкажіть, з якою речовиною етанова кислота вступає в реакцію етерифікації: А) C2H5COH Б) CH3OH В) C4H9COOH Г) C3H8 7.Вкажіть формулу оцтової кислоти: А) C2H5OH Б) CH3OH В) CH3COOH Г) C3H7OH 8. Вкажіть речовину, яка реагує і з етиловим спиртом, і з оцтовою кислотою: А) Nа2CО3 Б) Nа В) NаCl Г) NаОН 9. Вкажіть, як називається реакція між спиртами і карбоновими кислотами: А) нейтралізації Б) обміну В) заміщення Г) естерифікації 10. Агрегатний стан вищих карбонових кислот: А) рідини Б) гази В) тверді речовини Г) не має різниці 11. Укажіть сполуки, які при взаємодії зі спиртами утворюють естери: А) альдегіди; Б) карбонові кислоти; В) багатоатомні спирти; Г) вуглеводи. 12. Укажіть колір індикатора лакмусу в розчині етанової кислоти: А) рожевий; Б) синій; В) прозорий; Г) червоний. |
1. Вкажіть речовину, яку можна використовувати для виявлення етанової кислоти: А) CuO Б) CuSO4 В) лакмус Г) Cu(ОН)2 2. Вкажіть, з якою речовиною етанова кислота вступає в реакцію етерифікації: А) C2H5COH Б) CH3OH В) C4H9COOH Г) C3H8 3. Вкажіть речовину, яка реагує і з етиловим спиртом, і з оцтовою кислотою: А) Nа2CО3 Б) Nа В) NаCl Г) NаОН 4. Вкажіть функціональну групу карбонових кислот: А) –СОН Б) –СООН В) –ОН Г) –NН2 5. Вкажіть формулу стеаринової кислоти А) C2H5COOH Б) C17H35COOH В) C15H31COOH Г) C3H7COH 6. Вкажіть загальну формулу насичених одноосновних карбонових кислот: А) СnН2n-1ОН Б) СnН2n+1ОН В) СnН2nО Г) СnН2nО2 7. Вкажіть, як називається реакція між спиртами і карбоновими кислотами А) нейтралізації Б) обміну В) заміщення Г) естерифікації
8. Вкажіть метал, який заміщує Гідроген у карбоксильній групі кислот 9. Вкажіть формулу оцтової кислоти: А) C2H5OH Б) CH3OH В) CH3COOH Г) C3H7OH 10. Укажіть сполуки, які при взаємодії зі спиртами утворюють естери: А) альдегіди; Б) карбонові кислоти; В) багатоатомні спирти; Г) вуглеводи. 11. Агрегатний стан вищих карбонових кислот: А) рідини Б) гази В) тверді речовини Г) не має різниці 12. Укажіть колір індикатора лакмусу в розчині етанової кислоти: А) рожевий; Б) синій; В) прозорий; Г) червоний. |
Після закінчення тестування застосувати метод взаємоперевірки.
Метод «Взаємоперевірка»
|
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
|
І-В |
Б |
Г |
В |
В |
Б |
Б |
В |
Б |
Г |
В |
Б |
Г |
|
ІІ-В |
В |
Б |
Б |
Б |
Б |
Г |
Г |
В |
В |
Б |
В |
Г |
Прийом «М'яке опитування»
1. Як називається функціональна група органічних кислот?
2. Як називаються органічні кислоти, що містять карбоксильну групу?
3. Який агрегатний стан оцтової кислоти? А який у вищих карбонових кислот, що містять 15 і більше атомів Карбону?
4. Чому в разі дії натрієм на оцтову кислоту виділяється газ? Який?
5. Який газ виділяється під час дії оцтової кислоти на соду?
Метод «Дивуй»
Звернемось до стародавньої легенди, яка стверджує, як цариця Клеопатра виграла оригінальне парі, з’ївши „сніданок”, який коштував 100 000 систерцій. Ось як це описано в повісті Г. Хаггарда „Клеопатра – володарка зорі”: „...Вона вийняла з вуха одну з величезних перлин...і... опустила її в оцет. Запала мовчанка, вражені гості, завмерши, спостерігали, як незрівнянна перлина повільно розчиняється в міцному оцті. От від неї не залишилось і сліду, і тоді Клеопатра підняла кубок, покрутила його, і випила весь до останньої краплі.”
На сьогоднішній день у науковців є припущення, що це був справжній історичний факт.
Музеї оцту у світі
У світі є різні музеї: музеї історії, музеї архітектури, музеї, присвячені видатним особистостям, певним подіям… Але чи знаєте ви, що є музеї, присвячені одній речовині. Наприклад, в Києві діє відомий музей води.
У деяких країнах існують музеї, присвячені винятково оцту. Наприклад, в 2001 році був відкритий перший у Китаї Музей оцту на березі гарного озера в провінції Шаньси. За зовнішнім виглядом музей схожий на вежу (9 поверхів), що піднімається на великій площі. У ньому експонуються матеріали про історію розвитку оцту й більше 200 оригінальних речей для виготовлення, зберігання й транспортування оцту. У провінції Шаньси, що називають «столицею оцту», існує особлива культура пиття оцту і його приготування.
Є подібний музей оцту й у Південній Дакоті (США). Там є що подивитися для тих, хто цікавиться оцтом. Музей заснував стипендію для студентів, що спеціалізуються на дослідженнях оцту.
Вправа «Цікаве запитання»
А) Як обчистити яйце, не розбиваючи його?
(Опустити його в розчин оцтової кислоти)
Б) Як відчистити накип на посуді, якщо бракує грошей на спеціальний засіб?
(Налити в чайник чи каструлю розчин оцтової кислоти)
VIІІ. Рефлексія
Вправа "Мікрофон" - "Сьогодні на уроці я…"
Сьогодні я дізнався… Було цікаво… Мене здивувало…
Якщо вважати, що повне засвоєння навчального матеріалу уроку відповідає дистанції А ______________________________В, то покажіть точкою ваше місцезнаходження.
VIІ. Домашнє завдання
Опрацювати §17 ст. 99-101. Завдання: записати рівняння реакцій взаємодії оцтової кислоти з металами, основними оксидами, основами, солями.
Творче завдання. «Рецепти консервування овочів, де використовується оцет».


про публікацію авторської розробки
Додати розробку
