Хімічні властивості основ.
Про матеріал
Мета уроку:
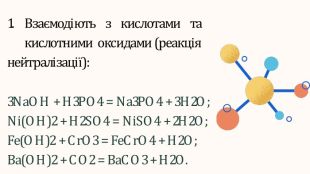
- сформувати знання про хімічні властивості основ;
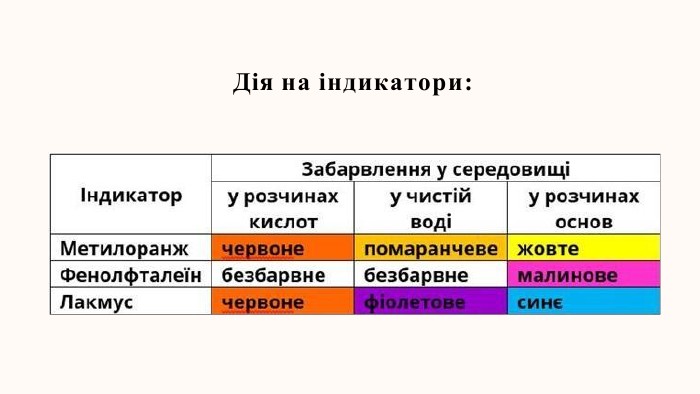
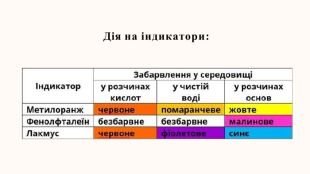
- навчитись виявляти зв’язки між будовою та властивстями лугів, розширити знання учнів про виявлення кислот та основ за допомогою індикаторів.
- продовжувати розвивати вміння складати рівняння реакцій;
- удосконалювати експериментальні навички;
- розвивати логічне мислення, уміння аналізувати та порівнювати.
Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку