Презентація. "Солі. Хімічні і фізичні властивості солей"


















Мета уроку: Формування ключових компетентностей:- саморозвитку й самоосвіти – створення проблемних ситуацій, уміннязнаходити нові рішення;- інформаційної – вміння обирати головне, розуміння та усвідомленняотриманої інформації, вміння робити висновки та узагальнення. Формування предметних компетентностей: закріпити знання про номенклатуру солей, повторити формули солей; розширити уявлення учнів про солі, сформувати знання про класифікацію ї фізичні властивості солей, ознайомити з поширенням солей у природі та їх застосуванням; розвивати хімічну мову; виховувати інтерес до вивчення хімії.
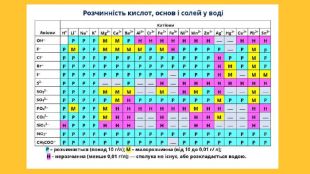
Тип уроку: І Організаційний етап. Привітання, перевірка присутності учнів та їхньої готовності до урокуІІ Перевірка домашнього завданняІІІ Актуалізація опорних знаньІV Мотивація навчальної діяльностіV Повідомлення теми і цілей уроку. VI Вивчення нового матеріалу. VІI Узагальнення та систематизація знань. VIII Домашнє завдання. IX Підбиття підсумків уроку. Періодична система хімічних елементів Д.І. Менделєєва, таблиця розчинності кислот, основ і солей у воді, ряд активності металів, відео-зразки речовин: сіль кальцій карбонат, розчини НСl, Na2 S04, Ва. Сl2 мультимедійна презентація. Обладнання:засвоєння нових знаньплан уроку:
основні терміни та поняття: Міжпредметний зв’язок: біологія, інформатика, основи здоров’я..солі, йонні сполуки, катіони металічних елементів та аніони кислотних залишків. I. Організаційний етап. Налаштування учнів на роботу. II. Актуалізація опорних знань учнів.. Що таке сіль?На першому місті в солях записуються.., а потім … ?Як даються назви солям, утвореним металічним елементом зі сталою валентністю? Як даються назви солям, утвореним металічним елементом зі змінною валентністю?Як класифікують солі за розчинністю? Де ми можемо знайти інформацію про розчинність солей? Які фізичні властивості притаманні солям?
Завдання. Допишіть рівняння реакцій, назвіть тип реакцій:/ варіант II варіанта) Zn (OH)2 + H2 S04 → а) Аl (ОН)3 + Н3 Р04 →б) КОН + H2 S03 → б) Cu(OH)2+HBr →в) Fe. O + HCl → в) Zn. O + H2 SO4 →г) А1203 + H2 S04 → г) Fe203 + HCl →д) Ca(OH)2+S02 → д)КОН + N205 → Дайте назви солям за їх молекулярними формулами: І-ВАРІАНТ ІІ-ВАРІАНТNa3 PO4, Ba. SO4, Cu3(PO4)2, Fe. Cl2, Fe(NO3)3, Sn. Br2, Mg. CO3, K2 SO3 Ca. CO3, Ag. NO3, Cr. Cl3, Cu2 S
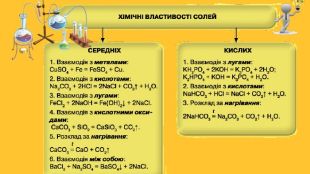
ІV Мотивація навчальної діяльностіЗапитання:1. Які властивості виявляють солі?2. З якими речовинами взаємодіють солі?3. Які умови перебігу хімічних реакцій за участю солей? Що ж таке солі? Солі — це складні речовини, що найбільш поширені в природі. У великій кількості містяться в морських та океанічних, мінеральних і ґрунтових водах, ґрунтах, гірських породах і мінералах. Солі є в живих організмах, зокрема в клітинному соку рослин і тварин. В організмі людини — у складі макро- й мікроелементів стимулюють нервову та м'язову тканини, наявні в крові, сльозах і поті. Найпоширенішими в природі є такі групи солей та їхні мінерали: хлориди, карбонати, силікати, сульфати, нітрати й ортофосфати. Усі вони набули широкого застосування в різних галузях промисловості та сільського господарства України. Хлориди — солі хлоридної кислоти. У природі вони є в складі мінералів сильвініту і галіту містить зрощені кристали натрій та калій хлоридів Na. Cl · KCl. З хлоридів найчастіше застосовують натрій хлорид передусім як харчовий продукт. Його використовують для підсолювання їжі, консервування овочів і фруктів.
Солі — сполуки, до складу яких входять катіони металічних елементів та аніони кислотних залишків. Першій формулі відповідають солі, що містять йони кислотних залишків безоксигенових кислот, а другій — солі, аніони яких походять від оксигеновмісних кислот. Приклади формул солей: LіF, Са. S, NNO3, Аl2(S04)3. Графічні формули для солей, як і для інших йонних сполук, не використовують. Кожна сіль має хімічну назву, а деякі солі — ще й тривіальні назви (табл. ). Хімічна назва солі складається із двох слів. Перше слово є назвою металічного елемента, а друге походить від хімічної назви відповідної кислоти. Якщо металічний елемент утворює катіони з різними зарядами, то значення заряду катіона солі вказують після назви елемента римською цифрою в дужках. За відмінками змінюється лише друге слово хімічної назви солі
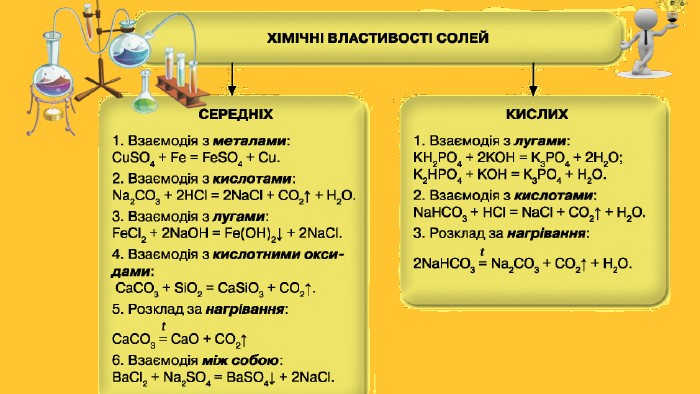
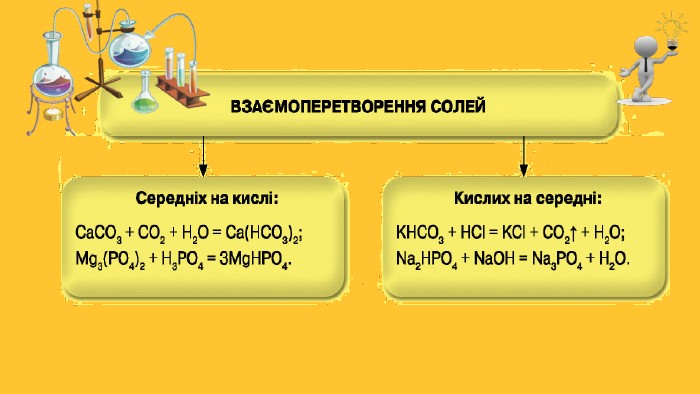
Типи солей. Середні солі. До солей цього типу належать сполуки із формулами Na. Cl, NH4 F, Al2 S3, Na2 CO3, Ca3(PO4)2та багато інших. Загальні формули середніх солей — Мn. Еm, Мn(ЕОm)р. Кислі солі. Продукт неповного заміщення атомів Гідрогену в молекулі багатоосновної кислоти на атоми (йони) металічного елемента або йони амонію. Приклади формул кислих солей: Na. HCO3, NH4 HS, КН2 РО4, К2 НРО4. Кожна сполука містить аніони гідрогеновмісного кислотного залишку. Основні солі. Утворюються при гідролізі деяких середніх солей. Вони походять від основ або амфотерних гідроксидів М(ОН)n (n ≥ 2): Mg(OH)Cl, Al(OH)SO4, Al(OH)2 NO3
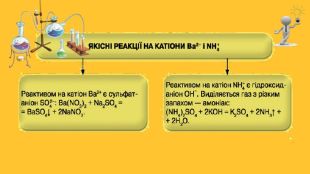
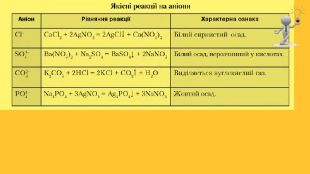
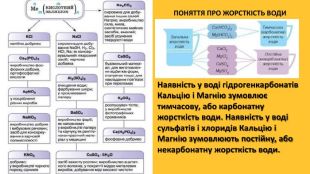
Властивості солей. Багато солей розчиняється у воді. При випарюванні їх розчинів часто виділяються кристалогідрати; їхній колір зумовлений кольором гідратованих катіон. Нерозчинними є аргентум хлорид, барій сульфат, більшість карбонатів, ортофосфатів, сульфідів тощо. Таку властивість солей використовують для виявлення відповідних йонів у водних розчинах, тобто при проведенні якісних реакцій . Розчинність у воді сульфатів Аргентуму, Плюмбуму, Кальцію, деяких інших солей досить мала. Кислі солі, як правило, розчиняються краще за середні. Активні метали реагують у розплавах із деякими солями (хлоридами, фторидами). Так добувають, наприклад, уран.
ПОШИРЕННЯ СОЛЕЙ У ПРИРОДІ, ЗАСТОСУВАННЯ Найбільше поширення у природі мають сульфати, карбонати, хлориди. Природні сульфати — це гіпс Ca. SO4 · 2 Н2 О; глауберова сіль Na2 SO4 · 10 H2 О; гірка сіль Mg. SO4 · 7 H2 О. Із наведених формул стає зрозуміло, що вони належать до кристалогідратів. Нагріванням гіпсу зменшують вміст у ньому кристалізаційної води й одержують алебастр 2 Са. SO4 · Н2 О. Саме з алебастру накладають пов'язки при переломах кісток. Глауберову сіль Na2 SO4 · 10 H2 О застосовують у виробництві скла, соди, фарб, у медицині. Гірку сіль Mg. SO4 · 7 H2 О використовують в обробці тканин, дубінні шкіри, виготовленні медичних препаратів.
Висновки. Сіль — йонна сполука, до складу якої входять катіони металічного елемента й аніони кислотного залишку. Кожна сіль має хімічну назву, а деякі солі — ще й тривіальні назви. Солі дуже поширені в природі. Склад солей відповідає загальним формулам. Солі — це електроліти, що дисоціюють з утворенням катіонів металічного елемента й аніонів кислотного залишку, наприклад: К2 СО3 = 2 К+ + СО2- 3. Серед неорганічних сполук за поширеністю у природі солі займають друге місце після оксидів.
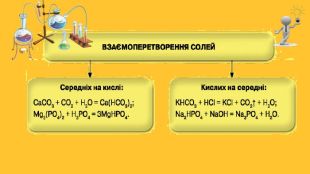
Закріплення нових знань. Чим відрізняється від середньої солі:а) кисла сіль;б) основна сіль?Чи можуть утворювати кислі солі хлоридна, сульфатна, нітратна кислота? У разі позитивної відповіді запишіть формули відповідних кислих солей Калію та Кальцію. Складіть формули кислих ортофосфатів Кальцію, основних хлоридів Хрому(ІІІ) і дайте назву кожній солі. Напишіть рівняння реакцій магній нітрату з лугом, амоній карбонатом, сульфатною кислотою. Укажіть умови, за яких відбувається кожна реакція. Наведіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення: SO3 → Mg. SO4 → K2 SO4 → Pb. SO4. Доберіть другий реагент для того, щоб добути алюміній сульфат:а) із солі Al(OH)SO4;б) із солі Al(HSO4)3.


про публікацію авторської розробки
Додати розробку