Презентація до уроку. "Кислоти"


















Мета уроку: Формування ключових компетентностей:- саморозвитку й самоосвіти – створення проблемних ситуацій, уміннязнаходити нові рішення;- інформаційної – вміння обирати головне, розуміння та усвідомленняотриманої інформації, вміння робити висновки та узагальнення. Формування предметних компетентностей: закріпити знання про номенклатуру кислот, повторити формули кислот; розширити уявлення учнів про кислоти, познайомити з історією відкриття кислот, формувати знання про класифікацію ї фізичні властивості кислот, ознайомити з поширенням кислот у природі та їх застосуванням; розвивати хімічну мову; виховувати інтерес до вивчення хімії.
Обладнання:періодична система хімічних елементів Д.І. Менделєєва, таблиця «Основні класи неорганічних сполук», таблиця розчинності. Тип уроку: І Організаційний етап. Привітання, перевірка присутності учнів та їхньої готовності до урокуІІ Перевірка домашнього завданняІІІ Актуалізація опорних знаньІV Мотивація навчальної діяльностіV Повідомлення теми і цілей уроку. VI Вивчення нового матеріалу. VІI Узагальнення та систематизація знань. VIII Домашнє завдання. IX Підбиття підсумків уроку. План урокузасвоєння нових знань
(Питання відображаються на екран. Учні по черзі задають питання один одному.)1. На які дві групи поділяються всі речовини?2. Які речовини називаються простими?3. Які речовини відносяться до складних?4. Наведіть приклади складних речовин.5. Що таке оксиди?6 На які групи поділяються оксиди?(Завдання на екрані. Розв’язання обговорюються.)1) Са, Mg. O, Na. Cl, H2 SO4 ;2) SO2 , H2 CO3 , Na2 O, Cu. O;3) K2 O, Ag2 O, CO2 , Fe. O;4) Si. O2 , Mn. O, P2 O5 , N2 O5 ;5) HCl, H2 CO3 , K2 SO4 , H3 PO4 .Інтерактивна гра «Мікрофон»Прийом «Знайди зайве»
Правила техніки безпеки при роботі з кислотами. Кислоти - їдкі речовини, тому поводитися з ними слід обережно: 1. Уважно читайте етикетки на склянках2. Речовини для дослідів беріть не більше 1 - 2 мл3. Не залишайте склянки з кислотами відкритими4. Не виливайте залишки реактивів з пробірки назад у склянку, з якої він був узятий5. Якщо випадково кислота потрапила на руки чи на одяг - негайно змийте її великою кількістю води, нейтралізуйте розчином соди і знову змийте водою6. Якщо потрібно розбавити сульфатну кислоту, пам'ятайте правило:„Спочатку вода,Потім кислота.Інакше - трапиться біда!”7. Категорично забороняється проводити досліди, не зазначенні в роботі, та самостійно зливати та змішувати реактиви
ІV Мотивація навчальної діяльності-Вивченню якої теми ми присвятили останній урок? (…)- Які класи речовин нами вже знайомі? (…)Проблемне питання:- Сьогодні ми приступаємо до вивчення наступного класу неорганічних речовин. На екрані представлені речовини з формулами і HCl і HNO3 – це представники цього численного класу. Багато з них - небезпечні речовини: серед них зустрічаються дуже їдкі і навіть отруйні. З іншого боку: одна з них потрібна для роботи шлунка, а її надлишок веде до медичних проблем - появі печії; інша - поповнює в грунті запас Нітрогену, необхідний для росту рослин, а випадаючи на землю у вигляді кислотних дощів, веде до серйозних екологічних проблем. Подібне можна сказати про багатьох представників цього класу.- Здогадалися, про який клас йде мова? (...)- Про кислотах, правильно! Кислоти беспорно впливають на життя людини і навколишнє середовище, тому завдання людини правильно використовувати цей клас речовин
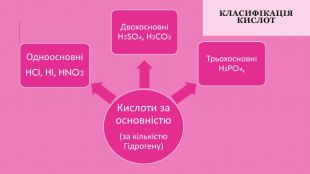
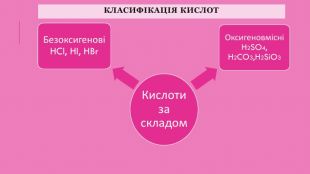
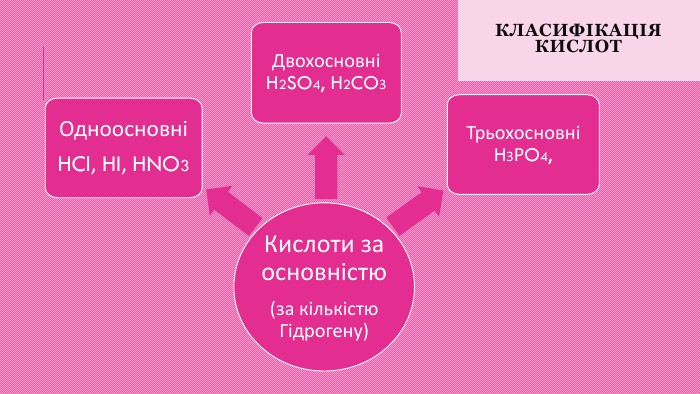
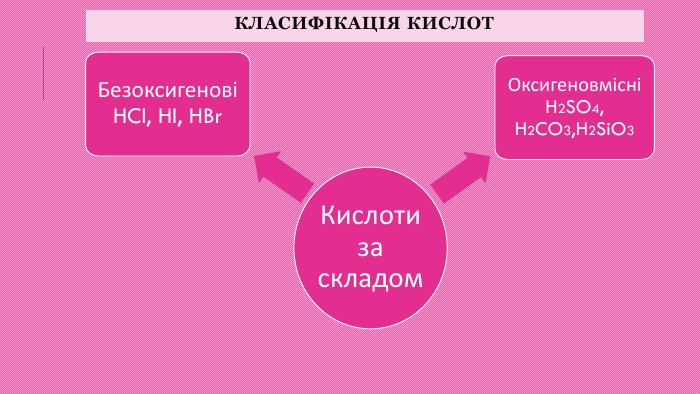
Класифікація кислот1. За наявністю у складі кислотного залишку Оксигену кислоти поділяють на оксигеновмісні (кисневі) і безоксигенові (безкисневі). Приклади оксигеновмісних кислот: сульфатна (сірчана) кислота H2 SO4, нітратна (азотна) кислота HNO3 і фосфатна (фосфорна) кислота H3 PO4. Приклади безоксигенових кислот: хлоридна (хлороводнева, або соляна) кислота HCl, бромідна кислота HBr, сульфідна (сірководнева) Н2 S. 2. За кількістю атомів Гідрогену кислоти поділяються на одноосновні, двоосновні, триосновні тощо. Наприклад, хлоридна кислота HCl — одноосновна, сульфатна кислота H2 SO4 — двоосновна, фосфатна кислота H3 PO4 — триосновна.
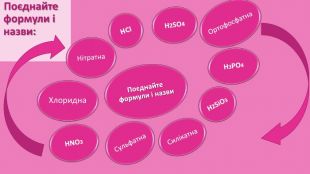
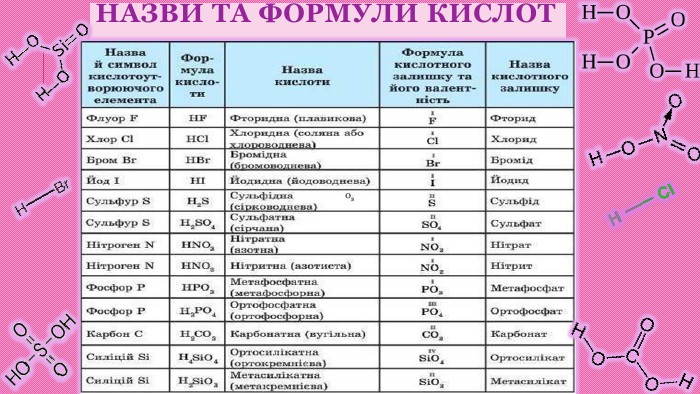
Номенклатура кислот. Назви кислот походять від назви кислотоутворюючого елементу. Якщо кислотоутворюючий елемент оксигеновмісних кислот проявляє найвищу можливу валентність, назва кислоти має закінчення -атна,наприклад: HNO3 — нітратна кислота (азотна)Н2 SO4 — сульфатна кислота (сірчана)Н3 РО4 — ортофосфатна кислота (фосфорна)НРО3 — метафосфатна кислота. Н2 СО3 — карбонатна кислота (вугільна)Н3 ВО3 — боратна кислота (борна)Якщо кислотоутворюючий елемент оксигеновмісних кислот проявляє нижчу позитивну валентність, назва кислоти має закінчення -итна, наприклад: HNO2 — нітритна кислота (азотиста) Н2 SO3 — сульфітна кислота (сірчиста)Назви безкисневих кислот мають закінчення -идна або -ідна. Наприклад: HCl — хлоридна кислота (хлороводнева, або соляна)HI — йодидна кислота (йодоводнева)HBr — бромідна кислота (бромоводнева)H2 S — сульфідна кислота (сірководнева)
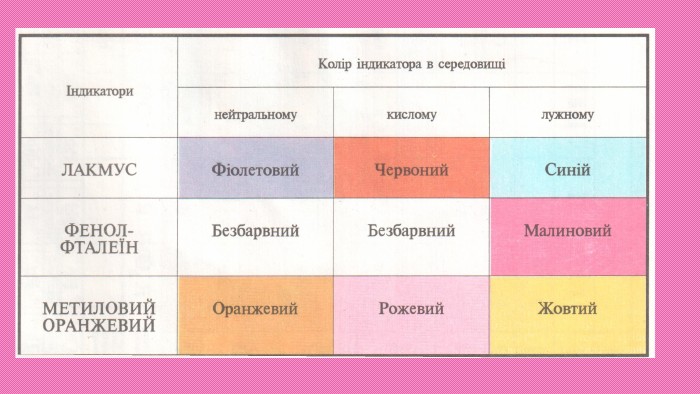
Фізичні властивості кислот. Більшість кислот — рідини, наприклад нітратна HNO3 і сульфатна Н2 SO4 кислоти. Деякі кислоти — тверді речовини, наприклад фосфатна Н3 РО4 і боратна Н3 ВО3 кислоти. Більшість кислот добре розчинні у воді. Виняток — силікатна кислота H2 Si. O3, яка практично нерозчинна. Водні розчини кислот відзначаються кислим смаком, руйнують рослинні і тваринні тканини.
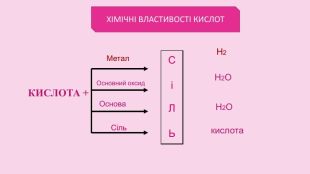
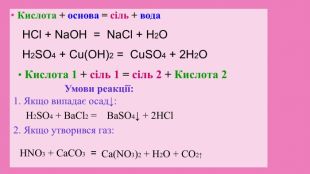
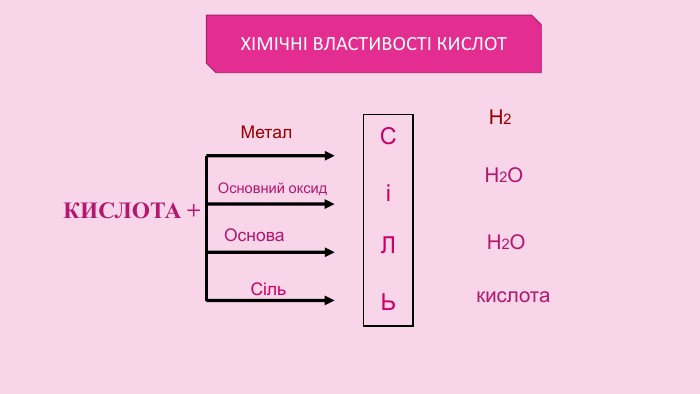
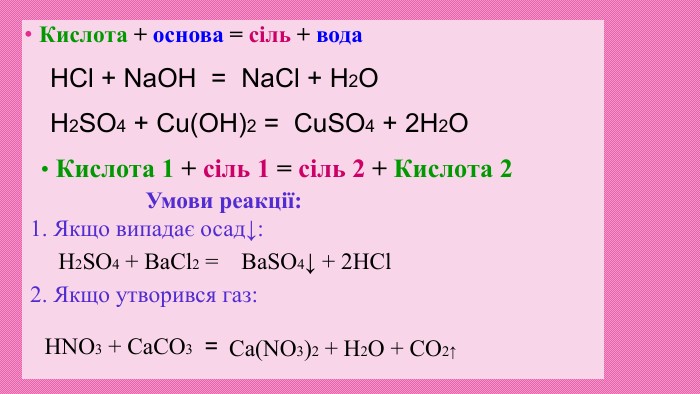
Кислоти — сильні окисники. Концентрована сульфатна кислота а також нітратна кислота будь-якої концентрації є сильними окисниками. Вони взаємодіють з металами, які в ряду напруг розміщені після Н, обвуглюють органічні речовини. Реакція з металами: Cu + 2 Н2 SО4 концентрована = Cu. SО4 + SО2 + Н2 О Cu + 4 HNO3 = Cu(NO3)2 + 2 NO2 + 2 H2 O Окиснення (обвуглювання) органічних речовин
Використання кислот. У промисловості для виробництва металів, мийних засобів, барвників, мінеральних добрив, вибухових речовин, лаків, фарб, пластмас;У харчовій промисловості як смакові приправи, консерванти, для виготовлення напоїв;Ліки домашньої аптечки: аскорбінова кислота (вітамін. С), ацетилсаліцилова кислота (аспірин), боратна кислота.
Назва кислотного залишку HBr Вміст атомів якого елемента впливає на класифікацію кислот за основністю Якщо кислотоутворюючий елемент оксигеновмісних кислот проявляє нижчу позитивну валентність, тоді назва кислоти має таке закінчення Тривіальна назва цієї кислоти HNO3 Назва цієї кислоти HF Кислоти також класифікують за вмістом цього елемента Цей індикатор в кислотному середовищі змінює колір на червоний Деякі кислоти тверді речовини, ця кислота одна із них. Більшість кислот добре розчинні у воді. Ця кислота – є виняток, вона практично не розчинна. Це складна речовина, до складу якої входять атоми Гідрогену й кислотний залишок Розгадайте кросворд та прочитайте назву кислотного залишку цієї кислоти HPO3

про публікацію авторської розробки
Додати розробку