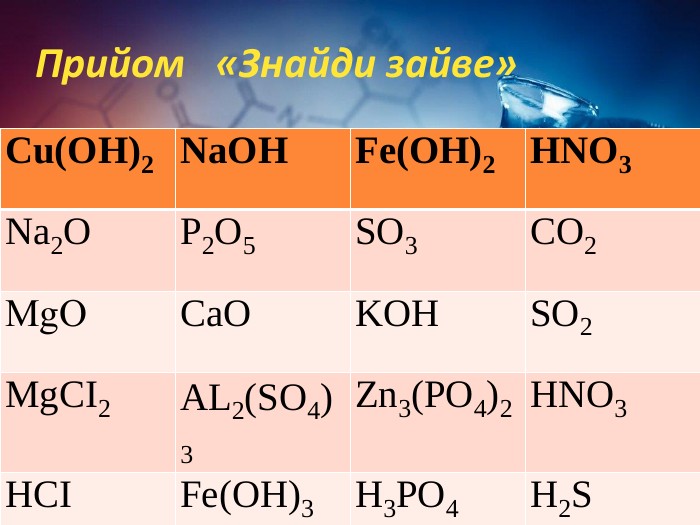
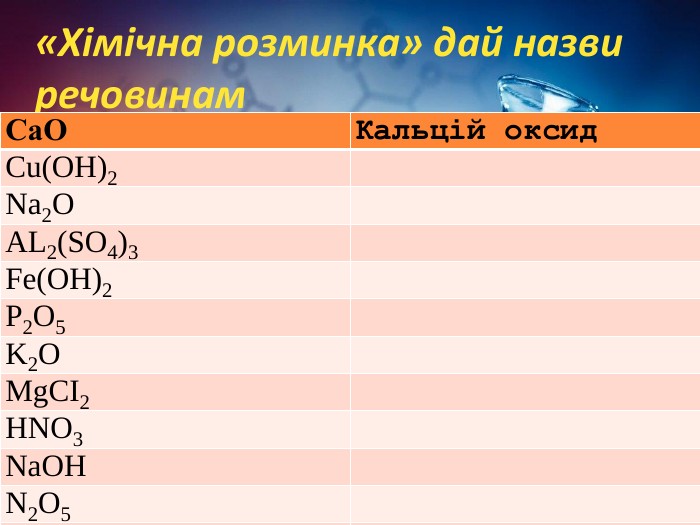
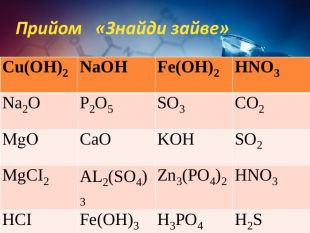
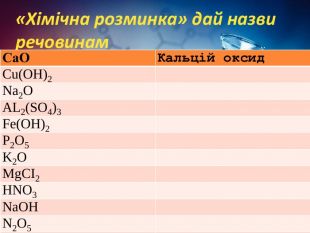
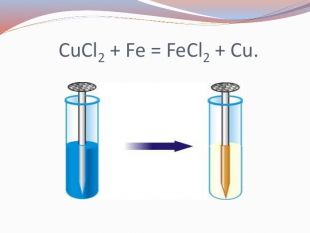
Хімічні властивості середніх солей
Про матеріал
Презентаційний матеріал для роботи у 8 класі для опанування теми про хімічні властивості солей. Є можливість керованої практики Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку