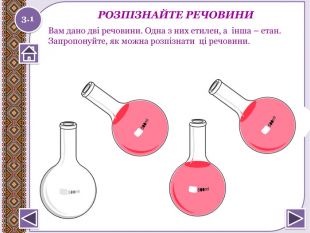
Хімічні властивості вуглеводнів: відношення до розчинів кислот, лугів, калій перманганату; реакції повного окиснення, заміщення, приєднання водню та галогенів.





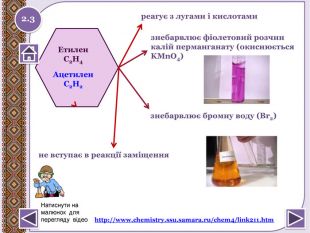
![Реакції окиснення: а) Реакція Вагнера3 CH2 = CH2 + 2 КМn. О4+4 Н2 О →3 НО-СН2-СН2-ОН+ 2 КОН + 2 Мn. О2↓ етиленгліколь (етандіол) КМn. О4,(Н+), t0 Cб) СН3-CH = CH-СН3 + 4[О] → 2 СН3 СООН (оцтова кислота)3 CH ≡ CH + 8 КМn. О4+ 4 Н2 О → НОО-С-С-ООН + 8 КОН + 8 Мn. О2↓ щавлева кислота Якісне визначення ненасичених вуглеводнів (кратний зв’язок) - знебарвлення розчину калій перманганату. http://www.chemistry.ssu.samara.ru/chem2/index2.htm 2.4 Натиснути на малюнок для перегляду відео Реакції окиснення: а) Реакція Вагнера3 CH2 = CH2 + 2 КМn. О4+4 Н2 О →3 НО-СН2-СН2-ОН+ 2 КОН + 2 Мn. О2↓ етиленгліколь (етандіол) КМn. О4,(Н+), t0 Cб) СН3-CH = CH-СН3 + 4[О] → 2 СН3 СООН (оцтова кислота)3 CH ≡ CH + 8 КМn. О4+ 4 Н2 О → НОО-С-С-ООН + 8 КОН + 8 Мn. О2↓ щавлева кислота Якісне визначення ненасичених вуглеводнів (кратний зв’язок) - знебарвлення розчину калій перманганату. http://www.chemistry.ssu.samara.ru/chem2/index2.htm 2.4 Натиснути на малюнок для перегляду відео](/uploads/files/294366/161528/174160_images/9.jpg)





![Утворення ацетиленідів. http://www.chemistry.ssu.samara.ru/chem2/link_v9.htm СН≡СН + Na. NH2 →Na. Н≡СNa+NH3 СН≡СН + 2[Cu(NH3)2]OH → Cu. НС≡ССu+ 4 NH3 +2 H2 OЗапишіть рівняння утворення ацетиленідуаргентуму. HCCH+2[Ag(NH3)2]OH Ag. CCAg +4 NH3+2 H2 O 2.12 Натиснути на малюнок для перегляду відео Утворення ацетиленідів. http://www.chemistry.ssu.samara.ru/chem2/link_v9.htm СН≡СН + Na. NH2 →Na. Н≡СNa+NH3 СН≡СН + 2[Cu(NH3)2]OH → Cu. НС≡ССu+ 4 NH3 +2 H2 OЗапишіть рівняння утворення ацетиленідуаргентуму. HCCH+2[Ag(NH3)2]OH Ag. CCAg +4 NH3+2 H2 O 2.12 Натиснути на малюнок для перегляду відео](/uploads/files/294366/161528/174160_images/17.jpg)



![Дайте назви реакціям. СН2=СН2+Cl2→СН2 Cl- СН2 Cl. СН2 Cl- СН2 Cl → СН2= СНCl - HCl. СН2= СНCl → ( -СН2- СН-)n Cl. СН2=СН2+ Н2 О → C2 H5 OH СН2=СН2 + C6 H6 → C6 H5-CH2-CH3 C6 H5-CH2-CH3 → ( -СН- СН2-)n [O] C6 H5 СН2=СН2 → CH3 CHOСН≡СН + HCl → СН2= СНCl СН2= СНCl →( -СН2- СН-)n Cl. СН≡СН + Н2 О → CH3 CHO [O] CH3 CHO → CH3 COOH3.5 Дайте назви реакціям. СН2=СН2+Cl2→СН2 Cl- СН2 Cl. СН2 Cl- СН2 Cl → СН2= СНCl - HCl. СН2= СНCl → ( -СН2- СН-)n Cl. СН2=СН2+ Н2 О → C2 H5 OH СН2=СН2 + C6 H6 → C6 H5-CH2-CH3 C6 H5-CH2-CH3 → ( -СН- СН2-)n [O] C6 H5 СН2=СН2 → CH3 CHOСН≡СН + HCl → СН2= СНCl СН2= СНCl →( -СН2- СН-)n Cl. СН≡СН + Н2 О → CH3 CHO [O] CH3 CHO → CH3 COOH3.5](/uploads/files/294366/161528/174160_images/30.jpg)



Хімічні властивості вуглеводнів: відношення до розчинів кислот, лугів, калій перманганату; реакції повного окиснення, заміщення, приєднання водню а галогенів. Розглянемо такі питання:123 Пригадаємо особливості будовивугдеводнів. Хімічні властивостівуглеводнів: насичених таненасичених. Закріпимо наші знання. Хімія9 клас
1 Закінчіть речення. Сполуки Карбону з Гідрогеном називаються…Вуглеводні, що мають у своєму складі прості одинарні зв’язки, називаються…Сполуки, які різняться на групу СН2 і мають подібну будову і подібні властивості, називаються…Сполуки, які мають однаковий склад, але відрізняються за будовою та властивостями, називаються…Відстань між атомами Карбону в молекулах алканів становить…Алкани мають такі фізичні властивості :…1
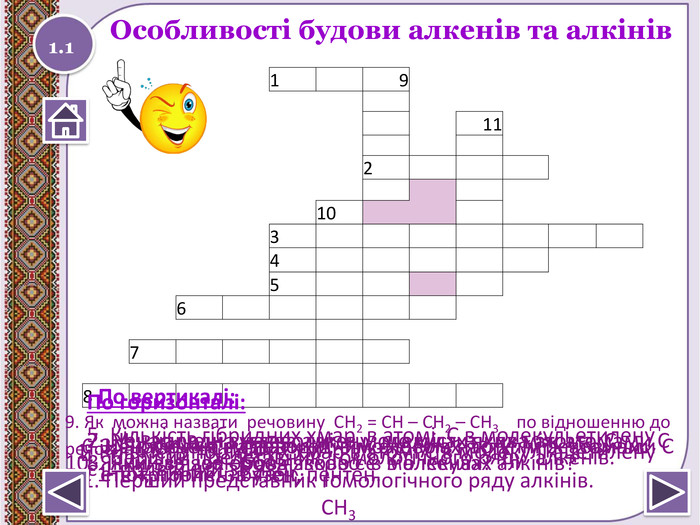
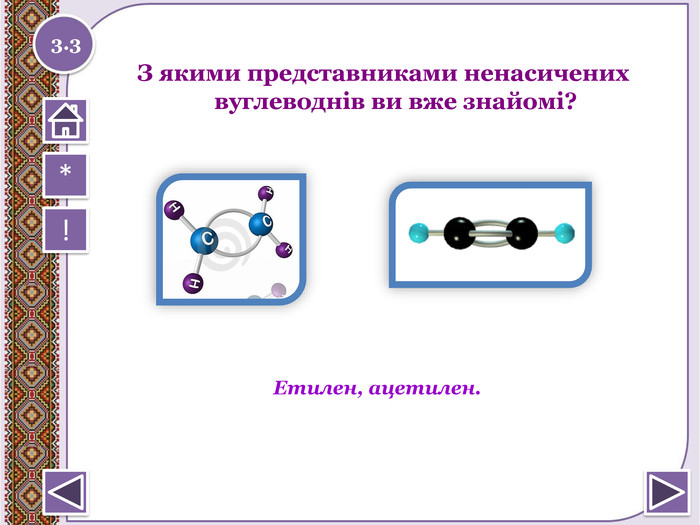
Особливості будови алкенів та алкінів 1 9 11 2 10 3 4 5 6 7 8 По горизонталі:1. Кількість гібридних хмар в атомі С в молекулі ацетилену2. Міжнародна назва алкену, що містить два атома С.3. Як можна назвати одним словом наступні речовини: етен, пропен, бутен, пентен.4. Перший представник гомологічного ряду алкенів.5. Кількість гібридних хмар в атомі С в молекулі етилену6. Ненасичені вуглеводні, в молекулах яких між атомами С є 1 потрійний зв'язок.7. Ненасичені вуглеводні, в молекулах яких між атомами С є 1 подвійний зв'язок.8. Який зв'язок обов'язково є в алкенах?9. Як можна назвати речовину СН2 = СН – СН2 – СН3 по відношенню до речовини СН2 = С– СН3 | СН3 По вертикалі:10. Який зв'язок обов'язково є в молекулах алкінів?11. Перший представник гомологічного ряду алкінів.1.1
Визначення якісного складу алканів за допомогою реакції горіння парафіну. Парафін Безводний купрум(ІІ) сульфат Сu. SO4 Вапняна вода Ca(OH)2 2312 Демонстрація:а) газ, що утворюється пропускають через вапняну воду – вона каламутніє СО2+ Са(ОН)2 →Са. СО3↓+Н2 О б) Сu. SO4+Н2 О → Сu. SO4 ·Н2 О білий синій в) якщо холодне скло потримати над полум’ям, то на ньому конденсується вода. Отже, до складу алканів входять С і Н. style.color
ХІМІЧНІ ВЛАСТИВОСТІ ВУГЛЕВОДНІВ.2.1http://www.youtube.com/watch?v=MYP1 ITM_tok – ч.5, алканиhttp://www.youtube.com/watch?v=S1j2 H06v. Zt. Q –фіз та хім. вл-ті ацетилену http://www.youtube.com/watch?v=x6 WSEKw8 I-I алкени, 2 урок Хімічні властивості http://www.chemistry.ssu.samara.ru/chem2/index2.htm -підручник
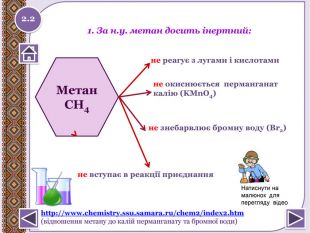
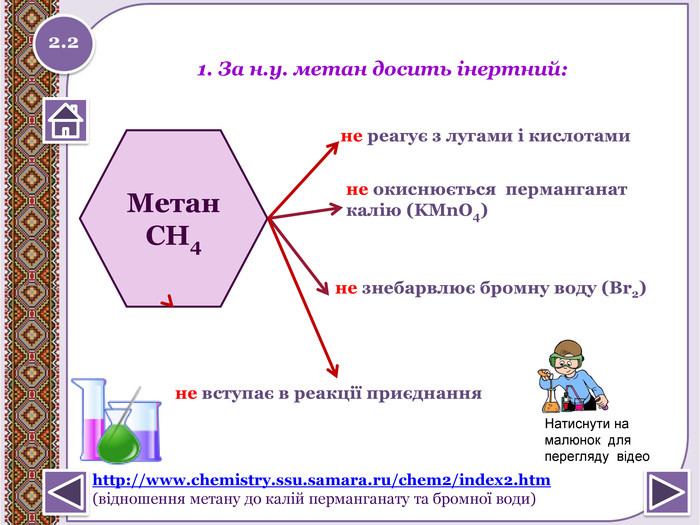
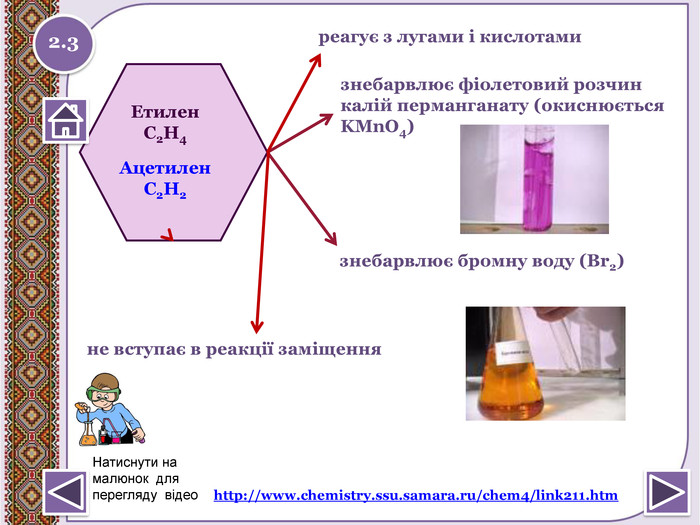
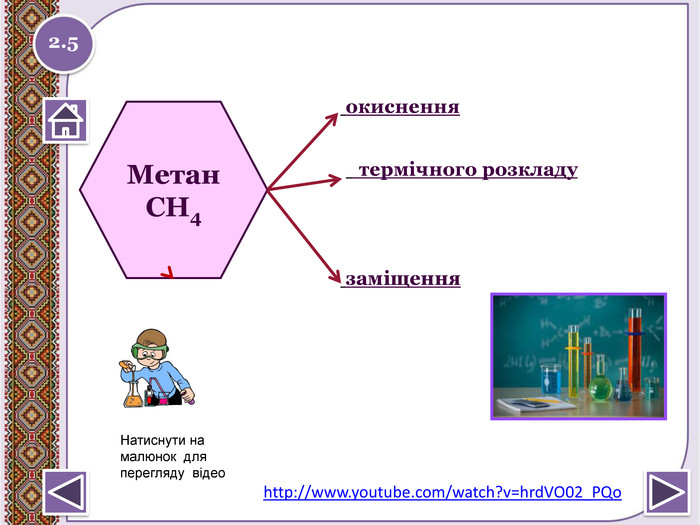
не вступає в реакції приєднання. Метан. СН4не реагує з лугами і кислотамине окиснюється перманганат калію (KMn. O4)1. За н.у. метан досить інертний:не знебарвлює бромну воду (Вr2)2.2http://www.chemistry.ssu.samara.ru/chem2/index2.htm (відношення метану до калій перманганату та бромної води)Натиснути на малюнок для перегляду відеоstyle.colorfillcolorfill.type
Реакції окиснення: а) Реакція Вагнера3 CH2 = CH2 + 2 КМn. О4+4 Н2 О →3 НО-СН2-СН2-ОН+ 2 КОН + 2 Мn. О2↓ етиленгліколь (етандіол) КМn. О4,(Н+), t0 Cб) СН3-CH = CH-СН3 + 4[О] → 2 СН3 СООН (оцтова кислота)3 CH ≡ CH + 8 КМn. О4+ 4 Н2 О → НОО-С-С-ООН + 8 КОН + 8 Мn. О2↓ щавлева кислота Якісне визначення ненасичених вуглеводнів (кратний зв’язок) - знебарвлення розчину калій перманганату. http://www.chemistry.ssu.samara.ru/chem2/index2.htm 2.4 Натиснути на малюнок для перегляду відео
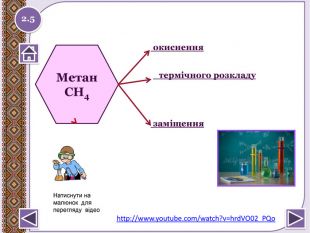
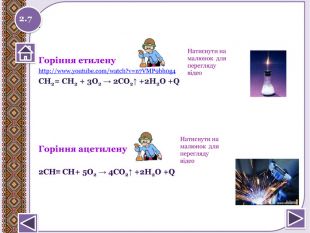
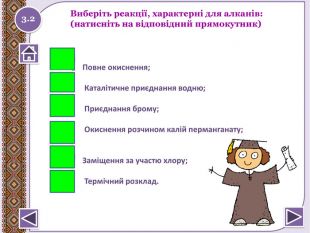
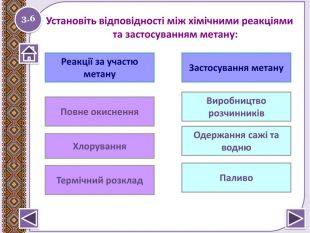
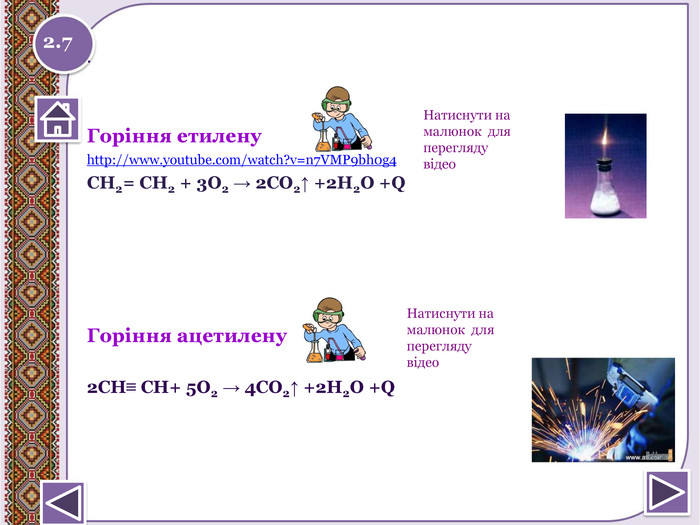
Реакція горіння або повне окиснення (з виділенням великої кількості теплоти) Запишіть рівняння реакцій горіння метану, етену таацетилену. Горіння метануhttp://www.youtube.com/watch?v=QZ1 Vwuz. Sw. Zs СН4 + 2 О2 → СО2↑ + 2 Н2 О +Q; ∆Н = 890 к. Дж/моль. У разі нестачі кисню метан окиснюється неповністю. І тодізамість карбон (ІУ) оксиду СО2 утворюється карбон (ІІ) оксид. СО, відомий як чадний газ.2 СН4 + 3 О2 → 2 СО↑ + 4 Н2 ОЗапамятай! Суміш СН4 і О2 дуже вибухонебезпечна. Спричинює аварії в шахтах, може статися вибух в приміщенні.http://www.youtube.com/watch?v=tz. T2 Qehcgi. I&list=PL0 Rzc1qw08b. Nj. Bq. Cwb. KN8p1-kpo-s. Spfg- вибух суміші метану з киснем.2.6 Натиснути на малюнок для перегляду відео
Реакції заміщення – галогенування по радикальному типу 2.10 hνСН4 + Cl2 → CH3 Cl + HCl хлорметан hνCH3 Cl + Cl2 → CH2 Cl2 + HCІ дихлорметан hνCH2 Cl2+ Cl2 → CHCl3 + HCl трихлорметан (хлороформ) hνCHCl3 + Cl2 → CCl4 + HCl тетрахлорметан Сумарне рівняння: hν СН4 + 4 Cl2 → CCl4 + 4 HClhttp://www.chemistry.ssu.samara.ru/chem2/flash/clor0.swf -анімація р-я хлоруванняhttp://www.chemistry.ssu.samara.ru/chem2/flash/clor_s.swf -р-я хлорування анімація зі звуковим коментарем Запамятай! Усі продукти хлорування алканів токсичні й руйнують озоновий шар. Використовують в холодильних установках, в медицині для місцевої анестезії, в органічному синтезі. Розчинник. Розчинник, анестезуюча дія, раніше використовували в медицині для знеболювання. Розчинник, протипожежний засіб. Не для закритих приміщень, оскільки утворюється отруйний фосген СОСl2. Натиснути на малюнок для перегляду відео
Утворення ацетиленідів. http://www.chemistry.ssu.samara.ru/chem2/link_v9.htm СН≡СН + Na. NH2 →Na. Н≡СNa+NH3 СН≡СН + 2[Cu(NH3)2]OH → Cu. НС≡ССu+ 4 NH3 +2 H2 OЗапишіть рівняння утворення ацетиленідуаргентуму. HCCH+2[Ag(NH3)2]OH Ag. CCAg +4 NH3+2 H2 O 2.12 Натиснути на малюнок для перегляду відео
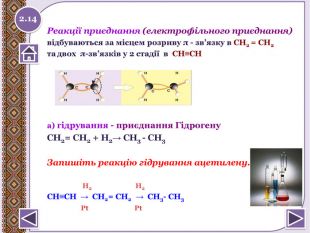
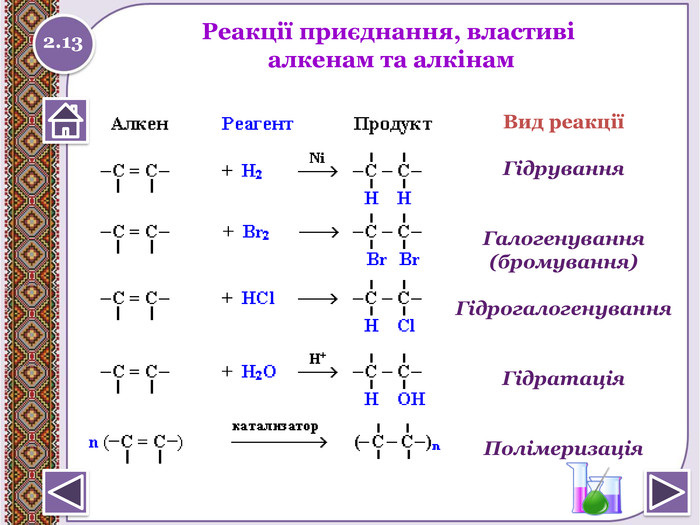
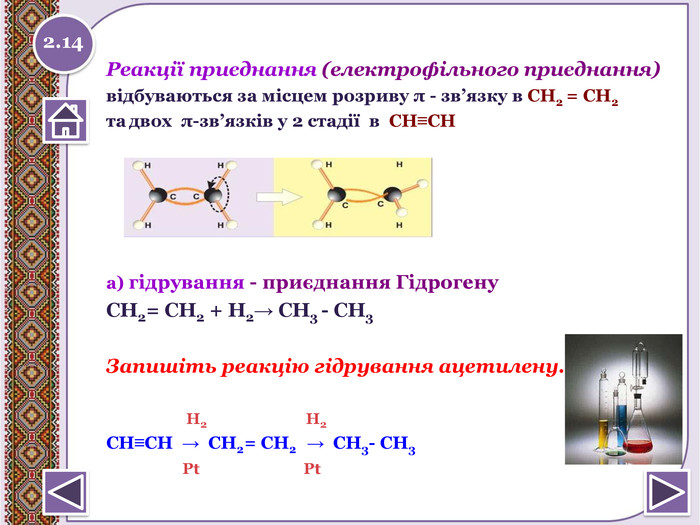
Реакції приєднання (електрофільного приєднання)відбуваються за місцем розриву π - зв’язку в СН2 = СН2та двох π-зв’язків у 2 стадії в СН≡СН а) гідрування - приєднання Гідрогену. СН2= СН2 + Н2→ СН3 - СН3 Запишіть реакцію гідрування ацетилену. Н2 Н2 СН≡СН → СН2= СН2 → СН3- СН3 Pt Pt2.14
б) галогенування - приєднання галогенів. CH2 = CH2 + Br2→ Br. H2 C-CH2 Br Br2 СН≡СН + Br2→ Br. HC=CHBr → Br2 НC - CНBr2 Якісна реакція на кратний зв’язок. Бурий колір бромузнебарвлюється. Запишіть рівняння хлорування етиленута ацетилену. Cl2 СН2 =СН2 + Cl2 → Cl. H2 C-CH2 Cl Cl2 СН≡СН + Cl2 → Cl. HC=CHCl → Cl2 HC-CHCl22.15 Натиснути на малюнок для перегляду відео
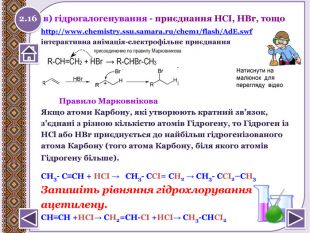
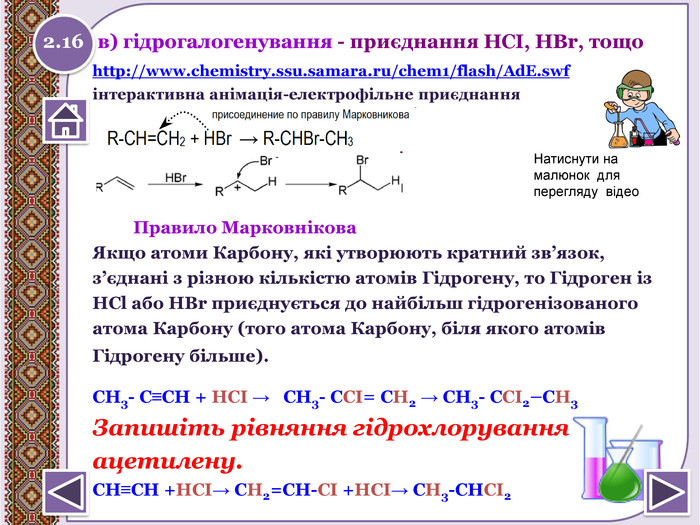
в) гідрогалогенування - приєднання НСІ, НBr, тощоhttp://www.chemistry.ssu.samara.ru/chem1/flash/Ad. E.swf інтерактивна анімація-електрофільне приєднання Правило Марковнікова Якщо атоми Карбону, які утворюють кратний зв’язок,з’єднані з різною кількістю атомів Гідрогену, то Гідроген із. НСl або НВr приєднується до найбільш гідрогенізованогоатома Карбону (того атома Карбону, біля якого атомів. Гідрогену більше). СН3- С≡СН + НCI → СН3- СCI= СН2 → СН3- СCI2–СН3 Запишіть рівняння гідрохлоруванняацетилену. СН≡СН +НСІ→ СН2=СН-СІ +НСІ→ СН3-СНСІ2 2.16 Натиснути на малюнок для перегляду відео
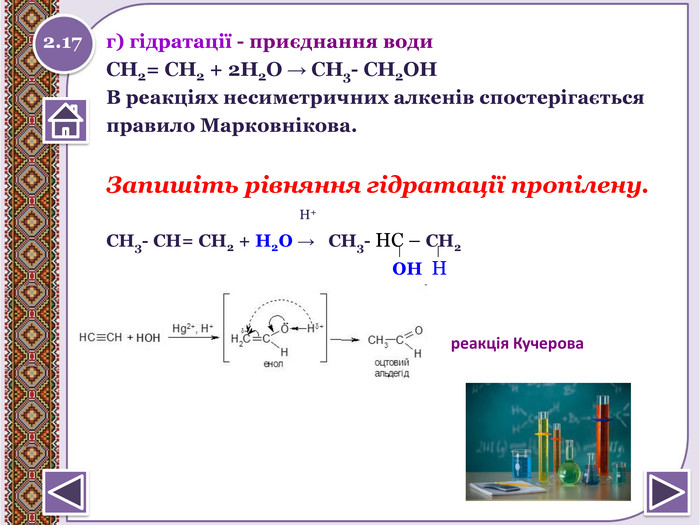
г) гідратації - приєднання води СН2= СН2 + 2 Н2 О → СН3- СН2 ОНВ реакціях несиметричних алкенів спостерігаєтьсяправило Марковнікова. Запишіть рівняння гідратації пропілену. Н+СН3- СН= СН2 + Н2 О → СН3- НС – СН2 ОН Н2.17реакція Кучероваstyle.colorfillcolorfill.typestyle.colorfillcolorfill.typestyle.colorfillcolorfill.type
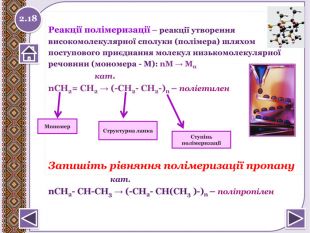
Реакції полімеризації – реакції утвореннявисокомолекулярної сполуки (полімера) шляхомпоступового приєднання молекул низькомолекулярноїречовини (мономера - М): n. М → Мn кат.n. СН2= СН2 → (-СН2- СН2-)n – поліетилен Запишіть рівняння полімеризації пропану кат.n. СН2- СН-СН3 → (-СН2- СН(СН3 )-)n – поліпропілен. Структурна ланка. Ступінь полімеризаціїМономер 2.18
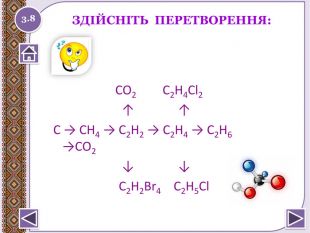
Дайте назви реакціям. СН2=СН2+Cl2→СН2 Cl- СН2 Cl. СН2 Cl- СН2 Cl → СН2= СНCl - HCl. СН2= СНCl → ( -СН2- СН-)n Cl. СН2=СН2+ Н2 О → C2 H5 OH СН2=СН2 + C6 H6 → C6 H5-CH2-CH3 C6 H5-CH2-CH3 → ( -СН- СН2-)n [O] C6 H5 СН2=СН2 → CH3 CHOСН≡СН + HCl → СН2= СНCl СН2= СНCl →( -СН2- СН-)n Cl. СН≡СН + Н2 О → CH3 CHO [O] CH3 CHO → CH3 COOH3.5


про публікацію авторської розробки
Додати розробку