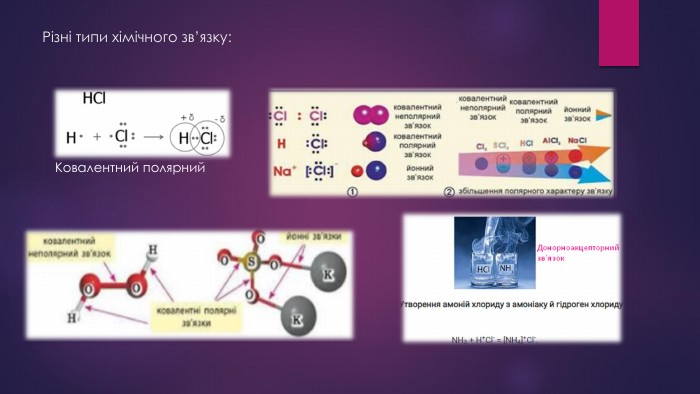
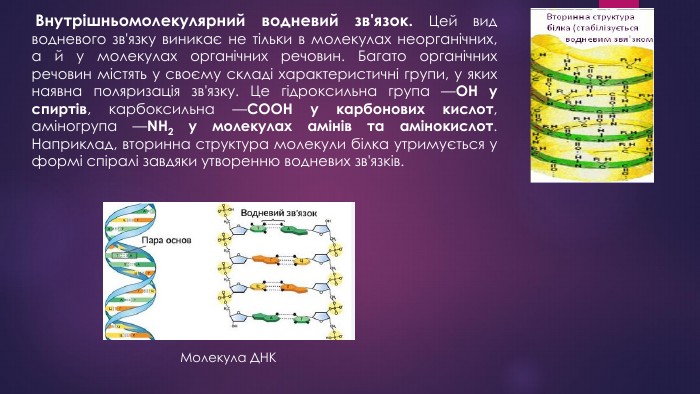
Хімічний зв'язок. Типи хімічного зв'язку.
Про матеріал
Дану тему вивчають під час повторення курсу неорганічної хімії в 11- му класі Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку