Презентація "Розв'язування вправ з теми "Солі""
Про матеріал
Презентація до уроку в 11 класі на тему "Розв'язування вправ з теми "Солі"" призначена для повторення та узагальнення знань учнів. Містить задачі, тестові вправи, завдання на перетворення речовин. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки

Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку



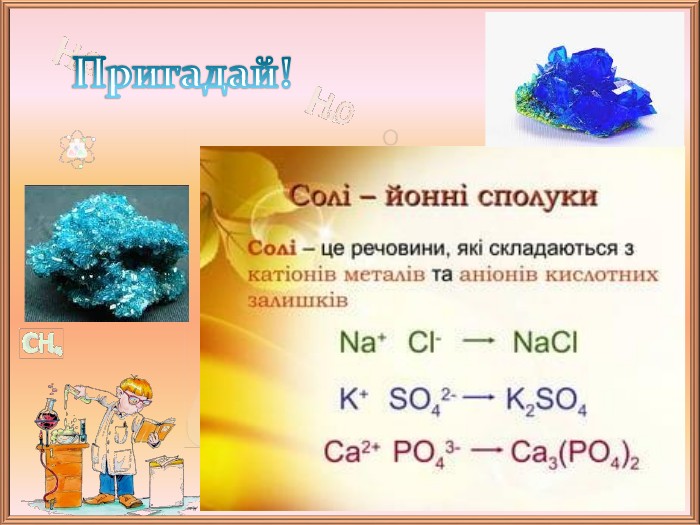
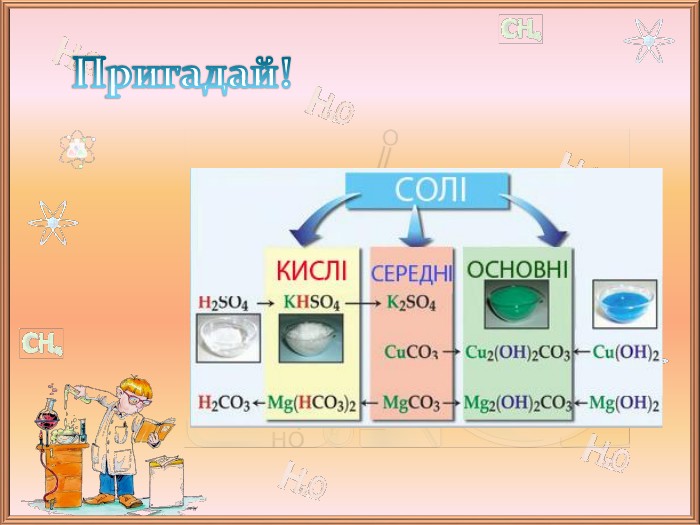
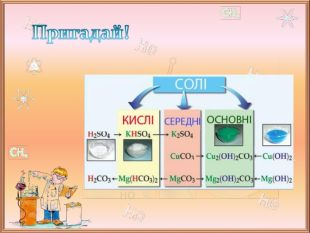
![Пригадай!Жовта кров’яна сіль (калій гексаціаноферат (ІІ) K4[Fe (CN)6])Червона кров’яна сіль (калій гексаціаноферат (ІІІ) K3[Fe (CN)6])Комплексні солі Пригадай!Жовта кров’яна сіль (калій гексаціаноферат (ІІ) K4[Fe (CN)6])Червона кров’яна сіль (калій гексаціаноферат (ІІІ) K3[Fe (CN)6])Комплексні солі](/uploads/files/172593/331824/373108_images/5.jpg)






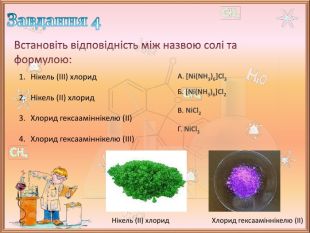
![Завдання 4 Встановіть відповідність між назвою солі та формулою: Нікель (ІІІ) хлорид. Нікель (ІІ) хлорид. Хлорид гексааміннікелю (ІІ)Хлорид гексааміннікелю (ІІІ)А. [Ni(NH3)6]Cl3 Б. [Ni(NH3)6]Cl2 В. Ni. Cl2 Г. Ni. Cl3 Нікель (ІІ) хлорид. Хлорид гексааміннікелю (ІІ) Завдання 4 Встановіть відповідність між назвою солі та формулою: Нікель (ІІІ) хлорид. Нікель (ІІ) хлорид. Хлорид гексааміннікелю (ІІ)Хлорид гексааміннікелю (ІІІ)А. [Ni(NH3)6]Cl3 Б. [Ni(NH3)6]Cl2 В. Ni. Cl2 Г. Ni. Cl3 Нікель (ІІ) хлорид. Хлорид гексааміннікелю (ІІ)](/uploads/files/172593/331824/373108_images/12.jpg)

![Завдання 6 Встановіть відповідність між формулою солі та типом: Na2 SО4 Na. НCО3 K4[Fe (CN)6]4. Mg2(OH)2 CO3 А. комплексні соліБ. середні солі В. подвійні соліГ. кислі соліД. основні солі Алюмокалієві галуни (подвійні солі)Малахіт (основна сіль) Завдання 6 Встановіть відповідність між формулою солі та типом: Na2 SО4 Na. НCО3 K4[Fe (CN)6]4. Mg2(OH)2 CO3 А. комплексні соліБ. середні солі В. подвійні соліГ. кислі соліД. основні солі Алюмокалієві галуни (подвійні солі)Малахіт (основна сіль)](/uploads/files/172593/331824/373108_images/14.jpg)