Презентація на тему : ''Будова атома.''
Про матеріал
В цій презентації розкрито 3 питання:
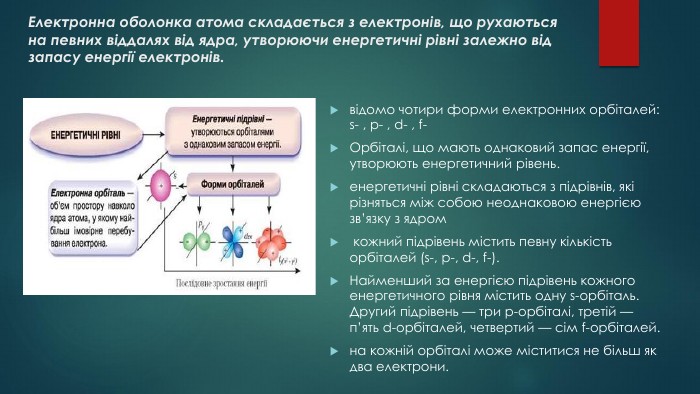
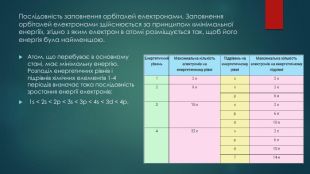
1. Будова атома.
2. Створення графічних електронних формул.
3. Основний і збуджений стан атома (розглянуто на прикладі Сульфуру). Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку