Календарно-тематичне та поурочне планування. Хімія 7 клас.
Наведені матеріали за змістом і структурою повністю відповідають програмі для загальноосвітніх навчальних закладів.
Календарно-тематичне планування для 7 класу складено згідно
«Хімія. 7-9 класи. Навчальна програма для загальноосвітніх навчальних закладів»// Наказ МОН №804 від 07.06.2017 р.
Посібник містить орієнтовне календарно-тематичне і поурочне планування, критерії оцінювання навчальних досягнень.
Наведено зразки самостійних та контрольних робіт.
Посібник призначений для вчителів хімії.
Новосельська Наталія Віталіївна
Куник Наталія Володимирівна
Семиволос Галина Іванівна
Орієнтовне календарне і поурочне планування Хімія 7 клас
Зміст
1. Анотація........................................................................................................3
2. Вступ.............................................................................................................4
3. Орієнтовне календарне планування Хімія 7 клас.....................................9
4. Орієнтовне поурочне планування Хімія 7 клас...................................... 26
5. Бібліографія...............................................................................................210 Анотація
Наведені матеріали за змістом і структурою повністю відповідають програмі для загальноосвітніх навчальних закладів.
Календарно-тематичне планування для 7 класу складено згідно
«Хімія. 7-9 класи. Навчальна програма для загальноосвітніх навчальних закладів»// Наказ МОН №804 від 07.06.2017 р.
Посібник містить орієнтовне календарно-тематичне і поурочне планування, критерії оцінювання навчальних досягнень.
Наведено зразки самостійних та контрольних робіт.
Посібник призначений для вчителів хімії.
Вступ
За новим державним стандартом метанавчання хімії полягає у формуванні засобами навчального предмета ключових компетентностей учнів, необхідних для соціалізації, творчої самореалізації особистості, розуміння природничо-наукової картини світу, вироблення екологічного стилю мислення і поведінки та виховання громадянина демократичного суспільства.
Вивчення хімії спрямоване на виконання таких освітніх, розвивальних і виховних завдань:
1. розвиток особистості учня, його природних задатків, інтелекту, пам'яті, здатності до самоосвіти;
2. формування наукового світогляду учня на основі засвоєння системи знань про речовини та їхні перетворення, основні хімічні закони й теорії, методи наукового пізнання в хімії; 3. формування життєвої і соціальної компетентностей учня, його екологічної культури, навичок безпечного поводження з речовинами у побуті та на виробництві;
4. розкриття ролі хімії у розвитку суспільного господарства та забезпеченні добробуту людини.
У 7 класі на рівні складу речовини триває формування основних хімічних понять (атом, молекула, хімічний елемент, прості й складні речовини), розпочате у природознавчих курсах 1-5 класів; формуються нові поняття (хімічна формула, валентність, хімічна реакція). Ознайомлення зі структурою періодичної системи хімічних елементів і складом атома передбачено програмою задля того, щоб учні мали змогу встановити взаємозв’язок між розташуванням елементів у періодичній системі та їхньою валентністю, використовувати інформацію, яку містить періодична система, про відносні атомні маси хімічних елементів.
Деякі властивості простих і складних речовин розглядаються на прикладах кисню і води в наступних двох темах. Хімічні процеси добування кисню є підставою для ознайомлення з законом збереження маси речовин під час хімічних реакцій та хімічними рівняннями. На основі хімічних властивостей кисню вводиться поняття про реакцію сполучення та оксиди металічних і неметалічних елементів.
Вивчення хімічних властивостей води дає змогу розглянути взаємодію оксидів з водою та ознайомитися з характером гідратів оксидів. Це забезпечує мінімальну фактологічну базу про сполуки хімічних елементів і їхні властивості для подальшого вивчення періодичного закону і хімічного зв’язку у 8 класі.
На цьому етапі навчання хімії триває формування поняття про розчин та його компоненти, масову частку розчиненої речовини (пропедевтичні знання надавались на уроках природознавства). Учні навчаються виготовляти розчини, розв’язувати задачі на обчислення кількісного складу розчину, визначення масової частки розчиненої речовини.
Перелік вимог зорієнтує вчителя на досягнення мети навчання з кожної теми програми, полегшить планування цілей і завдань уроків, дасть змогу виробити адекватні методичні підходи до проведення навчальних занять, поточного й тематичного оцінювання.
Критерії оцінювання навчальних досягнень учнів із хімії
При оцінюванні рівня навчальних досягнень з хімії враховується:
• рівень засвоєння теоретичних знань;
• оволодіння хімічною мовою як засобом відображення знань про речовини і хімічні явища;
• сформованість експериментальних умінь, необхідних для виконання хімічних дослідів, передбачених навчальною програмою; здатність учнів застосовувати набуті знання на практиці; уміння розв'язувати розрахункові задачі.
За відмінностями між обсягом і глибиною досягнутих результатів, ступенем самостійності у виконанні завдань, здатністю використовувати знання у нових ситуаціях виокремлено рівні навчальних досягнень учнів, що оцінюються за 12-бальною шкалою.
Кожний наступний рівень вбирає в себе вимоги до попереднього, а також додає нові характеристики.
Визначальними в оцінюванні рівня навчальних досягнень учнів є особистісні результати пізнавальної діяльності, у яких відображаються загальнопредметні компетентності, набуті учнями в процесі навчання хімії.
Критерії оцінювання навчальних досягнень учнів
|
Рівні навчальних досягнень учнів |
Бали |
Критерії оцінювання навчальних досягнень учнів |
|
Початковий І |
1 |
Учень (учениця) розпізнає деякі хімічні об'єкти (хімічні символи, формули, явища, посуд тощо) і називає їх (на побутовому рівні); знає правила безпеки під час проведення практичних робіт |
|
|
2 |
Учень (учениця) описує деякі хімічні об'єкти за певними ознаками; знає призначення лабораторного обладнання |
|
|
3 |
Учень (учениця) має фрагментарні уявлення з предмета вивчення і може відтворити окремі його частини; під керівництвом учителя виконує найпростіші хімічні досліди |
|
Середній ІІ |
4 |
Учень (учениця) знає окремі факти, що стосуються хімічних сполук і явищ; складає прості прилади для проведення дослідів і виконує їх під керівництвом учителя; складає з допомогою вчителя скорочену умову задачі |
|
|
5 |
Учень (учениця) з допомогою вчителя відтворює окремі частини навчального матеріалу, дає визначення основних понять; самостійно виконує деякі хімічні досліди, описує хід їх виконання, дотримується порядку на робочому місці; самостійно складає і записує скорочену умову задачі |
|
|
6 |
Учень (учениця) відтворює навчальний матеріал з допомогою вчителя; описує окремі спостереження за перебігом хімічних дослідів; робить обчислення за готовою формулою |
|||
|
Достатній ІІІ
|
7 |
Учень (учениця) самостійно відтворює значну частину навчального матеріалу; з допомогою вчителя порівнює хімічні об'єкти, описує спостереження за перебігом хімічних дослідів; наводить рівняння реакцій за умовою задачі |
|||
|
8
|
Учень (учениця) самостійно відтворює фактичний і теоретичний навчальний матеріал, порівнює і класифікує хімічні об'єкти; самостійно виконує всі хімічні досліди згідно з інструкцією; робить обчислення за рівнянням реакції |
||||
|
|
9 |
Учень (учениця) виявляє розуміння основоположних хімічних теорій і фактів, наводить приклади на підтвердження цього; робить окремі висновки з хімічних дослідів; з допомогою вчителя розв'язує задачі |
|||
|
Високий ІV |
10 |
Учень (учениця) володіє навчальним матеріалом ізастосовує знання у стандартних ситуаціях, уміє аналізувати, узагальнювати й систематизувати надану інформацію, робити висновки; робить висновки з практичної роботи; самостійно наводить і використовує необхідні формули для розв'язування задач |
|||
|
|
11 |
Учень (учениця) володіє засвоєними знаннями і використовує їх у нестандартних ситуаціях, установлює зв'язки між явищами: самостійно знаходить і використовує інформацію згідно з поставленим завданням; виконує хімічний експеримент, раціонально використовуючи обладнання і реактиви; самостійно розв'язує задачі, формулює відповіді |
|
|||
|
|
12 |
Учень (учениця) має системні знання з предмета, аргументовано використовує їх, у тому числі у проблемних ситуаціях; аналізує додаткову інформацію; самостійно оцінює явища, пов'язані з речовинами та їх перетвореннями; робить обгрунтовані висновки з хімічного експерименту; розв'язує експериментальні задачі за власним планом; самостійно аналізує та розв'язує задачі раціональним способом |
|
|||
Орієнтовне тематичне планування
Хімія 7 клас
(Усього 52 години, 1,5 год на тиждень, із них 5 год — резервних)
Програма для загальноосвітніх навчальних закладів
Хімія7-9 класи
Календарно-тематичне планування для 7 класу складено згідно
«Хімія. 7-9 класи. Навчальна програма для загальноосвітніх навчальних закладів»// Наказ МОН №804 від 07.06.2017 р.
|
Номер уроку |
Дата |
Тема уроку |
Дидактична мета уроку |
Демонстрації та лабораторні досліди |
|
Вступ (3 год)
|
||||
|
1 |
|
Хімія — природнича наука. Речовини та їх перетворення у навколишньому світі.Короткі відомості з історії хімії. НП. 1. Хімічні речовини навколо нас. |
Пояснити місце хімії серед наук про природу, з'ясувати цілі й завдання хімії. Сформувати знання про роль хімічної науки для розвитку народного господарства, у повсякденному житті людини. Вивчити основні етапи становлення хімії як науки. Назвати найвидатніших хіміків і охарактеризувати їх внесок у науку. Повторити відомості про речовини, вивчені в курсі «Природознавство» |
Демонстрації: 1.Взаємодія харчової соди з оцтом. 2. Зміна забарвлення індикаторів у різних середовищах.
|
|
2 |
|
Правила поведінки учнів у хімічному кабінеті. Ознайомлення з обладнанням кабінету хімії та лабораторним посудом. НП. 2.Історичне |
Ознайомити учнів з правилами поведінки в кабінеті хімії, під час уроку, демонстраційних і лабораторних дослідів, практичних робіт. Повторити правила надання першої медичної допомоги в разі потрапляння шкідливих речовин на шкіру, в очі, у дихальні шляхи. Познайомити з |
|
|
|
|
значення вогню. |
основним обладнанням кабінету хімії, лабораторним посудом |
|
|
|
3 |
|
Практична робота №1 Правила безпеки під час роботи в хімічному кабінеті. Прийоми поводження з лабораторним посудом, штативом і нагрівними приладами. Будова полум’я. |
Формуватинавичкипракт ичноїроботи; перевіритинавичкиповод женняпідчасроботивкабі нетіхімії, зхімічнимиречовинамиілабораторним обладнанням. Сформувативміннявикор истовуватихімічнийпосу д, лабораторнийштатив, нагрівальніприлади.
|
|
|
|
Початкові хімічні поняття (21год +2) |
|||||
|
4 |
|
Фізичні тіла. Матеріали. Речовини. |
Активізувати знання про поняття «речовина», «матеріал», «тіло». Навчити учнів розрізняти фізичні тіла, речовини, матеріали.
|
|
|
|
5 |
|
Як вивчають хімічні сполуки та явища. |
Познайомити учнів із методами вивчення хімічних сполук і явищ. |
|
|
|
|
|
Спостереження й експеримент у хімії. |
Дати поняття про спостереження й експеримент як методи дослідження фізичних і хімічних властивостей речовин і явищ у хімії |
|
|
6 |
|
Фізичні властивості речовини. |
Узагальнити й поглибити знання учнів про властивості речовин із попередніх курсів «Природознавство» і «Фізика». |
Лабораторний дослід 1. Ознайомлення з фізичними властивостями речовин. |
|
7 |
|
Чисті речовини й суміші. Способи розділення сумішей.
|
Повторити поняття «чисті речовини» та «суміші», основні способи розділення сумішей. Продовжити знайомство з лабораторним обладнанням і методикою проведення хімічного експерименту.
|
|
|
8 |
|
Практична робота №2 Розділення неоднорідної суміші.
|
Формувати навички практичної роботи; перевірити навички поводження під час роботи в кабінеті хімії, з хімічними речовинами і лабораторним обладнанням. |
|
|
|
|
|
Сформувати вміння використовувати хімічний посуд, лабораторний штатив, нагрівальні прилади. Поглибити знання про способи розділення сумішей. |
|
|
9 |
|
Атоми, хімічні елементи, їхні назви й символи.
|
Поглибити знання учнів про атоми і молекули як складні структурні частинки речовини. На основі будови атома дати поняття про хімічний елемент як певний тип атомів. Познайомити учнів із сучасною українською науковою номенклатурою. Дати уявлення про поширення хімічних елементів у природі.
|
|
|
10 |
|
Поняття про періодичну систему хімічних елементів Д. І. Менделєєва.
|
Познайомити учнів із будовою періодичної системи хімічних елементів Д. І. Менделєєва. Сформувати початкові навички визначення положення хімічного елемента в періодичній системі. Продовжити |
Демонстрація 9. Періодична система хімічних елементів Д.І. Менделєєва.
|
|
|
|
|
знайомство із символами й назвами елементів за сучасною українською номенклатурою. |
|
|
11 |
|
Атомна одиниця маси. Відносна атомна маса хімічних елементів.
|
Розширити знання учнів про періодичну систему елементів; закріпити знання про хімічний елемент, хімічну символіку. Ознайомити учнів з поняттям абсолютної та відносної атомної маси, одиницею вимірювання відносної атомної маси — атомною одиницею маси (а.о.м.). Навчити визначати відносну атомну масу за періодичною системою. |
|
|
12 |
|
Багатоманітність речовин. Метали й неметали.
|
Увести поняття про багатоманітність речовин. Дати елементарну класифікацію елементів на метали та неметали, їх поширення в природі. Навчити розрізняти металічні й неметалічні елементи за їх положенням у періодичній системі. Показати суттєву відмінність фізичних і |
Демонстрація 8. Зразки металів і неметалів.
|
|
|
|
|
хімічних властивостей металів і неметалів. |
|
|
13 |
|
Прості та складні речовини.
|
Поглибити знання учнів про класифікацію речовин за складом їх молекул. Дати поняття про прості та складні речовини. Навчитися розрізняти поняття «хімічна сполука» і «суміш речовин», «проста речовина» і «хімічний елемент». Навчити аналізувати якісний склад простих і складних речовин. |
Лабораторний дослід 2. Ознайомлення зі зразками простих і складних речовин. |
|
14 |
|
Хімічні формули речовин.
|
Закріпити знання про прості та складні речовини. Навчити записувати хімічні формули простих і складних речовин, користуючись хімічними знаками й індексами. Навчитися читати хімічні формули речовин, визначати їх якісний і кількісний склад. |
|
|
15 |
|
Валентність хімічних елементів. Визначення |
Визначити поняття «валентність» як здатність атомів утворювати хімічні спо- |
|
|
|
|
валентності за формулами бінарних сполук.
|
луки. Познайомити учнів зі значенням валентностей окремих атомів. Показати найпростіші способи визначення валентності за періодичною системою. Навчити визначати валентність атомів одного елемента за валентністю іншого в сполуках, що утворені атомами двох хімічних елементів (бінарних сполуках). |
|
|
16 |
|
Складання формул бінарних сполук за валентністю елементів. |
Продовжити формування вміння складати хімічні формули бінарних сполук на основі валентності й визначати валентність атомів хімічних елементів за формулами. Узагальнити й поглибити знання про зміст хімічної формули, склад простих і складних речовин. Підготовка до тематичного оцінювання. |
|
|
17 |
|
Проміжне оцінювання знань з теми |
Виявити рівень засвоєння основних понять, термінів, |
|
|
|
|
«Початкові хімічні поняття». |
правил; визначити рівень навчальних досягнень учнів з теми. |
|
|
18 |
|
Відносна молекулярна маса речовини, її обчислення за хімічною формулою.
|
Поглибити поняття про хімічну формулу, її використання для розрахунків. Дати поняття про відносну молекулярну масу. Формувати вміння й навички обчислення за хімічними формулами. Навчити визначати відносну молекулярну масу простих і складних речовин за їх формулами. |
|
|
19 |
|
Розв’язування розрахункових задач на обчислення відносної молекулярної маси речовини. |
Узагальнити і закріпити знання про відносну молекулярну масу. Продовжити формувати вміння й навички обчислення за хімічними формулами. |
|
|
20 |
|
Масова частка елемента в складній речовині.
|
Закріпити знання про хімічні формули, вміння обчислювати відносну молекулярну масу. Поширити знання з математики про частки на обчислення масової частки елемента в складній |
|
|
|
|
|
речовини. Навчити обчислювати масову частку елемента в складній речовині. |
|
|
21 |
|
Обчислення масової частки елемента в складній речовині. |
Поглибити знання учнів про масові частки елемента в складі речовини. Оцінити рівень засвоєння вмінь та навичок використання поняття « масова частка». |
|
|
22 |
|
Розв'язування задач на виведення хімічних формул за масовою часткою елемента, що входить до складу речовини. |
Удосконалити практичні навички обчислення масової частки речовини, розв'язання задач на виведення хімічної формули за масовою часткою елементів, що входять до складу речовини. |
|
|
23 |
|
Фізичні та хімічні явища. Хімічні реакції та ознаки, що їх супроводжують. Хімічні властивості речовин. |
Повторити й поглибити знання про фізичні та хімічні явища, з'ясувати їх суттєві відмінності. Сформувати поняття про хімічні реакції як спосіб вираження хімічного явища. З'ясувати ознаки хімічної реакції та умови їх виникнення за екс- |
Демонстрації: 3-7. Хімічні реакції, що супроводжуються виділенням газу, випаданням осаду, зміною забарвлення, появою запаху, тепловим ефектом. Лабораторний дослід |
|
|
|
|
периментальними даними. Вдосконалити навички роботи з хімічними речовинами і лабораторним обладнанням. |
3. Проведення хімічних реакцій. |
|
24 |
|
Практична робота№3 Дослідження фізичних і хімічних явищ.
|
Продовжити формування навичок роботи з хімічними речовинами й лабораторним обладнанням. Перевірити знання правил техніки безпеки під час роботи в кабінеті хімії. Поглибити знання про фізичні та хімічні явища, умови перебігу, ознаки хімічних реакцій на підставі експериментальних даних. |
|
|
25 |
|
Узагальнення й систематизація знань з теми «Початкові хімічні поняття» НП. 3. Хімічні явища у природі. 4. Хімічні явища у побуті. |
Узагальнення та систематизація знань про початкові хімічні поняття, хімічні формули, хімічні реакції. Підготовка до тематичного оцінювання. |
|
|
|
|
5. Використання хімічних явищ у художній творчості й народних ремеслах. 6. Речовини і хімічні явища в літературних творах і народній творчості. |
|
|
|
26 |
|
Контрольна робота №2 «Початкові хімічні поняття» |
Узагальнити й систематизувати знання з теми. З'ясувати рівень засвоєння основних понять і законів. Визначити рівень навчальних досягнень учнів з теми «Початкові хімічні поняття». |
|
|
|
Кисень (13 год +2) |
|||
|
27 |
|
Закон як форма наукових знань. Закон збереження маси речовин. |
Вивчити закон збереження маси речовин як один з основних законів природи. Показати роль учених-хіміків А. Лавуазьє, М. Ломоносова в розкритті цього закону як форми |
Демонстрація: 10. Дослід, що ілюструє закон збереження маси речовин.
|
|
|
|
|
наукових знань про природу. Пояснити значення закону збереження маси речовини в хімії. Дати пояснення хімічних рівнянь як підтвердження закону збереження маси речовини. |
|
|
28 |
|
Хімічні рівняння. |
Повторити й розширити знання про хімічні реакції. Сформувати поняття про хімічне рівняння як умовне зображення хімічної реакції. Формувати вміння й навички складання рівнянь хімічних реакцій, розстановки коефіцієнтів на підставі закону збереження маси речовини, читання хімічних рівнянь. |
|
|
29 |
|
Семінарське заняття «Хімічні рівняння». |
Узагальнити та закріпити знання про хімічні рівняння, виробити навички розстановки коефіцієнтів. |
|
|
30 |
|
Повітря та його |
Сформувати поняття про якісний та |
|
|
|
|
склад. |
кількісний склад повітря. |
|
|
31 |
|
Оксиген. Кисень. Склад його молекули, фізичні властивості. |
Повторити класифікацію речовин. Закріпити поняття про елементи-неметали та прості речовини на прикладі Оксигену і кисню. Дати поняття про хімічний елемент Оксиген і просту речовину кисень. Ознайомити з історією відкриття кисню, його поширенням у природі, фізіологічною дією і фізичними властивостями. |
|
|
32 |
|
Одержання кисню в лабораторії. Реакції розкладу. Поняття про каталізатори. |
Сформувати уявлення про реакції розкладу та каталізатор на прикладі реакцій одержання кисню в лабораторії. Підготувати учнів до практичної роботи. |
Демонстрації: 11. Добування кисню з гідроген пероксиду. 12. Збирання кисню витісненням повітря та витісненням води. 13. Доведення наявності кисню. |
|
33 |
|
Практична робота №4 Добування кисню з гідроген пероксиду, збирання, доведення його |
Перевірити знаннятехніки безпеки підчас виконання практичної роботи. Продовжити розвивати навички роботи з хімічними речовинами |
|
|
|
|
наявності.
|
й лабораторним обладнанням. Навчити складати прилад для одержання газів, збирати гази шляхом витіснення повітря й води. Формувати вміння й навички проведення хімічного експерименту й аналізу явищ, що спостерігаються, робити висновки в ході практичної роботи. |
|
|
34 |
|
Хімічні властивості кисню: взаємодія з простими речовинам.Реакц ія сполучення. |
Вивчити хімічні властивості кисню на прикладі взаємодії з вугіллям, сіркою, воднем, магнієм, залізом, міддю. Закріпити й розширити знання про хімічні реакції, складання рівнянь хімічних реакцій. Дати уявлення про реакції сполучення, окиснення. Дати поняття про оксиди як продукти окиснення елементів металів і неметалів. |
Демонстрація: 14. Спалювання простих і складних речовин.
|
|
35 |
|
Поняття про оксиди, окиснення, |
Розвивати вміння складати рівняння хімічної реакції взаємодії кисню з про- |
|
|
|
|
горіння. |
стими речовинами. Поглибити знання про складні речовини на прикладі оксидів, навички складання бінарних сполук. |
|
|
36 |
|
Взаємодія кисню зі складними речовинами (повне окиснення метану, гідроген сульфіду, глюкози). |
Розвивати вміння складати рівняння хімічної реакції взаємодії кисню зі складними речовинами. Продовжити розвивати вміння складати рівняння хімічної реакції взаємодії кисню з простими речовинами. Поглибити знання про складні речовини на прикладі оксидів, навички складання бінарних сполук. |
|
|
37 |
|
Умови виникнення і припинення горіння. Маркування небезпечних речовин. |
Розширити й поглибити знання учнів про процес горіння. З'ясувати умови виникнення і припинення горіння, механізм дії засобів пожежогасіння, заходи протипожежної безпеки в побуті й на виробництві. |
Демонстрація: 15. Маркування небезпечних речовин.
|
|
38 |
|
Семінарське |
Закріпити та |
|
|
|
|
заняття «Хімічні властивості кисню» НП. 7. Проблема забруднення повітря та способи розв’язування її. 8. Поліпшення стану повітря у класній кімнаті під час занять. |
систематизувати теоретичні знання про хімічні властивості кисню, методи його добування та збирання; виробити навички складання відповідних рівнянь реакцій. |
|
|
39 |
|
Поширеність та колообіг Оксигену в природі. Озон. Проблема чистого повітря. Застосування кисню,його біологічна роль. |
Узагальнити й систематизувати знання про хімічний елемент Оксиген та просту речовину кисень. Розглянути поширеність і колообіг Оксигену в природі. З'ясувати біологічну роль Оксигену. Виявити рівень засвоєння основних понять, навичок складання хімічних рівнянь. |
|
|
40 |
|
Розв’язування розрахункових задач і вправ. |
Узагальнення та систематизація знань з теми. Підготовка до тематичного оцінювання. |
|
|
41 |
|
Контрольна робота № 3 |
Перевірити рівень засвоєння теоретичних знань та практичних навичок з вивченого матеріалу теми. |
|
|
|
Вода (10 + 1 год) |
|||||
|
42 |
|
Вода, склад її молекули, поширеність у природі. Вода – розчинник. |
Розглянути будову молекули води як полярної молекули; розглянути загальні явища розчинності в різних розчинниках на основі принципу подібності. Дати поняття водневого зв’язку, як одного з найпоширеніших у природі, та розкрити його роль у хімічних процесах. |
|
|
|
43 |
|
Розчин і його компоненти: розчинник, розчинена речовина.
|
Сформувати поняття про розчини, розкрити суть поняття «розчин», «розчинник», «розчинена речовина» взаємозв’язок між ними. Розібрати основні ознаки класифікації розчинів; виробити вміння розрізняти типи дисперсних систем. |
|
|
|
44 |
|
Кількісний склад розчину. Масова частка розчиненої речовини. |
Ознайомити учнів із кількісним зображенням складу розчину; сформувати вміння розраховувати масову частку розчиненої речовини, масу розчиненої речовини за відомою масовою часткою, масу води для приготування розчину із заданою масовою часткою. |
Демонстрації: 16.Виготовлення розчинів.
|
|
45 |
|
Розв’язування розрахункових задач на визначення масової частки розчиненої речовини і маси розчиненої речовини в розчині. |
Закріпити вміння розв’язувати задачі на розрахунки масової частки розчиненої речовини, масу розчиненої речовини за відомою масовою часткою, масу води для приготування розчину із заданою масовою часткою. |
|
|
46 |
|
Розв’язування розрахункових задач на визначення масової частки розчиненої речовини і маси розчиненої речовини в |
Продовжити закріплення вмінь розв’язувати задачі на розрахунки масової частки розчиненої речовини, масу розчиненої речовини за відомою масовою часткою, масу води для приготування |
|
|
|
|
розчині. |
розчину із заданою масовою часткою. |
|
|
47 |
|
Виготовлення розчину |
Сформувати практичні навички у виготовленнірозчину з певною масовою часткою розчиненої речовини Перевірити знання техніки безпеки під час виконання лабораторних дослідів. Продовжити розвивати навички роботи з хімічними речовинами й лабораторним обладнанням. Формувати вміння й навички проведення хімічного експерименту й аналізу явищ, що спостерігаються, робити висновки в ході лабораторних дослідів. |
Лабораторні досліди: 5.Виготовлення водних розчинів із заданими масовими частками розчинених речовин.
|
|
48 |
|
Взаємодія води з оксидами. Поняття про гідрати оксидів: кислоти й основи. Поняття про індикатори. |
Сформувати уявлення про загальну класифікацію неорганічних речовин на підставі отриманих раніше знань про прості та складні речовини. Розширити знання про класифікацію неорганічних речовин на |
Демонстрації: 17. Взаємодія кальцій оксиду з водою. Дія водного розчину добутої речовини на індикатори. 18.Взаємодія фосфор(V) оксиду з водою. Дія водного розчину добутої |
|
|
|
|
прикладі оксидів та їх гідратів: кислот і основ. Ознайомити учнів з процесом взаємодії води з оксидами. Дати поняття індикаторів, пояснити значення їх використання для визначення кислот і основ. Розвивати логічне мислення учнів на прикладі порівняння взаємодії кислотних і основних оксидів з водою. Розвивати вміння й навички складання рівнянь хімічних реакцій на прикладі оксидів з водою. |
речовини на індикатори. Лабораторні досліди: 6. Випробування водних розчинів кислот і лугів індикаторами.
|
|
49 |
|
Значення води та розчинів у природі та житті людини. Кислотні дощі. Проблема чистої води. Охорона водойм від забруднень. Очищення води на водоочисних станціях та в домашніх умовах.
|
Розкрити особливе значення яке займають розчини у природі та житті людини. |
|
|
50 |
|
Семінарське заняття «Вода». НП. 9. Дослідження якості води з різних джерел. 10. Дослідження фізичних і хімічних властивостей води. 11. Способи очищення води в побуті. 12. Збереження чистоти водойм: розв’язування проблеми у вашій місцевості. 13. Екологоекономічний проект «Зберігаючи воду – заощаджую родинний бюджет». |
Закріпити та систематизувати теоретичні знання про розчини і його компоненти, кількісний склад розчинів, взаємодію води з оксидами, значення води та розчинів у природі та житті людини ; виробити навички складання відповідних рівнянь реакцій.
|
|
|
51 |
|
Контрольна робота № 4. |
Узагальнити й скоригувати знання |
|
|
|
|
|
учнів з теми «Вода». Визначити рівень навчальних досягнень учнів з теми, розуміння основних понять, уміння використовувати їх на практиці. |
|
|
52 |
|
Підсумковий урок |
Підбити підсумки за ІІ семестр.
|
|
Орієнтовне поурочне планування Хімія 7 клас
Урок 1
Тема: Хімія — природнича наука. Речовини та їх перетворення у навколишньому світі.
Короткі відомості з історії хімії.
Мета:Пояснити місце хімії серед наук про природу, з'ясувати цілі й завдання хімії. Сформувати знання про роль хімічної науки для розвитку народного господарства, у повсякденному житті людини. Вивчити основні етапи становлення хімії як науки. Назвати найвидатніших хіміків і охарактеризувати їх внесок у науку. Повторити відомості про речовини, вивчені в курсі
«Природознавство»
Основні поняття: хімія, речовина.
Формування компетентностей: Навчально-пізнавальна, комунікативна, саморозвитку та самоосвіти. Тип уроку:урок засвоєння нових знань.
Обладнання і реактиви: харчова сода, оцет, індикатори, розчини кислоти і лугу, пробірки, штатив для пробірок.
Хід уроку
І Актуалізація і корекція опорних знань.
• З чого складається земля під нашими ногами, сонце над головою, будинки, машини, рослини й наше власне тіло?
• Які науки вивчають оточуючий нас світ?
• Спробуйте самі назвати предмети, що так чи інакше не пов'язані з хімією.
• Наведіть приклади розмаїтості властивостей речовин.
• Спробуйте запропонувати хімічні перетворення з оточуючого вас життя.
ІІ Мотивування учіння.
На уроках природознавства ви дізналися про існування кількох наук про природу. До них належить і хімія.
ІІІ Повідомлення теми, цілей і завдань уроку.
Сьогодні ми спробуємо:
• Пояснити, що саме вивчає хімія;
• Показати місце хімії серед наук про природу;
• Пояснити цілі й завдання хімії; Сформувати знання про роль хімічної науки в розвитку народного господарства, житті людини;
• Повторити відомості про речовини та хімічні елементи, вивчені в курсі“Природознавства”
• Отримати короткі відомості з історії хімії.
ІVСприймання й усвідомлення учнями фактичного матеріалу.
1. Хімія – це наука про речовини, їх властивості, перетворення та явища, які супроводжують ці перетворення.
(Демонстрація взаємодії соди з оцтом, зміни кольорів індикаторів у різних середовищах.)
2. Місце хімії серед наук про природу.
Всі явища природи,які оточують людину, є предметом природничих наук. Кожна з них часто розглядає один і той же феномен з різних сторін. Базові природничі науки – це:
• Астрономія
• Біологія
• Географія
• Геологія
• Фізика Хімія
3. Цілі й завдання хімії.
Головне завдання хімії — з'ясування природи речовини, головний підхід до рішення цієї задачі — розкладання речовини на простіші компоненти і синтез нових речовин. Використовуючи цей підхід, хіміки навчилися відтворювати безліч природних хімічних субстанцій і створювати матеріали, що не існують в природі. Сучасна хімія є широким комплексом наук, що поступово та повільно складався в ході її тривалого історичного розвитку.
4. Роль хімічної науки в розвитку народного господарства, житті людини.
5. Короткі відомості з історії хімії.
V Осмислення зв'язків і залежностей між елементами вивченого матеріалу.
• Які природничі науки вам відомі?
• Що вивчає хімія?
• Які споріднені з хімією науки вам відомі?
• Назвіть приклади хімічних перетворень з повсякденного життя. З якого історичного моменту вважається, що хімія народилася як наука?
• Назвіть імена вчених – хіміків, які внесли свій вклад у розвиток хімії.
VІПідсумки уроку;повідомлення домашнього завдання.
Вивчити §. Виконати вправу (с. підручника).
Урок 2
Тема:Правила поведінки учнів у хімічному кабінеті. Ознайомлення з обладнанням кабінету хімії та лабораторним посудом.
Мета:Ознайомити учнів з правилами поведінки в кабінеті хімії, під час уроку, демонстраційних і лабораторних дослідів, практичних робіт. Повторити правила надання першої медичної допомоги в разі потрапляння шкідливих речовин на шкіру, в очі, у дихальні шляхи. Познайомити з основним обладнанням кабінету хімії, лабораторним посудом
Основні поняття: Хімія, хімічний експеримент, техніка безпеки, хімічний посуд, хімічне обладнання, реактиви.
Формування компетентностей: Загальнопредметна, здоров’язберігаюча,саморозвитку і самоосвіти.
Тип уроку:урок засвоєння нових знань.
Обладнання: лабораторний штатив, спиртівка, штатив з пробірками, вода, сірники, порцелянова чашка, набір лабораторного посуду.
Хід уроку
І Актуалізація і корекція опорних знань.
1. Що вивчає хімія і яке місце серед природничих наук має?
2. Як виникла і розвивалася хімія як наука?
3. Які завдання стоять перед сучасною хімією?
ІІ Мотивування учіння.
Щодня нас оточують мільйони хімічних речовин. Чи завжди ми правильно поводимося з ними? Хімія не прощає помилок. Тому перше, що потрібно знати, перш ніж вивчати хімію, — як правильно використовувати хімічні речовини та які небезпеки в них таяться. Сьогодні ми з вами саме про це і поговоримо.
ІІІПовідомлення теми, цілей і завдань уроку.
ІVСприймання й усвідомлення учнями фактичного матеріалу.
1. Правила техніки безпеки під час роботи в хімічному кабінеті
Попереджувальні знаки застерігають від можливої небезпеки.

![]()
2. Устаткування кабінету. Лабораторний посуд.
V Осмислення зв'язків і залежностей між елементами вивченого матеріалу.
Заповнити таблицю про призначення лабораторного посуду
ЛАБОРАТОРНЕ ОБЛАДНАННЯ
|
№ з/п |
Назва лабораторного обладнання і посуду |
Призначення лабораторного обладнання |
|
|
1 |
Пробірка хімічна |
Для проведення дослідів |
|
|
2 |
Склянка з носиком |
Для зберігання речовин, для проведення |
|
|
|
|
найпростіших хімічних операцій |
|
|
3 |
Ступка з товкачиком |
|
Для подрібнення та розтирання речовин |
|
4 |
Колба конічна плоскодонна |
та |
Для зберігання речовин, для проведення різних хімічних операцій |
|
5 |
Колба круглодонна |
|
Для нагрівання речовин |
|
6 |
Лійка конусоподібна |
|
Для наливання рідин і для фільтрування |
|
7 |
Мірний циліндр |
|
Для вимірювання об’єму рідин |
|
8 |
Скляна паличка |
|
Для перемішування рідин |
|
9 |
Чашка порцелянова |
|
Для випарювання розчинів |
|
10 |
Лабораторний штатив |
|
Для закріплення посуду під час дослідів |
|
11 |
Штатив для пробірок |
|
Для розміщення пробірок |
|
12 |
Ложка порцелянова, шпатель |
Для набирання твердих речовин |
|
|
13 |
Пробіркотримач |
Для закріплення пробірок під час нагрівання в полум’ї спиртівки |
|
|
14 |
Спиртівка |
Для здійснення нагрівання |
|
VІУзагальнення і систематизація знань.
1. Де зберігаються необхідні для роботи реактиви та посуд ?
2. Що використовують для вимірювання маси речовини ?
3. Що використовують для того, щоб перемішати вміст рідини в конічній колбі ?
4. За допомогою чого слід розтирати тверду речовину ?
5. Щоб виміряти об’єм рідини чи можна використати мірний стакан?
6. Що використовують для спалювання твердих речовин ?
7. За допомогою чого можна виміряти 50 мл води ? 8. Чи можна плоскодонну колбу поставити на стіл?
9. Для чого використовують лійку?.
10. Що використовують для перемішування рідини?
11. Для чого на скляній паличці є гумовий наконечник?
12. Коли і навіщо користуються пробірко тримачем?
13. Чи можна на столі разом з хімічними реактивами класти продукти харчування і чому?
VІІ Підсумки уроку;повідомлення домашнього завдання.
Вивчити §. Виконати вправу (с. підручника).
Урок 3
Тема:Практична робота №1
Правила безпеки під час роботи в хімічному кабінеті. Прийоми поводження з лабораторним посудом, штативом і нагрівними приладами. Будова полум’я.
Мета:Формувати навички практичної роботи; перевірити навички поводження під час роботи в кабінеті хімії, з хімічними речовинами і лабораторним обладнанням. Сформувати вміння використовувати хімічний посуд, лабораторний штатив, нагрівальні прилади.
Обладнання і реактиви: лабораторний штатив, спиртівка, штатив з пробірками, вода, сірники, порцелянова чашка.
Формування компетентностей: Загальнопредметна, здоров’язберігаюча,саморозвитку і самоосвіти.
Тип уроку:Урок практичного застосування знань, навичок і вмінь.
Хід уроку
І Перевірка домашнього завдання, актуалізація і корекція опорних знань, навичок і вмінь.
Варіант І
1. Входити до кабінету хімії можна:
а) без дозволу вчителя;
б) з дозволу вчителя;
в) з дозволу старости класу.
2. Під час роботи на робочому столі можуть знаходитися:
а) портфель;
б) верхній одяг;
в) бутерброд;
г) підручник хімії;
д) письмове приладдя.
3. Під час роботи слід використовувати тільки реактиви в склянках: а) без етикеток;
б) з етикеткою, на якій написано формулу і назву речовини.
4. Залишки реактивів:
а) необхідно виливати або висипати назад у склянку, з якої вонибули взяті;
б) не можна виливати або висипати назад у банку, в якій вони містилися;
в) слід віддати лаборанту;
г) можна злити або зсипати разом в одну склянку.
5. Нагріваючи пробірку, необхідно:
а) тримати її пробіркотримачем;
б) тримати її руками;
в) направляти отвором до себе;
г) направляти отвором на товариша;
д) направляти убік від усіх.
6. На смак:
а) можна куштувати всі реактиви;
б) не можна куштувати жодні речовини;
в) можна куштувати деякі речовини.
7. Після закінчення роботи:
а) можна залишити неприбраним робоче місце;
б) слід самому прибрати робоче місце;
в) необхідно вимити руки;
г) усі невикористані реактиви злити або зсипати разом в одну склянку.
Варіант ІІ
1. На робочому місці:
а) слід підтримувати порядок;
б) може бути безладдя;
в) можна тримати зайві речі.
2. Виконувати досліди потрібно:
а) спокійно;
б) швидко;
в) стоячи;
г) сидячи;
д) голосно розмовляючи.
3. Виконувати необхідно тільки ті досліди, що:
а) хочеться виконати самому;
б) дозволені вчителем або погоджені з ним.
4. Для дослідів необхідно:
а) різні речовини набирати однією і тією ж ложкою або піпеткою;
б) набирати кожну речовину окремою ложкою або піпеткою;
в) набирати речовини в кількостях, зазначених в інструкції;
г) набирати речовини так, щоб заповнити пробірку цілком.
5. Посуд, з якого взяли реактиви, слід:
а) відразу закрити й поставити на місце;
б) поставити на місце, не закриваючи пробкою;
в) закрити й поставити на місце після виконання всіх дослідів.
6. Щоб пробірка не перегрілася і не лопнула:
а) її нагрівають тільки внизу;
б) її нагрівають тільки вгорі;
в) спочатку прогрівають усю пробірку, а потім ту її частину, де знаходиться речовина.
7. У разі потрапляння речовин в очі або на руки необхідно:
а) промити уражене місце великою кількістю води;
б) протерти ганчірочкою або долонею;
в) повідомити вчителя;
г) розповісти товаришеві.
ІІ Повідомлення теми, цілей і завдань уроку.
ІІІ Актуалізація мотивації учіння учнів.
Актуалізація знань учнів про необхідність дотримання правил техніки безпеки під час роботи в хімічному кабінеті. (Бесіда.)
ІVОсмислення змісту й послідовності застосування способів виконання дій.
Вступне слово вчителя.
Інструктаж з техніки безпеки під час виконання практичної роботи.
1. Будова лабораторного штатива, прийоми поводження з ним.
а)Ознайомтеся з будовою штатива, схематично зобразіть його і запишіть
назви його деталей. (Позначте на малюнку відповідними цифрами.)
б) Виконайте такі операції:
• закріпіть муфту на середині стержня штатива. Пересуньте її вгоруі опустіть вниз. Закріпіть у муфті тримач.
• закріпіть на штативі кільце, не знімаючи тримача. Що для цьоготреба зробити?
• закріпіть пробірку у тримачі штатива. Це треба зробити так, щобпробірка не випадала і щоб її можна було переміщувати, тобто пробірку треба затиснути, але не дуже сильно, бо вона може тріснути. Закріплювати пробірку треба не на середині, а біля отвору. Щоб вийняти пробірку зі штатива, треба послабити гвинт.
• помістіть на кільце штатива порцелянову чашку.
2. Будова спиртівки. Робота зі спиртівкою.
а)Вивчіть будову спиртівки, зробіть схематичний малюнок і запишіть назви її деталей.
б) Робота зі спиртівкою.
• перш ніж запалити спиртівку, перевірте, чи є у ній спирт та чи хороший ґніт;
• спирт можна наливати тільки у погашену спиртівку. Якщо спиртівка горить, наливати спирт категорично заборонено;
• для запалення спиртівки зніміть ковпачок, розправте ґніт і піднесіть до ґнота запалений сірник;
• користуючись спиртівкою, не запалюйте її від іншої спиртівки, бо може вилитися спирт і виникнути пожежа;
• щоби погасити полум'я спиртівки, необхідно закрити її ковпачком, підносячи його збоку. Дмухати на запалену спиртівку категорично забороняється. Це може спричинити пожежу;
• закріпіть у лапці штатива пробірку з 1-2 мл води і нагрійте всю пробірку, а потім ту частину, де знаходиться вода. Коли вода закипить — нагрівання припиніть.
3. Будова полум’я.
• Запаліть спиртівку.
• Розгляньте будову полум’я.
• Зробіть схематичний малюнок кольоровими олівцями.
• За допомогою дерев’яної скіпки перевірте як швидко вона буде загорятися в різних частинах полум’я.
• Позначте на малюнку зміну температури полум’я у різних його частинах.
4. Зробіть узагальнюючий висновок про правила поведінки в кабінетіхімії, правилакористування лабораторним обладнанням, нагрівальнимприладом.
VСамостійне виконання учнями завдань під контролем і за допомогою вчителя.
VІ Звіт учнів про роботу і теоретичне обґрунтування отриманих результатів.
VІІ Підсумки уроку й повідомлення домашнього завдання.
Вивчити §. Виконати вправу (с. підручника).
Урок 4
Тема:Фізичні тіла. Матеріали. Речовини.
Мета: Активізувати знання про поняття «речовина», «матеріал», «тіло». Навчити учнів розрізняти фізичні тіла, речовини, матеріали.
Основні поняття: речовина, властивості речовин, агрегатний стан, тіло, матеріал.
Формування компетентностей: компетентність продуктивної праці, саморозвитку та самоосвіти, соціальна та комунікативна.
Тип уроку:урок засвоєння нових знань.
Хід уроку
І Мотивація навчальної діяльності учнів.
Що вивчає хімія?
ІІ Сприймання і усвідомлення учнями нового навчального матеріалу
1. Різноманітність речовин. (Розповідь вчителя з демонструванням.)
Вам уже відомо багато речовин. Одні з них природні (вода, кисень, азот), інші — штучно добуті (поліетилен, капрон, нейлон, поліхлорвініл). Всього відомо понад 20000000 речовин. Вчені щоденно "відкривають" нові хімічні речовини у природі, а інші добувають синтетичним шляхом.
2. Речовина, матеріал, тіло. (Розповідь учителя з використанням схеми.)
|
речовина |
матеріал |
тіло |
|
вид матерії
має масу |
речовини,що використовуються для виготовлення предметів,фізичних тіл
|
Все, що має масу і об’єм |
|
мідь, |
мідь, |
мідна пластинка, |
|
золото, алюміній, залізо |
золото, алюміній, залізо |
золота обручка, алюмінієвий дріт, залізний цвях |
3. Властивості речовин – це ознаки, за якими речовина відрізняється від іншої або подібна до неї.
|
Властивості речовин |
|
|
фізичні |
хімічні |
|
Визначаються спостереженням, вимірюванням без перетворювання речовини. |
Визначаються в процесі перетворювання одних речовин на інші. |
4. Агрегатний стан
|
|
Агрегатний стан речовини |
|
|
Газ |
Рідина |
Тверда речовина |
|
Не має форми, об’єму, розширюється і стискається |
Не має форми, має об’єм, стискається погано |
Має форму, має об’єм, стискається погано |
Агрегатний стан – це не фізична властивість речовини взагалі, а лише стан, в якому вона перебуває за певних умов.
Речовина, змінюючи агрегатний стан, не перетворюється на іншу!
(водяня пара, рідка вода, лід)
ІІІ Осмислення, узагальнення і систематизація знань
1. З наведеного переліку випишіть окремо назви речовин і тіл: цегла, сірка, залізо, підкова, мідь, кисень.
2. Виберіть ряд , в якому перелічені тільки назви речовин .
а) залізо , гума , срібло , вода;
б) м’яч, іграшка, гума, шина;
в) вода , лід , ванна, пара;
3. Агрегатні стани , в яких може перебувати речовина вода:
а) рідкий , пароподібний , твердий;
б) рідкий , твердий , газоподібний ;
в) газоподібний , м’який, рідкий;
ІV Домашнє завдання
Вивчити §. Виконати вправу (с. підручника).
Урок 5
Тема:Як вивчають хімічні сполуки та явища. Спостереження й експеримент у хімії.
Мета:Познайомити учнів із методами вивчення хімічних сполук і явищ. Дати поняття про спостереження й експеримент як методи дослідження фізичних і хімічних властивостей речовин і явищ у хімії
Основні поняття: спостереження,експеримент, гіпотеза, закон, теорія.
Формування компетентностей: компетентність продуктивної праці, саморозвитку та самоосвіти.
Тип уроку:урок засвоєння нових знань.
Хід уроку І Актуалізація опорних знань учнів.
• Що таке властивість. (Це ознаки, за якими одні речовини подібні або відрізняються одна від одної)
• Які властивості ми знаємо? (Фізичні та хімічні)
• Які властивості називаються фізичними? Наведіть приклади.
• Які властивості називаються хімічними?
ІІ Мотивація навчальної діяльності учнів. • Якими способами можна досліджувати властивості речовин? (Записуємо пропозиції учнів на дошці та коментуємо.) Виділимо основні:
• спостереження,
• експеримент.
ІІІСприймання і усвідомлення учнями нового навчального матеріалу Розповідь учителя
Усі наукові відкриття відбувалися завдяки людям, які вміли спостерігати за явищами навколо себе, аналізувати, робити висновки. Сміливці наважувалися на небезпечні експерименти, що допомагали зрозуміти явища, які вони спостерігали.
Спостереження — один з перших методів вивчення властивостей речовин з допомогою органів дотику.
Спостереження — цілеспрямоване, спеціально організоване сприйняття предметів і явищ.
На підставі аналізу явищ учені висувають гіпотези.
Гіпотеза — наукове припущення, що висувається для пояснення визначених явищ.
Великий крок уперед — це експеримент. З метою підтвердження гіпотези вчені організовують проведення експериментів.
Експеримент — цілеспрямований і контрольований вплив на досліджуваний об'єкт за певних умов.
Накопичення експериментальних даних, їх систематизація, аналіз дозволяють людині не лише вивчати, але й передбачати властивості речовин. На підставі отриманих даних формулюються закони й теорії.
Закон — теоретично обґрунтоване і практично доведене наукове твердження.
Необхідно чітко розуміти, що людина лише відкриває закони природи, вони існують незалежно від нашої свідомості.
Теорія — вища досконала форма наукового відбиття дійсності.
З допомогою теорій можна не лише пояснити явища, але й передбачати нові явища, речовини із заданими властивостями.
• Наведіть приклади використання спостережень для вивчення природних явищ.
(Учні наводять свої приклади, клас аналізує, коригує.) ,
• Що таке експеримент?
• Наведіть приклади дослідження фізичних і хімічних властивостей експериментально. (Дивитися, як кипить вода, — спостереження, вимірювати температуру кипіння — експеримент)
• Які методи проведення експерименту ви вивчали в курсі природознавства?
Записуємо всі запропоновані методи на дошці:
• зважування;
• вимірювання;
• порівняння.
ІV Осмислення, узагальнення і систематизація знань
1) Для чого люди досліджують різні речовини та явища?
2) Якими методами ми користуємося для вивчення властивостей речовин?
3) Спробуймо розробити план проведення експерименту з вивчення розчинності речовин у воді. Наприклад, дослідження розчинності у воді речовин: пісок, сода, рослинна олія, сіль.
V Домашнє завдання
Вивчити §. Виконати вправу (с. підручника).
Урок 6
Тема:Фізичні властивості речовини.
Мета:Узагальнити й поглибити знання учнів про властивості речовин із попередніх курсів «Природознавство» і «Фізика».
Основні поняття: речовина, властивості речовин
Тип уроку:урок засвоєння нових знань.
Формування компетентностей: компетентність продуктивної праці, саморозвитку та самоосвіти,здоров’язберігаюча, соціальна та комунікативна.
Обладнання: зразки речовин з різними фізичними властивостями в пробірках (цукор, сіль, вода, крейда, сірка), колекція металів (мідь, цинк, алюміній), вода в склянках, скляні шпателі, скляні палички, пробірки, спиртівка, пробіркотримач.
Хід уроку
І Актуалізація опорних знань учнів.
• Що таке властивість.
• Які властивості ми знаємо?
• Якими способами можна досліджувати властивості речовин?
ІІ Мотивація навчальної діяльності учнів.
• Які властивості називаються фізичними?
ІІІ Сприймання і усвідомлення учнями нового навчального матеріалу
|
|
властивості |
|
|
фізичні |
|
хімічні |
|
а) колір; б) блиск; в)запах; г) смак; ґ) розчинність у воді; д) твердість; є) пластичність; є) електропровідність; ж) теплопровідність. |
|
Виявляються лише у процесі перетворення одних речовин в інші. (Наприклад, здатність кисню підтримувати горіння.) |
На столах в учнів - колекція речовин з різними фізичними властивостями. Прості речовини: мідь, цинк, алюміній, сірка. Складні речовини: цукор, сіль, вода, крейда, парафін.
Лабораторний дослід № 1. Ознайомлення з фізичним властивостями речовин
Інструктивна картка
а) Опишіть властивості виданих вам речовин і заповніть таблицю.
б) Щоб визначити розчинність речовини у воді, треба невелику її кількість
насипати у пробірку (лише вкрити дно) і долити 1 мл води. Для прискорення розчинення легенько струшуйте пробірку, тримаючи її на рівні очей.
в) Пам'ятайте, що неможна закривати пробірку пальцем і сильно збовтувати
рідину. Це може спричинити її попадання на шкіру і одяг.
Дослід 1. Роздивіться прості речовини мідь, цинк, алюміній, сірку.
Порівняйте їхні фізичні властивості та запишіть у таблицю.

Зробіть висновок.
Дослід 2. Роздивіться складні речовини цукор, сіль, крейду,парафін. Порівняйте їхні фізичні властивості та запишіть у таблицю.
|
№з/п |
Властивість |
цукор |
сіль |
крейда |
парафін |
|
1 |
Агрегатний стан |
|
|
|
|
|
2 |
Колір |
|
|
|
|
|
3 |
Запах |
|
|
|
|
|
4 |
Розчинність у воді |
|
|
|
|
Зробіть висновок про ознаки подібності та відмінностей фізичних властивостей речовин.
Дослід 3. Оцініть температуру плавлення (легкоплавка або тугоплавка речовина).
З допомогою шпателя помістіть у три пробірки одну дрібку цукру, солі або парафіну відповідно. Закріпіть пробірку в пробіркотримачі й, дотримуючись правил техніки безпеки й нагрівання, по черзі нагрійте кожну пробірку і потримайте на вогні 1-2 хв.
Що спостерігаєте? Зробіть висновок.
А тепер зробімо загальний висновок: за фізичними властивостями речовини можуть відрізнятися одна від одної або бути подібними.
ІV Осмислення, узагальнення і систематизація знань
1. З якими фізичними властивостями ми познайомилися під час виконання лабораторного досліду?
2. Якими методами ми скористалися для вивчення властивостей речовин?
V Домашнє завдання
Вивчити §. Виконати вправу (с. підручника).
Урок 7
Тема:Чисті речовини й суміші. Способи розділення сумішей.
Мета:Повторити поняття «чисті речовини» та «суміші», основні способи розділення сумішей. Продовжити знайомство з лабораторним обладнанням і методикою проведення хімічного експерименту.
Основні поняття: чисті речовини, суміші, відстоювання, фільтрування, випаровування, кристалізація, дистиляція, хроматографія, фільтр, фільтрат.
Тип уроку:урок засвоєння нових знань.
Формування компетентностей: компетентність продуктивної праці, саморозвитку та самоосвіти, соціальна та комунікативна.
Обладнання і реактиви: циліндр, хімічні склянки, ділильна лінійка, фарфорова чашка, спиртівка, прилад для дистиляції,магніт, вода, залізні ошурки, тирса, кухонна сіль, олія, пісок.
Хід уроку
І Актуалізація опорних знань учнів.
• Що таке властивість.
• Які властивості ми знаємо?
• Якими способами можна досліджувати властивості речовин?
• Які властивості називаються фізичними?
• Назвіть фізичні властивості води.
ІІ Мотивація навчальної діяльності учнів.
Чи можна вивчати загальні властивості води, якщо для цього використовувати морську воду?
ІІІ Сприймання і усвідомлення учнями нового навчального матеріалу
1. Щотаке чисті речовини? (Бесіда з учнями.)
Учні згадують молекулярну теорію з курсу фізики і роблять висновок, що чисті речовини складаються з частинок одного виду (наприклад, з однакових атомів, з однакових молекул) і тому мають сталі фізичні властивості.
Вчитель доповнює, що абсолютно чистих речовин у природі не існує та й добути їх штучно практично неможливо.
2.Поняття про суміш.
Суміш — це сукупність різних речовин, що становлять одне фізичне тіло.
До складу суміші входять дві або більше чистих речовин.
Речовини, що входять до складу сумішей, зберігають притаманні їм властивості.
Вчитель складає схему:
|
Чисті речовини |
Суміші |
|
|
Сталі фізичні властивості, складаються з частинок певного виду(однакових атомів, молекул). Залізо, алюміній, сода, дистильована вода, цукор, кисень. |
Сукупність різних речовин, що складають одне фізичне тіло. Речовини, що входять до складу суміші, зберігають притаманні їм властивості. |
|
|
однорідні |
неоднорідні |
|
|
Повітря, |
Суміш заліза та |
|

3. Способи розділення сумішей. (Самостійна робота учнів.)
Завдання. Опрацьовуючи матеріал підручника про розділення сумішей, накресліть у зошиті схему основних способів розділення неоднорідних і одноріднихсумішей. До кожного способу наведіть приклади.
|
Методи розділення сумішей |
||||
|
неоднорідні |
однорідні |
|||
|
відстоювання |
фільтрування |
Дія магніту |
випарювання |
дистиляція |
|
пісок+вода, олія+вода |
тирса+вода, пісок+вода. |
залізні і деревні ошурки. |
водний розчин кухонної солі. |
нафта, природна вода. |
4.Виділення речовин з неоднорідної суміші шляхом відстоювання.
Вчитель вводить поняття про відстоювання та демонструє дослід із розділення суміші тирси і залізних ошурок, олії і води (за допомогою ділильної лійки).
5.Розділення суміші розчинних і нерозчинних у воді речовин шляхом фільтрування.
Вчитель демонструє фільтрування суміші кухонної солі з піском.
Знайомить учнів з поняттями фільтр, фільтрат.
6.Виділення з неоднорідної суміші речовин, здатних намагнічуватися. Вчитель демонструє дослід із розділення суміші порошків заліза і сірки за допомогою магніту.
7.Випарювання і кристалізація — спосіб виділення твердих, розчинних у воді речовин.
Вчитель демонструє випарювання розчину кухонної солі — хлориду натрію — у воді.
8.Дистиляція — спосіб розділення рідин (розчинних одна в одній), що грунтується на відмінності їхніх температур кипіння. Леткі рідини випаровуються, а потім пара конденсується. Одержання дистильованої води зі звичайної питної.
(Вчитель демонструє дослід — добування дистильованої води шляхом випаровування.)
ІV Осмислення, узагальнення і систематизація знань Завдання 1. Вставте пропущені слова:
Чисті речовини складаються______________ і мають сталі фізичні властивості.
Суміші складаються______________ що складають одне фізичне тіло.
Речовини, що входять до складу суміші, ____________ притаманні їм властивості.
Компоненти однорідної суміші _________________ виявити спостереженням.
Компоненти неоднорідної суміші _________________ виявити спостереженням.
До методів розділення сумішей можна віднести _________________________.
Завдання 2. Назвіть ознаки, за якими можна розрізнити чисту речовину і суміш. Наведіть приклади.
Завдання 3.Дано суміш: а) спирту і води; б) річкового піску і цукру; в) мідних і залізних ошурків; г) води і бензину. Як розділити ці суміші? Поясніть, на яких властивостях компонентів сумішей грунтується їх розділення.
V Домашнє завдання
Вивчити §. Виконати вправу (с. підручника).
Урок 8
Тема:Практична робота №2 Розділення неоднорідної суміші.
Мета:Формувати навички практичної роботи; перевірити навички поводження під час роботи в кабінеті хімії, з хімічними речовинами і лабораторним обладнанням. Сформувати вміння використовувати хімічний посуд, лабораторний штатив, нагрівальні прилади. Поглибити знання про способи розділення сумішей.
Основні поняття: чисті речовини, суміші, відстоювання, фільтрування, випаровування, кристалізація, фільтр, фільтрат.
Обладнання і реактиви: лабораторний штатив з малим кільцем, дві хімічних склянки місткістю 50 мл кожна, скляна паличка з гумовим наконечником, лійка, ложечка для спалювання речовин, мірні циліндри, спиртівка, сірники, фільтрувальний папір, випарювальна чашка, забруднена кухонна сіль, дистильована вода.
Формування компетентностей: Загальнопредметна, здоров’язберігаюча,саморозвитку і самоосвіти.
Тип уроку:Урок практичного застосування знань, навичок і вмінь.
Хід уроку
І Перевірка домашнього завдання, актуалізація і корекція опорних знань, навичок і вмінь.
1. Чим відрізняються чисті речовини і суміші?
2. Які бувають суміші?
3. Які методи розділення сумішей вам відомі?
ІІ Повідомлення теми, цілей і завдань уроку.
ІІІ Актуалізація мотивації учіння учнів.
Як можна розділити суміш кухонної солі і піску?
ІVОсмислення змісту й послідовності застосування способів виконання дій.
Вступне слово вчителя.
Інструктаж з техніки безпеки під час виконанняпрактичної роботи.
Інструктивна картка.
1. У хімічний стакан місткістю 50 мл влийте 10 мл дистильованої води і розчиніть в ній одну ложечку забрудненої кухонної солі. Щоб прискорити розчинення солі, розчин помішуйте скляною паличкою з гумовим наконечником.
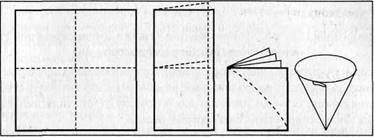
2.Складіть фільтр у послідовності, показаній на малюнку, або повторюючи всі операції за вчителем. Слідкуйте, щоб конуси фільтра і лійки співпадали.
3.Фільтрування. Спочатку змочіть фільтр чистою водою, щоб він щільно прилипав до лійки. Лійку з фільтром уставте у пробірку і по скляній паличці наливайте забруднений розчин солі. Слідкуйте, щоб не пошкодити фільтр. Наливайте рідину невеликими порціями, аби вона не доходила до країв фільтра на 5 мм.
4.Один мілілітр очищеного розчину кухонної солі налийте у
випарювальну чашку і нагрійте на полум'ї спиртівки до появи дрібних кристаликів солі. Для того, щоб розчин при випарюванні не розбризкувався, його потрібно періодично перемішувати скляною паличкою. Коли в чашці з'являться кристали солі, нагрівання припиніть. Порівняйте сіль, що випала в чашці, з тією, яку вам видали на початку роботи.
5.Промийте використаний посуд і поставте на місце.
6.Оформіть роботу таким чином:
а) Замалюйте схематичний малюнок фільтрування розчину кухонної
солі і зробіть пояснюючі підписи до нього.
б) Заповніть таблицю.

в) Зробіть висновки.
г) Виконайте додаткові завдання. Складіть план розділення сумішей:
1.Цукор, мідні і залізні ошурки, тирса;
2.Кухонна сіль, порошок сірки і залізні ошурки.
VСамостійне виконання учнями завдань під контролем і за допомогою вчителя.
VІ Звіт учнів про роботу і теоретичне обґрунтування отриманих результатів.
VІІ Підсумки уроку й повідомлення домашнього завдання.
Вивчити §. Виконати вправу (с. підручника).
Урок 9
Тема:Атоми, хімічні елементи, їхні назви й символи.
Мета:Поглибити знання учнів про атоми і молекули як складні структурні частинки речовини. На основі будови атома дати поняття про хімічний елемент як певний тип атомів. Познайомити учнів із сучасною українською науковою номенклатурою. Дати уявлення про поширення хімічних елементів у природі.
Основні поняття: атом, молекула, хімічний елемент, номенклатура.
Формування компетентностей: компетентність продуктивної праці, саморозвитку та самоосвіти, соціальна та комунікативна.
Тип уроку:комбінований.
Хід уроку
І Перевірка домашнього завдання.
Виконання тестового завдання
1. Вкажіть назву явища, що відбувається з зміною агрегатного стану та форми речовини:
а) географічне; б)біологічне в) хімічне; г) фізичне
2. Агрегатні стани , в яких може перебувати речовина вода:
а) рідкий , пароподібний , твердий;
б) рідкий , твердий , газоподібний ;
в) газоподібний , м’який, рідкий;
3. Суміші бувають
а) однорідні та неоднорідні;
б)однорідні та чисті ;
в) неоднорідні та рідкі;
4. Виберіть спосіб за допомогою якого можна розділити суміші, що
складаються із солі та заліза
а) відстоювання ; б) фільтрування; в) дія магнітом; г) випаровування;
5. Які суміші можна розділити фільтруванням
а) суміші піску і глини;
б) суміші спирту і мідних ошурків ;
в) суміші води і бензину ;
г) суміші води з кусочками пластмаси;
6. Для поділу суміші води і глини потрібно скористатися методом: а) дистиляції;
б) фільтрування.
7. Із запропонованого списку виберіть фізичні властивості речовин:
а) колір;
б) блиск;
в) хімічні взаємодії з іншими речовинами;
г) тепло- і електропровідність.
8. Залізо, сіль, стеарин, срібло — це:
а) фізичні тіла;
б) речовини;
в) хімічні явища.
9.У яких агрегатних станах можуть знаходитися речовини? Чи може одна і таж речовина знаходитися у різних агрегатних станах? Від чого це залежить?
10.Які види сумішей ви знаєте? Наведіть приклади.
ІІ Актуалізація і корекція опорних знань.
• Що таке речовина?
• З чого складається речовина?
ІІІ Повідомлення теми, цілей і завдань уроку.
ІVМотивування учіння.
VСприймання й усвідомлення учнями фактичного матеріалу.
1. Атом— це найдрібніша хімічно неподільна частина речовини.
(Демонстрування досліду — пропускання постійного електричного
струму крізь воду.)
Пояснення досліду: молекули води розпадаються і утворюються хімічно неподільні частинки — атоми Оксигену і Гідрогену. Потім атоми сполучаються по два і з двох молекул води утворюється одна двохатомна молекула кисню і дві двохатомні молекули водню. Вчитель демонструє моделі молекул води, кисню, водню та замальовує на дошці схему розпаду молекул води і утворення молекул кисню та водню.
Будова атома: ядро і електронна оболонка.
2. Хімічний елемент. Атом як форма існування хімічного елемента. Хімічні елементи метали і неметали, їх властивості. (Розповідь вчителя.)
Записи на дошці.
|
Типи атомів |
Хімічний елемент |
|
Оксигену Гідрогену Сульфуру Феруму Алюмінію |
Оксиген Гідроген Сульфур Ферум Алюміній |

|
Форми існування |
|
|
|
Прості речовини |
Поодинокі атоми |
Складні речовини |
|
Атоми, зв’язані хімічним зв’язком з іншим атомом того ж елемента |
За умов високих температур |
Атоми, зв’язані хімічним зв’язком з атомами інших елементів |
|
Водень, кисень, графіт |
Інертні гази |
|
3. Назви і символи хімічних елементів
|
Всі хімічні елементи мають латинську назву.
|
Oxygenium(оксигеніум) Sylfur(сульфур) Hydrogenium(гідрогеніум) Ferrum(ферум) |
|
Одна або дві літери латинської назви – це символи хімічних елементів(Класифікацію елементів створив шведський хімік Й. Берцеліус у 1814 р.) |
O - Оксиген S - Сульфур H - Гідроген Fe - Ферум |
4. Поширення хімічних елементів у природі. (Розповідь вчителя з демонструванням діаграми "Поширення хімічних елементів у природі".) (% за масою).
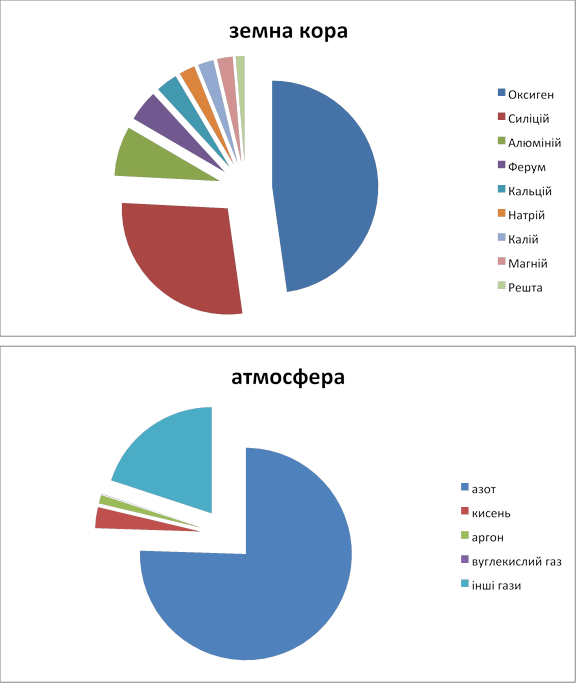
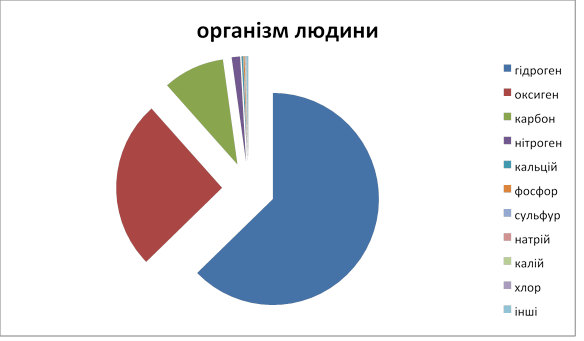
VІОсмислення зв'язків і залежностей між елементами вивченого матеріалу.
Заповніть таблицю.
|
Символ |
Вимова |
Назва |
|
Аg |
аргентум |
Аргентум |
|
Н |
|
Гідроген |
|
О |
|
Оксиген |
|
N |
|
Нітроген |
|
Fe |
ферум |
|
|
К |
|
|
|
Si |
силіцій |
|
|
Са |
|
|
|
Р |
|
|
|
S |
|
|
VІІУзагальнення і систематизація знань.
У результаті розкладання однієї складної речовини добули купрум оксид і воду, а іншої—калій хлорид і кисень. Які хімічні елементи входили до складу цих речовин?
VІІІПідсумки уроку;повідомлення домашнього завдання.
Вивчити §. Виконати вправу (с. підручника).
Урок 10
Тема:Поняття про періодичну систему хімічних елементів Д. І. Менделєєва.
Мета:Познайомити учнів із будовою періодичної системи хімічних елементів Д.І.Менделєєва. Сформувати початкові навички визначення положення хімічного елемента в періодичній системі. Продовжити знайомство із символами й назвами елементів за сучасною українською номенклатурою.
Основні поняття: періодична система хімічних елементів; великі та малі періоди; групи — (головні та побічні підгрупи).
Тип уроку:урок засвоєння нових знань.
Формування компетентностей: Загальнопредметна, комунікативна, інформаційна., саморозвитку та самоосвіти,продуктивної творчості.
Обладнання: Періодична система хімічних елементів Д.І. Менделєєва.
Хід уроку
І Актуалізація і корекція опорних знань.
• Що таке речовина?
• З чого складається речовина?
• Що таке хімічний елемент?
• Які ви знаєте хімічні елементи?
• Які є форми існування хімічних елементів?
• Які назви і символи мають хімічні елементи?
ІІ Повідомлення теми, цілей і завдань уроку.
ІІІ Мотивування учіння.
Розвиток будь-якої науки починається з накопичення багатьох фактів, які згодом підлягають класифікації. Такий же шлях пройшла і хімія. Після відкриття певного числа хімічних елементів виникла потреба у їх класифікації. Багато вчених робили спроби класифікувати елементи відповідно до їх властивостей. І тільки у 1869 році російський вчений Д.І.Менделєєв запропонував таблицю, в якій розмістив відомі на той час 63 хімічних елементи. Її було названо періодичною системою хімічних елементів.
ІVСприймання й усвідомлення учнями фактичного матеріалу.
1. Періоди і групи — основні структурні одиниці системи.
2. Клітинка періодичної системи.
3. Порядковий номер.
4. Заряд ядра.
V Осмислення зв'язків і залежностей між елементами вивченого матеріалу.
1. Які відомості про хімічний елемент можна отримати із періодичної системи?
• символ;
• назву;
• порядковий номер;
• заряд ядра атома;
• кількість електронів в атомі;
• номер періоду;
• номер групи.
VІУзагальнення і систематизація знань.
1. Знайдіть у періодичній системі елемент із порядковим номером 5 і випишіть у зошит відомості про нього.
2. Заповніть таблицю:
|
Елемент |
Розміщення у періодичній системі |
Характеристика атома |
|||
|
символ |
назва |
№ періоду |
№ групи |
Заряд ядра |
Кількість електронів |
|
Na |
|
|
|
|
|
|
|
Магній |
|
|
|
|
|
|
|
|
|
+20 |
|
VІІПідсумки уроку;повідомлення домашнього завдання.
Вивчити §. Виконати вправу (с. підручника).
Урок 11
Тема:Атомна одиниця маси. Відносна атомна маса хімічних елементів.
Мета:Розширити знання учнів про періодичну систему елементів; закріпити знання про хімічний елемент, хімічну символіку. Ознайомити учнів з поняттям абсолютної та відносної атомної маси, одиницею вимірювання відносної атомної маси — атомною одиницею маси (а.о.м.). Навчити визначати відносну атомну масу за періодичною системою.
Основні поняття: періодична система хімічних елементів, хімічний елемент, хімічна символіка, абсолютна та відносна атомна маса, атомна одиниця маси (а.о.м.).
Тип уроку:урок засвоєння нових знань.
Формування компетентностей: Загальнопредметна, комунікативна, інформаційна., саморозвитку та самоосвіти,продуктивної творчості.
Обладнання: Періодична система хімічних елементів Д.І. Менделєєва.
Хід уроку
І Актуалізація і корекція опорних знань.
1. Які відомості про хімічний елемент можна отримати із періодичної системи?
2. Як можна визначити заряд ядра атома і число електронів?
3. Що таке період?
4. Що таке група?
ІІ Повідомлення теми, цілей і завдань уроку.
ІІІМотивування учіння.
Важливою характеристикою атома є його маса. Оскільки атоми є дуже дрібними частинками, їхні маси неможливо визначити за допомогою зважування, але все ж таки ці значення було визначено за допомогою розрахунків.
Маса атома Урану – найважчого серед усіх атомів становить
0,000 000 000 000 000 000 000 4г (4*10-22 г)
Оперувати такими значеннями незручно, тому замість абсолютних атомних мас використовують їх відносні атомні маси.
ІVСприймання й усвідомлення учнями фактичного матеріалу.
1. Що таке відносна атомна маса?
1 а. о. м = 1/12 т (атома С) = 1.66 · 10 -27 кг.
т (атома Н) = 1.67 · 10 -27 кг.
Аг (елемента) =m(атома елемента)/1а.о.м.
Ar(H)= 1.66 · 10 -27 кг./ 1.66 · 10 -27 кг.=1а.о.м.=1.
Ar (F)= 3,15 · 10 -27 кг./ 1.66 · 10 -27 кг.=18,99а.о.м.≈19.
2. Де знайти значення відносних атомних мас хімічних елементів?
Значення відносних атомних мас хімічних елементів записані в клітинках періодичної системи. У звичайних розрахунках значення відносних атомних мас прийнято округлювати до цілих чисел. Лише значення атомної маси Хлору округлюють до десятих, тобтоAr (Cl)=35,5.
VОсмислення зв'язків і залежностей між елементами вивченого матеріалу.
1. Знайдіть у періодичній системі значення відносних атомних мас Літію, Карбону, Оксигену, Неону й округліть їх до цілих чисел.
2. Яка відмінність між масою атома і відносною атомною масою?
VІУзагальнення і систематизація знань.
1.Користуючись даними періодичної таблиці,порівняйте відносні атомні маси таких елементів: Купруму, Карбону, Сульфуру, Гідрогену, Магнію. Запишітьхімічні символи цих елементів у порядку зростання їхніх відносних атомних мас.
2.Заповніть таблицю за зразком:
|
Хімічний символ елемента |
Атомна маса |
Відносна атомна маса |
|
О Р Н Не
|
2,656∙10-26кг 5,15∙10-26 кг 1,67∙10-27 кг 6,647∙10-24 г |
16
|
VІІПідсумки уроку;повідомлення домашнього завдання.
Вивчити §. Виконати вправу (с. підручника).
Урок 12
Тема:Багатоманітність речовин. Метали й неметали.
Мета:Увести поняття про багатоманітність речовин. Дати елементарну класифікацію елементів на метали та неметали, їх поширення в природі. Навчити розрізняти металічні й неметалічні елементи за їх положенням у періодичній системі. Показати суттєву відмінність фізичних і хімічних властивостей металів і неметалів.
Основні поняття: багатоманітність речовин, метали та неметали.
Формування компетентностей: Загальнопредметна, комунікативна, інформаційна., саморозвитку та самоосвіти, продуктивної творчості.
Тип уроку:урок засвоєння нових знань.
Обладнання і реактиви: Періодична система хімічних елементів
Д.І.Менделєєва; сірка, вугілля, цинк, алюміній, мідний дріт, залізний дріт.
Хід уроку
І Перевірка домашнього завдання.
1. Що таке відносна атомна маса?
2. Де знайти значення відносних атомних мас хімічних елементів?
3. Яка відмінність між масою атома і відносною атомною масою?
ІІ Актуалізація і корекція опорних знань.
1. Що таке речовина?
2. З чого складається речовина?
3. Що таке хімічний елемент?
4. Які є форми існування хімічних елементів?
ІІІ Повідомлення теми, цілей і завдань уроку.
ІVМотивування учіння.
Певна кількість букв алфавіту може утворити велику кількість різних за змістом слів. Подібне ми можемо спостерігати і в хімії. Внаслідок різного поєднання атомів між собою утворюється велике розмаїття хімічних речовин. Зрозуміло, що їх потрібно класифікувати, тобто об’єднати в класи за певними ознаками.
V Сприймання й усвідомлення учнями фактичного матеріалу.
1. Демонстрація
Зразки металів і неметалів.
Зразки речовин: сірка, вугілля, цинк, алюміній, мідний дріт, залізний дріт.
Завдання: розглянути зразки речовин, визначити схожі і відмінні властивості, ознаки за якими їх можна об’єднати у різні групи.
Питання для обговорення.
Яку спільну ознаку мають всі речовини?
Чим відрізняються?
Які речовини ми можемо об’єднати в групи? Чому? За якими ознаками?
У XVIII сторіччі французький хімік А.Л.Лавуазьє запропонував класифікацію простих речовин, поділивши їх на метали і неметали.
2. Металічні і неметалічні хімічні елементи у періодичній системі хімічних елементів.
3. Метали – речовини, які складаються з атомів металічних елементів.
Властивості, особливості будови.
4. Неметали – речовини, які складаються з атомів неметалічних елементів. Властивості, особливості будови.
5. Прості речовини – речовини, які складаються з атомів одного хімічного елемента.
Назви простих речовин.
VІ Осмислення зв'язків і залежностей між елементами вивченого матеріалу.
VІІУзагальнення і систематизація знань.
1. Прочитайте формули речовин і визначте, вони є простими (метали, неметали) чи складними, запишіть у відповідний стовпчик таблиці: N2,
CaO, Fe, NaOH, NH3, O2, Hg, Au, H2SO4, Mn, I2, P, PbO, Zn, LiOH, H3PO4, C, SO3, AlCl3
|
Прості речовини |
|
|
Метали |
Неметали |
|
|
|
2. Знайди зайвого:
• Al,Cu,S,Zn.
• S, P, O2 , Fe.
3. У переліку Cu, Mg, O, S, Cl більше металічних чи неметалічних елементів?
VІІІПідсумки уроку;повідомлення домашнього завдання.
Вивчити §. Виконати вправу (с. підручника).
Урок 13
Тема:Прості та складні речовини.
Мета:Поглибити знання учнів про класифікацію речовин за складом їх молекул.
Дати поняття про прості та складні речовини. Навчитися розрізняти поняття «хімічна сполука» і «суміш речовин», «проста речовина» і «хімічний елемент».
Навчити аналізувати якісний склад простих і складних речовин.
Основні поняття: прості та складні речовини.
Формування компетентностей: Загальнопредметна, комунікативна, інформаційна., саморозвитку та самоосвіти,здоров’язберігаюча, продуктивної творчості.
Тип уроку:урок засвоєння нових знань.
Обладнання і реактиви: Періодична система хімічних елементів Д.І.
Менделєєва;залізо, сірка, пірит, кальцій (у скляній ампулі), вода, кухонна сіль, графіт.
Хід уроку
І Перевірка домашнього завдання.
1. Що таке проста речовина?
2. Які ви знаєте прості речовини?
3. Як розміщені металічні і неметалічні елементи у періодичній системі?
4. Як відрізнити метали від неметалів?
ІІ Актуалізація і корекція опорних знань.
1. Які є форми існування хімічних елементів?
ІІІ Повідомлення теми, цілей і завдань уроку.
ІV Мотивування учіння.
Отже, крім простих речовин, для хімічних елементів існує ще й форма існування у вигляді складних речовин. Чим же вони відрізняються?
VСприймання й усвідомлення учнями фактичного матеріалу.
Складні речовини – речовини, які складаються з атомів двох чи більше хімічних елементів.
1. Будова складних речовин (молекулярна, атомна, йонна).
2. Назви складних речовин.
3. Органічні і неорганічні речовини.
4. Лабораторний дослід № 2.
Тема. Розгляд зразків простих і складних речовин.
Мета: Розглянути зовнішній вигляд виданих вам речовин з назвами. Визначити ознаки, на підставі яких речовини поділяють на прості і складні, а прості
— наметали і неметали.
Інструктивна картка.
1.Розмістіть окремо в один ряд прості речовини, а в інший — складні. Дізнайтесь у вчителя, з яких елементів складається пірит. Зверніть увагу, чи зберігаються властивості заліза і сірки у піриті.
2.Простіречовини поділіть на метали і неметали.
3.Заповніть таблицю.
|
Назва речовини |
Зовнішній вигляд |
3 яких елементів складається |
Речовина (проста складна |
чи |
Проста речовина (метал чи неметал) |
|
Залізо |
|
|
|
|
|
|
Сірка |
|
|
|
|
|
|
Пірит |
|
|
|
|
|
|
Кальцій |
|
|
|
|
|
|
Графіт |
|
|
|
|
|
|
Вода |
|
|
|
|
|
|
Кухонна |
|
|
|
|
|
4.Висновок. (Зазначте відмінність у будові складних і простих речовин, металів і неметалів.)
VІ Осмислення зв'язків і залежностей між елементами вивченого матеріалу.
|
|
Речовини |
|
||
|
|
прості |
скл |
адні |
|
|
метали |
|
неметали |
||
|
|
неорганічні |
органічні |
||
VІІУзагальнення і систематизація знань.
1. Прочитайте формули речовин і визначте, вони є простими (метали, неметали) чи складними, запишіть у відповідний стовпчик таблиці: N2, CaO, Fe, NaOH, NH3, O2, Hg, Au, H2SO4, Mn, I2, P, PbO, Zn, LiOH, H3PO4, C, SO3, AlCl3
|
Прості речовини |
Складні речовини |
|
|
Метали |
Неметали |
|
|
|
|
|
VІІІ Підсумки уроку;повідомлення домашнього завдання.
Вивчити §. Виконати вправу (с. підручника).
Урок 14
Тема:Хімічні формули речовин.
Мета:Закріпити знання про прості та складні речовини. Навчити записувати хімічні формули простих і складних речовин, користуючись хімічними знаками й індексами. Навчитися читати хімічні формули речовин, визначати їх якісний і кількісний склад.
Основні поняття: хімічна формула,індекс, коефіцієнт, якісний і кількісний склад речовини.
Формування компетентностей: Загальнопредметна, комунікативна, інформаційна., саморозвитку та самоосвіти.
Тип уроку:урок засвоєння нових знань.
Обладнання: Періодична система хімічних елементів Д.І. Менделєєва.
Хід уроку
І Актуалізація і корекція опорних знань.
1. Що таке речовина?
2. З чого складається речовина?
3. Що таке прості і складні речовини?
ІІМотивування учіння.
Кожна речовина має свою назву. Але чи можна за назвою визначити, з яких частинок складається речовина, як побудована речовина?
Відповіді на такі запитання може дати особливий запис – хімічна формула.
ІІІ Повідомлення теми, цілей і завдань уроку.
ІVСприймання й усвідомлення учнями фактичного матеріалу.
• Хімічна формула як умовний запис складу речовини за допомогою хімічних символів та індексів.
Склад будь-якої речовини передає її хімічна формула. Хімічною формулою називають умовний запис складу речовини за допомогою хімічних знаків та індексів. Індексом у хімічній формулі позначають число атомів. Хімічні формули читають зліва направо, називаючи по порядку символи елементів і нижні індекси. Якщо біля елементу знаходиться індекс один, його не вказують і не називають при читанні. Індекс за дужками читається: двічі, тричі. Наприклад, формула кисню читається о-два, формула води аш-два-о, формула вуглекислого газу це-о-два, формула крейди кальцій-це-о-три.
• Якісний і кількісний склад речовини.
З хімічної формули можна дізнатися про якісний та кількісний склад речовини. Якісний склад речовини визначають за символами, що входять до хімічної формули. Якісний склад речовини показує, з яких хімічних елементів складається речовина. Наприклад, за формулою кальцій-о-аш-двічі визначаємо, що речовина складається з атомів Кальцію (кальцій), Оксигену (о) та Гідрогену (аш). Кількісний склад речовини визначають за індексами (добутком індексів) у хімічній формулі. Кількісний склад речовини показує число атомів кожного хімічного елемента в хімічній формулі. Наприклад, за формулою натрій-три-пе-о-чотири визначаємо, що речовина складається з трьох атомів Натрію (натрій), одного атому Фосфору (пе) та чотирьох атомів Оксигену (о).
Числа, що стоять перед хімічними формулами (або перед хімічними знаками), називають коефіцієнтами. Коефіцієнти показують кількість структурних одиниць речовини. Наприклад, запис три купрум означає три атоми Купруму. Число три у даному випадку є коефіцієнтом. Запис ен-два – що одна молекула азоту містить два атоми Нітрогену (ен). Число два у даному випадку є індексом.
Для речовин, що мають молекулярну будову, хімічна формула збігається з молекулярною. Для речовин, що мають немолекулярну будову (складаються з атомів або йонів), не можна записати молекулярну формулу. Їх склад виражають хімічною формулою.

VОсмислення зв'язків і залежностей між елементами вивченого матеріалу.
1. Яку інформацію про речовину містить хімічна формула?
2. У чому полягає відмінність між коефіцієнтом і індексом у хімічних записах?
VІУзагальнення і систематизація знань.
1. Запишіть формули речовин, які мають такий склад:
• 2 молекули водню, кожна з яких складається з двох атомів Гідрогену;
• 3 формульних одиниці натрій хлориду, кожна з яких складається з одного йона натрію і одного йона хлору;
• 1 атом Фосфору, 3 атоми Гідрогену;
• 2 атома Брому;
• 1 атом Силіцію, 2 атоми Оксигену;
• 2 атоми Хрому, 3 атоми Оксигену;
• 1 атом Гідрогену, 1 атом Нітрогену, 3 атоми Оксигену;
• 1 атом Мангану, 2 атоми Оксигену, 2 атоми Гідрогену;
2. Дайте характеристику речовин за складом, користуючись алгоритмом:
• Хімічна формула;
• Проста (метал, неметал) чи складна;
• Кількість молекул;
• Кількість атомів в одній молекулі; Загальна кількість атомів. відповідно до зразків:
3О2 – проста, неметал 3 молекули О2 в 1 молекулі: О – 2 ат.
всього: О – 6 ат
2Na2O – складна
2 молекули Na2O в 1 молекулі: Na – 2 ат., О – 1 ат. всього: Na – 4 ат., О – 2 ат.
• 4Н2;
• 3NH3;
• 10Ca;
• PbO;
• 5H2O;
• ZnBr2;
• 4SiO2;
• 3NaOH;
• Н3PО4; 6Mg(NO3)2;
• 2Pb3(PO4)2.
VІІ Підсумки уроку;повідомлення домашнього завдання.
Вивчити §. Виконати вправу (с. підручника).
Урок 15
Тема:Валентність хімічних елементів. Визначення валентності за формулами бінарних сполук.
Мета:Визначити поняття «валентність» як здатність атомів утворювати хімічні сполуки. Познайомити учнів зі значенням валентностей окремих атомів. Показати найпростіші способи визначення валентності за періодичною системою. Навчити визначати валентність атомів одного елемента за валентністю іншого в сполуках, що утворені атомами двох хімічних елементів
(бінарних сполуках).
Основні поняття: валентність.
Формування компетентностей: Загальнопредметна, комунікативна, інформаційна., саморозвитку та самоосвіти,продуктивної творчості.
Тип уроку:урок засвоєння нових знань.
Обладнання: Періодична система хімічних елементів Д.І. Менделєєва.
Хід уроку
І Актуалізація і корекція опорних знань.
1. Що показує хімічна формула?
2. Напишіть формули речовин, до складу яких входять:
а)атом Феруму і три атоми Хлору;
б)два атоми Алюмінію і три атоми Оксигену;
в)атом Кальцію, атом Карбону і три атоми Оксигену.
ІІМотивування учіння.
1. Чи можуть хімічні формули бути іншими, ніж написані?
ІІІ Повідомлення теми, цілей і завдань уроку.
ІVСприймання й усвідомлення учнями фактичного матеріалу.
1. Закономірності сполучення хімічних елементів при складанні хімічних формул. Валентність.
Вчитель записує хімічні формули складних речовин на дошці, а учні — у своїх зошитах:
НCl, Н2О, NН3 СН4
Хлороводень Вода Аміак Метан
Вчитель звертає увагу на те, що один атом Хлору, Оксигену, Нітрогену, Карбону здатний приєднувати певну кількість атомів Гідрогену. Такі властивості мають інші елементи у різних сполуках і це поняття називають валентністю.
Учні зачитують, що таке валентність, і у згаданих вище формулах разом із вчителем позначають валентність елементів, беручи до уваги, що атом Гідрогену не може приєднати більше одного атома іншого хімічного елемента, тому валентність Гідрогену прийнято за одиницю.
|
I I |
І II |
I IIІ |
IV І |
|
HCl, |
H2O, |
NH3, |
CH4 |
2. Визначення валентності хімічних елементів за Оксигеном. (Вчитель звертає увагу учнів на попередні хімічні формули, записує, яку валентність проявляєОксиген у сполуці Н2О, доводить, що Оксиген завжди двовалентний). Потім учнівизначають валентність хімічних елементів у таких сполуках:
Нg0, Сu2О, N02 А12О3, Р2О5.
3. Визначення валентності елементів за формулами їхніх сполук, що складаються з двох елементів. Вчитель пояснює, роблячи відповідні записи на дошці,а учні у зошитах пишуть наступне:
Визначаючи валентність елементів за формулою, необхідно враховувати, що кількість одиниць валентності всіх атомів одного елемента дорівнює кількості одиниць валентності всіх атомів іншого елемента. Валентність елементів за формулами можна визначити таким чином:
1) Пишуть хімічну формулу речовини і позначають відому валентність елемента:
ІІ I II II
СuО, Н2S, SО3, Fе2О3.
2) Знаходять і записують загальну кількість одиниць валентності
(найменше спільне кратне) цього елемента: 2 2 6 6
3) Обчислюють і записують над хімічним знаком валентність іншого елемента, ділячи найменше спільне кратне на його індекс:
II II І II VI II III II
СuО, Н2S, S 03, Fе2О3.
|
Визначення валентностей хімічних елементів за формулами речовин 1. Записати формулу речовини. 2. Позначити відомі валентності. 3. Записати загальну кількість валентностей відомого елемента (число валентностей х кількість атомів відповідного елемента) ЗКВ (О) = 2 х 3 = 6 4. Визначити і записати найменше спільне кратне валентностей для двох елементів VІ6ІІ 6 5. Розрахувати валентність невідомого елемента (Найменше спільне кратне / з невідомою валентністю)
В(S) = 6 / 1 = 6 Сульфуроксид |
4. Стала валентність.
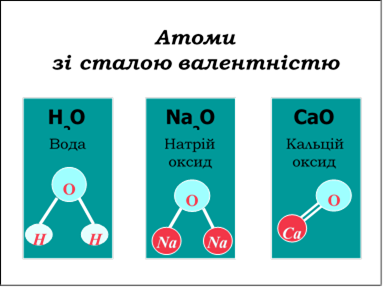
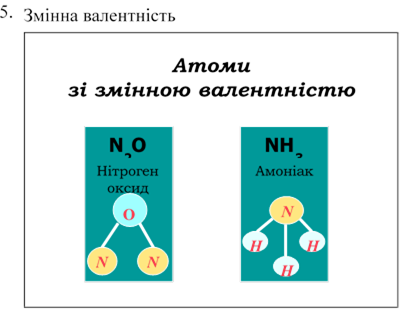
|
Валентності атомів хімічних елементів
|
VОсмислення зв'язків і залежностей між елементами вивченого матеріалу.
1. Що таке валентність?
2. Назвіть мінімальне і максимальне значення валентності хімічних елементів.
3. Які елементи мають сталу валентність?
4. Які елементи мають змінну валентність?
VІУзагальнення і систематизація знань.
Завдання 1.
Визначте валентність елементів:
а) за Гідрогеном (І): РН3,SіН4, НС1, Н20;
б) за Сульфуром (II): А12S3, СS2, FеS, Na2S, МgS.
Сполуки елементів із сульфуром називають сульфідами.
в) за Хлором (І): FеС13, NaС1, СаСІ2 СаС14.
Сполуки елементів із хлором називають хлоридами.
Завдання 2.
Вкажіть елементи, які в наведених сполуках є:
а) одновалентними; б) двовалентними; в) тривалентними;
г) чотиривалентними; д)п'ятивалентними:
Na2О, НС1, РН3, Fе2О3, СаО, МnО2, МgО, FеО, ZпО, СО2, Р2О5, С12О7,СгО3, СН4,I2O5
VІІ Підсумки уроку;повідомлення домашнього завдання.
Вивчити §. Виконати вправу (с. підручника).
Урок 16
Тема:Складання формул бінарних сполук за валентністю елементів.
Мета:Продовжити формування вміння складати хімічні формули бінарних сполук на основі валентності й визначати валентність атомів хімічних елементів за формулами. Узагальнити й поглибити знання про зміст хімічної формули, склад простих і складних речовин. Підготовка до тематичного оцінювання.
Основні поняття: валентність.
Формування компетентностей: Загальнопредметна, комунікативна, інформаційна, саморозвитку та самоосвіти,продуктивної творчості.
Тип уроку: урок засвоєння нових знань.
Обладнання: Періодична система хімічних елементів Д.І. Менделєєва.
Хід уроку
І Актуалізація і корекція опорних знань.
1. Що таке валентність?
2. Назвіть мінімальне і максимальне значення валентності хімічних елементів.
3. Які елементи мають сталу валентність?
4. Які елементи мають змінну валентність?
5. Як можна визначити валентність за формулами бінарних сполук?
ІІ Мотивування учіння.
1. Чи можна, знаючи валентність хімічних елементів, скласти формулу хімічної сполуки?
ІІІ Повідомлення теми, цілей і завдань уроку.
ІVСприймання й усвідомлення учнями фактичного матеріалу.
Складання хімічних формул за валентністю елементів.
а) записати поряд хімічні символи елементів, які входять до складу сполуки NаО, А1С1, РО;
б) над знаками хімічних елементів позначити їх валентність:
І II Ш І V II
NаО АІСІ РО
в) визначити найменше спільне кратне чисел, які виражають валентність обох елементів:
|
2 |
3 |
10 |
|
І II |
Ш І |
V II |
|
NaО |
АІСІ |
РО |
г) діленням найменшого спільного кратного на валентність відповідного елемента знайти індекси (індекс " 1" не пишемо):
|
2 |
3 10 |
|
І II |
Ш І V II |
|
Na2 О |
АІСІ3 Р 2О 5 |
|
Натрій оксид |
Алюміній Фосфор(V) хлорид оксид |
Вчитель зауважує, що у назвах речовин, утворених елементами зі змінною валентністю, пишемо у дужках цифру, яка позначає валентність даного елемента в цій сполуці.
Наприклад, СuО — Купрум (II) оксид, Сu2О — Купрум (І) оксид.
VОсмислення зв'язків і залежностей між елементами вивченого матеріалу.
1. Що таке валентність?
2. Назвіть послідовність дій при складанні формул за відомою валентністю.
3. Запишіть алгоритм складання формул за відомою валентністю.
VІУзагальнення і систематизація знань.
1.Напишіть формули сполук з Оксигеном таких елементів:
а)Аргентуму (І); г) Силіцію (IV);
б)Магнію (II); ґ) Алюмінію (III);
в)Фосфору (V); д) Мангану (VII);
є) Сульфуру (VI).
2.Розставте індекси у формулах:
|
І IІ |
III |
V |
VIII |
IVII |
II І |
IV |
|
II |
VII |
|
|
КS |
РО |
АsО |
ОsО |
Sn S |
NiС1 |
СН |
СаН |
НgС1 |
МnО |
А1F |
3. Знаючи валентності хімічних елементів, напишіть формули їхніх сполук:
III II IV I I II VI II ІІ IV III IV
Fe O C H Na S S O Mg O Si H B O S O
II I II I VIII III II I III I IV
C O K Cl Pb I Os O Al S Na P Ag O Sn O
III I III II I IV II
AlCl B O H I C O
VІІ Підсумки уроку;повідомлення домашнього завдання.
Вивчити §. Виконати вправу (с. підручника).
Урок 17
Тема: Проміжне оцінювання знань з теми «Початкові хімічні поняття».
Мета: Виявити рівень засвоєння основних понять, термінів, правил; визначити рівень навчальних досягнень учнів з теми.
Тип уроку:Урок перевірки знань, умінь і навичок учнів.
Формування компетентностей: Соціальної, продуктивної творчості.
|
Оцінювання тестових завдань з теми |
Завдання |
Кількість балів |
Час |
|
7 кл. Діагностичний тест |
1 - 8 |
0,5 |
45 хв. |
|
9 - 10 |
1 |
||
|
11 - 13 |
2 |
Варіант 1
Виберіть одну правильну відповідь
1.Вкажіть назву явища, що відбувається з зміною агрегатного стану та форми речовини:
А географічне; Б біологічне; В хімічне; Г фізичне
2.Вкажіть назву числа перед формулою, що показує кількість частинок:
А індекс; Б валентність; В заряд; Г коефіцієнт
3.Вкажіть назву найменшої частинки речовини, що зберігає її хімічні властивості:
А атом; Б йон; В молекула; Г катіон
4.Вкажіть частинки, що входять до складу складних речовин:
А молекули різних елементів; В сукупність катіонів;
Б атоми різних елементів; Г молекули речовин
5. Виберіть ряд , в якому перелічені тільки назви речовин .
А) залізо , гума , срібло , вода;
Б) м’яч, іграшка, гума, шина;
В) вода , лід ванна, пара;
6. Суміші бувають:
А) однорідні та неоднорідні;
Б)однорідні та чисті ;
В) неоднорідні та рідкі;
7. Усі речовини за складом поділяються на такі:
|
А однорідні та неоднорідні |
Б прості та складні |
В органічні та прості |
Г неорганічні та складні |
Виберіть кілька правильних відповідей
8.Випишіть з переліку елементи-неметали:
А Li; Б P; В Fe; Г As; Д Zn
9.Випишіть формули сполук у яких атоми металів мають валентність II:
А СaF2; Б MnO2; В CO; Г Zn3P2
10. Запропонуйте способи розділення сумішей:
а) розчин крейди у воді;
б) деревного вугілля та порошку заліза.
11. Визначити валентність атомів елемента у сполуках з Оксигеном:
СаО, АІ2О3 СО2, Н2О, N2O3, SO3.
12. Який атом легший – Карбону чи Титану? У скільки разів?
13. Обчисліть відносну атомну масу Гідрогену , якщо атомна маса цього елемента становить 1, 673.10-24 г.
|
Оцінювання тестових завдань з теми |
Завдання |
Кількість балів |
Час |
|
7 кл. Діагностичний тест |
1 - 8 |
0,5 |
45 хв. |
|
9 - 10 |
1 |
||
|
11 - 13 |
2 |
Варіант 2
Виберіть одну правильну відповідь
1 Вкажіть назву явища, що відбувається з зміною складу, будови речовини:
А біологічне; Б хімічне; В фізичне; Г географічне
2 Вкажіть як позначається фізична величина, що визначається відношенням маси атома до 1/12 маси атома Карбону:
А Mr; Б m; В Ar; Г A
3 Валентність – це:
А) цифра над значком хімічного елемента ;
Б) властивість атомів утворювати певну кількість хімічних зв’язків ;
В) кількість атомів Гідрогену , що може приєднати до себе хімічний елемент.
4 Вкажіть відносну атомну масу Натрію:
А 22; Б 11; В 10; Г 23
5 Вкажіть назву числа перед формулою, що показує кількість частинок:
А індекс; Б валентність; В заряд; Г коефіцієнт
6 Вкажіть формулу простої речовини:
|
A NaCI; |
Б H2; |
В CuO; |
Г HNO3; |
7 Визначити валентність елементів у сполуці Р2О5;
|
А Фосфор – V, Оксиген – ІІ;
|
Б Фосфор – ІІ, Оксиген – V. |
Виберіть кілька правильних відповідей
8 Випишіть з переліку формули простих речовин:
А Lі; Б H2SO3; В Cl2; Г H2О; Д HJ
9 Випишіть формули сполук у яких атоми металів мають валентність I:
А F2O; Б K2O; В CsJ; Г AuCl3
10 Випишіть з переліку хімічні елементи, що мають зміну валентність:
|
А) О; |
Б) Сu; |
В) Н; |
Г) N. |
11 Запропонуйте способи розділення сумішей :
а) залізних ошурків і порошку крейди;
б) розчин цукру у воді
12 Який атом легший Карбону чи Феруму ? У скільки разів?
13 Обчисліть відносну атомну масу Гелію, якщо маса атома цього елемента становить 6,647 . 10-24г.
Урок 18
Тема: Відносна молекулярна маса речовини, її обчислення за молекулярною формулою.
Мета: Поглибити знання про хімічну формулу, її використання для розрахунків. Дати поняття про відносну молекулярну масу. Формувати вміння й навички обчислення за хімічними формулами. Навчити визначати відносну молекулярну масу простих і складних речовин за їх формулами.
Формування компетентностей: Загальнопредметна, комунікативна.
Тип уроку: Урок засвоєння нових знань, умінь і навичок.
Обладнання і матеріали: Періодична система хімічних елементів
Д.І.Менделєєва
Хід уроку
І Актуалізація і корекція опорних знань.
1. Яку будову має атом?
2. Що таке відносна атомна маса хімічного елемента?
3. Які речовини називаються простими?
4. Які речовини називаються складними?
ІІ Повідомлення теми, цілей і завдань уроку.
ІІІ Мотивування учіння.
Розповідь учителя.
Відомо, що атоми мають певну масу, яка утворена масою протона і масою нейтрона , що входять в склад молекули. Молекули мають масу, яка утворена масою атомів.
Запитання.
1 Де можна знайти атомну масу елемента?
2 Чим утворена маса молекули?
Розповідь учителя.
Оскільки маси атомів дуже малі величини , то і маси молекул також дуже малі.Наприклад маса молекули кисню 5,32 ∙10-23 г. Такими числами користуватися незручно, тому для мас молекул введена спеціальна величина:
відносна молекулярна маса.
ІVСприймання й усвідомлення учнями фактичного матеріалу.
1. Відносна молекулярна маса – це відношення маси молекули даної речовини до 1/12 частинки маси атома Карбону.
Відносну молекулярну масу Мr можна обчислити, додавши відносні атомні маси Аrелементів, з яких складається молекула, з урахуванням числа атомів, що входять до складу молекули., наприклад:
Мr(CО2)=Аr(C)+2Аr(О); Мr (СО2)=12+2∙16=44
Значення відносних атомних мас, які наведені в періодичній системі при обчисленні заокруглюються до цілих чисел за винятком елемента Хлору.
Іноді застосовується поняття маса молекули. Якщо масу, що дорівнює 1/12 маси атома Карбону (1,67∙10-24 г) позначити як 1 атомну одиницю маси (а.о.м.), то масу молекули можна виразити в цих одиницях.Чисельно маса молекули і відносна молекулярна маса дорівнюють одна одній тільки перша має одиницю вимірювання а.о.м.
Для речовин з кристалічною(немолекулярною ) будовою замість терміна «відносна молекулярна маса» використовують термін «відносна формульна маса». Позначення цієї фізичної величини та її розрахунок такі самі, як і відносної молекулярної маси.
2. Відносна формульна маса йона.
Оскільки йон містить на один, або кілька електронів більше, або менше ніж атом , а маса електрона дуже мала і практично нею можна нехтувати, то маса йона майже не відрізняється від маси відповідного атома. Також збігаються відносні формульні маси простих йонів і відносні атомні маси елементів:
Мr(Nа+)=Аr(Nа)
Відносні формульні маси складних йонів рахуються так само, як відносні молекулярні маси.
Завдання :
Обчисліть відносні формульні маси йонів РО4 і СО3
3. Відносна формульна маса йонної сполуки
Відносні формульні маси йонних сполук можна обчислювати двома способами:
• використовуючи відносні атомні маси,
• використовуючи відносні формульні маси йонів.
VОсмислення зв'язків і залежностей між елементами вивченого матеріалу.
Завдання: Робота в парах.
1. Обчислити відносні молекулярні маси кисню О2 та відносну молекулярну масу ортофосфатної кислоти Н3РО4.
2. Обчислити двома способами відносну формульну масу йонних речовин
АlCl3 та К3РО4
VІУзагальнення і систематизація знань.
1. Що таке відносна молекулярна маса речовини?
2. Як можна обчислити відносну молекулярну масу речовини?
VІІПідсумки уроку;повідомлення домашнього завдання.
Вивчити §. Виконати вправу (с. підручника).
Урок 19
Тема: Розв’язування розрахункових задач на обчислення відносної молекулярної масиречовини.
Мета: Узагальнити і закріпити знання про відносну молекулярну масу. Продовжити формувати вміння і навички обчислення за хімічними формулами.
Формування компетентностей: Загальнопредметна, соціальна, комунікативна, саморозвитку і самоосвіти.
Тип уроку: Урок застосування знань,навичок і умінь,творчого застосування їх на практиці
Обладнання: Періодична система хімічних елементів Д.І.Менделєєва.
Хід уроку.
І Перевірка домашнього завдання, актуалізація і корекція опорних знань, навичок і вмінь
Бесіда .
1. Чому в хімії використовують не маси молекул а відносні молекулярні маси?
2. Що таке відносна молекулярна маса?
3. Чому дорівнює відносна маса молекули?
4. Для яких речовин знаходять відносну формульну масу?
5. Як знаходять відносну формульну масу йона?
6. Що таке відносна формульна маса?
ІІ Повідомлення теми, цілей і завдань уроку
ІІІ Осмислення змісту й послідовності застосування способів виконання дій
1 Робота учнів в парах. Виконання учнями завдань під контролем і за допомогою вчителя (враховуючи індивідуальні особливості).
Завдання.1
Обчислити відносну молекулярну масу речовин: NH3 , Cl2O , NO2 , H2SO3.
Перевірка виконаного завдання.
Завдання 2.
Обчислити відносну формульну масу йона: Al3+,F-, SO42-,
Перевірка виконаного завдання.
Завдання 3
Обчислити відносну формульну масу речовини: Ca3 (PO4)2
Перевірка виконаного завдання.
ІVСамостійне виконання учнями завдань під контролем і за допомогою вчителя
Завдання.
1 Знайти відносну молекулярну масу речовини до складу, якої входять один атом Гідрогену,один атом Нітрогену та три атоми Оксигену.
2. Знайти відносну формульну масу речовини: CaCl2
VПідсумки уроку;повідомлення домашнього завдання.
Вивчити §. Виконати вправу (с. підручника).
Урок 20
Тема: Масова частка елемента в складній речовині.
Мета: Закріпити знання учнів про хімічні формули, вміння обчислювати відносну молекулярну масу. Поширити знання з математики про частки на обчислення частки елемента в складній речовині. Навчити обчислювати масову частку елемента в складній речовині. Розвивати мислення учнів.
Формування компетентностей: Загальнопредметна, комунікативна, саморозвитку і самоосвіти.
Тип уроку: Комбінований.
Обладнання: Періодична система хімічних елементів Д.І. Менделєєва.
Хід уроку
І Перевірка домашнього завдання, актуалізація і корекція опорних знань, навичок і вмінь
1. Що таке відносна молекулярна маса?
2. Чому дорівнює відносна маса молекули?
3. Для яких речовин знаходять відносну формульну масу?
4. Як знаходять відносну формульну масу йона?
5. Що таке відносна формульна маса?
ІІ Мотивування учіння.
Знаючи відносну молекулярну масу речовини , можна визначати ще одну важливу характеристику молекули, або йонної сполуки- масову частку атомів чи йонів будь-якого елемента в молекулі , або йонній сполуці.
ІІІ Повідомлення теми, цілей і завдань уроку.
ІVСприймання й усвідомлення учнями фактичного матеріалу.
Розповідь вчителя.
Хімічна формула дає можливість визначити масову частку кожного елемента в речовині.
W =nAr / Mr , де w- масова частка елемента у речовині, Аr – відносна атомна маса, Mr – відносна молекулярна маса, n – кількість атомів елемента.
Алгоритм визначення масової частки елемента у речовині.
1.Уважно прочитати умову задачі.
2.Стисло записати умову задачі.
3.Записати формулу для обчислення масової частки елемента в речовині.
4.Обчислити молекулярну масу речовини.
5.Обчислити масову частку елемента в речовині.
6.Записати відповідь.
Задача 1. (Зразок)
Обчислити масову частку Fe у його оксиді Fe2O3.
Розв’язання.
Дано:
![]() Fe2O3.
w=nAr(Fe) / Mr(Fe2O3) w(Fe) -?
Mr(Fe2O3)=56 ∙ 2 +16 ∙ 3 =112+48=
160 w(Fe) = 2 ∙ 56 / 160 =112/160
=0,7 ~70%
Fe2O3.
w=nAr(Fe) / Mr(Fe2O3) w(Fe) -?
Mr(Fe2O3)=56 ∙ 2 +16 ∙ 3 =112+48=
160 w(Fe) = 2 ∙ 56 / 160 =112/160
=0,7 ~70%
Відповідь: w (Fe) =70 %.
А тепер спробуємо за відомими масовими частками вивести хімічну формулу речовини.
Алгоритм виведення формули речовини за відомими масовими частками
1.Уважно прочитати умову задачі.
2.Записати стисло умову задачі.
3.Позначити кількості атомів невідомих елементів через Х,У…
4.Використати відношення:
Х : У …=w(E1) /Ar(E1) :w (E2) /Ar (E2) ….
5.Підставити значення.
6.Позбутися дробів.
7.Поділити на найменше число і заокруглити.
8.Якщо виходять числа 1,5 ; 2,5 ; 3,5 …., потрібно збільшити їх у два рази.
9.Записати шукану формулу.
10.Записати відповідь.
Задача 2. (Зразок)
Виведіть формулу речовини кальцій карбіду, якщо відомо що до її складу входить Кальцій і Карбон, масові частки яких відповідно становлять 62,5 % і 37,5 %.
Розв’язання.
Дано:
![]() w( Ca) =62,5
% x:y =w(Ca) / Ar(Ca) :w(C) / Ar(C) w(C)= 37,5
% x:y =62,5/40 :37,5 /12
w( Ca) =62,5
% x:y =w(Ca) / Ar(Ca) :w(C) / Ar(C) w(C)= 37,5
% x:y =62,5/40 :37,5 /12
——————— x:y =1,56 :3,125
Ca xCy -? x:y =1:2 x, y-? CaC2
Відповідь : CaC2 .
VОсмислення зв'язків і залежностей між елементами вивченого матеріалу.
1.Два учні працюють біля дошки.
Обчислити масову частку елементів у речовинах: Р2О5, NО2 2 .Робота в парахза завданнями:
Обчислити масові частки елементів у сполуках:
Ва3(РО4)2, РН3,.Сl2О7, К4Fе(СN)6
VІУзагальнення і систематизація знань.
1. Що таке масова частка елемента в складній речовині?
2. Як визначити масову частку елемента в складній речовині?
3. Який алгоритм визначення масової частки елемента в складній речовині?
VІІПідсумки уроку;повідомлення домашнього завдання.
Вивчити §. Виконати вправу (с. підручника).
Урок 21
Тема: Обчислення масової частки елемента в складній речовині.
Мета:Поглибити знання учнів про масові частки елемента в складі речовини.Оцінити рівень засвоєння вмінь і навичок використання поняття «масова частка».
Формування компетентностей: компетентність продуктивної праці, саморозвитку та самоосвіти, соціальна та комунікативна.
Тип уроку: Урок практичного застосування знань, навичок і вмінь.
Обладнання: Періодична система хімічних елементів Д.І.Менделєєва.
Хід уроку
І Перевірка домашнього завдання, актуалізація і корекція опорних знань, навичок і вмінь;
1. Як знаходиться відносна молекулярна маса?
2. Що таке масова частка елемента в речовині?
3. За якою формулою можна знайти масову частку елемента в речовині?
ІІ Повідомлення теми, цілей і завдань уроку;
ІІІ Осмислення змісту й послідовності застосування способів виконання
дій;
1 .Робота учнів в групах гомогенного складу за завданнями.
І група Обчислити відносну молекулярну масу ,масові частки та співвідношення мас елементів у речовині К2СО3 та РН3
ІІ група
Обчислити відносну молекулярну масу, масові частки та співвідношення мас елементів у речовині СuSО4 та СО2
ІІІ група
В якому з двох оксидів масова частка Феруму більша: в магнітному залізняку
Fe3O4чи в червоному Fе2О3
ІV група
Молекула фосфатної кислоти складається з 3 атомів Гідрогену, 1 атома Фосфору і 4 атомів Оксигену. Написати хімічну формулу фосфатної кислоти, обчислити її відносну молекулярну масу , масові частки та співвідношення елементів .
2 . Презентація робіт представниками груп.
ІV Самостійне виконання учнями завдань під контролем і за допомогою вчителя;
І варіант
1.Вивести формулу одного з оксидів феруму, масова частка Феруму в якому становить 70%, а Оксигену 30%.
2. Обчислити масові частки елементів у сполуці НNO3
ІІ варіант
1.Вивести формулу одного з оксидів сульфуру, масова частка Сульфуру вякому становить40%, а Оксигену 60%.
2. Обчислити масові частки елементів у сполуці Н2SO3
V Звіт учнів про роботу і теоретичне обґрунтування отриманих результатів;
VІ Підсумки уроку й повідомлення домашнього завдання.
Вивчити §. Виконати вправу (с. підручника).
Урок 22
Тема: Розв’язування задач на виведення хімічної формул речовин за масовою часткою елемента, що входить до складу речовини.
Мета:Удосконалити практичні навички обчислення масової частки речовини, розв’язаннязадач на виведення хімічної формули за масовою часткою елементів, що входятьдо складу речовини.
Формування компетентностей:загальнопредметна, соціальна , комунікативнасаморозвитку та самоосвіти.
Тип уроку: Урок практичного застосування знань, навичок і вмінь.
Обладнання:Періодична система хімічних елементів Д.І. Менделєєва.
Хід уроку.
І Перевірка домашнього завдання, актуалізація і корекція опорних знань, навичок і вмінь;
ІІ Повідомлення теми, цілей і завдань уроку;
ІІІ Актуалізація мотивації учіння учнів;
ІV Осмислення змісту й послідовності застосування способів виконання
дій;
1.Знайдіть масові співвідношення у силіциді магнію, де на два атоми магнію припадає один атом кремнію.
Мg2Sі m(Mg): m(Si)=48:28=12:7
2 Виведіть формулу магній сульфату, якщо відомо, що до його складу входять 0.2 (20%)масових часток Магнію, 0266(26.6%), масових часток Сульфуру та 0,533 (53,3%) масових часток Оксигену.
V Самостійне виконання учнями завдань під контролем і за допомогою вчителя;
Робота в групах гетерогенного складу.
Завдання.
1. Знайдіть співвідношення мас атомів в феруму оксиді, де на два атоми Феруму припадає три атоми Оксигену.
2. Знайдіть співвідношення мас атомів в кремній оксиді, де на один атом Кремнію припадає два атоми Оксигену.
3. Знайдіть співвідношення мас атомів у метані , де на один атом Карбону припадає чотири атоми Гідрогену.
4. Виведіть формулу соди, якщо відомо, що до її складу входять
0,434(43,4%) масових часток Натрію, 01132(11,32%) масових часток
Карбону і 0,453(45,3%) масових часток Оксигену.
5. Виведіть хімічну формулу аргентум карбонату,якщо відомо, що до його складу
Входять0.7826(78,26%) масових часток Аргентуму, 0,0434 (4,34%) масових частокКарбону, та 0,174 (17.4%) масових часток Оксигену.
6. Виведіть формулу сполуки Сульфуру з Оксигеном, в якій масова частка Оксигену Становить 50%.
VІ Звіт учнів про роботу і теоретичне обґрунтування отриманих результатів;
VІІ Підсумки уроку й повідомлення домашнього завдання.
Вивчити §. Виконати вправу (с. підручника).
Урок 23
Тема: Фізичні та хімічні явища.Хімічні реакції та ознаки,що їх супроводжують. Хімічні властивості речовин.
Мета: Повторити та поглибити знання про фізичні та хімічні явища, з’ясувати їх суттєві відмінності. Сформувати поняття про хімічні реакції як спосіб вираження хімічного явища. З’ясувати ознаки хімічної реакції та умови їх виникнення за експериментальними даними. Вдосконалювати навички роботи з хімічними речовинами і лабораторним обладнанням.
Формування компетентностей: Загальнопредметна, комунікативна, інформаційна., саморозвитку та самоосвіти,продуктивної творчості.
Тип уроку: Урок поглиблення знань ,умінь і навичок.
Обладнання і матеріали:сода, оцтова кислота, вапняна вода, скляна трубка, штатив з пробірками.
Хід уроку. І. Організаційний етап.
ІІ Актуалізація опорних знань.
Бесіда.
1. Що ви маєте на увазі під терміном «явища»?
2. Які явища ви спостерігали в природі?
ІІІ. Вивчення нового матеріалу.
1. Розповідь учителя з використанням схеми.
Соціальні
Політичні Біологічні явища Геологічні
Атмосферні
Сонячні
Фізичні
Хімічні
Завдання.
Наведіть приклади даних явищ.
2. Самостійна робота учнів з підручником.
Завдання .
З’ясувати, які зміни відбуваються з речовинами під час хімічних і фізичних явищ.
Навести приклади фізичних і хімічних явищ, які ви спостерігали в природі та побуті.
3. Розповідь учителя.
3.1.Формування поняття про хімічну реакцію.
3.2. Ознаки хімічних реакцій та з’ясування умов протікання реакцій.
Демонстрація.
Запитання.
1.Які хімічні реакції за даними ознаками ви спостерігали в побуті?
Демонстрація.
Виділення газу. Взаємодія цинку з хлоридною кислотою.
Випадання осаду. Взаємодія натрій сульфату з барій хлоридом.
Зміна забарвлення. Прожарювання міді.
Поява запаху. Спалювання сірки.
Тепловий ефект. Горіння свічки.
ІV Проведення лабораторного досліду.
Учні проводять два досліди.
1. Взаємодія соди з оцтовою кислотою.
2. Взаємодія вапняної води з вуглекислим газом.
V. Узагальнення і систематизація знань.
Метод «Мікрофон»
Учні наводять приклади явищ і просять своїх товаришів визначити до якої групи вони належать.
VІ. Підбиття підсумків уроку.
VІІ. Домашнє завдання.
Вивчити §. Виконати вправу (с. підручника)
Урок 24
Тема: Практична робота №3. Дослідження фізичних і хімічних явищ.
Мета: Продовжити формування навичок роботи з хімічними речовинами й лабораторним обладнанням. Перевірити знання правил техніки безпеки під час роботи в кабінеті хімії. Поглибити знання про фізичні і хімічні явища, умови перебігу, ознаки хімічних реакцій на основі експериментальних даних.
Формування компетентностей: Загальнопредметна, здоров’язберігаюча,саморозвитку і самоосвіти.
Тип уроку:Урок практичного застосування знань, навичок і вмінь.
Обладнання і реактиви:
штатив з пробірками, скляна паличка, спиртівка,сірники,дерев’яний тримач, мідна дротина, фарфофова чашка, вода,парафін, цукор, крейда, оцтова кислота, натрій гідроксид, купрум сульфат, сульфатна кислота.
Хід уроку
І Перевірка домашнього завдання, актуалізація і корекція опорних знань, навичок і вмінь.
1. Що таке Фізичні та хімічні явища?
2. Що таке хімічні реакції та які ознаки їх супроводжують?
3. Які хімічні властивості мають речовини?
ІІ Повідомлення теми, цілей і завдань уроку.
ІІІ Актуалізація мотивації учіння учнів.
Перед початком роботи необхідно активізувати знання учнів про фізичні і хімічні явища.
ІVОсмислення змісту й послідовності застосування способів виконання дій.
Вступне слово вчителя.
Інструктаж з техніки безпеки під час виконанняпрактичної роботи.
Перед початком роботи повторити з учнями правила техніки безпеки під час роботи з хімічними речовинами, скляним хімічним посудом, нагрівальними приладами.
VСамостійне виконання учнями завдань під контролем і за допомогою вчителя.
Інструктивна картка
Тема: Дослідження фізичних і хімічних явищ
Мета: за допомогою експерименту встановити відмінності між фізичними та хімічними явищами, з'ясувати ознаки та умови виникнення і перебігу хімічних реакцій.
Прилади та реактиви: _______
(заповніть самостійно)
Дослід 1
Закрутіть мідну дротину в спіраль за допомогою олівця.
(???) Як змінилася дротина? Яке явище відбулося?---------------------------
----------------------
Дослід 2
Закріпіть виготовлену мідну спіраль у тримач і внесіть у полум'я спиртівки.
Прожарюйте її протягом 1—2 хв, а потім уважно розгляньте.
(А)Порівняйте прожарену й непрожарену частини спіралі.
(???) Що спостерігаєте? Як називається це явище?------------------------------------
----------------------------------------------------------------------------------------------------------------
-----------------------------------------------------
Дослід З
Покладіть у порцелянову чашку невеличкий шматочок парафіну. Поставте чашку з парафіном на кільце лабораторного штатива і нагрійте її на полум 'ї спиртівки.
(???)Що відбувається з грудочкою парафіну під час
нагрівання?__________________________________________________________ _____________________________________________________________________
Припиніть нагрівання. Розгляньте парафін після охолодження фарфорової чашки.
(???)Чи утворилася нова речовина? Як називається це
явище?_____________________________________________________________
____________________________________________________________________
Дослід 4
Налийте у пробірку 3—4 мл води. Закріпіть її у тримачі для пробірок та обережно нагрійте в полум'ї спиртівки.
(!!)Пригадайте правила техніки безпеки під час нагрівання та суворо дотримуйтесь їх!
(А) Зверніть увагу на стінки пробірки!
(???) Які зміни відбуваються з водою? Назвіть явища, які ви спостерігаєте_________________________________________________________
_____________________________________________________________________
Дослід 5
Нагрійте в пробірці виданий вам цукор.
(А) Пригадайте правила нагрівання речовин у пробірці за допомогою пробіркотримача.
(???)Що відбувається після перших хвилин нагрівання, як називається це явище?_______________________________________________________________ ______________________________________________________________________
Продовжуйте нагрівання. Зверніть увагу на стінки пробірки та вміщену в ній речовину.
(???) Що відбувається, якщо продовжити нагрівання, як називається
явище? Назвіть ознаки, якими воно супроводжується
_____________________________________________________________________
_____________________________________________________________________
_____________________________________________________________________
Дослід 6
![]() Покладіть у пробірку 2—3 шматочки крейди або мармуру завбільшки з горошину.
Залийте їх кислотою (наприклад, оцтовою).
Покладіть у пробірку 2—3 шматочки крейди або мармуру завбільшки з горошину.
Залийте їх кислотою (наприклад, оцтовою).
(!!) Не порушуйте інструкцій щодо використання кількостей речовин, необхідних для досліду!
(???) Що спостерігаєте?_____________________________________________________
__________________________________________________________________
Внесіть запалений сірник у пробірку.
(???)Що спостерігаєте? Чи утворилася нова речовина? Як вона називається?
(А) 3робіть відповідний висновок про явище, яке ви спостерігали.-------------
----------------------------------------------------------------------------------------------------------------------------------------------------------
Дослід 7
Налийте в пробірку 2 мл розчину натрій гідроксиду. Додайте до нього кілька крапель розчину купрум(ІІ) сульфату.
(!!)Поводьтеся з реактивами обережно! Дотримуйтеся правил техніки безпеки під час роботи!
(???)Що спостерігаєте? Як називається це явище?--------------------------------
---------------------------------------------------------------------------------------------------------------------------------------------------
Дослід 8
Долийте до осаду, що утворився в попередньому досліді, розчин сульфатної кислоти об'ємом 1—2 мл.
(???) Що спостерігаєте? Як називається це явище?-------------------------------
--------------------------------------------------------------------------------------------------------------
----------------------------------------------------
(А) Зробіть загальний висновок про явища, які ви спостерігали під час проведення дослідів.
Для хімічних реакцій укажіть ознаки та умови їх перебігу.
![]()
![]() (!!)Приберіть
своє робоче місце і вимийте руки після закінчення роботи.
(!!)Приберіть
своє робоче місце і вимийте руки після закінчення роботи.
![]()
(!!)Оцтова, сульфатна кислоти та натрій гідроксид їдкі речовини!
Їдка речовина
При необережному поводженні вони можуть спричинити хімічний опік та пошкодити одяг. У таких випадках реактиви слід змити великою кількістю проточної води.
![]()
(!!) Розчин купрум(П) сульфату отруйний!
Поводьтеся із солями Купруму обережно.
Після роботи ретельно вимийте руки, спочатку без мила, а потім з милом.
Спостереження, відповіді на запитання:
Висновок: __________________
VІ Звіт учнів про роботу і теоретичне обґрунтування отриманих результатів.
VІІ Підсумки уроку й повідомлення домашнього завдання.
Вивчити §. Виконати вправу (с. підручника).
Урок 25
Тема: Узагальнення і систематизація знань з теми «Початкові хімічні поняття»
Мета: Узагальнити і систематизувати знання про початкові хімічні поняття, хімічні формули, хімічні реакції . Підготувати учнів до тематичного оцінювання.
Формування компетентностей: Соціальна , комунікативна.
Тип уроку: Урок узагальнення і систематизації знань , умінь і навичок.
Обладнання: Періодична система хімічних елементів Д.І. Менделєєва, таблиця розчинності кислот, основ і солей.
Хід уроку.
І Повідомлення теми, цілей та завдань уроку;
ІІ Актуалізація мотивації учіння учнів;
ІІІ Відтворення й узагальнення понять і засвоєння відповідної їм системи знань;
Метод «Мікрофон». Учні заздалегідь підготовляють запитання один одному.
ІV Узагальнення та систематизація основних теоретичних положень і відповідних наукових ідей;
1. Робота учнів в групах гомогенного складу.
І група.
1. Визначити валентність елементів у формулах сполук: МgCl2 Р2О5 К2О І2О7 ОsO4
CaS
2 Знайти відносну молекулярну масу та масові частки елементів у речовині СаО.
ІІ група .
1 Використовуючи валентність хімічних елементів складіть відповідні формули сполук: Na2O AsO CrO BO SiO NH3
2 Знайти відносну молекулярну масу, масові частки та масові співвідношення мас елементів у сполуці H3PO4
ІІІгрупа
1. Що означають записи: 2SO2C 3Mg 3H2 4H
2. Знайдіть масові частки елементів у сполуці, що утворена двома атомами Фосфору та трьома атомами Оксигену.
ІV. Група
1. Позначте хімічними символами: а) сім атомів Феруму; б) дві молекули магній оксиду; в) чотири окремих атоми Хлору; г) чотири молекули водню.
2. Яка формула сульфур (ІІ) оксиду. якщо він містить 40% Сульфуру?
2. Презентація виконаних робіт представниками груп.
V Підсумки уроку і повідомлення домашнього завдання.
Вивчити §. Виконати вправу (с. підручника).
Урок 26
Тема: Контрольна робота «Початкові хімічні поняття».
Мета: Узагальнити і систематизувати знання учнів з теми. З’ясувати рівень засвоєння основних понять і законів. Визначити рівень навчальних досягнень учнів з теми«Початкові хімічні поняття».
Формування компетентностей: Соціальної, продуктивної творчості.
Тип уроку:Урок перевірки знань, умінь і навичок учнів.
Обладнання: Періодична система хімічних елементів Д.І. Менделєєва, таблиця розчинності.
Хід уроку.
І Організаційний етап.
ІІ Повідомлення теми і завдань уроку.
ІІІ Виконання контрольної роботи.
І варіант
Рівень 1
1. Вкажіть назву речовини:
а) залізний дріт; б) цв’ях в)ніж г) залізо
2. Нафту можна розділити на складові частини (гас, бензин тощо):
а)відстоюванням б)перегонкою
в)кристалізацією г)фільтруванням
3. Вкажіть хімічне явище:
а) почорніння цукру при нагріванні б)плавлення льоду
в) розчинення цукру у воді г)розділення повітря на кисень і азот
4. Елемент Купрум позначається символом:
а) Са б)Hg в)H г)Cu
5. Вкажіть формулу складної речовини:
а) В б) WO3 в)Ca г)Zn
6. Молекула фосфіну складається з одного атома Фосфору і трьох атомів Гідрогену.
Фомула фосфіну: а) PH3 б)CO2 в)CH4 г)N2O3 Рівень 2
1. Процес відокремлення спирту від води грунтується на різниці їх:
а) кольору б) густини в) температури плавлення г)температури кипіння
2. Який запис означає «п’ять молекул азоту»:
а) N б) N2 в)5N2
3. Який з хімічних елементів має значення відносної атомної маси ,що дорівнює 24?
а)Ферум б)Флуор в)Магній г) Сульфур
Рівень 3
1. Обчисліть відносну молекулярну масу карбонатної кислоти , формула
якої: Н2СО3
2. Вкажіть ознаку , яка свідчить про молекулярну будову сірки:
а) за звичайних умов має твердий агрегатний стан.
б) жовтий колір
в) легкоплавка
3.В якій сполуці масова частка Сульфуру більша- у сульфур( ІV) оксиді SO2 чи сульфур (VI ) оксиді SO3 ?
Рівень 4
1. Неметал утворює сполуку з Гідрогеном з відносною молекулярною масою 44.
Кількість атомів неметалу і Гідрогену у сполуці відносяться як 3:8.Визначте хімічну формулу сполуки.
2. Обчисліть масові частки елементів у сполуці, формула якої AlCl3
3. Яка формула кальцій броміду,якщо він містить 20% Кальцію?
ІІ варіант
Рівень 1
1. Вкажіть назву речовини:
а) алюміній б)фарфорова чашка в)алюмінієва ложка в)алюмінієвий дріт
2. Яка з даних речовин є чиста?
а)йод б)річкова вода
в)мінеральна вода г)спиртовий розчин йоду
3. Вкажіть хімічне явище:
а) замерзання води б)плавлення свічки
в) ржавіння заліза г)світіння нитки електричної лампочки
4. Елемент Фосфор позначається символом:
а)Sб)Naв)Pг)Ba
5. Вкажіть формулу складної речовини:
а) ZnOб)Oв)Wг)K
6 .Молекула метану складається з одного атома Карбону і чотирьох атомів Оксигену.Формула метану:
а)СOб)СН4в)ВаОг)SO2
Рівень 2
1.Процес розділення солі і піску грунтується на різниці їх:
а) температури плавлення б) кольору
в) розчинності у воді г) густини
2. Який запис означає «Дві молекули водню» :
а) Н2 б)2Н2 в) Н
3.Відносна молекулярна маса кисню О2:
а)16 б)64 в)32
Рівень 3
1.Обчисліть відносну молекулярну масу кухонної солі, формула якої: NaCl
2.Вкажіть ознаку ,яка свідчить про немолекулярну будову силіцій оксиду(річковий пісок):
а) практично нерозчинний у воді;
б) висока температура плавлення;
в) поширений у природі.
3.В якій сполуці масова частка Феруму більша у ферум(ІІ) оксиді FeO чи ферум (ІІІ) оксиді Fe2O3 ?
Рівень 4
1. За певних умов Оксиген утворює просту речовину з відносною молекулярною масою 48. Визначте формулу цієї сполуки.
2. Обчисліть масові частки елементів у сполуці , формула якої CaBr2.
3. Яка формула купрум оксиду, якщо він містить 80% купруму?
ІV Підсумки уроку і повідомлення домашнього завдання.
Вивчити §. Виконати вправу (с. підручника).
Урок 27
Тема : Закон як форма наукових знань. Закон збереження маси речовин.
Мета: Вивчити закон збереження маси речовин як один з основних законів природи. Показати роль учених-хіміків А.Лавуаьє, М. Ломоносова в розкритті цього закону як форми наукових знань про природу. Пояснити значення закону збереження маси речовини в хімії.
Формування компетентностей: Загальнопредметна, комунікативна, саморозвитку і самоосвіти.
Тип уроку: Урок засвоєння нових знань, умінь і навичок
Обладнання і матеріали: Періодична система хімічних елементів
Д.І.Менделєєва, портрет М.В.Ломоносова,технологічні терези, двоколінна пробірка, пробка, розчини барій хлориду та натрій сульфату.
Хід уроку.
І Актуалізація і корекція опорних знань.
На попередніх уроках ми з вами говорили про те, що все, що знаходиться навколо нас не стоїть на місці, все змінюється.
1. Як називають зміни, які відбуваються у навколишньому середовищі?
(Явищами).
2. Які види явищ вам відомі? (Біологічні, фізичні, хімічні, політичні, соціальні тощо).
3. Яке явище називають хімічним? (Явище, під час якого одні речовини перетворюються на інші).
Вибірковий диктант (взаємоперевірка).
Позначте фізичні та хімічні явища літерами «ф» та «х».
1. Прокисання молока (х) .
2. Танення льоду (ф) 3. Випаровування спирту (ф) .
4. Обвуглення деревини (х) .
5. Рубання дров (ф) .
6. Випадання снігу (ф) .
7. Згіркнення масла (х) .
8. Утворення веселки (ф) .
9. Горіння свічки (х) .
10. Витягування золота у довгу нитку (ф) .
ІІ Мотивація навчання.
Вам вже відомо, як хіміки пізнають світ речовин. Вони здійснюють експерименти, вивчаючи хімічні властивості речовин, спостерігають зміни, що відбуваються з речовинами, вивчають умови перебігу хімічних реакційтощо. У результаті нагромаджується багато фактів, які потребують пояснення та узагальнення. Внаслідок цього виявляються закономірності, що об'єктивно існують у природі, й формулюються закони. Так трапилося і з законом збереження маси, відкритим й експериментально підтвердженим російським хіміком М. В. Ломоносовим та французьким ученим А.Л.Лавуазьє.
ІІІ Повідомлення теми, цілей і завдань уроку.
ІVСприймання й усвідомлення учнями фактичного матеріалу.
1. Короткі відомості з історії відкриття закону збереження маси.
Розповідь учителя.
Ще античні філософи висловлювали думку, що матерія взагалі не зникає і не утворюється знову з нічого, а кількість речовин у Всесвіті залишається постійною. Вони вважали, що це положення очевидне і не вимагає доказів.Першим вченим хто визнав його за важливий закон, сформулював його (1748 р.) і підтвердив експериментально на прикладі прожарювання металів був М. Ломоносов. Для дослідів М.В.Ломоносов використав скляні посудини, наповнивши їх залізними, мідними і свинцевими ошурками, й запаяв. Зваживши посудини він почав нагрівати їх у великій печі. Залізні ошурки почорніли, червоні ошурки міді перетворилисяна чорно- коричневий порошок, свинцеві ошурки розплавилися на сріблясто-білі краплі, які швидко покрилися сірувато-жовтим нальотом.Зваживши посудини після
‘прожарювання вчений виявив, що вага посудин залишилася незмінною. Проте, зваживши, золу було виявлено,що її маса виявилася важчою.Однак в посудині була деяка кількість повітря.Учений припустив, що корпускули повітря з’єдналисяз металами і маса повітря зменшилась на стільки на скільки збільшилась маса золи.Це було велике відкриття, завдяки якому вдалося сформулювати основний закон хімії. Ломоносов писав: «Усі зміни в натурі, які трапляються такого суть стану, що скільки від одного тіла забирається,стільки додається до іншого; так коли де убуде трохи матерії,то збільшиться в іншому місці...» Не знаючи про відкриття закону М. Ломоносовим , аналогічного висновку дійшов у 1789 році французький вчений А.Л.Лавуазьє. Тому закон збереження маси речовини називається законом Ломоносова- Лавуазьє і формулюється так:
Маса речовин, що вступили в хімічну реакцію, дорівнює масі речовин, які утворилися в результаті реакції.
![]()
Демонстрація.
У двоколінну пробірку помістити розчини барій хлориду та натрій сульфату. Пробірку закрити пробкою і підвісити до терезів, за
допомогою важків перевести терези у стан рівноваги, а потім (із закритим аретиром) вміст двох колін пробірки змішати. В результаті реакції випадає білий осад, після повторного зважування виявляється, що маса пробірки до і після реакції не змінилася.
2. Закон як форма наукових знань.
Проблемне питання.
Де в практичній діяльності людини використовується закон збереження маси речовини?
Самостійна робота учнів з підручником.
3. Відповіді учнів на поставлене питання.
4. Хімічне рівняння.
Розповідь учителя.
Виходячи із закону збереження маси речовини випливає, що атоми хімічних елементівпід час реакції не зникають і не виникають, а відбувається тільки їх перегрупування.Тобто кількість атомів кожного елемента залишається незмінною до і після реакції.
Існують схеми хімічних реакцій:
Н2 +О 2→ Н2О
В обох частинах схеми кількість атомів Гідрогену однакова, але різна кількість атомів Оксигену, підібравши коефіцієнти, які ставляться перед формулою речовини перетворюємо схему на хімічне рівняння:
2Н2 +О2=2Н2О
VОсмислення зв'язків і залежностей між елементами вивченого матеріалу.
Задача.
Згідно з законом збереження маси речовини обчисліть, яка маса меркурій (ІІ) оксиду розклалася, якщо при цьому утворилось 32 г кисню і 402 г ртуті.
Задача. Робота в парах.
Згідно з законом збереження маси речовини обчисліть, яка маса фосфор (V) оксиду утворилась, якщо при цьому в 16г кисню спалили 12,4г фосфору
Перевірка виконаної роботи.
VІУзагальнення і систематизація знань.
Завдання :
Закінчити речення:
1. Закон збереження маси речовин експериментально підтвердили:
______________.
2. Сучасне формулювання закону збереження маси речовин таке _________________.
3. Закон збереження маси речовин є основою для складання _____________________.
4. Кількість атомів до реакції повинна дорівнювати ____________________________ .
5. Коефіцієнт - це
_________________________________________________________ .
6. Коефіцієнт завжди ставиться
_____________________________________________ .
VІІ Підсумки уроку;повідомлення домашнього завдання.
Вивчити §. Виконати вправу (с. підручника).
Урок 28
Тема: Хімічні рівняння.
Мета: Повторити й розширити знання про хімічні реакції.Сформулювати поняття про хімічне рівняння як умовне зображення хімічної реакції. Формувати вміння і навички складання рівнянь хімічних реацій, розстановки коефіцієнтів на підставі закону збереження маси речовини, читання хімічних рівнянь.
Формування компетентностей:Навчально-пізнавальна, комунікативна, саморозвитку та самоосвіти.
Тип уроку:Комбінований.
Обладнання: Періодична система хімічних елементів Д.І.Менделєєва, таблиця розчинності основ, кислот і солей.
Хід уроку.
І Актуалізація і корекція опорних знань.
Бесіда.
1. Ким і коли був відкритий закон збереження маси речовини?
2. Як формулюється закон збереження маси речовини?
3. Яке практичне значення має цей закон7
4. У чому полягає суть хімічної реакції з точки зору закону збереження маси речовини?
ІІ Повідомлення теми, цілей і завдань уроку.
ІІІСприймання й усвідомлення учнями фактичного матеріалу.
1. Складання рівнянь хімічних реакцій взаємодії простих речовин.
Розповідь учителя.
Для того,щоб скласти рівняння реакції утворення складної речовини з простих речовин, потрібно, щоб у лівій частині рівняння були присутні ті прості речовини, атоми елементів яких присутні у сполуці у правій частині рівняння.
Наприклад:
Для того, щоб одержати купрум оксид, необхідно, щоб між собою прореагувалимідь і кисень.
VОсмислення зв'язків і залежностей між елементами вивченого матеріалу.
1.Допишіть рівняння реакцій і розставте коефіцієнти:
2 учні працюють біля дошки.
Fe + Cl2→S + O2→
Mg + O2→ K + Cl2→
Cu + O2→ P + O2→
2. Робота в парах:
Cu + S→Zn + Cl2→
Ag + F2→Ca + N2→
Na + Br2→ Al + I2→
Взаємоперевірка правильності виконання завдання.
VІУзагальнення і систематизація знань.
Хімічний диктант.
З яких простих речовин утворюються:AlI3, CO2 , ZnS, Na2O , CuO, CH4 , Ca3P2,
Запишіть рівняння реакцій.
VІІ Підсумки уроку; повідомлення домашнього завдання.
Вивчити §. Виконати вправу (с. підручника).
Урок 29
Тема: Семінарське заняття «Хімічні рівняння».
Мета: Узагальнити і закріпити знання про хімічні рівняння, виробити навички розстановки коефіцієнтів.
Формування компетентностей: Загальнопредметна, саморозвитку і самоосвіти, соціальної, комунікативної.
Тип уроку: Урок закріплення знань, умінь і навичок.
Обладнання: Періодична система хімічних елементів Д.І. Менделєєва, таблиця розчинності кислот, основ і солей.
Хід уроку
І. Перевірка домашнього завдання (взаєморецензування завдань).
ІІ. Перевірка раніше засвоєних знань.
Фронтальна бесіда.
1. Що називається хімічним рівнянням?
2. Чим відрізняється хімічне рівняння від схеми реакції7
3. Що потрібно зробити , щоб перетаорити схему реакції на хімічні рівняння?
3. Що відбувається з атомами хімічних елементів під час хімічної реакції?
ІІІ. Мотивація навчання, повідомлення теми, мети, завдань.
ІV. Застосування учнями знань і умінь.
1.Тренувальні вправи. Робота в парах .
Завдання.
Ag + Cl → AgCl Al +HCl →AlCl3 +H2
Cu + HgCl2 → CuCl2 + Hg Ag2O →Ag +O2
H2O + Cl2 →HCl + O2 Na +H2O →NaOH +H2
Al +O2 →Al2O3 Al +S →Al2S3
KMnO4 →K2MnO4 +MnO2 +O2 NaNO3 →NaNO2 +O2
2.Перевірка виконаного завдання (взаєморецензування завдань)
3.Робота в групах гетерогенного складу.
Al + H2SO4→Al2(SO4)3 +H2
CaO +H3PO4→Ca3(PO4)2 +H2O
Cu2(OH)2CO3→ CuO +H2O +CO2
4.Перевірка виконаного завдання.
Презентація представниками групи. V. Підведення підсумків уроку.
VI. Домашнє завдання.
Вивчити §. Виконати вправу (с. підручника).
Урок 30
Тема: Повітря та його склад.
Мета: Сформувати поняття про якісний і кількісний склад повітря.
Виховувати в учнів бережливе ставлення до навколишнього середовища.
Формування компетентностей: Загальнопредметна, ключова, саморозвитку і самоосвіти, еколого-валеологічна, комунікативна
Тип уроку: Урок засвоєння нових знань.
Обладнання: Періодична система хімічних елементів Д.І. Менделєєва
Хід уроку
І Актуалізація і корекція опорних знань.
1.Яке значення має повітря в житті живих організмів?
2.Який газ бере участь в процесі дихання7
3. Чому кількість кисню в повітрі не зменшується?
4. Як пояснити, що вміст вуглекислого газу в повітрі залишаєься незмінним?
ІІ Мотивування учіння.
ІІІ Повідомлення теми, цілей і завдань уроку.
ІVСприймання й усвідомлення учнями фактичного матеріалу.
1. Розповідь учителя з елементами бесіди . (мал. підручника)
Питання про склад повітря в науці було розв’язане не відразу.
У1774 році французький вчений А. Лавуазьє довів, що повітря – це суміш двох газів-
азоту і кисню.Він нагрівав металічну ртуть в реторті на жаровні протягом 12 діб.
Кінець реторти був підведений під дзвін, вміщений в посудину з ртуттю. В результаті рівень ртуті у дзвоні піднявся приблизно на 1/5 його місткості. На поверхні ртуті у реторті утворилася речовина оранжевого кольору-меркурій (ІІ) оксид. Газ, що залишився під дзвоном , був непридатний для дихання.
Цим дослідом було доведено, що в повітрі міститься приблизно 4/5 азоту і
1/5 кисню (за об’ємом)
Якісний склад повітря можна довести таким дослідом. Спалити фосфор у повітрі під дзвоном. При цьому вода у дзвоні піднімається пртблизно на 1/5 його місткості, оскільки під час горіння фосфору витрачається тільки кисень.азот ,який є у повітрі в реакцію горіння не вступає.
У кінці ІX століття дослідження ми було доведено, що крім кисню і азоту вповітрі містяться ще п’ять газоподібних речовин: гелій He, неон Ne, аргон Ar, криптон Kr, ксенон Xe. Довго не вдавалося добути сполуки цих елементів. Тому їх назвали благородними газами.
2. Повідомлення учнів (випереджаючі завдання) про галузь застосування інертних газів.
3.Охорона повітря від забруднення. Презентація за участю учнів.
VОсмислення зв'язків і залежностей між елементами вивченого матеріалу.
Запитання .
1. Який газ видихають всі живі організми?
2. Крім даних газів,який газ входить також до складу повітря?
3. А як довести, що у повітрі є водяна пара?
Заповнення таблиці «Склад повітря»
|
Сладові частини |
Вміст газів ( %) |
|
|
|
за об’ємом |
за масою |
|
Азот |
78,08 |
75,50 |
|
Кисень |
20,95 |
23,10 |
|
Благородні гази (переважно аргон) |
0,94 |
1,30 |
|
Карбон (ІІ) оксид |
0,03 |
0,046 |
VІУзагальнення і систематизація знань.
Бесіда.
1. Який вміст газів у повітрі за об’ємом і масою?
Подумайте. Чому в повітрі кисню за масою більше, ніж за об’ємом, а для азоту навпаки.
2.За допомогою якого досліду можна визначити вміст кисню і азоту в повітрі?
3. Як А. Лавуазьє довів склад повітря?
4.Які інертні гази вам відомі і чому їх так називають? Яка інша назва цих газів?
5. Де застосовуються ці гази?
VІІ Підсумки уроку;повідомлення домашнього завдання.
Вивчити §. Виконати вправу (с. підручника).
Урок 31
Тема: Оксиген. Кисень. Склад його молекули,фізичні властивості.
Мета: Повторити класифікацію речовин.Закріпити поняття про елементи – неметали та прості речовини на прикладі Оксигену і кисню. Дати поняття про хімічний елемент Оксиген і просту речовину кисень. Ознайомити з історією відкриття кисню, його поширенням у природі, фізіологічною дією і фізичними властивостями.
Формування компетентностей: Загальнопредметна, саморозвитку і самоосвіти, еколого- валеологічна.
Тип уроку: Урок засвоєння нових знань.
Обладнання: Періодична система хімічних елементів Д.І. Менделєєва.
Хід уроку
І Актуалізація і корекція опорних знань.
1. Які речови входять в склад повітря?
2. Який кількісний склад повітря?
3. Доведіть яким чином ви зменшили б забрудненість повітря.
ІІ Мотивування учіння.
Запитання .
1.Як класифікують хімічні елементи?
2. Визначіть положення хімічного елемента Оксигену в Періодичній системі хімічних елементів.
ІІІ Повідомлення теми, цілей і завдань уроку.
ІVСприймання й усвідомлення учнями фактичного матеріалу.
1.Розповідь учителя.
Загальна характеристика.
Хімічний знак - О
Відносна атомна маса Аr(О) =16
Хімічна формула-О2
Відносна молекулярна маса Мr (О2)=32
У сполуках Оксиген двовалентний.
2. Історія відкриття кисню.
Кисень вперше був отриманий в чистому вигляді К.В. Шеєлє в 1772 році, а потімД. Прістлі(Англія), який виділив його із меркурій( ІІ) оксиду. Проте Прістлі не знав, щоотриманий ним газ входить в склад повітря. Тільки через декілька років Лавуазьє, детально вивчивши властивості цього газу, визначив, що він є складовою частиною повітря.
2. Випереджаючі завдання . Повідомлення учнів про поширеність кисню в природі.
3. Розповідь учителя. Склад молекули .
Молекула кисню складається з двох атомів Оксигену і являється стійкою молекулою.
4.Фізичні властивості кмсню.Самостійна робота учнів з підручником.
Запитання :
Які фізичні властивості має кисень?
5.Розповідь учителя. Фізіологічна дія кисню.
За участю кисню відбувається один із найважливіших життєвих процесів- дихання.
Потрапляючи через органи дихання цей газ зв’язується з гемоглобіном (компонентом крові ) і розноситься разом з кров’ю по всьому організму.
Окиснення киснем поживних речовинслужить джерелом енергії для живих організмів.
VОсмислення зв'язків і залежностей між елементами вивченого матеріалу.
Бесіда за питаннями.
1.Який хімічний елемент найпоширеніший у земній корі?
2. До складу яких сполук входить цей елемент і який його вміст у природі?
3.Як був відкритий кисень?
VІПідсумки уроку;повідомлення домашнього завдання.
Вивчити §. Виконати вправу (с. підручника).
Урок 32
Тема: Одержання кисню в лабораторії. Реакції розкладу.Поняття про каталізатори.
Мета: Сформувати уявлення про реакції розкладу та каталізатор на прикладі реакцій одержання кисню в лабораторії та промисловості. Підготувати учнів до практичної роботи.
Формування компетентностей: Загальнопредметна, саморозвитку і самоосвіти.
Тип уроку: Урок засвоєння нових знань,умінь.
Обладнання: Штатив з пробірками,пробка з газовідвідною трубкою,кристалізатор з водою,дерев’яна скіпка, скляна пластинка, сірники,пероксид гідрогену, манган(ІV)оксид,вода.
Хід уроку
І Актуалізація і корекція опорних знань.
1.Яка фізіологічна дія кисню на організм людини?
2.Які інші процеси, крім дихання підтримує кисень?
3. Як був добутий кисень?
ІІ Мотивування учіння.
ІІІ Повідомлення теми, цілей і завдань уроку.
ІVСприймання й усвідомлення учнями фактичного матеріалу.
1. Добування кисню в лабораторії. Розповідь учителя . Демонстрація.
Лабораторні способи добування кисню грунтуються на хімічних реакціях.
Його можна отримати розкладанням деяких оксигеновмісних речовин.
Реакції, під час яких із однієї речовини утворюється декілька інших ,називають реакціями розкладу.
Демонстрація:
Добування кисню розкладом пероксиду гідрогену в присутності манган(ІV)оксиду.
МnO2
2Н2О2→2Н2О +О2
2. Формування поняття про каталізатори.
Каталізатори широко застосовуються в хімічній промисловості.За їх допомогою можна підвищити прдуктивність хімічних процесів, зменшити собівартість продукції і повніше використовувати сировину.
3. Методи збирання кисню. Демонстрація методів збирання кисню.
а) витісненням повітря.
б) витісненням води,або над водою.
4.Доведення наявності кисню (за допомогою тліючої скіпки).
5. Інші лабораторні способи добування кисню.(Розклад КMnO4NaNO3H2O)
6. Добування кисню в промисловості. Самостійна робота учнів з підручником.
VУзагальнення і систематизація знань.
Бесіда за питаннями:
1.Як добувають кисень у промисловості?
2. Завдяки чому можна розділити рідкий азот і кисень?
3.Де зберігають газоподібний кисень і за яких умов?
4.Як розпізнати балони з киснем?
5.Чому вони мають такий колір? Адже кисень-газ без кольору?
6,Як утворюється кисень у природі?
VІ Підсумки уроку;повідомлення домашнього завдання.
Вивчити §. Виконати вправу (с. підручника).
Урок 33
Тема:Практична робота №4.
Добування кисню з гідроген пероксиду, збирання , доведення його наявності.
Мета: Перевірити знання техніки безпеки під час виконання практичної роботи.Продовжити розвивати навички роботи з хімічними речовинами й лабораторним обладнанням. Навчити складати прилад для одержання газів, збирати гази шляхом витіснення повітря і води.Формувати вміння і навички проведення хімічного експерименту й аналізу явищ, що спостерігаються, робити висновки в ході практичної роботи.
Формування компетентностей:Загальнопредметні, саморозвитку і самоосвіти, здоров’язберігаюча, продуктивної творчості.
Тип уроку:Урок практичного застосування знань, навичок і вмінь.
Обладнання: Штатив з пробірками, пробка з газовідвідною трубкою, кристалізатор з водою, деревяна скіпка,сірники,спиртівка,скляна пластинка, тигельні щипці, лопаточка або шпатель.
Реактиви: 30% -й розчин гідроген пероксиду (пергідроль), деревна вуглинка (розміром з горошину), вапняна вода; манган (IV) оксид; пісок.
Хід уроку
І Перевірка домашнього завдання, актуалізація і корекція опорних знань, навичок і вмінь;
1.З яких речовин можна добути кисень в лабораторії?
2.Якими методами можна збирати кисень?
3.Як можна перевірити наявність кисню?
4.Щотаке каталізатор?
ІІ Повідомлення теми, цілей і завдань уроку; ІІІ Актуалізація мотивації учіння учнів;
ІІІ. Інструктаж з техніки безпеки.
Перед початком роботи повторити з учнями правила техніки безпеки під час роботи з хімічними речовинами, скляним хімічним посудом.
Пергідроль (30%-й розчин гідроген пероксиду) — їдка речовина! У разі потрапляння на шкіру може призвести до слабких опіків. Знебарвлює одяг. У разі потрапляння пергідролю на шкіру або одяг його необхідно змити проточною водою. Якщо цього не зробити вчасно, можливе утворення опіку, при цьому відбувається пощипування шкіри та забарвлення її в білий колір.
Не лякайтеся: неприємні відчуття швидко минуть, а біла пляма зникне через 2-3 години. Побіління одягу в разі дії пергідролю усунути неможливо — барвник руйнується назавжди.
ІV Осмислення змісту й послідовності застосування способів виконання дій;
Інструктаж по проведенню практичної роботи.
Дослід 1. Добування та збирання кисню методом витіснення повітря
У пробірку з 2 мл гідроген пероксиду (цей реагент у пробірку наливає вчитель) лопаточкою або шпателем внесіть трохи речовини, що призводить до розкладу гідроген пероксиду.
Потім пробірку слід закрити пробкою з газовідвідною трубкою. Кінець трубки опустіть у склянку.
Через 2-3 хв. опустіть у склянку скіпку, що жевріє (видає вчитель), та відразу ж вийміть її. Якщо скіпка у склянці яскраво спалахнула, зачекайте ще кілька хвилин, потім вийміть газовідвідну трубку й накрийте склянку скляною пластиною.
Опишіть, що відбувається у пробірці в процесі добування кисню.
Опишіть, що залишається у пробірці після закінчення реакції.
Чому загоряння скіпки свідчить про наявність у склянці кисню?
Запишіть рівняння розкладу гідроген пероксиду H2O2.
Яка речовина сприяє розкладу гідроген пероксиду, чим вона є в реакції?
Висновок
Кисень можна добути шляхом розкладу ________________________ під дією ___________________, який є ____________________________________.
Довести наявність кисню можна з допомогою _________________________, вона ___________________________________________________________.
Дослід 2. Горіння вугілля в кисні
Візьміть склянку з киснем, добутим у досліді 1. На дно склянки насипте шар піску завтовшки приблизно 1 мм. Тигельними щипцями візьміть маленький (близько 5 мм у поперечнику) шматочок деревного вугілля та нагрійте його в полум’ї до червоного розжарювання. Щипцями внесіть у склянку з киснем розжарене вугіллячко. Не випускаючи вугіллячка із щипців, простежте за процесами, що відбуваються у склянці. Шар піску на дні запобігає розтріскуванню склянки, якщо гаряче вугіллячко випаде із щипців.
Після закінчення хімічного процесу вийміть щипці зі склянки й налийте в неї 2-3 мл вапняної води. Акуратно струсніть склянку. Простежте за змінами, які відбуваються з вапняною водою.
Опишіть, що відбувається з вугіллям, яке помістили в чистий кисень.
Запишіть рівняння реакції, що відбувається у склянці з киснем.
C + __________________________________
Висновок
Горіння вугілля в чистому кисні _________________________ (більш, менш) інтенсивне, ніж у повітрі. Під час горіння утворюється
________________________________.
Загальний висновок 1. Як добувають кисень?
2. Як збирають кисень?
3. Як довести наявність кисню?
4. Які властивості характерні для кисню?
V Самостійне виконання учнями завдань під контролем і за допомогою вчителя;
VІ Звіт учнів про роботу і теоретичне обґрунтування отриманих результатів;
VІІ Підсумки уроку й повідомлення домашнього завдання.
Вивчити §. Виконати вправу (с. підручника).
Урок 34
Тема: Хімічні властивості кисню: взаємодія з простими речовинами.Реакція сполучення.
Мета: Вивчити хімічні властивості кисню на прикладі взаємодії з вугіллям, сіркою, воднем, магнієм , залізом , міддю. Закріпити і розширити знання про хімічні реакції, складання рівнянь хімічних реакцій. Дати уявлення про реакції сполучення, окиснення . Дати поняття про оксиди як продукти окиснення елементів металів і неметалів.
Формування компетентностей: Загальнопредметних, саморозвитку і самоосвіти,комунікативні.
Обладнання: Штатив з пробірками, пробка з газовідвідною трубкою, хімічний стакан, металева ложечка, гідроген пероксид, манган (IV) оксид.
Хід уроку
І Актуалізація і корекція опорних знань.
1.Яка загальна характеристика елемента Оксигену?
2.Які процеси підтримує кисень?
3.Які фізичні властивості кисню?
ІІ Мотивування учіння.
ІІІ Повідомлення теми, цілей і завдань уроку.
ІVСприймання й усвідомлення учнями фактичного матеріалу.
1. Хімічні властивості кисню. Горіння в кисні простих речовин. Розповідь учителя.
Кисень при нагріванні енергійно реагує з багатьма речовинами, при цьому виділяється теплота і світло.Такі реакції називаються реакціями горіння.
Демонстрація. Горіння сірки в кисні.
Сірка горить у кисні яскравим синім полум’ям і утворюється газ із різким запахом-сульфур(ІV) оксид.
S + O2=SO2
Фосфор згоряє в кисні яскравим полум’ям , і утворюється білий дим , який складається з твердих частинок фосфор (V) оксиду.
4P + 5O2 =2P2O5
Якщо внести в посудину з киснем тліючу вуглинку, то вона розжарюється до білого і згоряє. Щоб визначити, яка речовина утворилася в результаті горіння потрібно налити у посудину вапняну воду. Вона стає каламутною, бо під час горіння утворюється карбон (IV) оксид.
C +O2= CO2
2. Горіння в кисні металів.(магнію, заліза, міді)
В кисні горять навіть такі речовини, які здаються негорючими, наприклад залізо. Якщо до стальної дротини прикріпити сірник, запалити його і опустити в посудину з киснем, то від сірника займеться і залізо, яке горить у кисні з тріском, розкидаючи яскраві іскри- розплавлені краплі залізної окалини Fe3O4
3 Fe +2O2 =Fe3O4
Реакції,під час, яких з їз кількох речовин утворюється одна називаються реакціями сполучення.
3. Горіння в кисні складних речовин.
Багато складних речовин реагує з киснем, який, як правило є окисником. На окиснювальній здатності кисню базується важлива його властивістьздатність підтримувати горіння речовин. Процес горіння як реакція сполучення (взаємодії) речовин з повітрям був вперше встановлений французьким хіміком Лавуазьє.
Наприклад , газ –метан, що входить до складу природного газу, згоряє, взаємодіючи з киснем так:
CH4 +2 O2 = CO2 +2 H2O
Горіння сірководню Н2S відповідає реакції:
2H2S + 3O2 =2SO2 +2H2O
4. Взаємодія речовин з киснем належить до реакцій окиснення .У більшості випадків в цих реакціях утворюються оксиди.
Оксиди- це сладні речовини, які складаються з двох елементів, один з яких обов’язково є Оксиген.
VОсмислення зв'язків і залежностей між елементами вивченого матеріалу.
1. Скласти рівняння реакцій ,за допомогою яких можна здійснити такі перетворення
2. Робота в парах.
3. Перевірка виконаного завдання.
VІУзагальнення і систематизація знань.
1. Які хімічні властивості характерні для кисню?
2. Які речовини утворюються в результаті горіння?
3. Що таке оксиди?
VІІПідсумки уроку;повідомлення домашнього завдання.
Вивчити §. Виконати вправу (с. підручника).
Урок35
Тема:Поняття про оксиди, окиснення, горіння
Мета: Розвивати вміння складати рівняння хімічної реакції взаємодії кисню з простими речовинами. Поглибити знання про складні речовини на прикладі оксидів, навички складання бінарних сполук. Розвивати вміння складати рівняння хімічних реакцій взаємодії кисню. Виховувати вміння працювати в групі.
Формування компетентностей: Загальнопредметних, саморозвитку і самоосвіти, комунікативні.
Тип уроку: поглиблення знань.
Обладнання: періодична система хімічних елементів, опорна схема
«Кисень».
Хід уроку
І. Організація класу
ІІ. Актуалізація знань
Клас поділяється на групи, кожна група одержує завдання
1 група
Розкажіть про будову молекули кисню та фізичні властивості.
Допишіть рівняння реакцій і урівняйте:
S + O2 = HgO =
2 група
Розкажіть про хімічні властивості кисню.
Допишіть рівняння реакцій і урівняйте:
Zn + O2 = KMnO4 =
3 група
Розкажіть про лабораторні способи добування кисню.
Допишіть рівняння реакцій і урівняйте:
Р + О2 = Н2О2 =
4 група.
Розкажіть про поширення Оксигену в природі та застосування кисню.
Допишіть рівняння реакцій і урівняйте:
Mg + O2 = Н2О =
Один представник кожної групи усно відповідає на перше запитання, а інший записує на дошці рівняння реакцій у вигляді стовпчика (розкладу і сполучення).
ІІІ Оцінювання роботи груп.
ІV. Поглиблення знань.
На дошці записані два стовпчики хімічних рівнянь. Один стовпчик характеризує способи одержання кисню (учні визначають який), другий – хімічні властивості кисню.
Які речовини називають оксидами?
Характерна хімічна властивість кисню- здатність під час нагрівання енергійно вступати в процеси окиснення – відновлення з простими і складними речовинами. Кисень безпосередньо сполучається з усіма елементами, крім інертних газів, галогенів, срібла і деяких інших. Залежно від інтенсивності реакції окиснення поділяють:
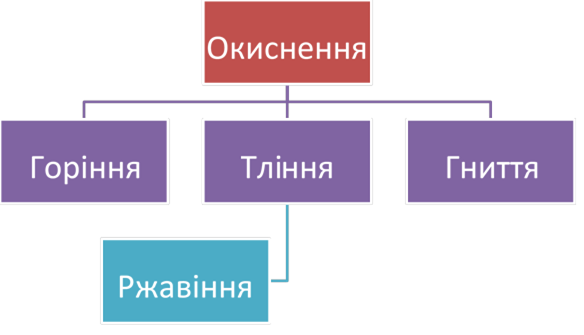
Горіння – реакції з виділенням тепла і світла. У чистому кисні речовини горять значно енергійніше, ніж на повітрі, бо теплота, що виділяється під час реакції, не витрачається на нагрівання азоту повітря, який в реакцію не вступає.
Тління – окиснення органічних речовин з виділенням тепла і навіть світла, але не полум’я.
Гниття – повільне окиснення на повітрі органічних речовин.
Ржавіння – повільне окиснення металу заліза киснем.
Що називають окисненням!
Що таке горіння?
Як називаються продукти горіння простих речовин?
Інтерактивна вправа «Ланцюжок» - учні по черзі наводять приклади оксидів і дають їм назву. V. Закріплення знань
Дається завдання за варіантами для самостійної роботи зі взаємоперевіркою.
Допишіть рівняння реакцій горіння і розставте коефіцієнти.
І в.Zn + O2 = II в. Mg + O2 =
Na + O2 = Li + O2 =
Al + O2 = Cr + O2 =
Ca + O2 = Cu + O2 =
Si +O2 = Hg + O2 =
VI. Домашне завдання
Прочитати параграф, відповісти на запитання, виконати вправи після параграфа.
Урок 36 - 37
Тема:Взаємодія кисню зі складними речовинами( повне окиснення метану, сірководню і глюкози). Умови виникнення і припинення горіння. Маркування небезпечних речовин.
Мета:Розвивати вміння складати рівняння хімічної реакції взаємодії кисню зі складними речовинами. Ознайомити учнів з умовами виникнення і припинення горіння.Продовжити розвивати вміння складати рівняння хімічної реакції взаємодії кисню з простими речовинами. Поглибити знання про складні речовини на прикладі оксидів, навички складання бінарних сполук, показати учням зв'язок науки з життям , підтримувати інтерес до хімії, працювати з додатковими джерелами інформації.
Формування компетентностей: Загальнопредметних, саморозвитку і самоосвіти, комунікативні.
Тип уроку: поглиблення знань.
Обладнання: періодична система хімічних елементів, опорна схема
«Кисень».
Хід уроку
І. Організація класу
ІІ. Актуалізація знань.
Хімічний диктант
1. Які види окиснення ви знаєте? (горіння, тління, ржавіння, гниття).
2. Реакція, в результаті якої з двох або більшої кількості вихідних речовин утворюється одна нова сполука – це реакція …….(сполучення)
3. Хімічна реакція , за якої відбувається окиснення речовин з виділенням тепла і світла - ………………. (горіння)
4. Складні речовини, утворені двома елементами, один з яких є Оксиген – це……….....(оксиди).
5. Рослини під час дихання кисень …………… (поглинають)
6. Під час взаємодії кисню з вугіллям утворюється……….(СО2)
7. Хімічна реакція взаємодії простих і складних речовин з киснем - ……...
(окиснення)
8. Унаслідок взаємодії кисню з магнієм утворюється……..(магній оксид)
9. Хімічна формула кисню ……….(О2)
10. Відносна атомна маса Оксигену дорівнює ……..(16)
11. Кисень в лабораторії добувають з ………….(калій перманганату)
12. Запишіть хімічне рівняння горіння сірки…..(S + O2 = SO2 )
ІІІ. Мотивація навчальної діяльності.
То що таке горіння? Як можа виникати горяння та припинятись?
IV.Поглиблення знань
- Коли горять прості речовини в кисні, то як називаються їх продукти?
- А чи можуть горіти складні речовини?
Так, наприклад, бензин, тканина, папір, природній газ. До складу природного газу входить складна речовина метан СН4, яка гарно горить з утворенням двох оксидів:
СН4 + 2О2 = СО2 + 2Н2О
Висновок: кожен елемент, що входить до складу складної речовини, утворює оксид.
Аналогічно буде відбуватись хімічна реакція з гідроген сульфідом та глюкозою.
С6Н12О6 + 9О2 = 6СО2 + 6Н2О
- В якому випадку горіння відбувається швидше: у чистому кисні чи на повітрі?
А без доступу повітря горіння не можливе взагалі.
- Папір добре горить, а чому наші зошити не загоряються зараз? Їх необхідно нагріти, піддати дії вогню, адже для кожної речовини існує своя температура загоряння (для деревини – 270° С,фосфору – 40° С, азоту 2500° С, вуглецю – 350º С) Це температури загоряння.
Умови виникнення горіння:
1. Наявність кисню.
2. Нагрівання речовин до температури загоряння.
Умови припинення горіння:
1. Перекрити доступ кисню
2. Остудити речовину до температури, нижчої за температуру загоряння.
Засоби гасіння пожеж:
1. Вогнегасники,
2. Пісок.
3. Вода та ін.
Деякі речовини можуть повільно окислюватись під впливом повітря без температури загоряння- це мимовільне окиснення. V. Закріплення знань.
Складіть рівняння горіння вугілля, фосфору, гідроген сульфіду, обчисліть масові частки Оксигену в одержаних оксидах і розташуйте їх в порядку спадання масової частки Оксигену.
VI.Підбиття підсумків, виставлення оцінок.
VI. Домашне завдання
Прочитати параграф, відповісти на запитання, виконати ваправи післі параграфа, повторити фізичні та хімічні властивості кисню.
Творче завдання. Підготувати повідомлення про кругообіг Оксигену в природі, використання кисню та його біологічну роль.
Опорна схема Кисень
|
Оксиген. Кисень Хімічний елемент – Хімічний символ – Відносна атомна маса Аr(O) = Валентність |
Оксиген. Кисень. Проста речовина – Хімічна формула – Відносна молекулярна маса Мr(O2) Фізичні властивості Розчинність у воді – tпл = tкип = Агрегатний стан – Колір – Запах – Смак – |
|
Способи одержання 1. Лабораторний спосіб – розклад оксигеновмісних речовин: КМnО4 = Н2О2 = KNO3 = КСІО3 = Н2О = 2. Промисловий спосіб
|
Хімічні властивості 1. Взаємодія з неМе: С + О2 = S + О2 = Р + О2 = N2 + О2 = 2. Взаємодія з Ме: Мg + О2 = Li + О2 = Al + О2 = Cu + О2 = Окиснення – це реакція |
|
Поширення у природі |
взаємодії__________________________ Горіння – реація окиснення, що супроводжується виділенням_________ і _____________. Оксиди – складні речовини, що складаються з _________ елементів, один з яких ______________
|
Урок 38.
Тема: Семінарське заняття «Хімічні властивості кисню».
Мета:Закріпити та систематизувати теоретичні знання про хімічні властивості кисню, методи його добування та збирання; виробити навички складання відповідних рівнянь реакцій. Розвивати пізнавальну активність і творчі здібності. Розвивати уміння логічно мислити ; вміння знаходити взаємозв'язок між різними темами в хімії . Розвивати самостійність мислення, мова, пам'ять. Підтримувати стійкий інтерес до хімії.
Формування компетентностей: Загальнопредметна, саморозвитку і самоосвіти, соціальної, комунікативної.
Тип уроку: узагальнення та систематизація знань, умінь і навичок
Обладнання:періодична система хімічних елементів, опорна схема «Кисень», картки - завдання.
Хід уроку І. Організаційний етап.
ІІ. Перевірка домашнього завдання
ІІІ. Семінар
1. Завдання для фронтальної роботи
Завдання 1. Запишіть рівняння реакцій відповідно до схем
NН3 + О2 = NO + Н2О СО + О2 = СО2 N2 + O2 = N2O5 Н2 + О2
= Н2О
Завдання 2. Визначити масові частки Оксигену в оксидах попередньго завдання і порівняти.
Учні виконують завдання по чензі біля дошки.
2. Завдання для групової роботи
Учні об’єднуються в чотири групи, завдання в групах повторюються з метою взаємоперевірки.
1,3 групи.
1. Складіть рівняння реакції горіння сірки в кисні .
2. Розмістіть формули оксидів у порядку збільшення валентності першого елемента: а)N2O5, б)SeO3, в)Rb2O, г)P2O3
3. Кисень можна отримати з речовин, формули яких: а)KHCO3, б)KClO3,
в)KMnO4, г)KOH.
4. Повільне окиснення відбувається під час:
а) займання торфу на болоті;
б) розкладання гною у парниках;
в) іржавіння металевих виробів
г)розщеплення поживних речовин в живих організмах.
5. Спосіб збирання кисню витісненням води ґрунтується а тому, що кисень
а) погано розчиняється у воді;
б) добре розчиняється у воді4;
в) осідає на дно пробірки;
г) піднімається до отвору пробірки
6. Тліюча скіпка, опущена на дно пробірки з киснем, повністю згоряє. Якщо її підняти вгору, вона швидко згасне, тому що
а) біля отвору пробірки кисню майже не має;
б) кисень легкий і швидко звітрюється;
в) кисень важчий за повітря і осідає на дно пробірки;
г) тліюча скіпка може горіти тільки в закритому просторі
2. 4 групи.
1. Складіть рівняння реакції горіння фосфору в кисні .
2. Розмістіть формули оксидів у порядку збільшення валентності першого елемента: а)ВаО, б)В2О3, в)СО2, г) Li2О.
3. Кисень можна отримати з речовин, формули яких:
а) СаСО3, б)С6Н12О6, в) КМnО4 , г) КNО3
4. Спосіб збирання кисню витісненням повітря ґрунтується на тому, що кисень
а) не розчиняється у повітрі
б) важчий за повітря
в) легший за повітря
г) добре розчиняється у поітрі
5. Тліюча скіпка, опущена на дно пробірки з киснем, довше горить на відміну від скіпки, що знаходиться у верхній частині пробірки, тому що
а) кисень легший і швидко звітрюється
б) біля отвору пробірки кисню майже не має
в) тліюча скіпка можу горіти тільки в закритому просторі
г) кисень важчий за повітря і осідає на дно пробірки. 6. Повільне окиснення відбувається під час
а) скисання молока
б) займання метану на болоті
в) бродіння соку
г) згіркнення вершкового масла.
IV. Підбиття підсумків уроку
Обговорення підсумків уроку, оцінювання учнів на уроці.
V. Домашне завдання
Опрацювати матеріал параграфів вивчених з теми, відповісти на запитання до них.
Урок 39
Тема: Поширення і колообіг Оксисену в природі. Озон. Проблеми чистого повітря. Застосування кисню і його біологічна роль.
Мета: Узагальнити й систематизувати знання про хімічний елемент Оксиген та просту речовину кисень. Розглянути поширеність і колообіг Оксигену в природі. З'ясувати біологічну роль Оксигену. Виявити рівень засвоєння основних понять, навичок складання хімічних рівнянь. Розвивати пізнавальну активність і творчі здібності. Підтримувати стійкий інтерес до хімії . Виховувати дбайливе ставлення до навколишнього середовища , природних ресурсів країни.
Формування компетентностей: Загальнопредметна, саморозвитку і самоосвіти, соціальної, комунікативної.
Тип уроку: Засвоєння і систематизація знань.
Обладнання: періодична система хімічних елементів, схема «Колообіг кисню в природі»
Хід уроку І. Організаційний етап.
ІІ. Актуалізація опорних знань.
1. Індивідуальні завдання (біля дошки)
- В атмосфері в результаті горіння палива накопичуються оксиди
N2O3,CO, SO2, які викликають глобальні екологічні проблеми, такі як «Парниковий ефект», «Кислотні дощі». Напишіть рівняння утворення цих оксидів та вкажіть типи хімічних реакцій.
- Протягом доби людина вдихає 25 кг повітря. Під час роботи автомобіля кожні 100км шляху використовується1825 кг кисню. Обчисліть скільки могло б дихати людина цим киснем, якщо масова частка кисню в повітрі становить 23%.
2. Індивідуальні картки(учні виконують за партами)
- Розставте коефіцієнти в хімічних рівняннях (10б)
Н2О = Н2 + О2 Mg + O2 = MgON2 + O2 = N2O5
Вкажіть тип хімічної реакції. Як називаються продукти реакцій?
- Яке мінеральне добриво багатіше на Оксиген: NH4NO3 чи K3PO4?
(12 б)
- Складіть формули оксидів Нітроген (І) , Фосфор (V), Кальцію (ІІ), Алюмінію (ІІІ), Феруму (ІІІ), Карбону (VІ), Цинку (ІІ). (8 б)
- Вставте пропущені слова в речення: «Хімічний елемент Оксиген утворює прості речовини ………… та ………… За звичайних умов кисень має ………….. агрегатний стан. Ця речовина ………….. за повітря, тому його можна зібрати ……………….. При температурі
-183°С він стає…………. Влабораторії його добувають із………… Наявність кисню можна визначити внесенням ……………………..
у посудину, вона ……………………» (6 б)
3. Фронтальна робота – гра «Морський бій»
На столах у учнів знаходиться ігрове поле, на якому написані формули простих і складних речовин. Першому учневі координати задає учитель: учень, який відповідає, повинен прочитати формулу і сказати, чи є ця речовина оксидом. Ця формула викреслюється, і учень називає нові координати учневі іншого ряду. Гра іде до тих пір, поки все поле не буде закреслено.
|
|
А |
Б |
В |
Г |
|
1 |
CuO |
HCL |
Al2O3 |
Fe |
|
2 |
H2 |
N2O5 |
H2CO3 |
BaF2 |
|
3 |
HNO3 |
MgO |
NH3 |
S |
ІІІ. Мотиваціянавчальної діяльності
Вірш – загадка «Ода Оксигену»
Из атомов мир создавала Природа.
Два атома легких взяла Гидрогена,
Прибавила атом один Оксигена
И получилась частица воды,
Море воды, океаны и льды… Стал Оксиген чуть не всюду начинкой.
С Силицием он обернулся песчинкой.
В воздух попал кислород,
Как ни странно,
Из голубой глубины океана.
И на Земле появились растения,
Жизнь появилась: дыханье, горение…
Первые птицы и первые звери, Первые люди, что жили в пещере… огонь добывали про помощи горения…
Роль Оксигена на нашей Земле
Понял великий Лавуазье.
IV.Вивчення нового матеріалу
1. Фронтальна робота з підручником та діаграмами «Вміст хімічних елементів в земній корі», «Склад повітря»
Завдання:
1. Відкрийте підручник. Знайдіть діаграму «Вміст хімічних елементів в земній корі»
3. По діаграмі визначте масову і атомну частки Оксигену в земній корі.
4. Зробіть висновок про його поширеність.
5. До складу чого може входити Оксиген.
6. Знайдіть діаграму «Склад повітря»
7. По діаграмі визначте складові частини повітря.
(показують на діаграмі на дошці)
8. Чому протягом тисяч років відсотковий склад повітря майже не змінився, адже всі живі істоти поглинають кисень, а виділяють вуглекислий газ при диханні, транспорт і вся промисловість працює завдяки горінню?
ВИСНОВОК (учні роблять самостійно):
Оксиген – найпоширеніший елемент земної кори. В повітрі його 23%. Його запаси поповнюються фотосинтезом рослин. Рослини мають планетарне значення.
2. Парна робота зі схемою «Колообіг Оксигену в природі»
Завдання:
1. Прочитайте матеріал параграфу «Біологічна роль Оксигену»
2. Проаналізуйте малюнок і визначте основні процеси в природі, які відбуваються за участю кисню.
3. Складіть колаж з позначенням всіх процесів, які забезпечують колообіг Оксигену.
ВИСНОВОК: (схема в зошиті)
О2

![]() Фотосинтез
дихання
гниття окиснення
горіння
Фотосинтез
дихання
гниття окиснення
горіння

СО2
Під дією на кисень електричного розряду утворюється озон О3 – світло – блакитний отруйний газ (але корисний у невеликих кількостях) із запахом
свіжості: 3О2 = 2О3 (озонування)
Озон, який міститься у стратосфері, захищає живі організми від дії ультрафіолетового випромінювання Сонця. Озон хімічно дуже активний: майже всі метали перетворює на оксиди,а рідкі та газоподібні горючі органічні речовини при контакті з ним займаються
3. Звіт про дослідницьку роботу «Проект «Вплив рослин на склад повітря»
|
№ |
етап проекту |
висновки |
|
1. |
Назва проекту |
«Вплив рослин на склад повітря» |
|
2. |
Мета та завдання проекту |
1. Опрацювати літературу про дихання та фотосинтез рослин; 2. Поставити дослід.
|
|
3. |
Теоретична частина проекту |
Знайти відповіді на питання: Що таке дихання? Як воно відбувається в рослинах? Що таке фотосинтез? В яких організмах він відбувається? Які умови впливають на фотосинтез? Чому рослини мають планетарне значення? |
|
4. |
Практична частина проекту |
Проведення досліду: В дві склянки постити рослини. Щільно закрити склянки. Одну оставити на світлі, а другу помістити в темне місце на 2-3 доби. Перевірити наявність кисню в обох посудинах внесенням тліючої лучинки. |
|
5. |
Аналіз результатів |
Рослини вдихають кисень, а виділяють вуглекислий газ. Разом з цим, переважно в листях рослин, відбувається фотосинтез. Фотосинтез – це процес утворення органічних речовин з неорганічних в рослинах на світлі з вуглекислого газу і води з виділенням кисню. Необхідною умовою фотосинтезу є світло. Тому в нашому досліді одну склянку ми помістили в темне місце, щоб довести, що тоді кисень виділятися не буде. Для того, щоб визначити наявність кисню в |
|
|
|
обох посудинах було внесено тліючу скіпочку. В склянці №1 – скіпочка спалахує, а в №2 - тухне. |
|
6. |
Висновки |
Рослини мають планетарне значення, тому що саме вони поповнюють запаси кисню в атмосфері, забезпечуючи життя на нашій Землі. |
|
7. |
Мої враження від роботи над проектом |
|
3. Інформбюро «Екологічні проблеми атмосфери»
4. Вчитель:
А тепер увага – дуже жахливий факт! В Японії вже почали продавати чисте повітря. Мешканці мегаполісів вже давно забули, яким є його ковток - ковток свіжості та запаху лісу. Що ж є причинами того, що цей товар чекає фінансовий успіх?
(учні називають причини)
Так, дійсно. Людство в результаті своєї господарської діяльності погіршує стан повітря і само собі створює велику кількість екологічних проблем.
(доповіді учнів, запис в зошиті)
V. Узагальнення матеріалу уроку
1. «Мікрофон»
§ «Сьогодні на уроці я зрозумів, що…»
§ Поясніть народну мудрість:
«Багато лісу - не губи.
Мало лісу – бережи.
Немає лісу – посади».
2. Лабораторія
Проаналізуйте зміст етикетки столової води «Тонус - кислород»

- Яким чином можна визначити наявність кисню в пляшці цієї води?
- Яку інформацію про застосування кисню ви можете знайти на етикетці?
VI. Домашнє завдання:Прочитати параграф, відповісти на запитання, виконати ваправи післі параграфа, повторити фізичні та хімічні властивості кисню.
VІІ. Підведення підсумків уроку
Оцінювання навчальних досягнень учнів.
Побажання учням:
І повітря, і вода –
Взагалі природа вся!
Хімію вивчай охоче – І в халепу ти не вскочиш. Будеш знать про неї все,
Вона користь принесе.
Урок 40.
Тема:Розв’язування розрахункових задач і вправ.
Мета:Узагальнення та систематизація знань з теми. Підготовка до тематичного оцінювання, удосконалювати знання, уміння, навички написання хімічних рівнянь, розв’язування розрахункових задач, розвивати логічне мислення, виховувати повагу до власної думки, самостійність мислення.
Формування компетентностей: Загальнопредметна, саморозвитку і самоосвіти, соціальної, комунікативної.
Тип уроку: узагальнення і систематизація знань, умінь, навичок і творчого їх застосування на практиці.
Обладнання: періодична таблиця хімічних елементів, таблиця розчинності, ряд активності металів, картки – завдання.
Хід уроку І. Організаційний етап.
ІІ. Перевірка домашнього завдання.
ІІІ. Розв’язування розрахункових задач і вправ.
1. Допишіть рівняння реакці горіння . Яка сума коефіцієнтів в обох частинах рівнянь реакцій?
СН4 + О2 = ___ + ___ С + О2 = К + ____ = К2О
Визначіть масові частки Оксигену в продуктах реакцій
2. Допишіть рівняння реакці горіння . Яка сума коефіцієнтів в лівій частині рівнянь реакцій?
____ + О2 = В2О3N2 + ____ = N2O5Al + ____ = Al2O3
Визначіть масові частки Оксигену в продуктах реакцій
3. Складіть рівняння реакції горіння в кисні : а) вугілля, б) сірки, в) фосфору, г) етану С2Н6. До якого типу реакцій вони належать?
4. Протягом доби людина вдихає 25 кг повітря. Під час роботи автомобіля кожні 1000км шляху використовується18250 кг кисню. Якщо автомобіль проїде на 100км менше, то людина зможе дихати повітрям близько скількох діб, якщо масова частка кисню в повітрі становить 23%.
5. Відносна молекулярна маса сполуки Сульфуру з Оксигеном удвічі більша за відносну молекулярну масу кисню. Знайдіть формулу сполуки.
6. Масова частка Оксигену в залишку після нагрівання калій нітрату КNО3 становить 40%. Чи повністю розклалась ця сполука?
7. У трьох пробірках без етикеток міститься повітря, кисень і вуглекислий газ. Як можна визначити вміст кожної пробірки?
8. Розставте пропущені коефіцієнти в записах рівнянь горіння:
2Н2S + O2 = SO2 + H2O 4NH3 + O2 = N2 + H2O
2CH3OH + O2 = CO2 + H2O
9. Запишіть формули сполук, що мають такі назви: нітроген (ІV) оксид, титан (ІІІ) оксид, берилій оксид, ванадій (V) оксид.
10. Сульфур (VІ) оксид взаємодіє з речовинами, формули яких: Н2О, СО2, СаО, HNO2,NаOH. Запишіть можливі рівняння реакцій.
11. Карбон (ІV) оксид взаємодіє з речовинами, формули яких: Н2О, HNO3, Ва(ОН)2, SO2, Na2O. Запишіть можливі рівняння реакцій.
ІV.Підбиття підсумків уроку. V. Домашне завдання повторити весь розділ «Кисень». Підготуватись до контрольної роботи.
Урок 41
Тема: Контрольна робота
Мета:Перевірити рівень засвоєння теоретичних знань та практичних навичок з вивченого матеріалу теми.
Формування компетентностей: Соціальної, продуктивної творчості.
Тип уроку : контроль та коригування знань, умінь і навичок
Обладнання : картки – завдання
Хід уроку
І.Організаційний етап
ІІ. Письмова контрольна робота
Варіант І
1. Запишіть рівняння реакції горіння в кисні, розставте коефіцієнти, а) S;
б) Мg.
2. Обчисліть масову частку елементів в одержаних оксидах.
3. Складіть формули оксидів за валентністю.
а) Cx;Oy б) А1xOy
в)NaxOy.
4. Розставте коефіцієнти в рівняннях реакцій.
а) Sі + O2→SiO2 б) КClO3→КС1 + O2
в) Н2S + NаОН >Nа2S + Н2O
5. Опишіть умови виникнення горіння і способи запобігання пожежам
Варіант II
1. Запишіть рівняння реакції горіння в кисні, розставте коефіцієнти, а) С;
б) Zn.
2. Обчисліть масову частку елементів в одержаних оксидах.
3. Складіть формули оксидів за валентністю. а)СхОy; б)PxOy;
в)СахО,.
4. Розставте коефіцієнти в рівняннях реакцій.
a) N2+O2→NO b) NaNO3 →NaNO2+O2
в) НВг + Са(ОН)2→ СаВг2 +Н2O. Розкажіть про застосування кисню.
Урок 42
Тема:Вода, склад її молекули, поширеність у природі. Вода – розчинник
Мета: формувати елементарні поняття, що вода — речовина, розчинник, розчин; вчити робити розчини; виробляти вміння самостійно виконувати досліди, узагальнювати сприйняте під час виконання дослідів, робити висновки; виховувати пізнавальний інтерес, самостійність, організованість, відповідальність за виконану роботу.
Тип уроку: Вивчення нового матеріалу
Формування компетентностей:Загальнопредметна, здоров’язберігаюча, саморозвитку і самоосвіти.
Обладнання: склянка з водою і паличками на кожну парту, різної форми (порожні) пляшки,шматочки льоду , банка з водою і ложкою для демонстрації, дощечки
Хід уроку
І. Організаційний етап
II. Мотивація навчальної діяльності. оголошення теми уроку Розгадування та обговорення загадок.
• Відома з віку рідина, Усяк її вживає, Буває маркою вона, Сніжинкою буває, Бува, як скло, Крихка, тверда — Звичайна, підкажіть,... (вода).
• Мене частенько просять, ждуть, а тільки покажусь — ховатися почнуть.(Дощ)
• Білим килимом все поле вкрило. (Сніг) Ніжна зірка сніжно-біла на рукав згори злетіла. Поки ніс її сюди, стала краплею води. (Сніжинка)
• Я вода і на воді плаваю. (Лід)
• Вночі спить на землі, а вранці висихає. (Роса)
• Ви відгадували загадки. Давайте ще раз скажемо, про що вони. (Дощ, сніжинка, лід, роса, вода... )А давайте подумаємо і скажемо одним словом: це все... (Вода)
• А тепер нам залишилося визначити тему уроку. Хто здогадався, про що йтиме мова? (Про воду)
Оголосити тему уроку
, банка з водою і ложкою для демонстрації,
III. Актуалізація опорних знань учнів Чи доводилося вам бачити воду в природі?
• Де вона знаходиться?
• Для чого потрібна вода?
• Ми відгадували загадки. В яких станах може перебувати вода?
• Які властивості води ви знаєте?
• Чому говорять: «Без води не було б життя на Землі»?
IV. Первинне сприйняття й усвідомлення нового матеріалу
1. Бесіда.
• Вода — багатство Землі. Вона необхідна для життя всіх живих організмів.
Кількість її на планеті зазначено на діаграмі.
• У природі вода перебуває у трьох станах: рідкому (дощ, туман, роса, вода), твердому (сніг, лід, іній, крига, бурульки), газоподібному (водяна пара).
• А тепер пригадаємо, з чого складається будь-яка речовина. (Підручник, С. 81)Які молекули води за формою і розміром в усіх трьох станах? Атом Оксигену утворює з двома атомами Гідрогену молекулу води, яка має кутову форму 104,5º. Молекула води існує у вигляді диполя, має полярні молекули, і тому в ній розчиняються речовини з полярними зв’язками. Вода мітиться в організмах тварин і рослин. У ссавців приблизно 70%, у людини – 65%, в кавуні, огіркові – 90%. Грунтові водні розчини забезпечують живлення рослин.
• А які відстані між молекулами у воді-рідині, воді — твердому тілі і воді — газоподібному тілі?
2. Ознайомлення з властивостями води.
• Про які властивості рідин ви дізнались на попередніх уроках?
• Виллємо воду в тарілку. Що трапилось?
• Яка ж перша властивість води? (Розтікається)
• Із банки переллємо воду у пляшки різної форми. Яку форму мала вода в банці?Яку форму має вода в пляшках?
• А свою форму має вода? (Вода набуває форми тієї посудини, в якій знаходиться.)
• Опустимо у склянку з водою ложку. Чи добре її видно? Отже, вода прозора.
• Подивіться, чи має вода колір? Визначте, чи має запах? (Вода — безбарвна рідина без запаху.)
• Як і всі інші рідини, вода під час нагрівання розширюється, а під час охолодження — стискається.
Кому з вас доводилось спостерігати, що станеться з пляшкою чи склянкою з водою, якщо її винести, закрити і поставити на мороз?
• Отже, ще одна властивість води: коли вода замерзає і перетворюється на лід, вона перестає стискатися і починає розширюватися, саме тому пляшка або склянка трісне.
Дослід 1. Кинути в склянку з водою 2—3 кришталики марганцівки, розмішати.
• Куди зникли кришталики?
• Якою стала вода? (Кришталики марганцівки розчинилися у воді.)
• Які ще речовини можуть розчинятись у воді? (Сіль, цукор, сік рослин, кров людей і тварин.)
• Для речовин, які розчинилися у воді, вода є розчинником. А вода з розчиненою в ній речовиною називається розчином (розчин солі, розчин цукру).
Дослід 2. У склянку з водою вкинемо пісок або глину. Ні пісок, ні глина не розчинилися. Речовини, які не розчиняються у воді, називають не розчинними у воді речовинами. V. Робота з підручником (С. 91—93)
VI. Закріплення та осмислення знань 1) Робота в зошиті (завдання 2, 3).
2. Як довести, що вода в газоподібному стані (пара) дійсно існує?
3. Чому вода має різний смак у колодязях, морях, мінеральних джерелах?
4. Чому плями від олії не змиваються водою?
VII. Узагальнення та систематизація знань Технологія «Мікрофон» 1. Які ви знаєте властивості води?
2. Вода — розчинник:
а) тверді речовини; б) рідкі речовини; в) газоподібні речовини.
VIII. Домашнє завдання:
Вивчити матеріал підручника, письмово зробити вправи після параграфа
Урок 43
Тема:Розчин і його компоненти: розчинник, розчинена речовина.
Мета: Сформувати поняття про розчини, розкрити суть поняття «розчин»,
«розчинник», «розчинена речовина» взаємозв’язок між ними. Розібрати основні ознаки класифікації розчинів; виробити вміння розрізняти типидисперсних систем. Виховувати бережне ставлення до природи.
Формування компетентностей: Загальнопредметна, саморозвитку і самоосвіти, соціальної, комунікативної.
Тип уроку: Вивчення нового матеріалу.
Обладнання: склянка з водою.
Хід уроку
І Організаційний етап
ІІ Перевірка домашнього завдання:
Індивідуальне опитування.
1. Загальна характеристика будови молекули води.
2. Поширення води в природі, її значення для живого організму.
3. Вода як розчини
4. Що таке кругообіг води?
5. Як називають воду в газоподібному стані?
6. У яких трьох станах може перебувати вода?
7. Чому на кришці каструлі, в якій кипить вода, з внутрішнього боку утворюються краплини?
8. Коли швидше висохне білизна — влітку чи навесні?
• Завдання 1. На якій річці розташоване твоє місто (село)? Як вона називається?
• Завдання 2. Який сніг — чистий чи брудний — навесні розтане швидше? Чому?
• Завдання 3. Чому буває роса?
• Завдання 4. Чи можна носити воду в решеті? Чому?
II. Повідомлення теми і мети уроку
III. мотивація навчальної діяльності
1. Слухання казки.
Ось чисте джерело, що пробивається з-під великого каменя.
- Послухайте-но, ви, маленькі жваві хвильки, розкажіть мені: чому ви так поспішаєте, куди й звідки біжите? Де ви були досі й що робили? — запитав камінь.
- Ми,— сказали перші дві краплі,— були сніжинками...
- Ми були двома градинками,— забелькотіли інші краплі...
- А ми були двома росинками й напоїли спраглу конвалію,— обізвалися ще дві.
- Ми носили кораблі на морі; ми напоїли спраглого і врятували йому життя; ми обертали млинове колесо, нас спінював пароплав; ми були
- Солодким соком у вишнях, ми — смачним вином, ми — ліками, ми — отрутою, ми — молоком,...— дзвеніли одна за одною прозорі крапельки...
- О, не думай, що ми нічого не робимо,— зажебоніли всі краплини разом.— Ми ніколи не знаємо спокою. Напрацювавшись досхочу і в хмарах, й у траві, і в місті, напоївши мільйони рослин, тварин і людей, ми поспішаємо в річку, а тоді — у широке безкрає море...
- Промені сонечка пригрівають нас і перетворюють у легкий туман.
Піднявшись високо, ми стаємо хмарами й линемо по небу...
2. Бесіда за прослуханим.
• Про що розповіли маленькі хвильки?
• Ким були хвильки спочатку?
• Що вони робили?
• Де працювали хвильки?
• Чому хвильки не мали ніколи спокою?
• Куди вони поспішали після роботи?
• Що роблять промені сонечка з маленькими краплинками?
• На що вони перетворюються?
• І куди ж вони подорожують потім?
IV. Актуалізація опорних знань учнів Для чого на Землі необхідна вода? Яке значення має вода для людей?
• Яке значення має вода для тварин, рослин?
V. Вивчення нового матеріалу
Вода входить до складу дуже багатьох розчинів. Найбільш характерна особливість розчинів, є тим, що розчинна речовина яка знаходиться у вигляді атомів, йонів або молекул , рівномірно оточених атомами, йонами або молекулами розчинника. Розчини можуть існувати в будь якому агрегатному стані (твердому, рідкому чи газоподібному)
Значення розчинів у природі , житті й практичній діяльності людини
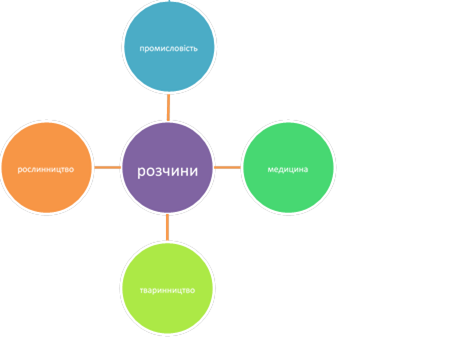
Розчин, в якому певна речовина за певної температури вже більше не розчиняється називається насиченим,а розчин, в якому ще можна розчинити дану речовину – ненасичений. Відношення маси речовини, насиченого при даній температурі, до об’єму розчинника називається розчинністю.
VIЗакріплення вивченого матеріалу
Читання вірша.
Дивовижне вічне коло
Є в цілющої води,
І нема йому початку, І нема йому кінця.
В нім, немов найменша цятка, Б'ється серце джерельця.
- Про яке вічне коло води говориться у вірші?
- Чиє серце б'ється в цьому колі?
- Хто з вас бачив джерело?
- Яка в ньому вода?
Задачі.
1. Розчинність хлориду натрію при 20ºС становить 36,5 г. Скільки г солі можна розчинити в 500г води при температурі 20ºС? Яка маса розчину?
2. У 200 г води при температурі30ºС розчинилось 90 г нітрату калію, Ака розчинність цієї солі при 30ºС?
VІI. Екологічна хвилинка
1. Бесіда «Вода має бути чистою». Розповідь учителя з елементами бесіди і використанням наочних посібників.
VIIІ. Домашнє завдання
1. Вивчити відповідний параграф підручника
2. Скласти казку про розчини.
3. Задача. Випарюючи досуха 51 г насиченого при 30®С водного розчину кухонної солі дістали 11 г солі. Чому дорівнює розчинність цієї солі при 30°С?
Урок 44.
Тема:Кількісний склад розчину. Масова частка розчиненої речовини.
Мета: Ознайомити учнів із кількісним зображенням складу розчину; сформувати вміння розраховувати масову частку розчиненої речовини, масу розчиненої речовини за відомою масовою часткою, масу води для приготування розчину із заданою масовою часткою. Розвивати логічне мислення.
Формування компетентностей: Загальнопредметна, саморозвитку і самоосвіти, соціальної, комунікативної.
Тип уроку: вдосконалення знань і вмінь.
Обладнання: Ключові формули, картки - завдання
Хід уроку
І. Актуалізація опорних знань
1. Дати відповіді на запитання:
• Як кількісно можна передати склад розчинів?
• Який спосіб вираження концентрації вам відомо і де його використовують?
• Що таке масова частка?
• Записати математичний вираз масової частки та його похідні.
• Як із концентрованого розчину зробити розбавлений?
• Як з розбавленого розчину отримати концентрований? Запропонуйте два способи.
2. Задачі для усного розв’язку:
—Яка маса солі міститься в 100 г розчину з масовою часткою розчиненої речовини 10 % ?
—Яка маса цукру міститься в склянці чаю (маса 200 г), якщо масова частка цукру15 %?
—Яка масова частка кухонної солі в розчині, що складається з 1 л води і 1 столової ложки солі (30 г)?
—Яка маса оцтової кислоти міститься в літровій пляшці столового оцту (w = 3 %), якщо густина розчину 1 г/л?
Розв’язування на дошці задач:
Задача 1.
Обчислити масу мідного купоросу, яку потрібно розчинити, щоб утворилося 400 г розчину купрум(ІІ) сульфату з масовою часткою розчиненої речовини 4 % ? (25г).
Задача 2.
Яку масу води потрібно додати до 80 г розчину натрій нітрату з масовою часткою солі 15 %, щоб отримати розчин з масовою часткою розчиненої речовини 12 %? (20г)
II. Повідомлення теми, мети і завдань уроку, мотивація навчальної діяльності.
Учитель. Оскільки розчини мають величезне значення в промисловості, важливо навчитися проводити обчислення, пов’язані з їх приготуванням. На цьому уроці ми закріпимо вміння розв’язувати розрахункові задачі з цієї теми.
III. Удосконалення знань та вмінь учнів розв’язувати розрахункові задачі.
Учні самостійно розв’язують задачі за розданими їм картками. Відповідно до кількості розв’язаних задач виставляється оцінка за урок. Упевнитися у правильності розв’язання можна, звірившись із відповіддю та розв’язанням відповідної задачі на дошці.
Задачі, які пропонуються учням для розв’язування
I варіант
1. Масова частка солі у морській воді становить 3,5 %. Скільки грамів солі залишиться після випарювання 10 кг морської води? (350 г.) 1,5бала.
2. Визначте масову частку калій гідроксиду у розчині, який одержали при змішуванні 400 г води з 200 г розчину калій гідроксиду з масовою часткою речовини 30 %.(10 %.) 2 бали.
3. Визначте масову частку хлоридної кислоти у розчині, одержаному розчиненням 33,6 л хлороводню в 245,25г води (н.у.) (18,25 %.) 2,5 бала.
4.Для боротьби з буряковим довгоносиком готують розчин барій хлориду з розрахунку близько 500 г ВаС12 ∙2Н2О на 10л води. Обчисліть масову частку безводної солі в такому розчині. (4 %.) З бали.
5. Яку масу розчину з масовою часткою калій гідроксиду 40 % -ного і розчину з масовою часткою калій гідроксиду 10% необхідно для приготування 600 г розчину цієї речовини з масовою часткою20 %? (200 г і 400 г.) 3бали.
II варіант
1. При деяких захворюваннях у кров вводять розчин натрій хлориду з масовою часткою солі 0,85 %, що називають фізіологічним розчином. Обчисліть маси води й солі, які потрібно взяти, щоб приготувати 5 кг фізіологічного розчину? (42,5 г солі) 1,5 бала.
2. Яку масу натрій нітрату необхідно розчинити в 400 г води для одержання розчину з масовою часткою речовини 20 % ? (100 г) 2 бали.
3. У лужних акумуляторах використовують розчин калій гідроксиду. Для приготування 500 мл такого розчину за температури 20 °С використали 133 г калій гідроксиду і 470 мл води. Визначте густину добутого розчину й масову частку КОН у ньому. (1,206 г/мл, 22 %.)
2,5 бала.
1. У якому випадку масова частка лугу в розчині буде більшою — при розчиненні 0,04 г кальцію у 196,2 мл води чи при розчиненні 0,074 г кальцій гідроксиду у 192,6 мл води? (У 2-му випадку.) З бали.
2. Гіпс Са8О4 ∙ 2Н2О від нагрівання до128 °С втрачає 3/4 своєї води за масою, перетворюючись на інший гідрат — палений гіпс. Яка формула паленого гіпсу (алебастру)? 3 бали.
IV. Домашнє завдання.
Розв’язання індивідуальних задач,повторити матеріал з теми «Розчини».
Уроки 45 – 46
Тема:Розв’язування розрахункових задач на визначення масової частки розчинюваної речовини і маси розчинюваної речовини в розчині.
Мета: навчити обчислювати масову частку і масу розчиненої речовини в розчині, ознайомити учнів з різними способами розв’язування задач, формувати уміння розкривати взаємозв’язок теорії і практики; розвивати логічне мислення, вдосконалювати пізнавальні здібності; виявляти зв’язок навчання з життям, практичну спрямованість навчального матеріалу.
Формування компетентностей: Загальнопредметна, саморозвитку і самоосвіти, соціальної, комунікативної.
Тип уроку: урок вивчення нового матеріалу та розвитку вмінь.
Основні методи і форми: розв’язування задач, розповідь з елементами бесіди.
Обладнання: періодична система хімічних елементів Д.І.Менделєєва.
Хід уроку
І. Мотивація навчальної діяльності
Наведіть приклади з повсякденного життя, які стосуються використання конкретних розчинів (оцет 9%, гідроген пероксид 2%, розчин йоду 1%, та інші). Що означають відсотки? Як приготувати розчини конкретної концентрації?
ІІ. Актуалізація опорних знань
На сьогоднішньому уроці ми будемо розв’язувати задачі на обчислення масової частки і маси розчиненої речовини в розчині. Давайте пригадаємо, як знайти масову частку елемента у сполуці. Ми будемо використовувати подібну формулу, оскільки розчини також можна розглядати як двокомпонентну систему. Один компонент – розчинник (вода), другий – розчинена речовина.
ІІІ. Вивчення нового матеріалу.
Основні поняття і розрахункові формули, що будуть використовуватися на уроках.
Розчин складається з розчиненої речовини та розчинника (для двокомпонентних систем), маса розчину являє собою суму мас розчиненої речовини та розчинника: m(розчину) = m (розчин. реч.) + m (розчинника)
Концентрація – це кількісний склад розчину. Це величина, що визначає співвідношення компонентів у розчині. Одним із способів вираження концентрації є масова частка.
Масова частка розчиненої речовини – це відношення маси розчиненої речовини до маси розчину.
m(реч.)
W% = ————— ∙100%;
m(розчину) похідні: m(розчину) = m(реч.)/ W∙100%; m(реч.) = m(розчину) W/100%.
1.Алгоритм для обчислення масової частки розчиненої речовини:
1. Прочитайте текст задачі. Задача. Обчисліть масову частку кухонної солі в розчині після розчинення 28г солі у 252г води.
2. Запишіть стисло умову і вимоги задачі.
3. Складіть формулу для обчислення масової частки:
m(NaCl)
W (NaCl) = ———— ∙100%; m(розчину)
4. Обчисліть масу розчину за формулою:
m(розчину)= m(NaCl)+ m(H2O) = 28+252 =280г
5. Обчисліть масову частку розчиненої речовини за формулою:
m(NaCl) 28г
W (NaCl) = ———— =———— = 0,1 (10%)
m(розчину) 280г
6. Запишітьвідповідь: W (NaCl) =0,1 (10%)
Задача. Натрій гідроксид масою 20г розчинили у 180 г води . Обчисліть масову частку розчиненої речовини. (Відповідь:0,1 або 10%) Розв’язування задачі (один учень біля дошки).
Задача. (Самостійно).У воді масою 440г розчинили 60г солі. Яка масова частка речовини в утвореному розчині? (Відповідь:0,33 або 33%).
2.Обчислення маси розчиненої речовини з відомою масовою часткою розчиненої речовини.
Задача. Обчисліть масу кухонної солі, яка необхідна для приготування 200г розчину з масовою часткою 5%. (Відповідь: m(NaCl)= 10г)
3. Обчислення масової частки розчиненої речовини у розчині при розведенні його певною масою розчинника
Приклад. До 80 г розчину натрій сульфату з масовою часткою солі 15 % додали 20 г води. Яка масова частка солі в добутому розчині?
Розв’язання
1. Знаходимо масу розчиненої речовини:
mречовини =mрозчину∙ w; тсояі = 80 • 0,15 = 12 (г).
2. Знаходимо масу нового розчину:
m2 розчину = m1 розчину +mводи; m2 розчину = 80 + 20 = 100 (г). 3. Знаходимо масову частку солі в утвореному розчині:
mречовини
W% = ∙100%; W%= 12%
m2 розчину
4. Обчислення масової частки розчиненої речовини у розчині при додаванні нової порції розчиненої речовини
Приклад. До 150 г розчину калій сульфату з масовою часткою 10 % додали 10 г калій сульфату. Визначте масову частку солі в новоутвореному розчині.
Розв’язання
1. Знаходимо масу розчиненої речовини в розчині:
m1 розчиненої речовини=m1 розчину ∙w1;
тсолі = 150 • 0,1 = 15 (г).
2. Знаходимо масу нового розчину: m2 розчину = m1 розчину +m2 солі; m2 розчину = 150+10= 160(г)
3. Знаходимо масу розчиненої речовини після додавання і розчинення солі:
m3 розчиненої речовини = m1 розчиненої речовини+ m2 розчиненої речовини; m3 розчиненої речовини = 15+10 = 25 г
4. Знаходимо масову частку солі в утвореному розчині:
m3 речовини
W2% =———— ∙100%; W%= 15,625%
m2 розчину
5. Обчислення масової частки розчиненої речовини в розчині, що утвориться з двох вихідних розчинів з відомими масами і масовими частками речовин у них
Приклад. Змішали 100 г розчину сульфатної кислоти з масовою часткою 20 % і 50 г розчину сульфатної кислоти з масовою часткою 32 %. Яка масова частка розчиненої речовини в добутому розчині?
Розв’язання
1. Знаходимо масу розчиненої речовини у першому розчині:
m1речовини=m1розчину∙ w1; mкислоти= 100 • 0,2 = 20г
2. Знаходимо масу розчиненої речовини у другому розчині:
m2речовини =m2розчину∙ w2; ткислоти= 50 • 0,32 = 16 (г).
1. Знаходимо масу розчиненої речовини в новому розчині:
m3 розчиненої речовини = m1 розчиненої речовини+ m2 розчиненої речовини; m3 розчиненої речовини = 20 + 16 = 36 (г).
1. Знаходимо масу нового розчину:
m3 розчину = m1 розчину +m2 розчину; m3 розчину = 150 + 50 = 150 (г).
1. Знаходимо масову частку солі в утвореному розчині: m3 речовини
W% = ———— ∙100%; W%= 24% ;
m3 розчину
6. Обчислення маси розчинів з певними масовими частками, які потрібно використати для приготування нового розчину певної маси з відомою масовою часткою розчиненої речовини
Приклад. Визначте маси розчинів барій хлориду з масовими частками 10 % та 50 %, необхідні для приготування 800 г розчину з масовою часткою 25 %.
Застосовується правило змішування, або квадрат Персона. Розв’язання
m3розчину(с-b) 800 (50-25)
m2 розчину= ————— = ————— = 500(г)
(c-b) + (a-c) (50-25) + (25-10)
Знаходимо масу другого розчину:
m2 розчину = m3 розчину - m1 розчину; m2 розчину = 800 – 500 = 300 (г).
ІV. Підсумки
На сьогоднішньому уроці ми навчилися обчислювати масову частку і масу розчиненої речовини в розчині та ознайомилися з різними способами розв’язування задач
V. Домашнє завдання
Вивчити відповідний § підручника, розв’язати задачі:
- Визначте масу води, що в ній необхідно розчинити 50 г калій сульфату для одержання розчину з масовою часткою речовини 10 %.
- У 400 г розчину з масовою часткою калій гідроксиду 10 % розчинили 20 г калій гідроксиду. Обчисліть масову частку лугу в утвореному розчині.
Урок 47
Тема: Виготовлення розчинів
Мета: Сформувати практичні навички у виготовленнірозчину з певною масовою часткою розчиненої речовини Перевірити знання техніки безпеки під час виконання лабораторних дослідів. Продовжити розвивати навички роботи з хімічними речовинами й лабораторним обладнанням. Формувати вміння й навички проведення хімічного експерименту й аналізу явищ, що спостерігаються, робити висновки в ході лабораторних дослідів.
Формування компетентностей:Загальнопредметна, здоров’язберігаюча, саморозвитку і самоосвіти.
Тип уроку: урок закріплення знань, умінь і навичок.
Обладнання та реактиви: хімічні склянки (чи конусоподібні колби), скляні палички, штапелі, мірні циліндри, терези з важками, дистильована вода, кристалічна сіль — натрій хлорид.
Хід уроку І. Актуалізація опорних знань
• Що таке розчини? .
• Як приготувати розчин із певною масовою часткою розчиненої речовини?
• У чому полягають правила поводження з терезами?
П. Перевірка знань із техніки безпеки під час роботи в хімічному кабінеті
III. Виконання лабораторних дослідів «Виготовлення водних розчинів із заданими масовими частками розчиненихречовин»
І варіант
Завдання № 1
Виготовити 100 г розчину з масовою часткою натрій хлориду 5 %.
Завдання № 2
Розв’язати розрахункові задачі
1. Визначити маси розчинів з масовою часткою оцтової кислоти 20 % та 60
%, необхідні для приготування 100 г розчину з масовою часткою кислоти 25 %.
2. У 4 об’ємах води розчинили 25 об’ємів амоніаку (н. у.). Визначити масову частку амоніаку в одержаному розчині.
II варіант
Завдання № 1
Виготовити 80 г розчину з масовою часткою натрій хлориду 0,04.
Завдання № 2
Розв’язати розрахункові задай
1.Визначити маси розчинів з масовою часткою хлоридної кислоти 40 % та
5 %, необхідні для приготування 90 г розчину з масовою часткою кислоти 20 %.
2.В 1 л води розчинили 25 л хлороводню (н. у.). Визначити масову частку хлороводню в одержаному розчині.
IV. Домашнє завдання
Повторити основні типи розрахункових задач з теми «Розчини». Скласти кросворд, використовуючи терміни з теми, яку ми вивчаємо.
Сам собі вчитель.
Придумай і розв’яжи розрахункові задачі на теми:
1. «Приготування розчинів з відомою масовою часткою».
2. «Обчислення масової частки розчиненої речовини».
Підказка: скористайся книгою з консервування.
Урок 48.
Тема:Взаємоді води з оксидами. Поняття про гідрати оксидів: кислоти й основи. Поняття проіндикатори
Мета: Сформувати уявлення про загальну класифікацію неорганічних речовин на підставі отриманих раніше знань про прості та складні речовини. Розширити знання про класифікацію неорганічних речовин на прикладі оксидів та їх гідратів: кислот і основ. Ознайомити учнів з процесом взаємодії води з оксидами. Дати поняття індикаторів, пояснити значення їх використання для визначення кислот і основ. Розвивати логічне мислення учнів на прикладі порівняння взаємодії кислотних і основних оксидів з водою. Розвивати вміння й навички складання рівнянь хімічних реакцій на прикладі оксидів з водою.
Формування компетентностей:Загальнопредметна, здоров’язберігаюча, саморозвитку і самоосвіти.
Тип уроку: Засвоєння нових знань.
Обладнання та реактиви: хімічні склянки (чи конусоподібні колби), скляні палички, штапелі, мірні циліндри, терези з важками, дистильована вода, хлоридна кислота, натрій гідроксид, кальцій оксид, фосфор (V) оксид.
Хід уроку І. Актуалізація опорних знань
ІІ. Мотивація навчальної діяльності
ІІІ. Вивчення нового матеріалу
Демонстрація:
Взаємодія кальцій оксиду з водою. Дія водного розчину добутої речовини на індикатори.
Дослід 1. У порцелянову чашку поміщаємо грудочки свіжопрожареного кальцій оксиду СаО (негашене вапно) і доливаємо до нього води (мал. 1). Спостерігається таке сильне розігрівання, що частина води перетворюється на пару, а грудочки розсипаються, перетворюючись на сухий пухкий порошок — гашене вапно, або кальцій гідроксид Са(ОН)2. Виділення теплоти засвідчує, що відбулася реакція. СаО + Н2О = Са(ОН)2
Мал. 1. Гашення вапна
• Пригадай, як називаються реакції, що відбуваються з виділенням теплоти.
Так само, як кальцій оксид, сполучаються з водою й оксиди інших активних металів, наприклад оксиди Натрію, Літію, Барію:
Na20 + Н20 = 2NaOH
Натрій гідроксид
Li20 + Н20 = 2LiOH
Літій гідроксид
ВаО + Н20 = Ва(ОН)2

водою чи ні) називаються основними.
Усі основні оксиди за стандартних умов — тверді речовини.
Речовини, які змінюють своє забарвлення під дією кислот (або лугів), називаються індикаторами.
Розчини їдких лугів мають здатність змінювати забарвлення індикаторів. Так, у лужному середовищі фіолетовий колір лакмусу змінюється на синій, оранжевий колір метилоранжу — на ясно-жовтий, а безбарвний розчин фенолфталеїну стає фіолетовим.
Демонстрація:
Взаємодія фосфор(V) оксиду з водою. Дія водного розчину добутої речовини на індикатори.
Дослід 2. У порцелянову чашку поміщаємо фосфор(V) оксид і додаємо води.
Реакція також екзотермічна. Суміш розігрівається так, що вода закипає. Утворюється нова речовина — фосфатна, або ортофосфатна, кислота. Якщо вода холодна, то утворюється метафосфатна кислота: Р205 + Н20 = 2НР03
холодна Метафосфатна кислота
Р205 + ЗН20 = 2Н3Р04
гаряча Ортофосфатна кислота
Під час взаємодії з водою багатьох оксидів неметалів, наприклад карбон(IV) оксиду С02або сульфур(VI) оксиду SO3, також утворюються кислоти.
Кислоти — це також певний клас неорганічних сполук:
CO2 + H2O = H2CO3
Карбонатна кислота
SO3 + Н2O = H2SO4
Сульфатна кислота
Кислоти діють на індикатори (речовини-визначники).
Дослід 3. У три пробірки з розчином сульфатної кислоти H2S04 додамо по кілька крапель індикаторів: у першу — лакмусу, розчин стає червоним; у другу — метилового оранжевого, розчин стає рожево-червоним; у третю — фенолфталеїну, розчин залишається безбарвним.
Лакмус, метиловий оранжевий (метилоранж), фенолфталеїн — індикатори на кислоти і луги
• До якого типу належать розглянуті реакції взаємодії оксидів металів і неметалів з водою?

Під час взаємодії з водою багатьох оксидів неметалів утворюються кислоти. Виникає запитання, чи всі оксиди неметалів розчиняються у воді, утворюючи кислоти? Ні, не всі. Наприклад, силіцій(IV) оксид Si02 (річковий пісок) у воді не розчиняється й кислоти у такий спосіб не утворює. Але це не означає, що силікатна кислота H2Si03 не існує. Вона так само, як і інші нерозчинні кислоти, що відповідають нерозчинним оксидам неметалів, може бути добута непрямим шляхом.
Оксиди, яким відповідають кислоти (незалежно від того, реагують оксиди з водою чи ні), називаються кислотними.
ВИСНОВКИ
Оксиди активних металів взаємодіють з водою, утворюючи гідрати - розчинні гідроксиди металів, або основи.
Оксиди металів, яким відповідають основи, називаються основними оксидами.
Оксиди неметалів взаємодіють з водою, утворюючи гідрати - розчинні кислоти.
Оксиди неметалів, яким відповідають кислоти, називаються кислотними оксидами.
Кислотним і основним оксидам, що не розчиняються у воді, відповідають нерозчинні кислоти й нерозчинні основи. Кислотні й основні оксиди — солетворні.
IV. Закріплення вивченого матеріалу.
Завдання для самоконтролю
1. Розстав коефіцієнти у таких схемах хімічних реакцій:
Na2O + Н2O → NaOH
Сl2O7 + Н2O → НСlО4
N2O5 + H2O → HN03
2. Які з наведених речовин можуть реагувати з водою: барій оксид, натрій оксид, сульфур(І\/) оксид, купрум(ІІ) оксид, силіцій(І\/) оксид, сульфур(\/І) оксид? Напиши рівняння реакцій.
3. Напиши рівняння реакцій, що відповідають таким перетворенням: а) Са → СаО → Са(ОН)2; б) С → С02 → Н2С03.
4. Обчисди масові частки елементів у натрій оксиді.
Додаткові завдання
5. Яку масу свинцевої руди треба взяти для добування свинцю масою 10 т?
Припускаємо, що домішок немає і руда являє собою чистий свинцевий блиск PbS.
6*. Визнач кількість речовини карбон(І\/) оксиду, необхідного для повної взаємодії з водою масою 1,8 г.
7*. Унаслідок спалювання металу масою 3 г утворився його оксид масою 4,2 г, в якому валентність атома металу 2. Який це метал? 8*. Виведи формулу одного з оксидів Мангану, якщо відомо, що співвідношення маси Мангану в ньому до маси Оксигену становить 1:1. V. Домашне завдання:
Опрацювати матеріал підручника, скласти схеми перетворень:
1. метал – оксид металу – основа
2. Неметал – оксид неметалу - кислота
Написати рівняння реакцій, що відповідають таким перетворенням
Урок 49.
Тема:Значення води і розчинів у природі та житті людини. Кислотні дощі. Проблема чистої води. Охорона водойм від забруднення.Очищення води на водоочисних станціях та в домашніх умовах.
Мета уроку: Розглянути значення води і розчинів у природі та житті людини, її поширеність в природі , способи очищення води. Охарактеризувати застосування води і розчинів для потреб людини , узагальнити і систематизувати пройдений матеріал; розвивати уміння пов’язувати знання, здобуті раніше на уроках хімії та інших предметів, з новою темою; розвивати логічне мислення; виховувати дбайливе ставлення до природи. Виховувати бережне ставлення до природи.
Формування компетентностей:Загальнопредметна, здоров’язберігаюча, саморозвитку і самоосвіти.
Тип уроку: формування нових знань.
Методи роботи: розповідь з елементами бесіди
Обладнання: періодична система Д.Менделєєва, таблиця «Розчинність кислот, основ і солей у воді», малюнок із зображенням будови молекули води, гідратів; вода.
Хід уроку
І. Організаційний момент .
ІІ. Перевірка домашнього завдання . ( 10 хвилин)
Рішення двома учнями домашніх завдань.
Завдання №1 . При випаровуванні 25г розчину отримали 0,25 г солі. Визначте масову частку розчиненої речовини і висловіть її у відсотках.
дано:
m ( р-ну) = 25г . , m ( cолі ) = 0,25 м. ,
Знайти : W ( солі) - ?
в 25 г розчину міститься 0,25 г солі в 100г розчину міститься Х г солі
Х = 100 * 0,25 / 25 = 1 або 1 %
Відповідь : W ( солі) = 1 %.Знайти : W ( солі) - ?
Завдання №2 . Дано 500г розчину з масовою часткою гідроксиду натрію 0 , 2.
Обчисліть речовини, які виходить при випаровуванні цього розчину. дано:
m ( р-ну ) = 500г
W (NaOH ) = 0,2 Знайти : m (NaOH ) - ?
в 500 розчину міститься Х г гідроксидунатрію в 100г розчину міститься 20 г гідроксиду натрію
Х = 500 * 20/ 100 = 100г
Відповідь: при випаровуванні розчину вийде 100 г гідроксиду натрію.
Робота за дидактичними картками:
( Ціна завдання А - 4 бали; завдання В- 9 балів; завдання С-11 балів)
А 1 . Розчинами називають ....
а ) ізольовані системи , відділені від навколишнього середовища реальної чи уявної поверхню розчину ;
б) гомогенні системи , не здатні до обміну речовиною з навколишнім середовищем ;
в) гомогенні системи, що містять не менше двох речовин;
г) гетерогенні суміші , що містять не менше двох речовин.
2 . Найбільш поширений розчинник - це ...
а ) спирт
б) царська горілка
в) бром
г) вода
3 . Суспензією називається ...
а ) гетерогенна суміш часток речовин певного розміру
б) гомогенна суміш не менше двох твердих речовин
в) гетерогенна суміш часток речовин будь-якого розміру
г) розчин зі строго виваженої масою розчиненої речовини.
4. Кількісний склад розчину виражають за допомогою поняття ...
а ) парціального тиску
б) концентрації
в) щільності
г) аддитивности
5 . Закон Рауля свідчить, що ...
а ) розчинність газів, що знаходяться в суміші , прямо пропорційним давлениям , а не загальному тиску в суміші;
б) якщо у воді вже розчинено небудь речовина , то в цьому розчині гази розчиняються гірше , ніж в чистій воді.
в) подібне розчиняється в подібному .
6 . Дим- це ....
а ) суспензія молекул нікотину в повітрі ;
б) суміш повітря і газоподібних продуктів згоряння;
в) розчин твердих речовин в рідині
7 . Дослідження водних розчинів показали , що в них знаходяться частинки розчиненої речовини з молекулами води , які називають ..
а ) гидроксидами ;
б) гідратами ;
в) ангедрідамі
г) метеоритами.
8 . Кристалогідрат купрум (ІІ) сульфат) CuSO4 * 5H2O а ) червоний
б) синій
в) фіолетовий
г) золотисто -жовтий
В. 1 . Визначити розчинні , малорозчинні і нерозчинні речовини користуючись таблицею "Розчинності кислот , основ і солей у воді" : Ca (
OH) 2 , H2SiO3 , HCl ,
Fe ( OH) 3 , MgCl2 , CaCO3 , HgBr2 , K3PO4 , CaSO4 , NaOH , Cr (OH) 3 , CuS , BaSO3 , H2SO4
2 ) Серед перерахованих нижче твердих речовин у воді добре розчинний ...
а ) сульфат барію
б) силікат кальцію
в) сульфід міді ( II)
г) нітрат заліза ( III)
С. Користуючись діаграмою вмісту води в організмі , визначте вміст води в кістках і жирової тканини , слюні , м'язах і внутрішніх органах , крові. Якщо загальний вміст води в організмі становить 60 % , а середня маса підлітка = 65 кг.
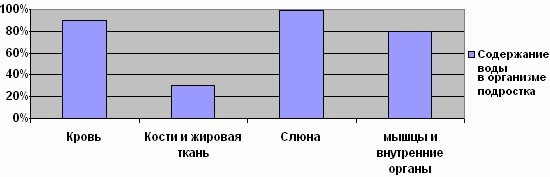
( Оцінювання: підрахунок балів за формулою тобто 100-80 % -11 – 10 балів , 80-60 % - 9 - 7 балів , 60-40 % - 3 6 - 4 бали. )
Перевірка завдань біля дошки , здача диференційованого завдання на перевірку .
ІІІ . Актуалізація знань:
Кожен з вас переглядаючи діаграму вмісту води в організмі , звернув увагу на те , що вона знаходиться у всіх частинах тіла людського організму.
Чи знаєте ви , що .....
• за добу нирки фільтрують 100 кг рідини ;
• в середньому за все життя при її тривалості 70 років людина споживає і виділяє близько 80000 кг води ;
• при втраті 6 % води від маси тіла частішає серцебиття і дихання , з'являються слабкість і запаморочення ;
• а при втраті води близько 25 % від маси тіла людина гине.
IV.Мотивація навчальної діяльності учнів.
Вода, у тебе немає ні смаку, ні кольору, ні запаху.
Тебе неможливо описати, тобою насолоджуються, не розуміючи, що ти таке!
Неможна сказати, що ти потрібна для життя: ти і є життя. Ти найбільше багатство на світі.
Антуан- де-Сент-Екзюпері
Чи є вода основою життя , багатством на планеті , яке треба берегти і охороняти?
Звучить музичний твір " Шум дощу " у виконанні Ванесси Мей , демонструються репродукції картин І. Айвазовського " Буря на Північному морі " , "Веселка" , " Дарьяльское ущелині " , "Хвиля" , " 9 вал" ; І.
Ендогурова "Дощ" ; Ю.Клевера " Зимовий захід " ; І.Левіта " Озеро . Русь".
V. Вивчення нового матеріалу
Записують тему уроку .
План .
1 ) Значення води і розчинів у природі та житті людини.
2 ) Кислотні дощі
3 ) Проблема чистої води.
4) Охорона водойм від забруднення
5) Очищення води на водоочисних станціях та в домашніх умовах.
«Я і хмара, і туман ,
І струмок , і океан ,
І літаю , і біжу ,
І скляній бути можу «.
Про який агрегатному стані води йде мова в загадці ?
Вода знаходиться в міжзоряному просторі , в льодах і снігу ( 2 %) , грунті ( 4 %) , атмосфері ( 0,01 %), в живих організмах ( 0,0003 %) , в річках , озерах джерелах ( 0,3 %) – інша вода в морях , океанах , солоних озерах.
З чого складається вода ? Вперше воду синтезував французький хімік А.
Лавуазьє і його колега П. Лаплас 24 червня 1783 г з «пального повітря» і «дефлогістованого повітря» . Трохи пізніше Лавуазьє розклав воду пропускаючи водяну пару над розпеченим залізом і отримав водень + оксид металу.
У лютому 1785 р А. Лавуазьє і Ж.Мінье дійшли висновку , що вода містить 85 % Оксигену 15 % Гідрогену (за сучасними даними кисню – 88 , 81 % , а водню 11,19 ) .
Отже , природа води розкрита. Вода – мінерал . Про воду , знайомої людині з дитинства , написані незліченні монографії , вчені продовжують вивчати її властивості . Вода складається з двох ЕЛЕМЕНТІВ – Оксигену і Гідрогену , існує 42 поєднання цих атомів в молекулі води і причому 9 з них стійкі , значить існує 9 властивостей води. В даний час встановлено існування води з молекулярною вагою 19,20,21,22 . Плавлення льоду при атмосферному тиску супроводжується зменшенням обсягу на 9 %.
Значення розчинів у природі та житті людини
Завдання: опрацюйте матеріал підручника та складіть схему «Значення розчинів у житті та практичній діяльності людини».
Давайте пригадаємо, що таке суміш. Які бувають суміші? (однорідні та неоднорідні).
Що таке однорідні та неоднорідні суміші?
Кисло тний дощ — усі види метеорологічних опадів: дощ, сніг, град, туман, дощ зі снігом, — кислотність яких вища від нормальної. У нове тисячоріччя людство вступає в умовах екологічної кризи. В останній чверті XX століття три глобальні екологічні проблеми: руйнування озонового шару Землі, що прогресує; потепління її клімату та кислотні дощі — зробили цілком реальною погрозу самознищення людства.
Ще наприкінці минулого століття Фрідріх Енгельс попереджав: «Не будемо, однак, занадто зваблюватися нашими перемогами над природою. За кожну таку перемогу вона нам мстить. Кожна з цих перемог має, щоправда, у першу чергу ті наслідки, на які ми розраховували, але в другу і третю чергу зовсім інші, непередбачені наслідки, що дуже часто знищують наслідки перших». Знайомство з проблемою кислотних дощів підтвердить нам правоту цих слів. Кислотні опади в кінці ХХ і на початку XXI ст. стали істотними компонентами атмосфери. Вони випадають у країнах Європи, Північної Америки, а також у районах найбільших агломерацій Азії і Латинської Америки. Головна причина кислотних опадів – надходження сполук сірки і азоту в атмосферу при спаленні викопного палива в стаціонарних установках і двигунах транспорту. Кислотні опади завдають шкоди будівлям, пам'ятникам і металевим конструкціям, викликають дигресію і загибель лісів, знижують урожай багатьох сільськогосподарських культур, погіршують родючість ґрунтів, що мають кислу реакцію, і стан водних екосистем.
У водяних екосистемах кислотні опади викликають загибель риб та інших водяних мешканців. Підкислення води рік і озер серйозно впливає і на сухопутних тварин, тому що багато звірів і птахів входять до складу харчових ланцюгів, що починаються у водяних екосистемах. Разом із загибеллю озер стає очевидною і деградація лісів. Кислоти порушують захисний восковий покрив листів, роблячи рослини уразливішими для комах, грибів і інших патогенних мікроорганізмів. Під час посухи через ушкоджені листи випаровується більше вологи. Вилуджування біогенів із ґрунту і вивільнення токсичних елементів сприяє уповільненню росту і загибелі дерев. Можна припустити, що відбувається і з дикими видами тварин, коли гинуть ліси. Якщо руйнується лісова екосистема, починається ерозія ґрунту, засмічення водоймищ, повінь і погіршення запасів води стають катастрофічними
Охорона водойм від забруднення
Забруднення водоймищ відбувається природним і штучним шляхами. Забруднення поступають із дощовими і талими водами, змиваються з берегів, а також утворюються у процесі відмирання тваринних та рослинних організмів, які знаходяться у водоймищі.
Штучне забруднення водоймищ є, головним чином, результатом спуску у них недостатньо очищених стічних вод промислових підприємств та населених пунктів. Забруднення, які поступають у водоймище, у залежності від їх об’єму і складу можуть надавати на нього різний вплив: змінюються фізичні властивості води, з’являється забарвлення, запахи та присмак; з’являються плаваючі речовини на поверхні водоймища і утворюються відкладення; змінюється хімічний склад води, на практиці санітарної охорони водоймищ користуються гігієнічними нормативами – гранично допустимими концентраціями (ГДК) речовин, які впливають на якість води. За ГДК приймають ту максимальну концентрацію речовин, при якій не порушується нормальний хід біологічних процесів, що формують якість води, та не погіршуються товарні якості промислових організмів. Найбільш ефективною охороною водоймищ від забруднення стічними водами є їхнє очищення. Для раціонального використання водних ресурсів і посилення охорони природних вод від забруднення передбачають повторне використання очищених стічних вод у системах виробничого водопостачання.
У межах великих міст необхідно враховувати забруднення не тільки побутовими та виробничими стічними водами, але і дощовими та талими, які стікають з території міста по водостоках. Мінімальна витрата води у річці для розбавлення дощових вод повинна складати не менше 0,016 л/с на жителя, у іншому випадку якість річної води буде незадовільною.
Наявність у стічних водах шкідливих речовин гальмує процеси самоочищення водоймищ. Такі забруднення виробничих стічних вод, як сірководень та сульфіди, надають отрутний вплив на живі організми. Крім того, вони є нестійкими у водному середовищі, окислюються за рахунок розчиненого у воді кисню, порушуючи цим кисневий режим водоймища. До таких же тяжких наслідків приводить випуск у водоймища фенолмістких стічних вод, зокрема стічних вод газогенераторних станцій, хімічних заводів, а також підприємств паперової промисловості.
Регенеруючі можливості водоймищ. Здатність самоочищення річки залежить від багатьох природних факторів: об’єму річного стоку, швидкості потоків, хімічного складу води, її температури і т.д. Урахувати їх усі при прогнозуванні оптимальних санітарних пропусків дуже важко. Діючі санітарні норми вимагають гранично мінімального вмісту забруднень у очищених стічних водах, які поступають у водоймища. Але у багатьох випадках глибоке очищення стоків відповідно до цих норм коштує значно дорожче, ніж розбавлення стічних вод, які проходять менш глибоке очищення, річною водою.
Очищення води на водоочисних станціях та в домашніх умовах - перегляд мультимедійної презентації.

VІ.Закріплення вивченого матеріалу
Графічний диктант ( учні будують відрізок від 1 до 12 – по кількості запитань
1__2___3__4__5__6__7___8___9___10___11___12 і ставлять «+» якщо погоджуються з твердженням, або «-» якщо – ні).
1. Лаувазьє вперше встановив співвідношення елементів Гідрогену та Оксигену в молекулі води (+).
2. Вода – це однорідна суміш (-).
3. Об’єм твердого стану води перевищує об’єм рідини (+).
4. Кислотні дощі ведуть до самознищення людства (+).
5. Фрідріх Енгельс говорив, що потрібно постійно боротись з природою (-).
6. Забруднення водойм є лише штучне (-).
7. В домашніх умовах можна очистити воду, заморозивши її (+).
8. При втраті води близько 25 % людина гине (+).
9. Гранично допустимимі концентрації(ГДК) речовин впливають на якість води(+).
10. Вода існує в двох агрегатних станах (-).
11. Забруднення, які поступають у водоймище можуть впливати на нього (+).
12. Річки здатні до самоочищення (+).
VІI. Домашнє завдання.
Підготуватись до семінарського заняття з теми «Розчини».
Урок 50.
Тема: Семінарське заняття з теми «Розчини».
Мета. перевірити знання, уміння і навички учнів, здобуті в ході вивчення теми «Розчини»; розвивати вміння розв’язувати розрахункові задачі, формувати вміння самостійної роботи на уроці. Створити умови для виділення в структурі знань наукових фактів, понять і законів та розглядати їх у взаємозв’язку.
Формування компетентностей:Загальнопредметна, комунікативна, продуктивної творчості, саморозвитку і самоосвіти.
Тип уроку: урок перевірки знань і вмінь.
Хід уроку І. Організаційна частина.
ІІ. Мотивація навчальної діяльності.
Знання залишаються в пам’яті тоді, коли їх можна використати для практичного застосування: використання вправ різного рівня складності й розрахункових задач.
ІІІ. Повідомлення теми, мети і завдань уроку.
Метою уроку є контроль і корекція знань, вмінь та навичок.
І варіант
І рівень
1. Туман — це:
а) розчин твердих речовин у повітрі;
б) розчин рідини в повітрі;
в) розчин газу в повітрі.
2. Розчин, у певному об’ємі якого міститься мало розчиненої речовини, називається:
а) розведеним; в) концентрованим.
б) ненасиченим;
3. Використовуючи таблицю розчинності, вкажіть малорозчинну речовину:
а) К2SО4; б) СаSО4; в) РbSО4.
4. Процес приєднання молекул води до частинок речовини, що розчиняється, називається:
а) асоціацією;
б) сольватацією;
в) гідратацією.
ІІ рівень
1. У розчині массою 80г знаходиться 10г харчової соди NaHCO3.
Визначте масу води в розчині.
2. У розчині масою 250 г міститься цукор масою 50 г.Обчисліть масову частку цукру в даному розчині.
3. Обчисліть масу розчину солі з масовою часткою натрій хлориду 22 %, що містить 50 г солі.
ІІІ рівень
8. Визначте масу натрій гідроксиду і масу води, необхідні для приготування 100мл розчину з масовою часткою NaОН 50 %. Густина розчину 1,525 г/мл.
9. На барій оксид подіяли розчином хлоридної кислоти масою 200 г з масовою часткою НСІ 14,6 %. Яка маса барій хлориду утворилася в результаті реакції?
IV рівень
10. 11,2 л хлороводню (н.у.) розчинили в 65 мл води. Обчисліть масову частку НС1 в отриманому розчині й об’єм розчину, якщо його густина 1,108 г/мл.
ІІ варіант
І рівень
1. Столовий оцет — це:
а) розчин спирту у воді;
б)чиста оцтова кислота;
в) розчин оцтової кислоти у воді.
2. Суміші, у яких частинки однієї рідини розподілені в іншій рідині, це:
а) суспензії; б) емульсії; в) золі.
3. Використовуючи таблицю розчинності, вкажіть розчиннуречовину:
а) NаСІ; б) РbС12; в) АgС1.
4. Щоб збільшити концентрацію розчиненої речовини в розчині, потрібно:
а) профільтрувати розчин;
б) упарити розчин;
в) додати води.
ІІ рівень 5.У 100 г води розчинили 2 г калій хлориду КС1. Обчислітьмасу отриманого розчину.
6.У розчині масою 25 г міститься натрій гідроксид NaОН масою 5 г.
Обчисліть масову частку натрій гідроксиду в розчині.
1. Обчисліть масу цукру, що міститься в 150 г розчину з масовою часткою цукру 14 %.
III рівень
8. У 300 г розчину калій гідроксиду з масовою часткою лугу 20 % долили 200 мл води. Визначте масову частку лугу в новому розчині.
9. Магній оксид масою 8 г розчинили в розчині нітратної кислоти з масовою часткою HNО3 30 %. Яку масу розчину азотної кислоти витратили?
IVрівень
1. Необхідно приготувати 500 мл розчину натрій гідроксиду з масовою часткою NаОН 20 %, густина якого 1,219 г/мл. Який об’єм розчину натрій гідроксиду з масовою часткою NаОН 50 % і густиною 1,525 г/мл необхідно взяти для цього?
IV. Підсумок уроку
V. Домашнє завдання
Повторити вивчений матеріал, підготуватися до контрольної роботи.
Урок 51
Тема: Контрольна робота.
Мета: Узагальнити й скоригувати знання учнів з теми «Вода». Визначити рівень навчальних досягнень учнів з теми, розуміння основних понять, уміння використовувати їх на практиці. Розвивати логічне мислення.Виховувати самостійність.
Формування компетентностей:Загальнопредметна, продуктивної творчості, саморозвитку і самоосвіти.
Тип уроку : контроль та коригування знань, уміньі навичок
Обладнання : картки – завдання
Хід уроку
І.Організаційний етап
ІІ. Письмова контрольна робота
Розчини
Кількісний склад розчину.Масова частка розчиненої речовини
І варіант
1. Масову частку розчиненої речовини позначають літерою
А)n Б)М В) V Г) W
2. Масову частку розчиненої речовини виражають в одиницях
А) г Б) г/моль В) % Г) моль
3. Маси марганцівки (калій перманганату) і води в засобі для промивання ран масою 120 г із масовою часткою калій
перманганату 0,005 дорівнюють відповідно
1. 0,005 г; 2. 0,6 г; 3. 119,4 г; 4 119,995 г; 5 120 г
А) 2,3 Б) 2, 5 В )1, 3 Г) 4, 5
4. Маси гідроген пероксиду і води в засобі для вибілювання масою 200 г із масовою часткою пероксиду 0,1 дорівнюють відповідно
1. 10 г; 2. 20 г; 3. 190 г; 4. 200 г; 5. 180 г
А) 1,5 Б) 2, 5 В) 3, 4 Г) 2, З
5. Установіть відповідність між масами води і солі
Маса води Маса солі, масова частка речовини
А) 30 г Б) 35 г В) 45 г 1. 15 г, 0,3 3. 30 г, 0,4
2 .20 г, 0,3 4 .20 г, 0,4
6. Установіть відповідність між масами солі і розчину
Маса солі Маса розчину, масова частка речовини
А) 30 г Б)50 г В) 52,5 г 1. 180 г, 0,35 3. 200 г, 0,25
2. 150 г, 0,2 4. 175 г, 0,3
7. Маси солі й розчинів у порядку збільшення масової частки солі в них розміщуються в
ряд
А)m(солі) = 22 г; m (розчину) = 120 г В)m (солі) = 18 г; m
(розчину) = 145 г
Б) m (солі) = 16 г; m (розчину) = 120 г Г ) m (солі) = 20 г; m
(розчину) = 125 г
8. Маси компонентів розчинів у порядку збільшення масової частки солі в них розміщуються в ряд
А)m (солі) = 25 г; m (води) = 140 г В)m (солі) = 20 г; m (води) = 120 г
Б ) m (солі) = 15 г; m (води) = 135 г Г ) m
(солі) = 28 г; m (води) = 125 г
9. Борний спирт (аптечний препарат) — це 3%-й спиртовий розчин борної кислоти. Щоб отримати борний спирт масою 100 г, до спирту треба добавити борну кислоту масою (г)
10. Для виготовлення йодної настоянки взяли кристалічний йод масою 3,5г і спирт масою 46,5 г. Масова частка (%) в цій настоянці дорівнює ……
ІІ варіант
1. Масову частку розчиненої речовини позначають літерою
А)М В)п В)W Г) V
2. Масову частку розчиненої речовини виражають в одиницях
А ) % Б) г В) г/моль Г) моль
3. Маси марганцівки (калій перманганату) і води в засобі для промивання ран масою 120 г із масовою часткою калій перманганату
0,003 дорівнюють відповідно
1. 0,003 г; 2. 0,36 г; 3. 116,4 г; 4. 119,997 г; 5. 120 г
А) 2, З Б) 2, 5 В) 1,3 Г) 4, 5
4. Маси гідроген пероксиду і води в засобі для вибілювання масою 300 г із масовою часткою пероксиду 0,1 дорівнюють відповідно
1. 30 г; 2. 10 г; 3. 290 г; 4. 300 г; 5. 270 г
А) 1,3 Б) 4, 5 В ) 2, 3 Г) 1, 5
5. Установіть відповідність між масами води і солі
Маса води Маса солі, масова частка речовини
А )30 г Б) 35 г В) 45 г 1. 20 г, 0,3 3. 15 г, 0,3
2 .20 г, 0,4 4. 30 г, 0,4
6. Установіть відповідність між масами солі і розчину
Маса солі Маса розчину, масова частка речовини
А) 30 г Б) 50 г В) 52,5 г 1. 175 г, 0,3 3. 150 г, 0,2
2 .180 г, 0,35 4 .200 г, 0,25
7. Маси солі й розчинів у порядку збільшення масової частки солі в них розміщуються вряд
А)m (солі) = 20 г; m (розчину) = 125 г В)m (солі) = 18 г; m (розчину) = 145 г
Б )m (солі) = 22 г; m (розчину) = 120 г Г)m (солі) = 16 г; m (розчину)
= 120 г
8. Маси компонентів розчинів у порядку збільшення масової частки солі в них розміщуються в ряд
А)m (солі) = 20 г; m (води) = 120 г В) m (солі) = 25 г; m (води) = 140 г
Б ) m (солі) = 28 г; m (води) = 125 гГ ) m (солі) = 15 г; m (води) = 135 г
9. Борний спирт (аптечний препарат) — це 3%-й спиртовий розчин борної кислоти. Щоб отримати борний спирт масою 200 г, до спирту треба добавити борну кислоту масою (г).
10. Для виготовлення йодної настойки взяли кристалічний йод масою 7г і спирт масою 93 г . Масова частка (%) в цій настоянці дорівнює
……
Бібліографія
1. Програма для загальноосвітніх навчальних закладів Хімія. 7-9 класи. Навчальна програма для загальноосвітніх навчальних закладів»// Наказ МОН №804 від 07.06.2017 р.
2. Стахаєв О.Ю. Хімія. Узагальнюючі схеми і таблиці. Посібник для учнів і абітурієнтів, студентів та вчителів. - Тернопіль - Харків:
«Навчальна книга - Богдан» - «Гімназія», 1998.
3. Общая химия. Глинка Н.Л.; под. ред..В.А.Рабиновича, - 5-е узд. - Киев: Вища школа. - 1982.
4. Березан О. Хімія. Тести для школярів і вступників у ВНЗ. - Тернопіль: підручники і посібники - 2007.
5. Хімія. Повний курс. Універсальний довідник для випускників та абітурієнтів /авт. Титаренко Н.В./ К: Літера ЛТД, 2011.
6. Григорович О.В. Хімічний експеримент у школі. 7-11 класи / Упорядкування О.В. Григорович, О.В. Невський – Х.: Веста:
Ранок, 2008. – 192 с.
8. http://teacherjournal.com.ua/
9. http:// metodportal.com/
10. http://ru.osvita.ua/


про публікацію авторської розробки
Додати розробку