кейс-урок Окисно-відновні реакції «за» чи «проти»
Тема кейс-уроку: «Окисно-відновні реакції «за» чи «проти»»
Тема уроку: Значення окисно-відновних процесів у житті людини, природі, техніці
Знання збираються по краплині, як вода в долоні.
Українське прислів'я
Мета уроку:
Освітня: поглибити знання учнів про окисно-відновні реакції, закріпити знання основних понять та вміння визначати й застосовувати такі поняття: «ступінь окиснення», «окисник», «відновник», «окиснення», «відновлення»; ознайомити зі значенням окисно-відновних реакцій у природі та на виробництві; розвивати навички виконання простих хімічних експериментів
Розвивальна: розвивати вміння і навички роботи в команді, вчити самостійно здобувати знання з різних джерел інформації та робити висновки, формувати вміння виступати перед аудиторією
Виховна: пробуджувати пізнавальний інтерес, використовуючи новини науки і техніки, ігрові ситуації та навчальні дискусії, виховувати пізнавальний інтерес учнів до вивчення хімії, товариськість і взаємодопомогу.
1
Тема кейс-уроку: «Окисно-відновні реакції «за» чи «проти»»
Тема уроку: Значення окисно-відновних процесів у житті людини, природі, техніці
Знання збираються по краплині, як вода в долоні.
Українське прислів’я
Мета уроку:
Освітня: поглибити знання учнів про окисно-відновні реакції, закріпити знання основних понять та вміння визначати й застосовувати такі поняття: «ступінь окиснення», «окисник», «відновник», «окиснення», «відновлення»; ознайомити зі значенням окисно-відновних реакцій у природі та на виробництві; розвивати навички виконання простих хімічних експериментів
Розвивальна: розвивати вміння і навички роботи в команді, вчити самостійно здобувати знання з різних джерел інформації та робити висновки, формувати вміння виступати перед аудиторією
Виховна: пробуджувати пізнавальний інтерес, використовуючи новини науки і техніки, ігрові ситуації та навчальні дискусії, виховувати пізнавальний інтерес учнів до вивчення хімії, товариськість і взаємодопомогу.
Програмне забезпечення:Microsoft PowerPoint, Word, Paint, Internet Explorer
https://learningapps.org/watch?v=p010g8zo317
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, пам’ятки з алгоритмом складання рівнянь окисно-відновних реакцій методом електронного балансу, правила визначення ступенів окиснення елементів в речовинах.
Базові поняття та терміни: окисно-відновні реакції, окисники, відновники, окиснення, відновлення, метод електронного балансу, реакція без зміни ступеня окиснення; міжмолекулярне окиснення-відновлення, внутрішньо-молекулярне окиснення-відновлення, самоокиснення-відновлення.
Тип уроку: закріплення й вдосконалення знань, умінь і навичок.
Структура уроку:
|
№ п/п |
Этап урока |
Примерное время |
|
|
Організаційний момент |
1 хв |
|
|
Етап перевірки домашнього завдання |
5хв |
|
|
Актуалізація опорних знань та мотивація навчальної діяльності |
3 хв |
|
|
Етап засвоєння нових знань |
5 хв |
|
|
Закріплення навчального матеріалу шляхом виконання завдань у групах |
10 хв |
|
|
Претворюємо інформацію на знання |
10 хв |
|
|
Узагальнення й систематизація знань |
7 хв |
|
|
Домашне завдання |
2 хв |
|
|
Рефлексія |
1 хв |
ХІД УРОКУ
1. Організаційний момент
1.1. Привітання.
1.2. Перевірка присутності учнів: кількість за списком ______, кількість присутніх на уроці __________, відсутніх __________.
1.3. Перевірка готовності учнів до уроку.
2. Етап перевірки домашнього завдання
2.1. Перевірка наявності в учнів виконаних письмових робіт. Обговорення запитань, що виявилися найбільш складними.
3. Актуалізація опорних знань та мотивація навчальної діяльності
3.1. Технологія «Незакінчені речення».
Учитель зачитує початок речення, а учні повинні письмово його закінчити.
3.2. Визначення ступенів окиснення
На цій огорожі деякі дошки закріплені не повністю, це дошки із формулами речовин в яких сульфур виявляє ступінь окиснення +6
3.3. Вправа на відповідність «Хтось знаходить, а хтось втрачає»
Установіть відповідність між схемою перетворення та кількістю електронів, відданих або приєднаних атомами, вкажіть окисник і відновник, процеси окиснення та відновлення.
3.4. Покажіть відповідність між рівнянням реакції та речовиною-окисником,яка приймає участь в даній реакції.
4. Етап засвоєння нових знань
- Слово вчителя
Світ навколо нас великий і різноманітний. Життя оточує нас усюди. Воно існує як у крижаних полярних зонах, так і в розпечених пустелях. Ми зустрічаємо життя всюди, починаючи з освітленої сонцем поверхні моря і закінчуючи самими темними глибинами океану. Під нашими ногами трудиться незліченна кількість мікроорганізмів, роблячи ґрунт родючим і придатним для росту рослин, які, у свою чергу, необхідні іншим формам життя. Земля так насичена життям, що це приголомшує нашу уяву. Життя — це найбільша цінність нашої планети й унікальна її особливість. Навколишній світ — це гігантська «хімічна лабораторія», у якій щомиті відбуваються тисячі реакцій, переважно — окисно-відновні, і доки ці реакції відбуваються, доки є умови для їхнього перебігу, можливо й саме життя.
3.2. Показ практичного значення вивчення нового матеріалу.
Перегляд відео «Як утворилась планета Земля»
4.1.З метою закріплення знань, одержаних вами в ході вивчення цієї теми, пропоную заповнити видані вам картки опорного конспекту.
4.1.Діти працюють з картками
1. У простих речовинах ступінь окиснення дорівнює:
S, O2, P4, O3, N2, Fe, Ca, C, Cl2, I2, Br2, Li, Mg.
2. У складних речовинах:
• Оксиген має ступінь окиснення _____ (винятки F2O, Cl2O, H2O2, Na2O2);
• Гідроген має ступінь окиснення _____ (винятки CaH2, LiH, AlH3);
Ступінь окиснення металів визначають за _____ зі знаком «+».
Взаємоконтроль
Обміняйтеся аркушами та виправте помилки, допущені сусідом.
Самоконтроль
Учитель. Поверніть аркуші, всі разом перевіримо правильність виконання завдання.
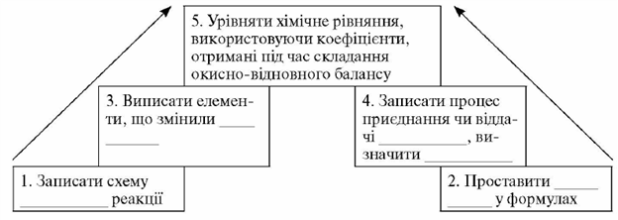
Алгоритм складання окисно-відновного рівняння методом електронного балансу
З допомогою цих схем ми пройдемо умовними сходинками, що приведуть нас до розв’язання вправ на урівняння рівнянь методом електронного балансу.
1. Запишіть схему хімічної реакції.
2. Проставте ступені окиснення елементів у формулах.
3. Випишіть елементи, які змінили ступінь окиснення.
4. 3апишіть процес приєднання чи віддачі електронів, визначте окисник та відновник.
5. Урівняйте схему хімічної реакції, використовуючи коефіцієнти, підібрані методом електронного балансу.
4.2. Закріплення навчального матеріалу шляхом виконання завдань у групах
Робота в групах з кейсами. Опрацювання матеріалів кейсів. Виконання завдань.
Завдання для груп:
- Опрацюйте навчальний матеріал згідно обраного кейсу
- Для окисно-відновної реакції складіть електронний баланс, укажіть окисник і відновник.
- Дайте відповіді на запитання кейсу
4.3.Претворюємо інформацію на знання
Група «Фізики»
Демонстрація Робота електрофорної машини
Найкраще вивчена лінійна блискавка, яка є іскровим розрядом. Під впливом електричного поля вільні електрони, які завжди є в атмосфері, набувають великої швидкості і при зіткненні з молекулами іонізують їх. Внаслідок цього у повітрі збільшується кількість електронів, які знову розганяються електричним полем і в свою чергу спричиняють іонізацію молекул.
У вузькому каналі повітря лавиноподібно збільшується кількість електронів, що рухаються від хмари до землі. Цим іонізованим каналом, як у провіднику, із хмари починають витікати заряди. Виникає т. з. лідер блискавки, який пробігає 50—100 м і зупиняється. Потім він відразу ж відновлюється у тому ж каналі і пробігає ще таку ж відстань. Так триває доки лідер не досягне землі.
Середня швидкість розвитку такого ступінчастого лідера становить 10² км/с. У момент досягнення лідером землі в його каналі починають рухатися заряди, які утворюють яскравий «головний канал» блискавки; швидкість його — порядку 104 км/с. Струм у головному каналі становить у середньому 20—40 кА, досягаючи 200 кА. Довжина блискавки в середньому 1—2 км, іноді 40—50 км. Діаметр каналу блискавки близько 10 см.
Розряд блискавки здебільшого не обмежується одним імпульсом, частіше виникають 2—3 імпульси, а іноді близько 50. Цим пояснюється мерехтіння блискавки. Наступні імпульси відрізняються від першого тим, що лідери їх безперервні, бо ці імпульси проходять вже іонізованим каналом (рис..). Такий лідер називається стрілоподібним; швидкість його трохи більша, ніж ступінчастого.
Час між імпульсами порядку 10−2 с. Тривалість повного розряду блискавки може становити близько 1 с і більше. У каналі блискавки розвивається висока температура, яка спричинює дуже швидке розширення і стиснення повітря в каналі. Це супроводиться звуковими явищами — громом. Багаторазовість імпульсів блискавки і відбиття звуку від хмар і від поверхні землі призводять до гуркоту грому.
Розряди лінійної блискавки в землю іноді завдають значної шкоди; жертвою таких розрядів блискавки бувають і люди. Дійовим засобом захисту земних об'єктів від ударів лінійної блискавки є блискавковідводи.
Статична електрика — це заряди електрики, що накопичуються на виробничому обладнанні, предметах побуту, на тілі чи одязі людини внаслідок контактного чи індуктивного впливу. .Статична електрика виникає на діелектриках або на ізольованих від землі провідниках. Найчастіше причиною виникнення надлишкового заряду є трибоелектричний ефект — електризація тертям. Серед інших причин можна назвати п'єзоелектричний ефект, як, наприклад, у кухонних п'єзоелектричних запалках. У піроелектриках статична електрика може виникнути при зміні температури. При торканні до наелектризованих предметів, людина, тіло якої є непоганим провідником, замикає електричне коло, і її може «вдарити струмом» — електричний струм через тіло людини призводить до мимовільного скорочення м'язів.
Добування енергії з будь-якого палива ґрунтується на окисно-відновних реакціях. Наприклад, у двигунах внутрішнього згоряння відбувається реакція згоряння бензину. Енергія, що виділяється в результаті реакції, перетворюється на механічну енергію для переміщення автомобіля.
У звичайних батарейках також відбуваються ОВР, енергія від яких перетворюється на електричну енергію. Такі джерела електричного струму називають гальванічними елементами. У батарейці відбувається реакція, яку схематично можна описати рівнянням:
Zn + Мп02 = ZnO + МпО.
Акумулятори в автомобілях, ноутбуках та мобільних телефонах — це також гальванічні елементи, в яких відбуваються різні ОВР.
У паливних елементах електрична енергія виробляється внаслідок окисно-відновної реакції горіння. Перспективним є паливний елемент, у якому відбувається згоряння водню, оскільки єдиним продуктом цієї реакції є вода. Автомобілі з такими паливними елементами будуть екологічно чистими.
Жертви блискавок
- Асклепій, Ескулап — син Аполлона — бог лікарів і лікарського мистецтва, не лише зціляв, але й оживляв мертвих. Аби відновити порушений світовий устрій Зевс уразив його своєю блискавкою.[5]
- Фаетон — син бога Сонця Геліоса — одного дня узявся управляти сонячною колісницею свого батька, але не стримав вогняних коней і трохи не погубив в страшному полум'ї Землю. Розгніваний Зевс пронизав Фаетона блискавками.
- Російський академік Г. В. Ріхман — в 1753 році загинув від удару блискавки.
- Садівник Рой С. Салліван зі штату Вірджинія, США, 7 разів постраждав від удару блискавки. У 1942 році він позбувся нігтя на великому пальці ноги, в липні 1969 йому обпалило брову, в липні 1970 обпалило ліве плече, в квітні 1972 у нього загорілося волосся, в серпні 1973 воно знову спалахнуло, але цього разу постраждали ще й ноги, а в червні 1976 йому поранило кісточку. 25 червня 1977 року, після того як під час риболовлі його черговий раз вдарило блискавкою, Саллівана поклали в лікарню з опіками грудей та живота. Помер він у вересні 1983 року, покінчивши життя самогубством через нещасливе кохання.
Запитання по відео:
- Яким чином блискавка відноситься до окисно-відновних реацій
- Яку роль відіграють ці окисно-відновні реакції в природі?
Виявляється, що внаслідок цих реакцій до ґрунту надходить Нітроген у вигляді солей нітратної кислоти, оскільки з нітроген(IV) оксиду утворюється нітратна кислота, що потім утворює солі.
Запитання до кейсу
- Чому при ударі блискавки іноді в декількох метрах від удару виявляються пошкодження чутливих електровимірюваних приладів, а також плавляться запобіжники в освітлювальній мережі?
Складіть електронний баланс та розставте коефіцієнти в таких окисно-відновних процесах: зв’язування атмосферного азоту киснем під час грозових розрядів:
N2 + O2 → NO;
NO + O2 → NO2;
NO + H2O → HNO3 + HNO2;
Спроби захищатися від блискавки відомі ще задовго до початку нашої ери. Це довели археологічні розкопки в Єгипті, де на стінах зруйнованих храмів написи свідчили, що встановлені навколо храму щогли служили «для захисту від небесного вогню». Давньоримський письменник і вчений Пліній Старший повідомляє в своїй відомій енциклопедичній праці, що жреці під час обрядів переводили блискавку в землю використовуючи для цього високі металеві жердини. Наукове пояснення блискавковідводів, які в побуті неправильно називають громовідводами, з'явилось лише в середині XVIII ст. в працях Ломоносова, Франкліна та інших учених
Група «Хіміки»
Демонстрація «горіння металів», горіння бенгальських вогників, горіння свічок феєрверків
Вогонь супроводжує людину на всьому шляху розвитку цивілізації. Коли люди навчилися користуватися вогнем, а потім здобувати його, їхні можливості збільшилися багаторазово. Так, було з’ясовано, що вогонь може зберігати від псування продукти харчування, очищати поля від бур’янів, допомагати отримувати метал. Вогонь допоміг людині розселитися по планеті, забезпечивши їй тепло в різних кліматичних умовах. Опанування вогню стало необхідним чинником для виникнення й існування сім’ї. Він збирає навколо себе людей, має об’єднувальну та очищувальну силу. Штучне отримання вогню сталося набагато пізніше, ймовірно, на початку епохи верхнього палеоліту. Відомо кілька дуже давніх способів добування вогню: скоблінням, випилюванням, свердлінням, коли два шматки деревини інтенсивно терли один об один, а також висіканням іскор за допомогою кременю. Останній спосіб від початку залізного віку був удосконалений шляхом використання кресала й побутував аж до винаходу в XIX сторіччі фосфорних сірників.Вогонь шанували як живу істоту, його боялися, йому вклонялися. У давньослов’янській міфології богом вогню був Сварог (Сварожич), якого ототожнювали з давньогрецьким Гефестом і вважали батьком Сонця та Даждьбога.
СПОСОБИ ОТРИМАТИ ВОГОНЬ :
- Використовуйте кремінь . Оглядівшись, майже завжди можна знайти камінь, який при ударі залізом дасть сніп іскр. Кремінь прагніть тримати якомога ближче до труту. Для висеченія іскр використовуйте, наприклад, ніж.
- Допомога від сонця . Часто туристи беруть з собою підзорні труби, біноклі, фотоапарати. Використовуйте лінзи від оптичної техніки для фокусування сонячних променів на труті. Лінзу можна виготовити з двох опуклих стекол від годинника, заповнивши проміжок водою і замазавши стик глиною.
- Добудьте вогонь тертям . Для того, щоб добути вогонь цим способом насамперед потрібно виготовити лук. Візьміть стовбур молодої берези, ліщини або тіса завтовшки 2-3 см і завдовжки в 1 метр. Натягніть між кінцями тятиву з мотузка.
На наступному кроці Вам знадобиться свердло – соснова паличка завтовшки з олівець і завдовжки приблизно 30 див. Крім того, не забудьте підібрати поліно з твердої породи дерева (дуб, береза і т.д.) – опору.
Він завжди буває різним
Дивовижний наш вогонь,
То Буяном неповторним,
То тихонею з тихонь.
То він змійкою швиденько
По сухі повзе траві,
То він гривою рудою
Майоріє на зорі ...
Да вогонь буває різний -
Жовтий, синій, золотий,
Дуже добрий, дуже злий.
Запитання по відео:
Поясніть реакцію горіння з позиції окисно-відновних реакцій
Запитання до кейсу
- Впізнайте механізм, в принципі роботи якого застосували один з найдавніших способів добування вогню. Цей спосіб використовували у казці Г. Х. Андерсена «Кресало».
- Впізнайте предмет, який був колись макальним, водневим, іноді його називають шведськими.
- Принцип отримання вогню таким чином вважають ще більш давнім, ніж висікання.
- Бувають декоративними, штормовими, а у нас ... «спецназ».
Складіть електронний баланс та розставте коефіцієнти в таких окисно-відновних процесах: згоряння сірника
Р + КСІО3 -> Р2О5 + + КСІ
Група «Біологи»
Кожна клітина живого організму- це мікролабораторія, в якій природа- наймайстерніший хімік на молекулярному рівні творить свої справи. Початки вивчення енергетичних процесів у живих організмах були закладені французьким ученим Лавуазьє ще в XVIII ст. Він уперше звернув увагу на подібність згорання органічних речовин поза організмом з процесом дихання в тварин. Оскільки при згоранні речовин утворюються СО2 і Н2О, а під час дихання виділяються такі ж речовини і певна кількість тепла, то Лавуазьє цілком логічно вважав, що дихання організму – процес з'єднання кисню повітря з вуглецем і воднем органічних речовин всередині тіла. Експерименти Лавуазьє, а також його висновки послужили основою для ствердження, що живі організми підпорядковуються першому принципу термодинаміки. Це означає, що спалювання цукру поза організмом (in vitro) і окиснення його в організмі (in vivo) можна зобразити у вигляді хімічної реакції:
С6Н12O6 + 6О2 → 6СО2 + 6 Н2О + тепло
Всі хімічні реакції в живих клітинах підпорядковуються законам термодінамики.
Перший закон: енергія не створюється з нічого та не зникає, вона лише перетворюється в еквівалентних кількостях з одного виду в інший, тобто внутрішня енергія системи залишається постійною. Самовільно хімічні процеси можуть проходити лише в одному напрямку – досягнення рівноваги, тобто максимальної ентропії. Ентропія – це міра хаосу, неупорядкованості.
Другий закон: ентропія при самовільних процесах зростає. Самовільно неупорядкована система ніколи не перетвориться в упорядковану. Для цього перетворення треба витратити додаткову енергію.
Процес фотосинтезу є основою живлення всіх живих істот, а також забезпечує людство паливом, волокнами і незліченними корисними хімічними сполуками. З діоксиду вуглецю і води, зв'язаних з повітря в ході фотосинтезу, утворюється близько 90-95% сухої ваги урожаю. Людина використовує близько 7% продуктів фотосинтезу в їжу, як корм для тварин і у вигляді палива і будівельних матеріалів
В біології міцно закріпилось уявлення, що дихання в організмі (окиснення) за своєю суттю є процесом “горіння", яке відбувається дуже повільно.
Отже, поживні речовини, що потрапили в організм з їжею, є “паливом", яке згорає в організмі шляхом приєднання кисню повітря.
Разом з тим, було звернуто увагу на той факт, що повільне “горіння" органічних речовин в організмі істотно відрізняється від такого, що проходить поза організмом: по-перше, воно відбувається при низькій температурі, по-друге, – при відсутності полум'я і, по-третє, – за наявності води, вміст якої в тканинах досить високий.
Біологічне окиснення – це сума всіх окисно-відновних процесів, включаючи анаеробні, що відбуваються в клітинах організму (цитоплазмі, мітохондріях, ендоплазматичному ретикулумі). Основними субстратами біологічного окиснення є вуглеводи та ліпіди, саме їх катаболізм дає найбільшу кількість хімічної енергії, що акумулюється у високоенергетичних зв’язках макроергів.
Демонстрація « Взаємодія Са(ОН)2 із СО2)
Демонстрація чистоти води
Як відрізнити брудну воду від чистої? В одну склянку наберіть чистої питної води, а в іншу — брудну воду з калюжі. Додайте в кожну декілька крапель рожевого розчину калій перманганату (марганцівки). У питній воді колір залишиться рожевим, а в брудній — забарвлення зникне. В останньому випадку відбувся процес окиснення — відновлення.
Запитання по відео:
Поясніть фотосинтез та дихання з позиції окисно-відновних реакцій
Складіть електронний баланс та розставте коефіцієнти в таких окисно-відновних процесах: знезараження овочесховищ:
H2S + O2 → S + H2O;
S + O2 → SO2.
Запитання до кейсу
Поблизу Австралії та на островах Індонезії мешкають сміттєві кури (alectura lathami). На відміну від більшості птахів вони не висиджують свої яйця, а закопують їх у купу гумусу, листя та гною. Яйця розвиваються завдяки теплоті, що виділяється під час окисно-відновної реакції гниття рослин. За допомогою ніжної шкіри всередині дзьобу самець відстежує температуру всередині такого «інкубатора» і залежно від неї розкопує яйця або засипає їх піском.
Група «Географи»
Ще в стародавні часи римляни вірили в богів, а найсуворішим з них був Вулкан. Пройшло декілька тисячоліть з тих пір, але дивний світ вулканів не зник і продовжує чарувати своєю красою кожного з нас або лякати світ черговою катастрофою, як одного дня вже було в Помпеї і багатьох інших місцях планети.
Сім вулканів світу – це група вулканів, які є найвищими в 7 різних частинах світу. До них входять: Північна Америка, Південна Америка, Європа, Азія, Австралія, Африка і Антарктида. В Австралії найвищий вулкан – Гілуве, в Європі – Ельбрус, в Південній Америці – Аконкагуа, в Африці – Кіліманджаро, в Антарктиді – Сідлей, в Північній Америці – Пік Орісаба. Насправді, є певні труднощі у визначенні найвищої точки не лише вулкана.
Не лише людина винна в забрудненні повітря. Як показало, наприклад, виверження вулкана Сент-Хеленс в Північній Америці, атмосферу нерідко забруднює сама природа.
Величезні хмари пилу і газу під час виверження було видно на багато кілометрів, але вулкан приховував в собі і невидиму небезпеку. За підрахунками американських вчених, він викинув радіоактивний газ радон загальною дозою 3 млн кюрі.
Окисно-відновні реакції відбуваються і при виверженні вулканів. Це явище спричиняє руйнування і супроводжується виділенням отруйних газів.
Римський письменник і вчений Пліній Старший загинув від отруйних газів при дослідженні вулкана. Відновником у цій хімічній реакції є гідроген сульфід Н2S, оскільки Сульфур має найнижчу ступінь окиснення –2, що підвищується до +4.
Демонстрації Хімічний «вулкан»
У фарфоровій ступці ретельно розітріть 50 г оранжево-червоних кристалів дихромату амонію і висипте у формі гірки на велику металеву пластинку або аркуш азбестового паперу. На вершині «вулкана» паличкою зробіть лунку і влийте в неї 1-2 мл етилового спирту. Спирт підпаліть сірником, світло в кімнаті вимкніть. Від горіння спирту починає бурхливо розкладатися дихромату амонію. При цьому з «кратера» викидається сніп яскравих іскор і «вулканічний попіл» – брудно-зелений хром (ІІІ) оксид, об’єм якого в багато разів перевищує об’єм взятого дихромату амонію. Екзотермічний розклад дихромату амонію дуже нагадує виверження справжнього вулкану. Реакція відбувається за таким рівнянням: (NH4)2Cr2O7 + N2 + 4H2O + Cr2O3.
Запитання по відео:
Поясніть явище виверження вулкану з позиції окисно-відновних реакцій
Запитання до кейсу
- Визначити найнебезпечніші вулкани на землі
Порівняйте наведені карти тектонічних плит і вулканічної активності. Як ви вважаєте, що пояснює взаємозв'язок між ними?
Складіть електронний баланс та розставте коефіцієнти в таких окисно-відновних процесах: виверження вулкана з утворенням сірки:
H2S + O2 →.
Група «Металурги»
Життя людини схоже на залізо: якщо його використовувати – воно зношується, якщо - ні, то воно іржавіє.
Римський письменник Катон Старший
Перші свідчення про виробництво людьми металу датуються шостим — п'ятим тисячоліттям до Христа Вони були знайдені при розкопках у Майданпеку, Ярмоваці та Плочнику (Сербія). Знайдена в Бєловоде, мідна сокира культури Вінча свідчить про добування міді. Інші свідчення про існування металургії датуються були знайдені археологічними розкопками в різних країнах Європи: у Пальмелі (Португалія), Кортес-де-Наварра (Іспанія), Стоунхендж (Англія). Однак, як часто буває при вивченні доісторичних часів, місце й час винаходу не може бути встановлений точно, і археологи час від часу отримують нові артефакти у різних куточках світу.
Срібло, мідь, олово й метеоритне залізо можна знайти у вигляді самородків, завдяки чому вже ранні культури могли в обмеженому обсязі використовувати обробку металів. Єгипетська зброя з метеоритного заліза, виготовлена приблизно за 3 тис. років до Христа, високо цінувалася як «кинджали з Небес»[4]. Однак уміння отримувати мідь та олово з породи й сполучати ці два метали у сплав під назвою бронза дало початок справжній металургії приблизно три з половиною тисячі років до Христа, й розпочало епоху в історії людства, яка отримала назву бронзової доби.
Видобування заліза з руди та його обробка набагато складніші процеси. Виробництво заліза, мабуть, вигадали хетти десь приблизно за 1200 років до Христа, і започаткували залізну добу. Надалі свідчення розвитку чорної металургії археологи знаходять у різних культурах та цивілізаціях. Серед них стародавні й середньовічні держави Середнього й Близького Сходу, стародавнього Ірану, Стародавнього Єгипту, Нубії, Анатолії, культури Нок, Карфагену, а також Стародавня Греція й Стародавній Рим, Стародавній Китай, стародавня Японія. Стародавній Китай збагатив металургію значними виноходами, такими як вдосконалення доменної печі, чавуну, гідравлічних молотів, ковальських міхів.
У 16 ст. Георг Агрікола видав книгу De Re Metallica, в якій описав складний процес видобування руди, виплавки та обробки металу, що відповідала розвитку металургії на той час. Агріколу називають «батьком» металургії.
Особливо швидкими темпами металургія стала розвиватися з початком промислової революції. Зріс об'єм виробництва металів, вдосконалювалися способи їх отримання, зростала якість. У сучасну епоху зростає роль високотехнологічних матеріалів, таких як сплави, леговані й композитні матеріали з металевими матрицями.
Велике значення в металургії мають процеси нанесення на метал різноманітних захисних покриттів, до яких крім хіміко-термічної обробки належать, наприклад, цинкування, лудіння, гальванотехніка (гальваностегія, гальванопластика) тощо.
Демонстрація «Відновлення міді на залізі»
Запитання по відео:
- Поясніть реакцію добування металів з позиції окисно-відновних реакцій
Запитання до кейсу
- Ейфелева вежа — найвідоміша архітектурна пам`ятка Парижу, що являє собою символ сучасної Франції. Вежа є популярним туристичним об`єктом, вона щорічно приймає близько 5,5 мільйонів відвідувачів. Вежа збудована в період з 1887 по 1889 конструктором Густавом Ейфелем на Марсовому полі. Висота вежі 300 метрів. Вага всіх металічних конструкцій 7 300 тонн, загальна ж маса становить 10 000 тонн. Ейфелеву вежу давно знищила б корозія, якби кожних 7 років вежу не покривали сіро-коричневою фарбою. Обчисліть масу фарби, необхідну для одного покриття, якщо на 1 т споруди витрачається приблизно 7 кг фарби. Визначте, яку масу фарби було витрачено за роки існування Ейфелевої вежі для її захисту від корозії. На фарбування вже витрачено кошти, які перевищують вартість самої споруди. Чи можеш ти запропонувати якісь інші засоби захисту від корозії?
- Чому сваї для будинку неможна ставити із металу?
- Почему водопроводна вода після застою в трубах завжди має жовтуватий колір?
Складіть електронний баланс та розставте коефіцієнти в таких окисно-відновних процесах: відновлення міді воднем
CuO + H2 = Cu + H2O
Група «Мистецтвознавці»
Кислотний дощ утворюється в результаті реакції між водою і такими забруднюючими речовинами, як діоксид сірки (SO2) і різних оксидів азоту (NOx). Ці речовини викидаються в атмосферу автомобільним транспортом, у результаті діяльності металургійних підприємств і електростанцій, а також при спалюванні вугілля і деревини. Вступаючи в реакцію з водою атмосфери, вони перетворюються в розчини кислот: сірчаної, сірчистої, азотистої й азотної. Потім, разом із снігом чи дощем, вони випадають на землю.
Природними джерелами надходження діоксиду сірки в атмосферу є головним чином вулкани і лісові пожежі. Тим часом природні надходження в атмосферу оксидів азоту зв'язані головним чином з електричними розрядами, при яких утвориться NO, згодом — NO2. Значна частина оксидів азоту природного походження переробляється в ґрунті мікроорганізмами, тобто включена в біохімічний колообіг.
Джерела викидів в атмосферу оксидів сірки (a) і азоту (б) Схема утворення кислотних аерозолів і дощів
Діоксид сірки, що потрапив в атмосферу, перетерплює ряд хімічних перетворень, що ведуть до утворення кислот. Частково діоксид сірки в результаті фотохімічного окислювання перетворюється в триоксид сірки (сірчаний ангідрид) SO3:
2SO2 + О2 → 2SO3,
який реагує з водяною парою атмосфери, утворюючи аерозолі сірчаної кислоти:
SO3 + Н2О → H2SO4.
Основна частина діоксиду сірки, що викидається у вологому повітрі утворить аерозоль сірчистої кислоти і зображують умовною формулою Н2SO3:
SO2 + H2O → H2SO3.
Сірчиста кислота у вологому повітрі поступово окисляється до сірчаної:
2H2SO3 + O2 → 2H2SO4.
Кислотні дощі роз'їдають метали, фарби, синтетичні з'єднання, руйнують архітектурні пам'ятки. Багато скульптур і будинкиів у Римі, Венеції й інших містах, пам'ятники зодчества, такі, як Парфенон у Афінах, Кельнський собор та інші, за кілька останніх десятиліть одержали значно більші ушкодження, ніж за весь попередій час. Під загрозою повного руйнування в результаті дії кислотних опадів знаходяться більш 50 тис. скульптур скельного «Міста Будд» під Юньанем у Китаї, побудованого 15 століть назад. Найхарактерніші кислотні дощі для індустріальних країн з високорозвиненою енергетикою.
Демонстрація Кристалографія
Складіть електронний баланс та розставте коефіцієнти в таких окисно-відновних процесах:
Висновки:
- Окисно-відновні процеси найбільш розповсюдженні й мають важливе значення у природі, промисловості, в теорії і практиці.
Яку роль відіграють окисно-відновні процеси у природі й техніці?
5. Узагальнення й систематизація знань
5.1.Метод «Т–схема»: Окисно- відновні реакції – добро чи зло?
Кожна група висловлює думки з приводу користі та шкоди ОВР з позиції кейсу який вони опрацьовували, заповнити таблицю у формі „Т – схеми” з метою формування своєї думки, особистої позиції на дошці.
5.2. Метод «Прес»
Метод «Прес» — це інтерактивний метод, що допомагає навчитися знаходити вагомі аргументи й формувати свою думку щодо дискусійного питання; пропонувати свої ідеї, а також формулювати їх у вигляді чіткої та логічної структури.
Етапи методу:
1. Висловлюємо свою думку: «Я вважаю …»
2. Пояснюємо причину такої точки зору: «Тому, що …»
3. Наводимо додаткові аргументи на підтримку своєї позиції: «Наприклад, …»
4. Узагальнюємо, формулюємо висновки: «Отже …», «Таким чином …»
6. Домашнє завдання, інструктаж щодо його виконання
7. Підбиття підсумків уроку
Підсумкова бесіда
— Яке завдання стояло перед нами на уроці?
— Який результат нашого уроку?
— Чи є ті, хто зробив сьогодні для себе маленьке відкриття?


про публікацію авторської розробки
Додати розробку
