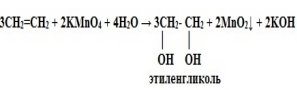Конспект уроку: «Хімічні властивості ненасичених вуглеводнів».
Конспект уроку для 9 класу з поглибленим вивченням хімії
Цілі:
навчальні (дидактичні) - ознайомити учнів з хімічними властивостями ненасичених вуглеводнів, розкрити механізм реакції приєднання, показати, що реакції цього типу є характерними для ненасичених вуглеводнів, розглянути якісну реакцію на ці вуглеводні, удосконалити вміння складати рівняння хімічних реакцій за участю органічних речовин на прикладі етену і етину;
розвиваючі - забезпечити розвиток розумових здібностей учнів, розвивати вміння спостерігати, аналізувати, порівнювати, пояснювати, встановлювати причинно-наслідкові зв'язки і робити логічні висновки про хімічні явища;
виховні - виховувати партнерські взаємостосунки, формувати вміння надати допомогу однокласнику, сприяти формуванню комунікативної та інформаційної компетенції.
Тип уроку: урок засвоєння нових знань.
Форми роботи: фронтальна, індивідуальна.
Методи і прийоми: словесні (розповідь, бесіда), наочні (демонстраційний експеримент), практичні (виконання тренувальних вправ), комунікативні (бесіда за новим матеріалом), проблематизація, ситуація успіху, формування пізнавального інтересу.
Обладнання: комп'ютер, проектор, фліпчарт.
Дидактичні та методичні матеріали: ПСХЕ, мультимедійна презентація уроку, роздадковий матеріал для самостійної роботи (таблиця), картки, демонстраційні відео-експерименти, використання електронних ресурсів «Єдина колекція цифрових освітніх ресурсів».
План-конспект
Тема уроку:
«Хімічні властивості ненасичених вуглеводнів».
Вонярха Яна Олегівна, вчитель хімії, спеціаліст.
Запорізька спеціалізована школа І-ІІІ ступенів з поглибленим вивченням хімії та біології № 72
9 клас (поглиблене вивчення)
Використана навчальна програма МОН України з хімії:
Програма для загальноосвітніх навчальних закладів із поглибленим вивченням предметів: Хімія. 8 — 9 класи. - Інтернет посилання на сайт МОН України: http://old.mon.gov.ua/ua/activity/education/56/692/educational_programs/1349869497/
Цілі:
навчальні (дидактичні) - ознайомити учнів з хімічними властивостями ненасичених вуглеводнів, розкрити механізм реакції приєднання, показати, що реакції цього типу є характерними для ненасичених вуглеводнів, розглянути якісну реакцію на ці вуглеводні, удосконалити вміння складати рівняння хімічних реакцій за участю органічних речовин на прикладі етену і етину;
розвиваючі - забезпечити розвиток розумових здібностей учнів, розвивати вміння спостерігати, аналізувати, порівнювати, пояснювати, встановлювати причинно-наслідкові зв’язки і робити логічні висновки про хімічні явища;
виховні - виховувати партнерські взаємостосунки, формувати вміння надати допомогу однокласнику, сприяти формуванню комунікативної та інформаційної компетенції.
Тип уроку: урок засвоєння нових знань.
Форми роботи: фронтальна, індивідуальна.
Методи і прийоми: словесні (розповідь, бесіда), наочні (демонстраційний експеримент), практичні (виконання тренувальних вправ), комунікативні (бесіда за новим матеріалом), проблематизація, ситуація успіху, формування пізнавального інтересу.
Обладнання: комп’ютер, проектор, фліпчарт.
Дидактичні та методичні матеріали: ПСХЕ, мультимедійна презентація уроку, роздадковий матеріал для самостійної роботи (таблиця), картки, демонстраційні відео-експерименти, використання електронних ресурсів «Єдина колекція цифрових освітніх ресурсів».
Структура уроку
І. Організаційний етап (1 хв.)
ІІ. Актуалізація опорних знань (5 хв.)
ІІІ. Мотивація навчальної діяльності (2 хв.)
ІV. Вивчення нового матеріалу (22 хв.)
V. Закріплення набутих навичок (10 хв.)
VI. Підведення підсумків (3 хв.)
VII. Домашнє завдання (2 хв.)
Хід уроку
І. Організаційний етап
Добрий день! На минулому уроці ми з Вами вивчили тему «Молекулярні, електронні та структурні формули, фiзичні властивості ненасичених вуглеводнів».
II. Актуалізація опорних знань
Я пропоную вам виконати експрес – тестування для того, щоб ви згадали ключові поняття минулого уроку.
Експрес – тестування представлено на слайді № 1
- Першим членом гомологічного ряду алкенів є …
- Першим членом гомологічного ряду алкінів є …
- В молекулах алкенів між атомами Карбону присутній зв'язок (за кратністю) …
- В молекулах алкінів між атомами Карбону присутній зв'язок (за кратністю) …
- При термічному розкладі алканів утворюються речовини …
- Продукти горіння метану це - …
- Галогенування це процес - …
- Обов'язкова умова хлорування алканів це - …
- Міжнародна назва алкену, що містить два атома С…
- Для насичених вуглеводнів характерні реакції…
Виконаємо взаємоперевірку (відповіді представлені на слайді № 2)
Першу оцінку ви вже отримали, працюємо далі та заробляємо бали протягом уроку (на уроці працює система накопичення балів – картки трьох кольорів з кількостю балів три , два та один).
IІI. Мотивація навчальної діяльності
Властивості речовин визначаються будовою речовини. Пригадайте алкани (насичені в.в.). Який зв’язок між атомами С в молекулах алканів? (простий). Це були не дуже активні речовини.
Який зв’язок між атомами С у алкенів і алкінів? (подвійний і потрійний). Отже, як поява кратних зв’язків в будові речовини відображається на її хімічних властивостях?
Відповідь на це питання ми будемо знаходити під час уроку, тема якого «Хімічні властивості ненасичених вуглеводнів» (слайд 3 ).
Мета учнів(слайд 4):
- ознайомитися з основними хімічними властивостями ненасичених вуглеводнів:
- сформувати вміння складати рівняння реакцій, що характеризують хімічні властивості насичених вуглеводнів, називати галогенопохідні згідно до їх формул.
- визначити, яке практичне значення мають вивчені хімічні властивості.
IV. Вивчення нового матеріалу
Учні працюють в роздаткових таблицях (додаток)
Два учні виходять до дошки та пишуть структурні формули етену та етину.
Переходимо до вивчення хімічних властивостей алкенів (на прикладі етену) та алкінів (на прикладі етину).
- Реакції повного та часткого окиснення.
Для ненасичених вуглеводнів характерні реакції повного та часткого окиснення.
- Реакція повного окиснення, горіння етену (перегляд відео-демонстрації) (слайд 5)
Записуємо хімічне рівняння:
С2Н4 + 3О2 → 2СО2 + 2Н2О + Q
Зазначаємо характер полум’я (світне полум’я)
- Реакція повного окиснення , горіння етену (перегляд відео-демонстрації) (слайд 6)
Записуємо хімічне рівняння:
2С2Н2 + 5О2 → 4СО2 + 2Н2О + Q
Зазначаємо характер полум’я (кіптяве полум’я).
Проблемне питання: Чому алкани горить майже безбарвним полум’ям, алкени – світнім, а алкіни – кіптявим?
До дошки виходять за бажанням троє учнів, які визначають масову частку карбону в етані, етені та етині.
C2H6 W(C) = 2* Ar (C)/ Mr (C2H6) = 0,80 = 80%
C2H4 W(C) = 2* Ar (C)/ Mr (C2H4) = 0,86 = 86%
C2H2 W(C) = 2* Ar (C)/ Mr (C2H2) = 0,92 = 92% (слайд 7)
Чим більша масова частка Карбону, тим більш кіптявим буде полум’я. У етану масова частка Карбону найменша – Карбон швидко згорає (етан горить безбарвним полум’ям). У етану масова частка Карбону більша, тому перед тим як згоріти Карбон розжарюється (ми бачимо світне полум’я). У ацетилена масова частка Карбону найбільша, тому Карбон не весь згорає із-за нестачі кисню (ми бачимо кіптяве полум’я).
Переходимо до неповного окиснення
У разі окиснення алкенів розведеним розчином калій перманганату утворюються спирти. Реакція відбувається на холоді: (слайд 8)
КMnO4
С2Н4 + Н2О + О → CH2 – CH2
| |
OH OH
(перегляд відео-демонстрації) (слайд 9)
Що ми спостерігали під час рекції? (знебарвлення розчину калій перманганату.) Реакція є якісною на подвійний зв’язок (учні зазначають у таблиці).
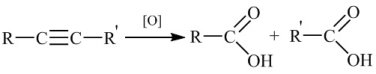
В жорстких умовах (нагрівання, концентрований розчин, кисле середовище) відбувається розщеплення алкіну по потрійному зв’язку з утворенням карбонових кислот.
Чи відбувається знебарвлення розчину калій перманганату? (перегляд відео-демонстрації). (слайд 10,11)
Так. Отже, знебарвлення калію перманганату є якісною реакцією на кратний зв'язок. (слайд 12)
- Реакції приєднання (слайд 13)
Для ненасичених вуглеводнів характерний тип хімічної реакції – приєднання.
На відміну від алканів етилен і його гомологи виявляють високу реакційну здатність, що зумовлено наявністю в їхніх молекулах подвійного зв'язку. Алкени здатні вступати в реакції приєднання за рахунок розриву π-зв'язку. Відмінність алкінів від алкенів полягає в тому, що реакції приєднання можуть протікати у дві стадії. На першій стадії йде приєднання до потрійного зв’язку утворенням подвійного зв’язку, а на другій стадії — приєднання за подвійним зв’язком. Реакції приєднання для алкінів протікають повільніше, ніж для алкенів.
- Приєднання водню ( гідрування, гідрогенізація) (слайд 14)
Реакцію приєднання атомів Гідрогену за рахунок розриву кратних зв'язків називають реакцією гідрування. І етен, і етин реагують із воднем при нагріванні в присутності нікелевого каталізатора.
У результаті гідрування ненасичених вуглеводнів утворюються насичені вуглеводні (розбираємо хімічні рівняння + даємо назви сполукам).
К
СН2 = СН2 + Н2 → СН3 – СН3
етен етан
К
СН ≡ СН + Н2 → СН2 = СН2
етин етен
К
СН ≡ СН + 2 Н2 → СН3 – СН3
етин етан
- Приєднання галогенів (галогенування) (слайд 15)
СН2 = СН2 + Br2 → СН2Br – СН2Br
- Практичне значення: розпізнування ненасичених вуглеводнів для отримання розчинників.
Галогени приєднуються до алкінів у дві стадії.
СН ≡ СН + Br2 → СН2 Br = СН2 Br
СН ≡ СН + 2Br2→ СНBr2 – СНBr2
(перегляд відео-демонстрації) (слайд 16,17)
Якісна реакція на кратний зв’язок. Бурий колір брому знебарвлюється. (слайд 18)
- Приєднання галогеноводнів (гідрогалогенування, гідроген галогенування) (учні записують в таблицю хімічні реакції та дають назви отриманим сполукам) (слайд 19)
СН2 = СН2 + НBr → СН3 – СН2Br
- Отримання хлоретану, який використовують для місцевої анестезії, для отримання розчинників, та обеззараження зерносховищ.
Правило Марковнікова: У результаті приєднання галогеноводнів до несиметричних алкенів Гідроген приєднується до найбільш гідрогенізованого атому Карбону.
CH3–CH=CH2 + HBr → CH3–CHBr–CH3
Галогеноводні приєднуються до потрійного зв’язку важче, ніж до подвійного. (слайд 20)
СН ≡ СН + НBr → СН2 = СНBr
СН2 = СНBr + НBr → СН3 - СНBr2
- Приєднання води (гідратація) (слайд 21)
Гідратація алкенів відбувається в присутності мінеральних кислот і підпорядковується правилу Марковнікова. Продуктами реакції є спирти
CH2=CH2 + H2O → CH3–CH2–OH
- Отримання етилового спирту, розчинників для виробництва каучука.
Приєднання води до алкінів каталізується солями ртуті (II): (слайд 22)
СН ≡ СН+ Н2О→ [H-C=C-H] →CH3-C-H
| | ||
H OH O
(вініловий (оцтовий
спирт) альдегід)
- Добування етилену і ацетилену.
При перегляді демонстрацій, Ви могли спостерігати за методами добування етилену та ацетилену. Нагадайте, що це були за реакції…
Так, етилен добували щляхом нагрівання етилового спирту із додаванням сульфатної кислоти, а ацетилен – з карбіду кальцію. Отже, запишимо ці реакції
- Етен добувають нагріванням етилового спирту з Н2SO4 конц – дегідратація
Н2SO4
С2Н5ОН → С2Н4 + Н2O
t
Етен - перший з виявлених газоподібних рослинних гормонів. Відома властивість етену прискорювати достигання багатьох городніх і садових плодів (помідорів, динь, груш, лимонів тощо). За допомогою цієї властивості можна транспортувати ще зеленими плоди, а потім доводити їх до стиглого стану уже на місці споживання, вводячи в повітря складських приміщень невеликі кількості етену. У комерційному зборі плодів і фруктів використовують спеціальні кімнати або камери для дозрівання плодів, в атмосферу яких етилен впорскується зі спеціальних каталітичних генераторів, що виробляють газоподібний етилен з рідкого етанолу.
- Етин добувають з кальцій карбіду
СаСО3 → СаО + СО2
СаО + 3С → СаС2 + СО
СаС2 + 2Н2О → С2Н2 + Са(ОН)2
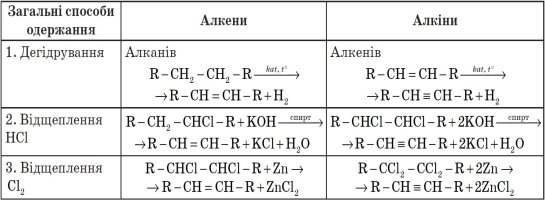
Також в таблиці у вас зазначено три загальних способи одержання алкенів та алкінів.
V. Закріплення набутих знань
(Фронтальна бесіда, виконання вправ і задач ).
- Порівняйте хімічну активність насичених вуглеводнів (алканів) і ненасичених вуглеводнів (алкенів і алкінів).
- Необхідно підібрати продукти реакції на окремих картках і прикріпити їх на фліпчаті до відповідних реагентів реакції, а також урівняти хімічні рівняння.
|
СО2 |
С2Н5Br |
С2Н6 |
С2Н4Cl2 |
Н2О |
С2Н4 + НBr =
С2Н4 + Н2 =
С2Н4 + Cl2 =
С2Н4 + О2 =
- Он-лайн завдання на встановлення хімічних властивостей
http://files.school-collection.edu.ru/dlrstore/2416fdd7-aae9-11db-abbd-0800200c9a66/x10_072.swf
- Вам дано дві речовини. Одна з них етен, а інша – етин. Запропонуйте, як можна розпізнати ці речовини.
VІ. Підведення підсумків роботи на уроці
Написання сенкана.
На вашу думку ви впоралися з поставленими завданнями? Що дізналися? Яке практичне значення мають набуті знання?
Оцінювання учнів.
Що необхідно зробити для повного засвоєння теми? (вивчити домашнє завдання)
VІI. Домашнє завдання
Вивчити § 22, опрацювати конспект.
- Середній рівень – підручник завдання 9 с.151
- Достатній рівень – написати рівняння хімічних реакції за наведеної схемою
C2H4 → C2H6 → C2H5OH
- Високий рівень – скласти схему хімічних перетворень та написати до неї рівняння хімічних реакцій .
Список використаних джерел:
- Підручник: Хімія : 9 : підруч. Для загальноосвіт. навч. закл. / О.Г. Буринська, Л.П. Величко. - К.: Ірпень : Перун, 2009. - 232 с
- Підручник для студентів вищих навчальних закладів І-II рівнів акредитації та учнів загальноосвітніх шкіл з класами поглибленого вивчення хімії / За ред. В.П. Черних. - Харьков: Вид-во НфаУ; Оригінал, 2004. - 464 с.
Додатки:
Хімічні властивості алкенів та алкінів (ненасичених вуглеводнів)
|
Алкени (етен (етилен)) |
|
Алкіни (етин (ацетилен)) |
|
Молекулярна формула:
|
І. Реакції окиснення |
Молекулярна формула: |
|
Структурна формула:
|
Горіння або повне окиснення |
Структурна формула: |
|
С2Н4 + 3О2 → 2СО2 + 2Н2О +Q Полум’я:
|
|
2С2Н2 + 5О2 → 4СО2 + 2Н2О +Q Полум’я: |
|
|
Часткове окиснення |
|
|
|
|
|
|
Якісна реакція на…
|
||
|
|
ІІ. Реакції приєднання |
|
|
СН2 = СН2 + Н2 → СН3 – СН3 __________ _____________
|
Приєднання водню ( гідрування)
|
СН ≡ СН + Н2 → СН2 = СН2
СН2 = СН2 + Н2 → СН3 – СН3
Сумарне рівняння: К СН ≡ СН + 2 Н2 → СН3 – СН3
|
|
|
Приєднання галогенів (галогенування) |
|
|
СН2 = СН2 + Br2 → СН2Br – СН2Br
|
Якісна реакція на…
|
СН ≡ СН + Br2 → СН Br = СН Br
СНBr = СНBr + Br2 → СНBr2 – СНBr2
Сумарне рівняння:
СН ≡ СН + 2Br2→ СНBr2 – СНBr2
|
|
|
Приєднання галогеноводнів |
|
|
Правило Морковникова:
|
||
|
СН2 = СН2 + НBr → СН3 – СН2Br
|
|
СН ≡ СН + НBr → СН2 = СНBr
СН2 = СНBr + НBr → СН3 – СНBr2
|
|
|
Приєднання води (гідратація) |
|
|
СН2 = СН2 + Н2О → СН3 – СН2ОН
|
|
СН ≡ СН+ Н2О→ [H-C=C-H] →CH3-C-H | | || H OH O (вініловий (оцтовий спирт) альдегід)
Реакція Кучерова Для інших алкінів утворюються кетони |
Добування етилену і ацетилену.
|
Алкени |
Алкіни |
|
Етен добувають нагріванням етилового спирту з Н2SO4 конц - дегідратація Н2SO4 С2Н5ОН → С2Н4 + Н2O t
|
Етин добувають з кальцій карбіду СаСО3 → СаО + СО2 СаО + 3С → СаС2 + СО СаС2 + 2Н2О → С2Н2 + Са(ОН)2
|
-
Цікавий урок виконаний за всіма критеріями та передовими педагогічними технологіями.


про публікацію авторської розробки
Додати розробку