Кейс урок «Поняття про лужні метали, інертні елементи, галогени»
Мета уроку: розширити знання учнів про хімічні елементи та їхні властивості на прикладі природних родин хімічних елементів (лужні метали, інертні елементи, галогени); розкрити залежність властивостей усередині груп лужних металів і галогенів від порядкового номера елемента.
Тип уроку: засвоєння нових знань та навичок.
Вид уроку: урок з використанням кейс-технології.
Обладнання та матеріали: кейс, правила роботи з кейсом, періодична система хімічних елементів Д. І. Менделєєва, таблиця розчинності, ряд активності металів; для демонстрації: кристалізатор, фільтрувальний папір, дистильована вода, ніж; розчини: фенолфталеїн, металевий натрій, кальцій, магній, запаяна ампула з бромом, ампула з кристалічним йодом.
Кейс урок «Поняття про лужні метали, інертні елементи, галогени»
Мета уроку: розширити знання учнів про хімічні елементи та їхні властивості на прикладі природних родин хімічних елементів (лужні метали, інертні елементи, галогени); розкрити залежність властивостей усередині груп лужних металів і галогенів від порядкового номера елемента.
Тип уроку: засвоєння нових знань та навичок.
Вид уроку: урок з використанням кейс-технології.
Обладнання та матеріали: кейс, правила роботи з кейсом, періодична система хімічних елементів Д. І. Менделєєва, таблиця розчинності, ряд активності металів; для демонстрації: кристалізатор, фільтрувальний папір, дистильована вода, ніж; розчини: фенолфталеїн, металевий натрій, кальцій, магній, запаяна ампула з бромом, ампула з кристалічним йодом.
Хід уроку
1. Підготовчий етап.
Конкретизація викладачем мети уроку.
- повторення основних питань пройдених тем.
Розглядаємо «Кросенси», малюнки, які підготували учні, і на дошці розділяємо їх на три групи: лужні метали, галогени, інертні елементи.
Зараз на дошці представлений один зі способів класифікації хімічних елементів за приналежністю до природних родин хімічних елементів. Наскільки схожі ці елементи за фізичними й хімічними властивостями всередині родини? Чим відрізняються один від одного? Який зв’язок існує між елементами різних груп? Спробуємо відповісти на ці питання на сьогоднішньому уроці.
2. Ознайомлювальний етап.
Ви вже знаєте, що за хімічною формулою можна визначити, з яких елементів складається речовина, скільки атомів кожного елемента міститься в молекулі. Хімічна формула дає змогу обчислити відносну молекулярну масу. А ще за хімічною формулою можна обчислити масову частку, яка припадає на кожний елемент у складі молекули речовини.
Тому сьогодні на уроці ми вивчимо, що таке масова частка елемента в речовині, і навчимось її обчислювати за формулою.
1. Лужні метали
— Назвіть хімічні елементи, що утворюють групу лужних металів.
Li, Na, К, Rb, Cs, Fr
Учні одержують для роботи таблицю із властивостями лужних металів.
— В якій групі періодичної системи вони розташовані?
Лужні метали — це хімічні елементи з різко вираженими металевими властивостями.
Кейс №1 Англійський хімік Г. Деві під час електролізу лугу КОН відкрив новий елемент, який він назвав потассіум, оскільки англійці називали КОН їдким поташем. Деві кинув калій у воду й очікував, що метал має негайно опуститися на дно. Але калій повівся інакше. З гучним шипінням цей метал забігав по поверхні води. Потім пролунав оглушливий вибух, і над потассіумом спалахнуло лілове полум’я. Так він і носився по воді, поки не перетворився на їдкий луг.
Запитання до кейсу:
- Як ви думаєте чому калій не тоне у воді?
- Визначте тип реакції?
- Наведіть приклади протилежних реакцій, які відбуваються в природі.
 Про цезій і рубідій, відкриті іншими вченими, писали, що це легкі сріблясті метали, які так само, як літій і калій, загорялися на повітрі, бігали по воді з полум’ям і тріском, навіть більш несамовито, ніж калій і натрій. Усі лужні метали зберігають під шаром гасу. Солі Рубідію і Цезію не відрізняються від звичайної кухонної солі. їдкий цезієвий луг та їдкий рубідієвий луг були слизькими на дотик і мильними, подібно до їдкого натру та їдкого калі.
Про цезій і рубідій, відкриті іншими вченими, писали, що це легкі сріблясті метали, які так само, як літій і калій, загорялися на повітрі, бігали по воді з полум’ям і тріском, навіть більш несамовито, ніж калій і натрій. Усі лужні метали зберігають під шаром гасу. Солі Рубідію і Цезію не відрізняються від звичайної кухонної солі. їдкий цезієвий луг та їдкий рубідієвий луг були слизькими на дотик і мильними, подібно до їдкого натру та їдкого калі.
Якою є типова валентність для всіх лужних металів?
Li, Na, К, Rb, Cs, Fr — валентність I.
Фізичні властивості: дуже м'які метали, легко ріжуться ножем, металевий блиск, гарна електро- й теплопровідність, незначна густина (легші за воду).
У ряді Li, Na, К, Rb, Cs, Fr tкип ° tплавл ° зменшуються (зі збільшенням атомної маси), густина збільшується, активність підвищується (щодо кисню й води).
Li, Na, К загоряються на повітрі лише за нагрівання, а метали з більшою атомною масою без нагрівання:
4Li + O2 ![]() 2Li2O
2Li2O
З водою літій реагує повільно, натрій значно швидше, а калій так швидко й виділяє стільки тепла, що водень, виділяючись, загоряється.
Демонстрація Взаємодія натрію, кальцію, магнію з водою
У перший підготовлений заздалегідь кристалізатор з дистильованою водою акуратно додаємо пінцетом маленький шматочок магнію. Що спостерігаємо? Видимих змін немає.
У другий кристалізатор кладемо шматочок кальцію. Що спостерігаємо? Шматочок кальцію повільно розчиняється у воді.
У третій кристалізатор — шматочок натрію. Що спостерігаємо? Натрій швидко розчиняється у воді та згоряє жовтуватим полум'ям.
Тепер у всі три кристалізатори додаємо по дві-три краплі фенолфталеїну. Про що свідчить зміну забарвлення розчину? Середовище в кристалізаторі лужне. Запишемо на дошці рівняння реакцій:
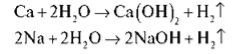
Кейс №2
 У Цюріху перед лекцією професора Вельта один зі студентів взяв із виставленої банки шматок калію і, ретельно загорнувши в носовичок, поклав до кишені. Під час лекцій калій почав реагувати з вологим повітрям. Студент неспокійно закрутився на лаві, потім раптом схопився на неї і стрімко вирвав кишеню, яка запалала, разом з її вмістом. У чому справа? – Вигукнув переляканий професор. У мене в кишені був шматочок калію, загорнутий в ганчірочку, відповів тремтячий від страху викрадач. Студенти почали голосно сміятись! Студент постраждав не тільки від глузувань, а й від опіків. Залишки кишені як застереження увійшли в хімічну колекцію кафедри і зберігалися в банці з написом: «Дія вкраденого калію на кишеню студентських брюк».
У Цюріху перед лекцією професора Вельта один зі студентів взяв із виставленої банки шматок калію і, ретельно загорнувши в носовичок, поклав до кишені. Під час лекцій калій почав реагувати з вологим повітрям. Студент неспокійно закрутився на лаві, потім раптом схопився на неї і стрімко вирвав кишеню, яка запалала, разом з її вмістом. У чому справа? – Вигукнув переляканий професор. У мене в кишені був шматочок калію, загорнутий в ганчірочку, відповів тремтячий від страху викрадач. Студенти почали голосно сміятись! Студент постраждав не тільки від глузувань, а й від опіків. Залишки кишені як застереження увійшли в хімічну колекцію кафедри і зберігалися в банці з написом: «Дія вкраденого калію на кишеню студентських брюк».
Запитання до кейсу:
- В чому мораль цієї історії?
- Чому студент отримав опіки?
- Визначте тип реакції?
2. Галогени
 Галогени — типові неметали, у періодичній системі розташовані в VII групі головної підгрупи. їх назва походить від слів галос — «сіль» і ген — «той, що народжує».
Галогени — типові неметали, у періодичній системі розташовані в VII групі головної підгрупи. їх назва походить від слів галос — «сіль» і ген — «той, що народжує».
Назвіть їх F, Cl, Br, I, At
Флуор — газ ясно-зеленого кольору, дуже отруйний. Багато вчених, які працюють із ним, постраждали від цього. Найбільш активний неметал (у флуорі навіть вода горить), реагує з воднем за значного охолодження в темряві.
Хлор — важкий газ зеленого кольору з різким запахом, отруйний, за звичайних умов реагує з воднем дуже повільно, а за температури або на світлі — з вибухом:
Н2 + Сl2 ![]() 2НСl
2НСl
Бром — важка темно-коричнева рідина, дуже активний неметал, але менш активний, ніж хлор. З воднем реагує виключно за нагрівання.
Іод — темно-фіолетові кристали, активний неметал, найменш активний у ряді галогенів, реакція з воднем навіть за нагрівання оборотна.
Флуор, Хлор, Бром, Іод — представники родини подібних за властивостями елементів, які називають галогенами. Типова валентність — І.
У ряді: F, Cl, Br, I, At t°С кип t°С плавл збільшуються, активність зменшується (найбільш активний — Флуор).
Запишемо кілька рівнянь, що характеризують хімічні властивості галогенів.
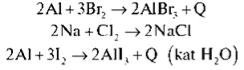
Кейс №3
 Йод відкрив 1811 року французький хімік- аптекар Б. Куртуа, якому допомогла кішка. У хімічній лабораторії вона перекинула склянку із сульфатною кислотою на попіл з морських водоростей. Відразу з'явилася хмаринка фіолетового кольору парів невідомої речовини. Нагріваючи матковий розсол попелу з концентрованою сірчаною кислотою, хімік спостерігав виділення фіолетової пари, яка конденсувався у вигляді темних блискучих пластинчастих кристалів. Найбільші концентрації йода в нафтових водах (3-10-3%) і морській воді (0,06 мг/мл). Власне мінералів що містять йод мало.
Йод відкрив 1811 року французький хімік- аптекар Б. Куртуа, якому допомогла кішка. У хімічній лабораторії вона перекинула склянку із сульфатною кислотою на попіл з морських водоростей. Відразу з'явилася хмаринка фіолетового кольору парів невідомої речовини. Нагріваючи матковий розсол попелу з концентрованою сірчаною кислотою, хімік спостерігав виділення фіолетової пари, яка конденсувався у вигляді темних блискучих пластинчастих кристалів. Найбільші концентрації йода в нафтових водах (3-10-3%) і морській воді (0,06 мг/мл). Власне мінералів що містять йод мало.
Запитання:
- Поясніть процес, що відбувався у лабораторії аптекаря.
- Назвіть медичні препарати, які містять йод.
- До чого призводить нестача йоду в організмі людини.
- У чому полягає профілактика йододефіциту.
- Назвіть продукти харчування багаті на йод.
- Запропонуйте спосіб визначення йоду у продуктах харчування або медичних препаратах.
- Назвіть галузі застосування йоду.
Застосування та значення
Незважаючи на те що всі галогени мають подібні хімічні властивості, застосовуються вони в абсолютно різних сферах.
Фтор дуже корисний для зубів, саме тому його додають в зубні пасти. Застосування лікувальних і профілактичних засобів, у складі яких присутній хімічний елемент фтор, запобігає появі карієсу.
Хлор використовують для отримання соляної кислоти, яка незамінна в промисловості та медицині. Хлор використовують для виготовлення каучуку, пластмаси, розчинників, барвників, а також синтетичних волокон. Сполуки, в яких міститься цей елемент, використовують у сільському господарстві для боротьби з шкідниками. Хлор незамінний для відбілювання паперу і тканин. Вважається, що застосування хлору для обробки питної води небезпечно. Бром, а також йод часто використовують у медицині.
Якщо уявити існування людства без галоїдів, то ми були б позбавлені таких речей, як фотографії, антисептичні та дезінфікуючі засоби, каучук, пластик, лінолеум і багатьох інших. Крім цього, ці речовини необхідні організму людини, щоб нормально функціонувати, тобто відіграють важливу біологічну роль. Хоч властивості галогенів і схожі, їх роль у промисловості і медицині різна.
3. Інертні елементи
Інертні елементи — це елементи головної підгрупи VIII групи періодичної системи. Назвіть їх.
Не, Ne, Аr, Кr, Хе, Rn
Елементи VІІІ А підгрупи: Гелій 2Не, Неон 10Nе, Аргон 18Аr, Криптон 36Кr, Ксенон 54Хе та Радон 86Rn – називають інертними (або благородними) газами. Електронна конфігурація першого представника групи – Гелію – 1s2. Атоми інших інертних газів на зовнішньому рівні мають вісім валентних електронів, що відповідає стійкій електронній конфігурації.
Повністю завершена конфігурація зовнішнього електронного шару (у випадку Неону та Гелію) чи наявність октету електронів зумовлює високі значення енергій іонізації атомів інертних газів та, як наслідок, їхню дуже невисоку хімічну активність.
Хімічні сполуки Не та Ne не відомі, тому їх називають інертними, у той час як Кr і Хе утворюють хімічні сполуки. Аr, Кr і Хе утворюють також клатрати.
Гелій – другий (після Гідрогену) елемент за розповсюдженістю у Всесвіті, тоді як маса "земного" Гелію складає лише одну мільйонну маси земної кори. На Сонці значна кількість ядер Гелію утворюється під час ядерних перетворень водню, тому вміст цього елементу у Всесвіті поступово збільшується. Гелій утворюється також при α-розпаді радіонуклідів. Він заповнює пустоти у радіоактивних гірських породах та мінералах, а звідти потрапляє в атмосферу. У вигляді домішок гелій супроводжує метан. Основним джерелом гелію є природний газ.
Всі інертні гази, головним чином – аргон, містяться у повітрі, що є джерелом їхнього промислового одержання. Радон – радіоактивний елемент.
Всі інертні гази не мають кольору, смаку, запаху, мають низькі температури плавлення та кипіння. Їхні молекули одноатомні та взаємодіють одна з одною лише за рахунок слабких лондоновських сил, що зростають із збільшенням атомного радіуса. У цьому ж ряду зростає також і розчинність у воді. Так, якщо гелій – один з найменш розчинних у воді газів, то розчинність радону за цих же умов у декілька разів вище, ніж розчинність кисню (230 мл/л при 200С). Гелій має найнижчу температуру кипіння з усіх відомих елементів (-2690С). Він у 7,25 рази легший, ніж повітря.
Інертні гази добувають фракційною дистиляцією рідкого повітря, ретельно очищеного від мікрочастинок пилу, вуглекислого газу та водяної пари.
Істинні хімічні сполуки отримані лише для криптону, ксенону та радону. Краще за інші досліджена хімія ксенону, тому що сполуки криптону дуже нестійкі, а радон є радіоактивним.
З кожним роком розширюється сфера застосування інертних газів. Легкість і негорючість гелію використовують для заповнення ним повітряних куль і дирижаблів. В інертному середовищі аргону здійснюють електрозварювання металів, що легко окислюються. Неоном, аргоном, криптоном і ксеноном заповнюють електричні лампочки. Суміш гелію з киснем застосовують для дихання під час підводних робіт. Якщо крізь розріджені інертні гази пропускати електричний струм, то вони випромінюють світло різного забарвлення. Наприклад, аргон дає синє світіння, неон — червоне, тому їх використовують для світлових реклам і в маяках.
Кейс №4
У 1868 році француз Жансе й англієць Лок'єр під час вивчення сонячних протуберанців відкрили спектр нового хімічного елемента, що не належав жодному з відомих на земній кулі. «Небесний» елемент назвали Гелієм. Через 25 років Релей виявив у звичайному повітрі домішок, який не вступав у хімічні реакції. Цей елемент назвали Аргон («ледачий»).
Незабаром Гелій був виявлений у мінералах, що містять Уран і Торій. Гелій виявився найлегшим після водню газом.
У 1897 році англієць Рамзай передбачив існування ще однієї газоподібної речовини, що мала перебувати між Гелієм і Аргоном. Це виявився відкритий у 1898 році Неон. А потім у короткий строк Рамзай та його співробітник Траверс виявили в земній атмосфері ще два елементи — Криптон («таємний») і Ксенон («прихований»).
До складу повітря, крім кисню й азоту, входять ще п'ять газоподібних простих речовин: гелій Не, неон Ne, аргон Аr, криптон Кr, ксенон Хе. Тривалий час не вдавалося одержати сполуки цих елементів їх назвали інертними газами.
Запитання до кейсу:
- Чому Аргон називали «ледачим» газом?
- Поясніть питання «інертний»?
- Наведіть сфери застосування інертних газів?
- Для чого повітряні кульки надувають «Гелієм»
IV. Підбиття підсумків уроку
Що нового ви дізналися сьогодні на уроці?
Які природні родини хімічних елементів ви вивчили?
Чим відрізняються ці три родини?
Учитель узагальнює відповіді учнів, відзначає, що така класифікація хімічних елементів не є універсальною. Спроби класифікації хімічних елементів тривали багато років аж до відкриття періодичної системи хімічних елементів Д. І. Менделєєвим у 1869 році.
V. Домашнє завдання
Під керівництвом учителя підготувати повідомлення з теми.
Наступний урок ми проведемо у формі семінару. Для цього сьогодні об’єднаємося у п’ять груп, кожна з яких підготує до семінару інформацію за однією з тем:
1) «Правило тріад» німецького хіміка Й. В. Деберейнера.
2) «Гвинтовий графік» французького геолога О. Е. Шанкуртуа.
3) «Хвильовий графік» німецького хіміка Ю. Л. Мейєра.
4) Класифікація елементів американського хіміка Дж. Ньюлендса.
5) Періодична система хімічних елементів Д. І. Менделєєва.
Довідкова інформація з теми
https://historyurok.com.ua/tsikavi-fakty/nauka/luzhni-metali.html


про публікацію авторської розробки
Додати розробку
