Урок "Кількість речовини. Моль – одиниця кількості речовини. Стала Авогадро."
Розробка уроку для 8 класу
Тема: Кількість речовини. Моль – одиниця кількості речовини. Стала Авогадро.
Мета:
- формування ключових компетентностей:
- -комунікативна, математична грамотність, вміння вчитись впродовж життя;
- формування предметних компетентностей:
- -ознайомити з поняттями «кількість речовини», «моль», «число Авогадро»;
- -сформувати вміння здійснювати розрахунки з використанням зазначених понять;
- -розвивати хімічну мову, виховувати інтерес до хімії;
- -сприяти розвитку вміння використовувати теоретичні знання для розв'язання завдань практичного характеру.
Урок 26 Дата проведення: 4.12
Тема: Кількість речовини. Моль – одиниця кількості речовини. Стала Авогадро.
Мета:
- формування ключових компетентностей:
- комунікативна, математична грамотність, вміння вчитись впродовж життя;
- формування предметних компетентностей:
- ознайомити з поняттями «кількість речовини», «моль», «число Авогадро»;
- сформувати вміння здійснювати розрахунки з використанням зазначених понять;
- розвивати хімічну мову, виховувати інтерес до хімії;
- сприяти розвитку вміння використовувати теоретичні знання для розв’язання завдань практичного характеру.
Тип уроку: вивчення нового матеріалу.
Форми роботи: розповідь, бесіда, розв’язування задач.
Основні поняття та терміни: моль, число Авогадро, кількість речовини.
Хід уроку
І. Організаційний етап.
ІІ. Актуалізація опорних знань та мотивація навчально-пізнавальної діяльності.
Фронтальна бесіда:
1. Що називають молекулою?
2. Що таке атом? Чим він відрізняється від йона?
3. Про що говорить закон збереження маси?
Для хіміків є дуже важливим знати число структурних частинок (атомів, молекул та йонів), які є в кожній порції речовини, оскільки саме вони вступають у хімічну взаємодію. Ось чому перед нами постало сьогодні дуже важливе завдання: навчитись не лише вимірювати речовину в об’ємі чи масі, а й рахувати число таких маленьких і не помітних для людського ока частинок як атоми, молекули чи йони.
Оголошення теми та мети уроку.
III. Вивчення нового матеріалу.
Світ, що нас оточує, складається з великої кількості «цеглинок» - атомів та молекул, розміри та маса яких дуже мала. В побуті ми зазвичай підраховуємо певні об’єкти порціями: взуття – парами, цеглу – тисячами штук, апельсини – ящиками Подібну мірку придумали вчені і для атомів.
Для цього взяли таку масу речовини у грамах, скільки одиниць становить її відносна молекулярна маса. Назвали цю порцію «моль». Неважко здогадатись, що у одному молі будь-якої речовини буде міститись однакове число молекул. Це число називається сталою Авогадро на честь Амадео Авогадро, який першим запропонував простий спосіб рахувати молекули. Це число дуже велике: 6,02×1023 , позначається Na.
Маса речовини, яку взято за в кількості 1 моль, називається молярною масою.
У Міжнародній системі одиниць пропонується таке визначення кількості речовини: фізична величина, що характеризує число структурних елементів у даній системі.Позначається кількість речовини літерою ν.
За 1 моль прийнято таку кількість речовини, в якій міститься стільки ж атомів (молекул), скільки атомів містить нуклід Карбону масою 0,012 кг.
Взаємозв'язок між кількістю речовини та сталою Авогадро виражається формулою:
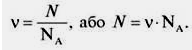
IV. Розв'язування задач.
1. Яке число молекул міститься у воді кількістю речовини 0,25 моль?
2. Скільки атомів та молекул міститься у кисні кількістю речовини 3 моль?
3. Яка кількість речовини, в якій міститься 18×1023 атомів Феруму?
Заповніть таблицю:
|
Назва речовини |
Формула речовини |
Кількість речовини |
Кількість структурних одиниць |
|
Озон |
|
0,5 моль |
|
|
Купрум (ІІ) оксид |
|
|
12×1023 |
|
Нітроген (IV) оксид |
|
0,8 моль |
|
|
Карбон (IV) оксид |
|
2,5 моль |
|
|
Вода |
|
|
24×1023 |
V. Підведення підсумків уроку.
VІ. Надання та пояснення домашнього завдання.
Опрацювати §18, виконати завдання 3 (ст. 104).

про публікацію авторської розробки
Додати розробку
