Кислоти: класифікація, властивості, застосування
мета уроку: удосконалювати знання учнів про склад кислот, систематизувати матеріал про назву, класифікацію та значення у житті людини; ознайомити з окремими представниками, правилами роботи з кислотами; розвивати навички учнів у проведенні хімічного експерименту, логічне мислення та пам'ять; виховувати свідоме ставлення до вивчення хімії.
1
Тема: Кислоти: класифікація, властивості, застосування.
Мета: удосконалювати знання учнів про склад кислот, систематизувати матеріал про назву, класифікацію та значення у житті людини; ознайомити з окремими представниками, правилами роботи з кислотами; розвивати навички учнів у проведенні хімічного експерименту, логічне мислення та пам’ять; виховувати свідоме ставлення до вивчення хімії.
Обладнання: Періодична система Д.І.Менделєєва, тексти завдань, фенолфталеїн, універсальний папірець, метилоранж, вода, хлоридна кислота, штатив з пробірками.
Тип уроку: узагальнення та систематизація знань.
Форма проведення: урок – подорож.
Хід уроку
І. Організація класу (слайд 1)
ІІ. Мотивація навчальної діяльності ( слайд 2)
Сьогодні ми відправимося в подорож «По країні кислот», щоб більше дізнатися про кислоти – незвичайні речовини. Девізом нашої подорожі будуть слова Гете «Просто знати – ще не все, знання потрібно вміти використовувати». А найчастіше мандрівники в своїх подорожах вели щоденники, то ж теж повинні вести щоденник спостережень, роль якого буде виконувати наша технологічна картка і зошит для практичних робіт. Отже, метою нашого уроку буде ( слайд 3) Ви повинні будете показати , як умієте використовувати свої знання в різних ситуаціях. Під час подорожі ми зробимо зупинки на станціях. ( слайд 4). Але щоб рушити ми повинні переконатися, а маємо ми знання необхідні для подорожі в цієї країні? Отож перевіримо.
Фронтальна бесіда
- Що таке кислоти? ( слайд 5) З чого вони складаються?
- Скільки атомів Гідрогену може бути у складі кислот?( слайд 6)
- Що таке кислотний залишок?
- В якій спосіб можна визначити валентність кислотного залишку?
- Назвіть відомі вам кислоти.
- За якими ознаками класифікують кислоти?
Доповніть схему В виданій вам ТК. Перевіримо ( слайд 7).
ІІІ. Вивчення нового матеріалу
Отже, ви добре підготувалися до подорожі, правильно відповіли на запитання, можна вирушати в дорогу. ( слайд 8) «Червоне око дивиться в упор – це суворий світлофор»
Перша зупинка «Інформаційна». Поїзд рушиться з місця, якщо ми довідаємось про історичні відомостями про кислоти, а також області їх використання.
( учні роблять повідомлення і обмінюються історичними відомостями про кислоти а також характеризують області їх використання
Повідомлення учня :ОЦТОВА КИСЛОТА ( слайд 9)
Показує табличку з формулою кислоти і розповідає про неї.
Відома з найдавніших часів, так як утворюється при скисанні вин (винний оцет). Її здатність розчиняти перли і вапняк послужила основою легенди про те, що
А. Македонський під час своїх походів усував скелі зі шляху військ, руйнуючи їх оцтом. У чистому вигляді була виділена в 1700р. Оцтова кислота широко використовується в промисловості: для виготовлення синтетичного (ацетатного) волокна, для виробництва гербіцидів( засоби захисту рослин), синтезу запашних речовин, в шкіряної та текстильної промисловості.
"З усіх кислот вона звичайно, прима!
Присутня скрізь і зримо і не зримо.
І у тварин, в рослинах є вона.
Назавжди техніка і медицина з нею!
Її потомство "ацетати" – потрібні всюди,
всім відомий "аспірин" – при хворобі
жар знижає і здоров'я повертає! "
Повідомлення учня СУЛЬФАТНА КИСЛОТА ( слайд 10)
Показує табличку з формулою кислоти і розповідає про неї.
Алхімікам вдалося отримати сірчану кислоту ще в X столітті при прожарюванні деяких сульфатів (купоросів). Звідси походить її історична назва - купоросна олія.
H2SO4 - найважливіший продукт хімічної промисловості. Використовується для отримання фосфорних і азотних добрив, для виробництва штучних волокон, миючих засобів, вибухових речовин, лікарських препаратів. Використовується в акумуляторах, для очищення нафтопродуктів.
Тому говорять: "Хліб промисловості - сірчана кислота", тому що жодне хімічне виробництво ні обходиться без неї.
Повідомлення учня ХЛОРИДНА КИСЛОТА ( слайд 11 - 12)
Показує табличку з формулою кислоти і розповідає про неї.
Вона є складовою частиною шлункового соку; розведену соляну кислоту раніше призначали всередину головним чином при захворюваннях, пов'язаних з недостатньою кислотністю шлункового соку.
У харчовій промисловості зареєстрована як регулятор кислотності, харчова добавка E507. Застосовується для виготовлення зельтерською (содової) води.
Застосовують для очищення поверхні металів при паянні і лудінні, для отримання хлоридів різних металів.
У суміші з поверхнево активними речовинами використовується для очищення керамічних і металічних виробів від забруднень і дезінфекції.
Чтоб охотней покупали, чтобы был приятный вид,
Все изделия из стали лучше никелем покрыть.
Удалим оксидов слой мы хлоридной кислотой,
А потом в особой ванне гальванируем металлы.
Или если раковина ржавчиной покрыта,
НЕ поможет даже «Мистер Мускул» знаменитый.
Лишь хлоридная кислота помогает нам всегда.
Повідомлення учня НІТРАТНА КИСЛОТА ( слайд 13)
Показує табличку з формулою кислоти і розповідає про неї.
HNO3 - була згадана в VIII столітті арабським хіміком Джабір Ібн Хайянь в його працях, а для виробничих цілей її почали отримувати в XV столітті.
Для вибухових речовин потрібна вона, для барвників, лаків, ліків йде найважливіша з кислот. Фотоплівка, целулоїд, полімери, добрива - ось нітратної кислоти застосування.
Отже ми прослухали повідомлення про кислоти. Але ми знаємо ще багато кислот, наприклад молочна, що використовується в харчовій промисловості для виробництва кисломолочних продуктів, мурашину кислоту, ін’єкцію якої ми отримуємо, коли нас кусає мурашка ( звідси й назва), а також коли, потрапляємо в зарості кропиви карбонатна кислота, яку ми споживаємо в літку, коли нас мучить спрага . Можна перелічити дуже багато кислот.
Будова речовини - обумовлює її властивості, саме це слід нам з’ясувати на наступній зупинці « Дегустаційна» ( слайд 14)
Станція дегустаційна.
Який смак має лимон, щавель, аскорбінка? Діти повинні переконатися, що більшість кислот кислі на смак . Рослинний та тваринний світ багатий на кислоти, які належать до органічних кислот. Лимонна, яблучна, щавлева кислоти містяться у деяких фруктах, ягодах, овочах, мурашина кислота – в мурахах, бджолиній отруті, кропиві. Коли скисає молоко і соки утворюються відповідні молочна та оцтова кислоти. Молочна також у квашеній капусті, силосі для худоби, вона накопичується у м’язах під час їх роботи. Шлунковий сік містить хлоридну кислоту.
В зв’язку з тим, що властивості залежать від будови, то спільні властивості, зокрема кислий смак кислот можна пояснити наявністю в них атомів Гідрогену. Висновок записуємо в ТК.
Висновок: загальне в складі ( атоми Гідрогену) і будові кислот зумовлює їх загальні властивості.
Наш поїзд рушає далі, але на світлофорі з’являється червоне світло, і попереджає про те, що наступна зупинка – «ПТБ». ( слайд 15)
Станція «ПТБ» ( слайд 16)
Кислоти, з якими ми знайомимося і будемо працювати належать до неорганічних кислот. Тому : Пам’ятайте, що коштувати речовини на смак в кабінеті хімії – це грубе порушення техніки безпеки. ( на дошці знак техніки безпеки – «Нічого не можна коштувати на смак».
Розповідь учня про правила техніки безпеки, яких необхідно дотримуватись під час роботи з кислотами.
Повідає і показує учень.
Під час роботи з кислотами потрібно дотримуватись деяких правил з техніки безпеки:
1.Необхідно наливати в пробірку кількість кислоти, що вказана в інструкції.
2.Заповнювати пробірку можна лише на 1/3 об’єму.
3.Струшувати речовину слід, злегка похитуючи пробіркою,
при цьому не закривати її отвір пальцем.
4. При розведенні концентрованої сульфатної кислоти виділяється велика кількість теплоти. Тому змішувати концентровану кислоту з водою слід з великою обережністю: треба вливати кислоту у воду, а не навпаки. Якщо вливати воду в сульфатну кислоту, то частина води за рахунок виділення теплоти може нагрітися до кипіння. Кислота почне розбризкується і може потрапити на шкіру, в очі.
5. Концентрована сірчана кислота викликає опіки. Тому якщо кислота потратила на шкіру або тканину необхідно її струхнути, змити великою кількістю води, а потім розчином питної соди та знов змити водою.
Поїзд відправляється далі – прямує до станції «Експериментальна»
Станція Експериментальна
На цієї станції ми повинні виконати лабораторну роботу « Дія індикаторів на кислоти»
Повідомлення учня . ( слайд 17)
Індикатори (від англійського indicate-вказувати) - це речовини, які змінюють свій колір в кислотах. Це дуже зручно, бо ми не можемо коштувати на смак речовини, а як же нам переконатися , що досліджуємо речовина належить до кислот?
Для цього і використовуються індикатори. До речи індикатори – це випадкове відкриття в хімії і як воно було зроблено розповість учень.
Вперше індикатори виявив в 17 столітті англійський хімік і фізик Роберт Бойль.
Щоб зрозуміти, як влаштований світ, Бойль провів тисячі дослідів. Ось один із них. У лабораторії горіли свічки, в ретортах щось кипіло, коли недоречно зайшов садівник. Він приніс кошик з фіалками. Бойль дуже любив квіти, але треба було почати дослід. Він взяв кілька квіток, понюхав і поклав їх на стіл. Дослід почався, відкрили колбу, з неї повалив їдкий пар. Коли ж дослід скінчився, Бойль випадково глянув на квіти, вони диміли. Щоб врятувати квіти, він опустив їх у склянку з водою. І - що за дива-фіалки, їх темно-фіолетові пелюстки, стали червоними. Випадковий досвід? Випадкова знахідка? Роберт Бойль не був би справжнім вченим, якби пройшов повз такого випадку. Вчений велів готувати помічникові розчини, які потім переливали у склянки і в кожен опустили по квітці. У деяких стаканах квіти негайно почали червоніти. Нарешті, учений зрозумів, що колір фіалок залежить від того, який розчин знаходиться в склянці, які речовини містяться в розчині. Потім Бойль зацікавився, що покажуть не фіалки, а інші рослини. Кращі результати дали досліди з лакмусовим лишайником. Тоді Бойль опустив в настій лакмусового лишайнику звичайні паперові смужки. Дочекався, коли вони просочяться настоєм, а потім висушив їх. Ці хитрі папірці Роберт Бойль назвав індикаторами, що в перекладі з латинської означає «покажчик», так як вони вказують на середу розчину.
В даний час на практиці широко застосовують такі індикатори: лакмус, фенолфталеїн, метиловий оранжевий.

Перевіримо результати ваших досліджень ( слайд 18)
Але поряд із загальними властивостями кислот – смаком, кислоти відрізняються одна від одної низкою ознак, з якими ми будемо поступово знайомитися в шкільному курсі хімії.
IV. Закріплення набутих знань.
Наша подорож завершується. Додому приведуть нас ці «хімічні доріжки».
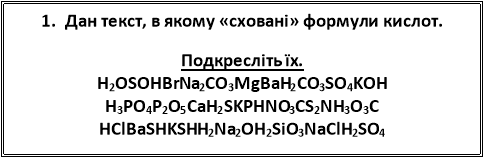
А зараз, ще раз повторимо склад кислот. ( слайд 19).
V. Підбиття підсумків
- Що нового дізналися на уроці?
- Чого навчилися? А спробуємо відповісти на слідуючи запитання: ( слайд 20)
VI. Домашнє завдання (слайд 21) § 15, стор 71-72, повторити § 8, дописати формули кислот и кислотних залишків в таблицю ТК
Вивчити всі формули кислот та ї назви
Додаткове завдання: в ТК пояснення, як виконати на слайді 22


про публікацію авторської розробки
Додати розробку
