Классификация химических реакций по разным признакам. Реакции соединения, разложения, замещения, обмена. Обратимые и необратимые реакции.
Урок №
|
Тема:
Цели урока:
Тип урока:
Формы работы:
Оборудование:
Прогнозируемые результаты: |
Классификация химических реакций по разным признакам. Реакции соединения, разложения, замещения, обмена. Обратимые и необратимые реакции.
Обобщение и систематизация знаний учащихся о химических реакциях; ознакомить с классификацией реакций на обратимые и необратимые; Развивать навыки и умения определения типов химических реакций по уравнениям и составления химических уравнений; Формировать знания учащихся о химических уравнениях на примерах классификации уравнений реакции по тепловому эффекту, наличии катализатора, изменения степени окисления атомов в процессе химической реакции; Воспитывать любовь к природе и глубокое понимание процессов, происходящих в ней, посредством применения химических знаний, знаний географии и геологии.
Комбинированный урок усвоения знаний и навыков и творческое применение их на практике.
Рассказ учителя, фронтальный опрос, работа с книгой и справочником, работа в группах, работа в парах, демонстрационный эксперимент, самостоятельная работа.
ПСХЕ Д. И. Менделеева, таблица растворимости, ряд активности металлов, правила техники безопасности, индивидуальные справочники, раздаточный материал, химическое оборудование и реактивы.
Учащиеся умеют определять типы химических реакций по уравнениям и составлять химические уравнения; ориентируются в видах и способах классификации химических реакций. |
Ход урока
- Организационный момент.
- Слово учителя. Добрый день, ребята. Прошу занять свои места. Прежде всего, хочу представиться… Ваши имена я прочту на бейджиках.
Надеюсь, сегодняшний наш урок будет взаимно интересным, познавательным и плодотворным.
- Обратите внимание на папочки, лежащие на ваших партах. Там содержится справочная информация по теме нашего урока. Ознакомьтесь с ними.
- Есть ли дежурные в классе? Напишите, пожалуйста на листочке фамилии отсутствующих.
- Домашнее задание. Ваше домашнее задание пригодится нам при изучении новой темы.
(беглая проверка домашнего задания)
- Слово учителя. На мониторе вы видите яркие картинки, которые сейчас вам вряд ли о чем-то говорят. К концу урока вы поймете их назначение. Могу сказать лишь, что каждая говорит о каком-то химическом чуде природы.
И так, сегодня мы начинаем изучение достаточно обширной темы «Химические реакции».
Сегодня нелегкая будет задача.
Пусть нам сопутствует с вами удача!
Теперь открыли тетради и записали число, классная работа, тема …
- Цели урока. Ребята, исходя из темы урока, какие вы перед собой ставите цели и задачи? Чего вы ждете от сегодняшнего урока?
- Хорошо. Будем вместе идти к намеченной вами цели.
- Перед вами лежат оценочные карточки, которые предлагаю вам заполнять на протяжении урока. Там проставляется балл за каждое задание. Если вы не принимали участие в каком-то виде деятельности, то ставите 0. Но вначале, подчеркните смайлик, который соответствует вашему настроению.
- Актуализация опорных знаний. Мотивация учебной деятельности.
- Слово учителя. А теперь давайте задумаемся, какие знания по данной теме мы уже имеем?
Для того, чтобы это выяснить, я предлагаю небольшую «Зарядку для ума»
Сколько чудес дарит химия нам!
О самых простых я загадки задам.
Ответы ищите в домашнем быту.
Природы откроют они красоту.
А если с ответом вам туго придется,
В справочничке подсказка найдется.
(на последних страницах справочничка находятся подсказки. Можете сразу с ними ознакомиться. От вас требуется написать схемы реакций и определить их тип.)
- Вода попала на кусок и превратилась в кипяток.
/щелочной металл + вода/
- Кислота тепла боится, быстро в воду превратится.
/карбонатная Н₂СО₃, сульфитная Н₂SО₃/
- Порознь каждый ядовит, вместе будет аппетит.
/натрий, хлор, поваренная соль-натрий хлорид/
- Расскажите, в чем тут дело: гасили то, что не горело?
/гашение извести СаО водой/
- Основание +кислот = соль и вода
/реакция нейтрализации/
- Ну что же, неплохо загадки решили.
Теперь подытожим все, что повторили.
Знания ваши проверим скорей!
Работаем устно. Ну же, смелей!
«Блиц-опрос»
- Реакция, в которой из двух простых веществ образуется только одно сложное, называется… /реакцией соединения/
- Реакция, в которой из одного сложного образуется несколько более простых, называется… /реакцией разложения/
- В реакцию вступает одно простое и одно сложное вещество… /реакция замещения/
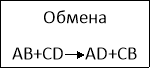
- Реакция между двумя сложными веществами называется… /реакцией обмена/
- Молодцы. Теперь, опираясь на уже имеющиеся знания, мы сейчас должны усовершенствовать, расширить, скорректировать и, по возможности, дополнить новыми сведениями.
- Изучение нового материала.
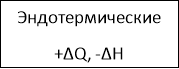
- Слово учителя. Превращение одних веществ в другие постоянно происходит в природе, радуя и удивляя нас все новыми чудесами. Эти превращения и есть химические реакции. Они могут протекать медленно и мгновенно, в обычных условиях или при нагревании, с добавлением катализатора или без него. Они могут сопровождаться различными внешними эффектами – образованием осадка или газа, изменением цвета, выделением теплоты и т.д. Чтобы установить порядок во множестве химических реакций, ученые классифицировали их по определенным признакам и особенностям.
Одни вещества превращая в другие,
Реакции делим на классы такие:
Классификация химических реакций.
![]()
![]()
![]()
![]()
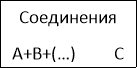
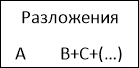
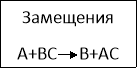
![]()
![]()
![]()

![]()
![]()
![]()
![]()
![]()
![]()
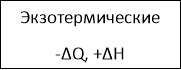
![]()
![]()
![]()
![]()
Работа с учебником в группах.
- Слово учителя . А сейчас у вас будет элемент самообразования. Разобьемся на четыре группы. Теперь откроем учебники на странице 71-75 ,§11. И первая группа нам подготовит сообщение по реакциям соединения, вторая – по реакциям разложения, третья – по реакциям замещения, четвертая – по реакциям обмена. По одному представителю от группы, после доклада команды, продемонстрируют нам предложенный на карточках опыт и подтвердят его написанием уравнения реакции. На подготовку отводится 2 минуты.
Заслушиваются ответы каждой группы – 1 чел.,
демонстрация опыта – 1 чел., написать реакцию – 1 чел.
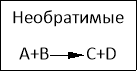
- Слово учителя . Молодцы! Отлично справились. Но у меня возник вопрос: какая реакция запросто может пойти в обратную сторону?
/ответ учащихся/
Что же получается? Реакции первой, третьей и четвертой групп протекают только в одном направлении и их продукты ни при каких температуре и давлении не смогут взаимодействовать с образованием веществ, которые были реагентами. Такие реакции будут называться необратимыми.
А как же будет называться реакция разложения карбонатной кислоты?
Ответ вы сможете сыскать
На странице 75!
/ответ учащихся/
Вы термины новые нынче узнали,
Правила с книги в тетрадь записали.
А прямой и обратной что называем –
На семьдесят шестой странице читаем.
Так какие классификации реакций мы сегодня выучили на уроке?
- Закрепление.
Теперь наши знания мы закрепим
И упражнения быстро решим.
- Сейчас каждый самостоятельно решит упражнение № 107, на странице77. Ответ можно оформить в тестовом виде.
/комментарии с места, самопроверка/
- Змейкой дорога чудес наших вьется
Работать командами снова придется.
Игра «Цепочка»
Игра на скорость: какая команда быстрее и правильнее уравняет предложенные реакции и определит их тип по изученным классификациям.
|
I команда
|
II команда
|
|
III команда
|
IV команда
|
- Теперь разобьемся с вами по парам.
Время не будем расходовать даром.
Знания чтобы сейчас закрепить,
Нужно природы задачки решить.
На каждой парте в конце справочничков находится персональное задание по одному из химических чудес природы, изображенных на доске. На подготовку отводится не более 3-х минут.
Каждый участник пары постарается написать свои реакции, а после – сделаете взаимопроверку.
- Решим напоследок задачку сейчас,
Времени мало осталось у нас.
Сколько воды нужно в известь долить,
Килограмм негашеной чтоб погасить?
- Итог урока
Время уходит… зовет нас с собой.
Дневник поскорее теперь ты открой.
Домашнее задание будет двойным
Знания с творчеством совокупим.
- Описать, исходя из темы, «Химические чудеса нашего края»
- Меловые пещеры Святогорья
- Уникальная целебность Азовского моря
- Проработать § 11, решить упражнение 111.
А оценки за урок предлагаю вам выставить себе самостоятельно по методу Райтенга (выставляете суммарную оценку за урок, а я через дробь поставлю свою). А в дневники вам Лариса Петровна поставит на следующем уроке.
- Достигли ли вы поставленных вами целей?
- Я считаю, что поработали мы сегодня на славу. Молодцы. А теперь, до свидания.

Урок




про публікацію авторської розробки
Додати розробку
