Конспект уроку для дистанційного навчання (для роботи з учнями) Тема: Кислоти і основи. Поняття про індикатори.
Конспект уроку для дистанційного навчання
(для роботи з учнями)
Тема: Кислоти і основи. Поняття про індикатори.
Мета для учня (за навчальною програмою):
Знаннєвий компонент: знати поняття: кислота, основа, індикатор, кислотність середовища, наводити приклади формул кислот і основ, називати їх.
Діяльнісний компонент: розрізняти кислоти та основи як гідрати оксидів, розпізнавати їх дослідним шляхом, складати рівняння хімічних реакцій типу сполучення на прикладі взаємодії води з оксидами активних металічних і неметалічних елементів, використовувати здобуті знання та навички в побуті.
Ціннісний компонент: обґрунтувати значення кислот та основ у природі та житті людини, розширити кругозір учнів.
І. Актуалізація опорних знань.
1. Повторити § 36 с. 164-165 (Ярошенко О.Г. Хімія 7 клас) або відповідний § підручника, за яким навчаються діти.
2. Дати відповіді на питання:
- Яку загальну назву мають продукти взаємодії з водою:
а) оксидів металічних елементів
б) оксидів неметалічних елементів?
- Що є спільного у формулах усіх основ?
- Як називаються розчинні у воді основи? Визначте їх за таблицею розчинності.
- Що є спільного у формулах усіх кислот?
- Укажіть правильне твердження, що стосується переліку формул HCl, NaOH, Ca(OH)2, SO3 , H2SO4, H2SiO3 , Cu(OH)2:
а) у переліку переважають формули кислот
б) у переліку переважають формули основ
в) формул основ і кислот у переліку порівну
г) у переліку відсутні формули кислот
- Установіть відповідність між оксидом та відповідним йому гідратом, запишіть рівняння реакції утворення гідрату з відповідного оксиду, назвіть реагенти і продукти реакції:
А) Р2O5 1. КOH
Б) СO2 2. H3РO4
В) К2O 3. H2СO3
- До якого типу реакцій належать реакції води з оксидами?
- Розв’яжіть задачу . У розчин нітратної кислоти масою 140 грам з масовою часткою кислоти 0,4 долили воду об’ємом 260 мл. Обчисліть масову частку кислоти в новому розчині. (Відповідь: 0,14)
- Перейдіть за посиланням і виконайте завдання:
https://naurok.com.ua/test/vzaemodiya-vodi-z-oksidami-341517.html
ІІ. Мотивація навчальної діяльності
Розгадайте кросворд.
Запитання: 1. Перший хімічний елемент, який утворює найважливіший для життя оксид (Гідроген);
2. Гідрати оксидів металічних елементів (основи);
3. Складні речовини, що складаються з двох елементів, один з яких Оксиген (оксиди);
4. Кислота, яка міститься в плодах цитрусових, особливо в неспілих лимонах (лимонна);
5. Гідрати оксидів неметалічних елементів (кислоти);
6. Найпоширеніший розчинник (вода);
7. Кислота, яка використовується для консервування овочів та як приправа (оцтова);
8. Суміш, що складається з розчинника та розчиненої речовини (розчин);
9. Кислота, що міститься в залозах мурах, кропиві (мурашина);
10. Розчинні у воді основи (луги).
|
3О |
|||||||||
|
К |
|
6В |
|
10Л |
|||||
|
|
2О |
С |
|
О |
7О |
|
9М |
У |
|
|
1Г |
С |
И |
4Л |
|
Д |
Ц |
8Р |
У |
Г |
|
І |
Н |
Д |
И |
5К |
А |
Т |
О |
Р |
И |
|
Д |
О |
И |
М |
И |
|
О |
З |
А |
|
|
Р |
В |
|
О |
С |
|
В |
Ч |
Ш |
|
|
О |
И |
|
Н |
Л |
|
А |
И |
И |
|
|
Г |
|
Н |
О |
|
Н |
Н |
|||
|
Е |
А |
Т |
|
А |
|||||
|
Н |
|
И |
|
|
|||||
- Яке ключове слово отримали? (Індикатори).
- Чи знайомі вам ці речовини? (Так, на попередньому уроці переглядали відеодосліди (https://youtu.be/kjtGcveOosY?t=13.
https://youtu.be/ElQeluOgPLM), в яких до пробірок додавали речовини під назвою індикатори. Вони змінювали свій колір після утворення продуктів реакції – кислот і основ .
- Виходить, що індикатор вміє розпізнавати розчини – де є кислота, а де – основа?
ІІІ. Вивчення нового матеріалу.
Перегляньте відео за посиланням:
https://www.youtube.com/watch?v=txhYVmap7GU
- Чому однаковий індикатор в різних розчинах має різний колір? (він змінює своє забарвлення, в залежності від того, до розчину кислоти чи лугу його додавали)
- Яке значення індикаторів ? (Допомагають розпізнати розчини певних класів або груп –де кислота, а де – основа)
Отже, речовини, що змінюють свій колір під дією лугів і кислот називаються індикаторами.
- Яке практичне значення індикаторів? Навіщо ми їх вивчаємо? (Контроль якості продукції на фармацевтичних, харчових та інших виробництвах, виявлення наявності отруйних або токсичних речовин, розслідування злочинів тощо).
Опрацюйте відео за посиланнями:
https://www.youtube.com/watch?v=CdYOSUUra7o
https://www.youtube.com/watch?v=u1S5bc9ANt0&t=9s - лабораторний дослід «Випробування водних розчинів кислот і лугів індикаторами»
Зверніть увагу на середовища розчинів, індикатори, та їх колір в різних середовищах. Дайте відповіді на питання:
- Про які середовища розчинів говориться у відео? (Кисле, лужне, нейтральне).
- Які індикатори найчастіше використовуються на практиці? (Лакмус, метиловий оранжевий, фенолфталеїн)
- Як вони змінюють своє забарвлення в різних середовищах розчинів? Заповніть запропоновану таблицю
|
Індикатор
|
Забарвлення досліджуваної речовини |
||
|
Вода (нейтральне середовище) |
Розчин кислоти(кисле середовище) |
Розчин лугу (лужне середовище) |
|
|
Лакмус |
фіолетовий |
? |
? |
|
Метилоранж |
оранжевий |
? |
? |
|
Фенолфталеїн |
безбарвний |
? |
? |
Відповідь:
|
Індикатор
|
Забарвлення досліджуваної речовини |
||
|
Вода (нейтральне середовище) |
Розчин кислоти(кисле середовище) |
Розчин лугу (лужне середовище) |
|
|
Лакмус |
Фіолетовий |
Червоний |
Синій |
|
Метилоранж |
Оранжевий |
Червоний |
Жовтий |
|
Фенолфталеїн |
Безбарвний |
Безбарвний |
Малиновий |
У домашніх умовах можна обійтися і без наведених індикаторів, а скористатися природніми індикаторами: соком квіток, плодів, коренеплодів. Забарвлення їм надають різноманітні речовини-барвники, які змінюють свій колір в присутності кислоти чи лугу. Наприклад, сік вишні чи смородини в лужному середовищі посиніє, а в кислому набуде рожево-червоного кольору.
Застосування природних індикаторів
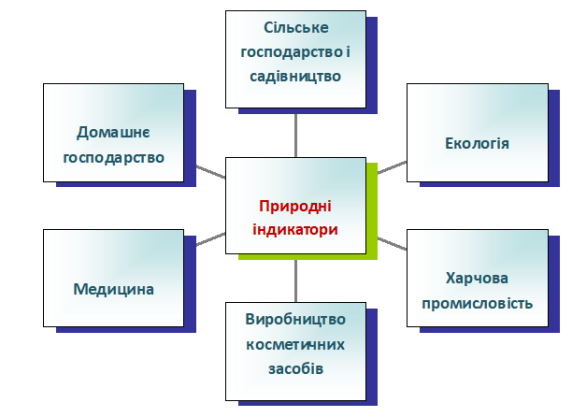
ІV. Закріплення
- Вставте пропущені слова:
- Основи утворюються в наслідок взаємодії …і…
- Кислоти утворюються в результаті взаємодії…і…
- Луги змінюють забарвлення фенолфталеїну з …на…
- Метилоранж в кислому середовищі набуває…забарвлення
- Лакмус в лужному середовищі набуває…забарвлення
- Вам видано пробірки з розчинами натрій гідроксиду і сульфатної кислоти. Поясніть як експериментально встановити кожну з речовин.
- Напишіть рівняння реакцій за поданими схемами:
А) S→SO2→H2SO3
Б) Ba →BaO→Ba(OH)2
Пояснення щодо виконання завдання.
Між простими речовинами (металами і неметалами), оксидами та їх гідратами(кислотами чи основами) існує зв'язок, а саме - можливість взаємного переходу від однієї речовини до іншої. Вам потрібно за допомогою рівнянь хімічних реакцій підтвердити цей взаємозв’язок.
Кожна стрілочка в такому завданні вказує на окрему хімічну реакцію: на одну з вихідних речовин і один з продуктіреакції.
Наприклад: Са → СаО → Са(ОН)2
Перша складова ланцюжка перетворень показує, що потрібно скласти рівняння реакції, в результаті якої з кальцію утворюється кальцій оксид, а саме, рівняння реакції взаємодії кальцію з киснем.
- Са + О2 → СаО
Кальцій Кальцій оксид
Друга складова ланцюжка перетворень показує, що потрібно скласти рівняння реакції, в результаті якої з кальцій оксиду утворюється кальцій гідроксид, а саме, рівняння реакції взаємодії кальцій оксиду з водою
- СаО + Н2О → Са(ОН)2
Кальцій оксид Кальцій гідроксид
(негашене вапно) (гашене вапно)
V. Домашнє завдання
Теоретичні завдання: відповісти на питання в кінці параграфа 36. (О.Г. Ярошенко. Хімія 7 клас), або завдання відповідно підручнику, за яким працюєте (https://imzo.gov.ua/pidruchniki/elektronni-versiyi pidruchnikiv/elektronni-versiyi-pidruchnikiv-dlya-uchniv-7-h-klasiv-2/himiya-7-klas/ ).
Практичні завдання:
Виконати тести за посиланням: https://naurok.com.ua/test/vzaemodiya-vodi-z-oksidami-ponyattya-pro-indikatori-344241.html
Завдання для допитливих:
Домашній експеримент:
Використовуючи власноруч виготовлений індикаторний папір або природні індикатори дослідити кислотно-основного характеру різних засобів побутової хімії.
Для приготування розчинів індикаторів з рослинної сировини рекомендуєтьс, використовувати забарвлені рослини або їх частини. Вибір рослинного матеріалу для приготування індикаторів необмежений.
Можливі шляхи приготування розчинів індикаторів з природної сировини:
І. Подрібнити потрібний матеріал та вичавити з нього сік. Отриманий сік розвести водою або спиртом для довшого зберігання.
ІІ. Подрібнити потрібний матеріал, залити його гарячою водою і настояти. Згодом відфільтрувати і використовувати фільтрат як індикатор.
ІІІ. Приготувати відвар – подрібнений матеріал недовго прокип’ятити, настояти до охолодження розчину, відфільтрувати.
Так як природнім індикаторам властивий недолік – вони не можуть довго зберігатися – тому можна виготовити індикаторний папір. Для цього :
- відібрати соки рослин (наприклад сік синьої капусти, цибулі та виноград);
- нарізати фільтрувальний папір на смужки та просочити його соками рослин-індикаторів.
- висушити смужки.
Індикаторний папір готовий!


про публікацію авторської розробки
Додати розробку
