7 клас Підготовка та варіанти завдань до підсумкової контрольної роботи. Дистанційна допомога
Дана презентація охоплює важливі теми неорганічної хімії за курс 7 класу. Зокрема, запис рівнянь хімічних реакцій та їх характеристика, розв'язування розрахункових задач на знаходження масової частки. Завдання різної складності полегшують підготовку до підсумкової контрольної роботи ( є зразки оформлення завдань , так і варіанти завдань для кожного учня).
Презентація стане в нагоді вчителю та учням для самоперевірки набутих знань
































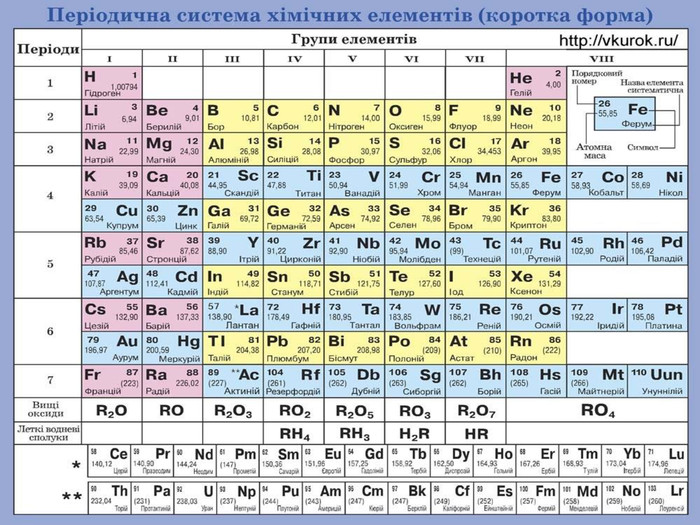
Умова завдання 1 Для всіх варіантів одна умова. Обчислити масову частку оксигену у сполуці, формула якої читається (підставляєте сполуку Вашого варіанта – поділ на варіанти - слайди №5, №6 ) і переписуєте у свою контрольну роботу. Вказати кількісний та якісний склад сполуки, охарактеризувати кожен хімічний елемент, що входить до складу цієї сполуки, які оксиди ці елементи можуть утворювати? (за зразком слайду № 4)
Зразок виконання завдання 1 Дано: ферум—ен-о-три-тричі Fe(NO3)3 Знайти:w (О) - %Скористаємося формулою для визначення масової частки елемента:𝐰=𝑨𝒓 Е∙ 𝒏𝑴𝒓(сполуки) 𝟏𝟎𝟎%Мr(Fe(NO3)3 ) = 56 + (14 + 16∙3) ∙3= 56+ (14+48)∙3=56+62∙3=56+186=242𝑤О=16∙3∙3242∙100%W(О) = 55%Відповідь: W(О) = 55%Кількісний склад сполуки – 13; якісний склад сполуки -3 Рівняння, що відповідають реакціям сполучення хімічних елементів з киснем, що входять до складу цієї сполуки мають вигляд:2 Fe + О2 →2 Fe. О 2 N2 + 5 О2 → 2 N2 О5
Самостійне опрацювання завдання 1 Варіант завдання відповідає порядковому номеру Вашого прізвища у списку учнів Вашого класу. Умова завдання до всіх варіантів вказана на слайді №2 цієї презентації. Свій варіант завдання переписувати. Варіант 1. Формула читається: калій-два-ес-о-чотири. Варіант 2. Формула читається : кальцій-ен-о-три-двічі. Варіант 3. Формула читається : ферум-о-аш-тричі. Варіант 4. Формула читається : літій-два-це-о-три. Варіант 5. Формула читається : купрум-о-аш-двічі. Варіант 6. Формула читається : магній-ен-о-три-двічі. Варіант 7. Формула читається : калій-манган-о-чотири. Варіант 8. Формула читається : натрій-аш-це-о-три. Варіант 9. Формула читається : алюміній-пе-о-чотири. Варіант 10. Формула читається : це-два-аш-п’ять-о-аш. Варіант 11. Формула читається : це-два-аш-п’ять-о- натрій. Варіант 12. Формула читається : барій-ес-о-чотири.
Самостійне опрацювання завдання 1 (продовження)Варіант 13. Формула читається: плюмбум-о-аш-двічі. Варіант 14. Формула читається : станум-ен-о-три-двічі. Варіант 15. Формула читається : ферум-ес-о-три. Варіант 16. Формула читається : калій-три-пе-о-чотири. Варіант 17. Формула читається : натрій-два-це-о-три. Варіант 18. Формула читається : магній-ен-о-три-двічі. Варіант 19. Формула читається : цинк –ен-о-три-двічі. Варіант 20. Формула читається : натрій-аш-два-пе-о-чотири . Варіант 21. Формула читається : це-аш-три-о-аш. Варіант 22. Формула читається : аш-два-ес-о-чотири. Варіант 23. Формула читається : хром-о-аш-тричі. Варіант 24. Формула читається : ферум-два-о-три. Варіант 25. Формула читається : аш-три-пе-о-чотири. Варіант 26. Формула читається : барій-це-о-три.
Розв’язання завдання 2 АДаний ланцюжок перетворень передбачає написання двох хімічних рівнянь . H2 CO3 → CO2↑ + H2 O - це рівняння розкладу карбонатної кислоти, водний розчин якої дає малинове забарвлення лакмусу, реагентом є одна речовина (H2 CO3 ), її Мr = 62, кількісний склад=6, якісний склад=3, продуктами реакції є дві складні речовини: Мr(СО2 ) =44, Мr (H2 O ) =18, коефіцієнт реагентів – 1, коефіцієнт продуктів реакції – 2, коефіцієнт реакції -3. CO2 → C + O2↑ - це рівняння розкладу Карбон оксиду ( складної речовини) на дві прості речовини, коефіцієнт реагентів -1, коефіцієнт продуктів реакції -2, коефіцієнт всієї реакції -3.
Розв’язання завдання 2 БДаний ланцюжок перетворень передбачає написання двох хімічних рівнянь: 2 Са + О2→ 2 Са. О - це рівняння горіння лужноземельного металу кальцію з утворенням Кальцій оксиду. Реагентами виступають дві прості речовини: кальцій та кисень. У результаті реакції сполучення утворюється одна складна речовина. Мr(Са. О) =56, коефіцієнт реагентів – 3, коефіцієнт продуктів реакції – 2, коефіцієнт всієї реакції -5. Са. О + H2 O →Сa(OH )2 – це рівняння сполучення кальцій оксиду (негашеного вапна) з водою з утворенням кальцій гідроксиду, водний розчин кальцій гідроксиду (гашене вапно) дає синє забарвлення, реагенти - дві складні речовини, їхній коефіцієнт -2, продукти – одна складна речовина, її коефіцієнт -1, коефіцієнт всієї реакції – 3. Мr (Сa(OH )2 ) = 40 + (16+1)∙2=40+34=74 кількісний склад=5, якісний склад=3.
Самостійне опрацювання завдання 2 Варіант завдання відповідає порядковому номеру Вашого прізвища у списку учнів Вашого класу. Умова завдання та зразок виконання до всіх варіантів вказані на слайдах №6, №7, №8, №9 цієї презентації. Свій варіант завдання переписувати. Варіант 1. а) Cu → Cu. О → Cu(OН)2 б) S → SO2 → Н2 SО3 Варіант 2. а) Mn(OН)2→ Mn. O→ Mn б) Mn→Mn2 O7 → НMn. O4 Варіант 3. а) Pb(OН)2 → Pb. O → Pb б) Р → P2 O5 → Н3 PO4 Варіант 4. а) Н2 SO3 → SO2 → S б) Mg→Mg. O → Mg(OН)2 Варіант 5. а) Ва(OН)2 → Ва. О → Ва б) І2 → І2 О5 → HІO3 Варіант 6. а) В → В2 O3 → Н3 ВО3 б) Mn(OН)3 → Mn2 O3 → Mn. Варіант 7. а) Fe → Fe. O → Fe2 O3 → Fe(OH)3 б) N2 → N2 O5 → HNO3 Варіант 8. а) Fe(OH)2 → Fe. O → Fe б) S → SO2 →SO3 → Н2 SO4 Варіант 9. а) Mn → Mn2 O7 → НMn. O4 б) К → К2 O → КOНВаріант 10.а) Al(OН)3 → Al2 O3 → Al б) НІO4 → І2 O7 → І2
Самостійне опрацювання завдання 2 (продовження )Варіант 11. а) Fe(OH)2 → Fe. O → Fe б) Р → P2 O5 → НPO3 Варіант 12. а) HNO3 → N2 O5 → N2 б) Zn → Zn. O → Zn(OН)2 Варіант 13. а) S→SO2 →Н2 SO3 б) Na → Na2 O → Na. OH Варіант 14. а) Li → Li2 O → Li. OH б) HІO3 → І2 О5 → І2 Варіант 15. а) H2 Cr. O4 → Cr. O3 → Cr б) Ag. OH → Ag2 O → Ag Варіант 16. а) Н3 PO4 → P2 O5 → Р б) Ag → Ag2 O → Ag. OHВаріант 17. а) НBr. О3 → Br2 О5 → Br2 б) Cu. OН → Cu2 O → Cu. Варіант 18. а) Al(OН)3 → Al2 O3 → Al б) Cr → Cr. O3 → H2 Cr. O4 Варіант 19. а) S → SO2 → SO3 → Н2 SO4 б) Na. OH →Na2 O → Na Варіант 20. а) As2 → As2 O5 → НAs. O3 б) Мg(OН)2 → Мg. O → Мg. Варіант 21. а) Cu→ Cu2 O → Cu. OН б) Br2 → Br2 О7→ НBr. О4 Варіант 22. а) Br2 → Br2 О5 → НBr. О3 б) Al → Al2 O3 → Al(OН)3 Варіант 23. а) НAs. O3 → As2 O5 → As б) Zn(OН)2→ Zn. O → Zn Варіант 24. а) Si → Si. O2 → Н2 Si. O3 б) Cu(OН)2→ Cu. O 2→ Cu
Розв’язок задачі 1. Дано:m(солі)=10гm(води)=100г. Знайти:w(солі)-?1. Визначаємо масу розчину: m(р-ну)= m(води)+ m(солі) =100г +10г = 110г2. Визначаємо масову частку солі в утвореному розчині за формулою. Сіль є розчиненою речовиною:w( розчиненої речовини )= 𝑚( розчиненої речовини)𝑚 (розчину)∙100%3. Підставимо у формулу відповідні числа:w(солі) = 10г/110г = 0,09 або 9%Відповідь: масова частка солі в утвореному розчині w(солі) становить 0,09 або 9%.
Розв’язок задачі 2. Дано:m(цукру)=40г. V(води)=160мл. Знайти:w(цукру)-?1. Об’єм води чисельно дорівнює її масі, тому m(води)=160г. 2. Визначаємо масу розчину: m(р-ну)= m(води)+ m(цукру) =160г+40г=200г3. Визначаємо масову частку цукру в утвореному розчині: w( розчиненої речовини )= 𝑚( розчиненої речовини)𝑚 (розчину)∙100%4. Підставимо у формулу відповідні числа: w( розчиненої речовини )= 40200∙100%Відповідь: масова частка цукру в утвореному розчині w(цукру) становить 20%.
Дано: w(солі) = 12%m (розчину) = 500г. Знайти:m(солі) -?m(води) -?1. Скористаємося формулою для масової частки розчиненої речовини:w( розчиненої речовини )= 𝑚( розчиненої речовини)𝑚 (розчину)∙100%2. Знайдемо масу солі, тобто масу розчиненої речовини:m(солі) = w(солі) ∙ m(р-ну) / 100%;m(солі) 12% ∙ 500 г / 100% = 60г.3. Визначаємо масу води в розчині:m(води)=500г- 60г=440г; Відповідь:60г солі і 440г води.
Розв’язок задачі 4. Дано:w(солі) = 5%m (розчину) = 1000г. Знайти:m(солі) -?m(води) -?1. Скористаємося формулою для масової частки розчиненої речовини: w( розчиненої речовини )= 𝑚( розчиненої речовини)𝑚 (розчину)∙100%2. Знайдемо масу солі, тобто масу розчиненої речовини:m(солі) = w(солі) ∙ m(р-ну) / 100%;m(солі) 5% ∙ 1000 г / 100% = 50г.3. Визначаємо масу води в розчині:m(води)=1000 г- 50г = 950г; Відповідь:50г солі і 950г води.
Розв’язок задачі 5 Дано:m (розчину) = 300гm(води) = 270г. Знайти:w(розчиненої речовини) -?1. Аналізуємо формулу для масової частки розчиненої речовини:w( розчиненої речовини )= 𝑚( розчиненої речовини)𝑚 (розчину)∙100%2. Визначаємо масу солі в розчині: m(солі) = m(р-ну) - m (води) = 300г-270г=30г3. Визначаємо масову частку розчиненої речовини в розчині:w( розчиненої речовини )= 30300∙100%w(солі)= 10%Відповідь: 10%
Розв’язок задачі 6 Дано: V(розчину) = 40млw(розчиненої речовини в даному випадку йоду) = 5%Знайти:m(йоду) - ? m(спирту) - ?1. Якщо густина розчину дорівнює 1 г/мл, то маса розчину буде 40мл ∙ 1 г/мл = 40 г - це m (розчину)2. Скористаємося формулою для масової частки розчиненої речовини:w( розчиненої речовини )= 𝑚( розчиненої речовини)𝑚 (розчину)∙100% 3. Знайдемо масу розчиненої речовини:m(йоду) = w(розчиненої речовини ) ∙ m (розчину)/100%4. Підставимо числові значення: m(йоду) = 5% ∙ 40г /100% = 2г5. Вся маса розчину складала 40 г, знаходимо масу розчинника( спирту) m(спирту)= m(розчину) - m(йоду) m(спирту) = 40г- 2г= 38г. Відповідь: m(йоду)= 2г; m(спирту) =38г
Розв’язок задачі 7 Дано: V(розчину) = 1000млw(розчиненої речовини в даному випадку оцту) = 9%Знайти:m(оцту) - ? m(води) - ?1. Якщо густина розчину дорівнює 1 г/мл, то маса розчину буде 1000мл ∙ 1 г/мл = 1000г - це m (розчину)2. Скористаємося формулою для масової частки розчиненої речовини:w( розчиненої речовини )= 𝑚( розчиненої речовини)𝑚 (розчину)∙100% 3. Знайдемо масу розчиненої речовини:m(оцту) = w(розчиненої речовини ) ∙ m (розчину)/100%4. Підставимо числові значення: m(оцту) = 9% ∙ 1000г /100% = 90г5. Вся маса розчину складала 1000 г, знаходимо масу розчинника( води) m(води)= m(розчину) - m(оцту) m(води) = 1000г- 90г= 910г. Відповідь: m(оцту)= 90г; m(води) = 910г
Задачі для самостійного опрацювання. Варіант завдання відповідає Вашому номеру у списку учнів Вашого класу. Зразок розв’язання типових задач вказані на слайдах №12 - №26 цієї презентації. Умову задачі переписати, скорочений запис обов’язково, математичні обчислення виконувати збоку. Варіант 1. Приготували 800 г розчину, де води - 640 мл. Визначити масову частку розчиненої речовини в розчині. Варіант 2. Приготували 300 г розчину, де масова частка солі становить 15%. Визначити масу солі і води в розчині. Варіант 3. На етикетці столового оцту вказано «Оцет столовий, 8% 900 мл». Обчислити масу розчиненої речовини й розчинника в одній пляшці, прийнявши густину розчину за 1 г/мл. Варіант 4. Обчислити масу кальцій гідроксиду, що міститься в розчині масою 660 г з масовою часткою речовини 0,15. Варіант 5. Обчислити масу солі, яку треба взяти, щоб отримати розчин масою 80 г з масовою часткою кальцій хлориду 8%.
Задачі для самостійного опрацювання. Варіант 6. Приготували 400 г розчину, де масова частка солі становить 8%. Визначити масу солі і води в розчині. Варіант 7. Приготували 650 г розчину, де води - 520 г. Визначити масову частку розчиненої речовини в розчині. Варіант 8. У хімічну склянку насипали цукор масою 40 г, а потім долили воду об’ємом 180 мл. Яка масова частка цукру в утвореному розчині?Варіант 9. На етикетці столового оцту вказано «Оцет столовий, 6% 1500 мл». Обчислити масу розчиненої речовини й розчинника в одній пляшці, прийнявши густину розчину за 1 г/мл. Варіант 10. Яка маса барій хлориду в розчині масою 220 г з масовою часткою солі 0,05. Варіант 11. На етикетці настоянки діамантово зеленого вказано «Спиртовий розчин діамантово зеленого, 6% 75 мл». Обчислити масу розчиненої речовини й розчинника в одному флаконі, прийнявши густину розчину за 1 г/мл. Варіант 12. До розчину солі масою 250 г з масовою часткою солі 20% долили 150 г води. Яка масова частка солі в утвореному розчині?Варіант 13. Приготували 500 г розчину, де масова частка солі становить 2%. Визначити масу солі і води в розчині.
Задачі для самостійного опрацювання. Варіант 14. На етикетці столового оцту вказано «Оцет столовий, 12% 800 мл». Обчислити масу розчиненої речовини й розчинника в одній пляшці, прийнявши густину розчину за 1 г/мл. Варіант 15. Для засолювання огірків застосовують розчин з масовою часткою солі 6%. Яку масу солі та води треба взяти, щоб приготувати 2 кг такого розчину?Варіант 16. Приготували 700 г розчину, де масова частка солі становить 8%. Визначити масу солі і води в розчині. Варіант 17. На етикетці настоянки фукарцину вказано «Спиртовий розчин фукарцину, 2% 60 мл». Обчислити масу розчиненої речовини й розчинника в одному флаконі, прийнявши густину розчину за 1 г/мл. Варіант 18. Обчислити масову частку (у відсотках) соди в розчині, який виготовляють, змішуючи соду масою 80 г і воду об’ємом 320 мл. Варіант 19. Для засолювання капусти застосовують розчин з масовою часткою солі 5%. Яку масу солі та води треба взяти, щоб приготувати 10 кг такого розчину?
Задачі для самостійного опрацювання. Варіант 20. На етикетці йодної настоянки вказано «Спиртовий розчин йоду, 3% 50 мл». Обчислити масу розчиненої речовини й розчинника в одному флаконі, прийнявши густину розчину за 1 г/мл. Варіант 21. Обчислити масову частку (у відсотках) хлориду магнію в розчині, який виготовляють, змішуючи хлорид магнію масою 62 г і воду об’ємом 248 мл. Варіант 22. Для засолювання овочів застосовують розчин з масовою часткою солі 0,05. Яку масу солі та води треба взяти, щоб приготувати 4 кг такого розчину?Варіант 23. На етикетці столового оцту вказано «Оцет столовий, 6% 1200 мл». Обчислити масу розчиненої речовини й розчинника в одній пляшці, прийнявши густину розчину за 1 г/мл. Варіант 24. Приготували 480 г розчину, де води - 456мл. Визначити масову частку розчиненої речовини в розчині.


про публікацію авторської розробки
Додати розробку