Конспект уроку "Електроліти та неелектоліти. Електролітична дисоціація. Реакції іонного обміну. Узагальнюючий урок."
Тема: Електроліти та неелектоліти. Електролітична дисоціація. Реакції іонного обміну. Узагальнюючий урок.
Мета: узагальнити та закріпити знання про електролітичну дисоціацію, сформувати та закріпити вміння складати рівняння реакції в повному та скороченому іонному вигляді, виховати толерантність, вміння слухати та поважати чужу думку, аргументовано захищати свою.
Тип уроку: урок узагальнення та систематизації знань.
Методи, прийоми і форми роботи: Метод «Місткий кошик», мозковий штурм, розгадування кросворду, метод «Впізнай мене».
Основні терміни і поняття: електроліти, неелектроліти, електролітична дисоціація, йони, катіони, аніони, йонні рівняння.
Обладнання: періодична система хімічних елементів Д.І. Менделєєва, таблиця розчинності солей.
Очікувані результати навчальних досягнень
Учень
- Застосовує набуті знання для виконання вправ і задач
- Наводить приклади і встановлює залежність між здатністю розчину речовини проводити електричний струм та типом хімічного зв’язку в цій речовині
- Записує рівняння реакцій йонного обміну в повному та скороченому вигяді.
Хід уроку.
І. Організаційний етап. (1 хв)
ІІ. Оголошення теми та мети уроку. Мотивація навчальної діяльності. (5 хв)
Колективне складання схеми «Що ми повинні по закінченні вивчення теми «Електролітична дисоціація»
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() ІІІ. Узагальнення та систематизація знань.
ІІІ. Узагальнення та систематизація знань.
1.Метод «Місткий кошик». (4 хв)
(написання формул електролітів, неелектролітів з поясненням)
2. «Мозковий штурм»(7 хв)
а) для зниження кислотності шлункового соку при язві шлунку, гастритах з підвищеною кислотністю лікарі рекомендують альмагель (Суміш спеціально приготованого гелю Аl(OH)3 з MgO та сорбіту. Багато хворих, якщо немає лікарства використовують для усунення печії звичайну питну соду (NaHCO3). Спробуйте порівняти механізм дії цих ліків і пояснити, чому лікарі віддають перевагу альмагелю і не рекомендують використовувати питну соду? (Печією називають відчуття горіння в області шлунку, що викликає соляна кислота, яка міститься в шлунковому соці).
б) У трьох пробірках знаходяться речовини – калій карбонат, барій сульфат, натрій гідроксид. При додаванні реактиву Х в одній з пробірок випав осад, в другій – виділився газ, в третій не відбулось нічого. Визначити речовину Х , якщо відомо, що всі три реакції – реакції іонного обміну, що відбуваються до кінця.
а) Розгадування кросворду(5 хв)
|
1.А |
|
|
|
|
|
|
|
|
||||
|
2.Р |
|
|
|
|
|
|||||||
|
3.Р |
|
|||||||||||
|
4.Е |
|
|
|
|
|
|
|
|
|
|
||
|
5.Н |
|
|
|
|
|
|
|
|
|
|
|
|
|
6.І |
|
|
|
|
|
|||||||
|
7.У |
|
|
|
|
||||||||
|
8.С |
|
|
|
|||||||||
- Об’єднання протилежно заряджених йонів.
- Гомогенна система змінного складу з кількома компонентами.
- Назва букви, що позначає густину розчину.
- Речовини, водні розчини яких проводять електричний струм.
- Назва реакції, що відбувається між лугом і кислотою.
- Один із видів хімічного зв’язку в електролітах
- Температура, тиск, каталізатор це …
- Сполуки, що дисоціюють з утворенням катіона металу та аніона кислотного залишку.
в) метод «Впізнай мене» (3 хв)
(Вчитель зачитує від імені хімічної речовини її фізичні, хімічні властивості, застосування.)
1.Я, речовина білого кольору, відношуся до класу солі. Я сильний електроліт з йонним зв’язком . Ви бачите мене щодня на своєму столі. У мене солоний смак . Мене звуть …
2. Я слабкий електроліт, належу до солей малорозчинних у воді. Мене використовують як будівельний матеріал. І в школі я також вам пригодився. Я білого кольору і в мене кислотний залишок карбонатної кислоти. Мене звуть…
3. Я прозора рідина без запаху і кольору. Сама по собі я не проводжу електричний струм, але це роблять інші речовини, якщо розчиняються у мені. Мене ви можете зустріти всюди. Я…
IV. Самостійна робота (15 хв)
(робота з картками)
Варіант 1
1. Написати рівняння дисоціації речовин:
NaNO3,BaSO4,AL2(SO4)3
2. Знайти допущені помилки:
1) Na2СO3 +СaCl2=СaCO3 +NaCl
2Na++ СO3- +Сa2-+ Сl2- = СaCO3![]() +2Na2+ + Cl-
+2Na2+ + Cl-
Сa++ СO32-= СaСO3
3. Написати всі можливі реакції йонного обміну у повній та скороченій йонній формі: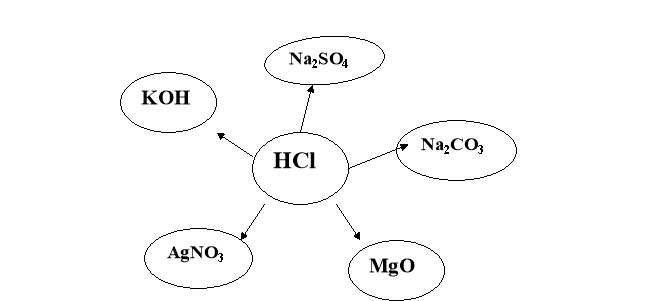
4. Замінити слова і букви формулами:
С + кислота → сіль + кислота;
Варіант 2
1. Написати рівняння дисоціації речовин:
AgCl,H2SO4,KOH
2. Знайти допущені помилки:
K2СO3+HCl =2KCl+H2O+CO2![]()
K++ 2СO32- +H2+ +2Cl-=2K++Cl-+H2O+CO2![]()
СO32-+H+= СO2-+H2O
3. Написати всі можливі реакції йонного обміну у повній та скороченій цонній формі: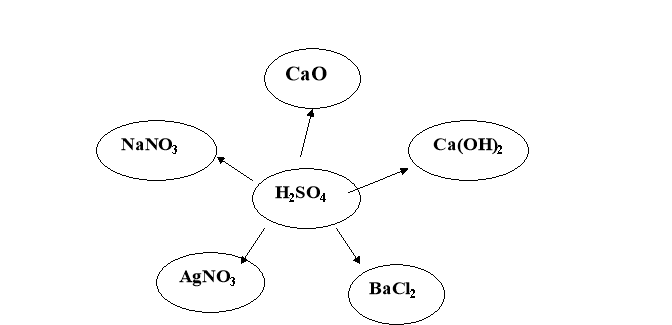
4. Замінити слова і букви формулами:
А + кислота → сіль + вода + газ;
V. Підбиття підсумків уроку.
Метод «Мікрофон» (4 хв)
- Чи сподобалась вам вивчена тема?
- Чому?
- Що в цій темі було для вас найважчим?
- А найлегшим?
- Над якими питаннями вам треба було б попрацювати?
- Яку оцінку ви б поставили собі за вивчену тему? Поставте її на аркуш паперу і підніміть вверх.
- Намалюйте фізіономію, оцінивши свій настрій і підніміть її вверх.
VI. Домашнє завдання. (1 хв)
Повторити §10, 11, 12
1


про публікацію авторської розробки
Додати розробку




