Конспект уроку з фізики на тему: "Тема уроку. Електричний струм у розчинах і розплавах електролітів. Кількість речовини , що виділяються під час електролізу."
Мета: пояснити природу електричного струму в розчинах і розплавах електролітів, показати практичне застосуванні електролізу спостерігати явища, викликані електричним струмом у різних середовищах; сформулювати два закони Фарадея
УРОКИ N 2
Тема уроку. Електричний струм у розчинах і розплавах електролітів. Кількість речовини , що виділяються під час електролізу.
Тип уроку: засвоєння нових знань
. Мета уроку: дидактична: пояснити природу електричного струму в розчинах і розплавах електролітів, показати практичне застосуванні електролізу спостерігати явища, викликані електричним струмом у різних середовищах; сформулювати два закони Фарадея.
розвиваюча: розвивати практичні навички під час виконання дослідів, а також увагу, спостережливість, логічне мислення; залучати учнів до дослідницької роботи, сприяти розвитку організаторських, інтелектуальних та комунікативних умінь; продовжувати формувати інтерес до вивчення явищ природи на основі фізичних та хімічних знань, показати роль міжпредметних зв'язків курсів фізики та хімії для розвитку учнів. виховна: виховувати почуття колективізму, працелюбність учнів.
Обладнання: фільтрувальний папір, скляна пластинка, водний розчин купрум сульфату, розчин двохромовокислого калію, батарейка (на 4,5 В), два шматки ізольованого мідною проводу, лампочка від ліхтарика, кілька склянок, дистильована вода, цукор, сіль, розчин фенолфталеїну (пургену) у спирті (одеколоні).
Хід уроку
1.Перевірка домашнього завдання
Учні презентують «Cтрум у живій природі»
2.Актуалізація опорних знань
Бесіда. ми пам'ятаємо, що метали проводять електричний струм.
• Хто може пояснити, чому ця властивість притаманна металам? (Металевий зв'язок, металеві кристалічні ґратки, вільні електрони в кристалічних ґратках і катіони у вузлах)
• Який метал має найвищу електропровідність? {Срібло, золото, мідь)
• Назвіть речовини, що проводять електричний струм (крім металів) і мають вільні електрони. (Графіт)
Проблемне питання: .(учні висловлюють свою думку)
- Чи проводить електричний струм вода? (Так, ні)
- На які групи поділяються речовини за своїми електричними властивостями?
- рідини належать до провідники електрики чи до діелектриків?
3.Мотивація навчальної діяльності
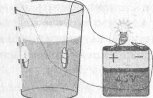
Демонстрація 1. На монети намотуємо кінці мідних проводів (два-три витки), які потім опускаємо в склянку з дистильованою водою. Складаємо електричне коло, як показано на рис. Лампочка не світиться. Це означає, що в колі немає електричного струму. Додамо у воду цукор — ефект той самий. Візьмемо другу склянку з дистильованою водою й додамо в неї кілька крапель кислоти. Лампочка починає світитися, а навколо монет піднімаються бульбашки газів
 .
. 
Демонстрація 2.Сухі електроди зануримо в сухий натрій хлорид — лампочка) не горить. Тепер приєднаємо до приладу склянку з дистильованою водою й акуратно шпателем насиплемо кілька кристалів натрій хлориду. Спостерігаємо за лампою, що поступово розгоряється.
Проблемне питання: Чому? Чим відрізняються дистильована вода й розчинена вода? .(учні висловлюють свою думку)
Висновок: розчинені у воді кристали зробили розчин електропровідним.
— Чи всі речовини здатні так змінювати воду? Проведемо аналогічне дослідження із содою, лимонною кислотою.
Робимо висновок:
• розчин цукру не проводить електричний струм;
• розчин лимонної кислоти проводить електричний струм;
• розчин соди проводить електричний струм.
Речовини, розчини й розплави яких проводять електричний струм, називаються електролітами. (До них належать усі солі, кислоти, основи, більшість основних оксидів, тобто речовини з йонним і ковалентним полярним типами зв'язку.)
Речовини, розчини й розплави яких не проводять електричний струм, називаються неелектролітами. Це прості речовини — неметали, речовини не молекулярної будови, більшість органічних речовин,)
4. вивчення нового матеріалу
Розберемося, чому розчин кислоти проводить електричний струм. Вода має властивість у 81 раз послабляти дію електричних зв'язків (сил притягання) у хімічній сполуці
. 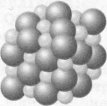
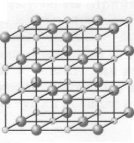
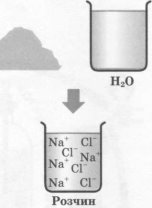
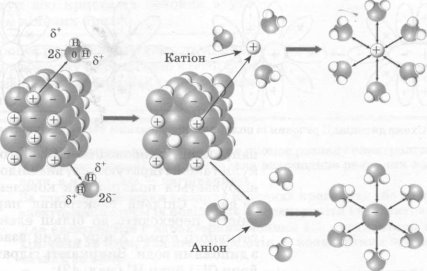
Так, молекула кухонної солі (NаСl) у водному розчині розпадається (дисоціює) на позитивні іони Натрію Nа+ і негативні іони Хлору Сl-, а молекула кислоти — на позитивно заряджені іони Гідрогену й негативна заряджені іони кислотного залишку. Цей процес починається без усякого впливу електричного струму! Називається він електролітичною дисоціацією. Безліч іонів рухаються безладно усередині розчину, то з'єднуючись один з одним (рекомбінуючи), то знову розпадаючись.
. Схема дисоціації речовин з йонним типом хімічного зв'язку
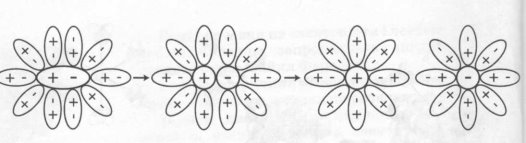
Схема дисоціації речовин з полярним ковалентним типом хімічного зв'язку

Якщо підвести до розчину електричний струм, опустивши в нього металеві пластини — електроди й з'єднавши їх з полюсами джерела струму, то під дією електричного поля іони починають рухатися упорядковано: позитивні іони (у нашому випадку Гідрогену) спрямовуються до негативного електрода (катода), а негативні іони — до позитивного електрода (анода). Коло замикається — електрична лампочка світиться. Оскільки напрямком струму в колі умовно вважається напрямок від «+» до «-», то позитивні іони рухаються у напрямку струму, їх називають катіонами («той, що йде вниз, за течією»), а негативні іони — аніонами («той, що
йде проти течії»).
Що ж відбувається далі? Позитивно заряджені іони Гідрогену наближаються до катода, і на катод переходять електрони. Перейшов один електрон — утворився атом Гідрогену, потім два такі атоми об'єдналися в молекулу, ми бачимо бульбашки газу — водню. А негативні іони віддають свої електрони аноду, також перетворюючись у нейтральні молекули. 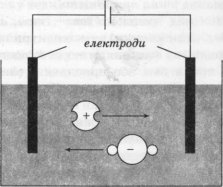
процес виділення речовини на електродах під час протікання електричного струму через розчин або розплав будемо називати електролізом. Яке його практичне застосування? Наприклад, електроліз дозволяє одержати чисту речовину з розплаву або розчину, наносити покриття на поверхню металів (цей процес називається гальваностегією). Предмет, що його покривають, завжди є катодом. Для покриття сріблом, золотом або іншими металами анод завжди виготовлюється з металу покриття, а електроліт являє собою розчин солі цього металу.
Демонстрація 2. У склянку наливаємо розчин кухонної солі й додаємо дві-три краплі розчину фенолфталеїну (пургену) у спирті (одеколоні). Опускаємо електроди-монети. Біля монет знову спостерігаємо бульбашки газів, а біля катода утворюється малинова пляма, що розширюється, заповнюючи весь розчин. Лампочка світиться
Демонстрація 3. Фільтрувальний папір просочуємо розчином кухонної солі й закріплюємо на скляній пластині. Зверху на неї кладемо дві вузькі смужки такого самого паперу, просочені: одна — мідним купоросом (водним розчином купрум сульфату), друга — розчином двохромовокислого калію і з'єднані: перша — з позитивним електродом джерела струму, друга — з негативним. Спостерігаємо появу біля катода жовтої смуги, біля анода — синьої смуги, що розширюється у бік катода. Синє забарвлення «забезпечують» іони Купруму, а жовте - іони кислотного залишку.
Уперше явище електролізу докладно дослідив англійський фізик Майкл Фарадей (1791 — 1867). У 1834 р. він експериментально встановив, що за певний час даний струм завжди виділяє з розчину електроліту ту саму кількість даного хімічного елемента. Таким чином, учений сформулював закони, які назвали законами електролізу або законами Фарадея. 
Кожен йон, який у процесі електролізу нейтралізується на електроді й виділяється на ньому у вигляді нейтрального атома, має певну масу. Але разом із тим він переносить через електроліт певний заряд. Тому й маса речовини, що виділилася, і кількість електрики, що пройшла, пропорційні числу йонів, які підходять до даного електрода.
Маса речовини, що виділилася: т = т1N, де т1 — маса йона, N— число йонів, що нейтралізуються на даному електроді.
Масу йона можна визначити як т. =M/NA, де
М — молярна маса, а NА — стала Авогадро. Тоді
т1 =![]() -.
-.
Число йонів N, які проходять крізь розчин електроліту до даного електроду, можна визначити таким чином: кожен одновалентний йон несе заряд, який дорівнює заряду електрона е або, якщо валентність йона дорівнює Z, кратний йому: еZ. Уся кількість електрики, яку переносять N йонів, — q= пеN, звідси N = ![]() , тоді т =
, тоді т =![]()
Позначимо через к коефіцієнт пропорційності між масою речовини й зарядом: k =![]()
Перший закон Фарадея. Кількість речовини, яка виділяється на електроді, прямо пропорційна електричному заряду, що пройшов через електроліт.
Або іншими словами:
Маса т речовини, яка виділяється на електроді під час електролізу, пропорційна силі струму та часу його проходження:
m=kIt
де к — коефіцієнт пропорційності, який одержав назву електрохімічний еквівалент речовини.
Електрохімічний еквівалент речовини визначено для всіх хімічних елементів. Він є табличною величиною, але його не важко розрахувати:, де ![]() – хімічний еквівалент речовини. Добуток числа Авогадро на заряд електрона називають сталою Фарадея:
– хімічний еквівалент речовини. Добуток числа Авогадро на заряд електрона називають сталою Фарадея:
F = NAe = 6,02·1023 1/моль ×1,6·10-19 Кл = 96500 Кл/моль.
![]() Електрохімічний еквівалент речовини чисельно дорівнює масі цієї речовини, яка виділяється на електроді за 1 с під час проходження через електроліт струму силою 1 А к.=
Електрохімічний еквівалент речовини чисельно дорівнює масі цієї речовини, яка виділяється на електроді за 1 с під час проходження через електроліт струму силою 1 А к.=![]() =
=![]()
Другий закон Фарадея. Електрохімічні еквіваленти речовин прямо пропорційні відношенням їхніх атомних мас до валентності.
Стала Фарадея дорівнює заряду, під час перенесення якого одновалентними іонами через розчин або розплав електроліту виділяється 1 моль речовини.
![]()
об'єднаний закон Фарадея для електролізу:
![]()

5.Закріплення нового матеріалу
Демонстрація 4. Металевий чайник і алюмінієву посудину від калориметра з'єднуємо провідниками з гальванометром (рис. ). У чайник наливаємо розчін кухонної солі. Переливаючи воду, спостерігаємо виникнення струму. Змінюючи довжину й товщину струменя, зазначаємо зміну сили струму! Запитання до класу: Як можна пояснити спостережуване явище?
Учні пояснюють спостережуване явище
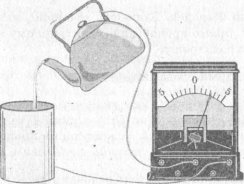
Рис.
1.Запитання для організації бесіди
Чи можуть при дисоціації утворитися іони одного знак
Чому?
• Чому навколо електроліту немає електричного поля, хоча всі редині нього є заряджені іони?
• Чому не можна торкатися голими руками неізольованих проводів під напругою?
• Чисту мідь одержують, пропускаючи струм через водний розчин купрум сульфату (СuS04). Який знак заряду з іонів Купруму? У якому напрямку вони переміщатимуться під дією електричного поля? На якому електроді виділятиметься чиста мідь?
• 3 якою метою металеві вироби покривають тонким шаром іншого металу (нікелем, хромом, міддю, сріблом тощо)?
• Розчин солі якого металу повинен бути електролітом для сріблення виробу? До якого полюса джерела струму потрібно приєднати цей виріб?
• Що показує електрохімічний еквівалент міді?
2. Навчаємося розв'язувати задачі
Відомий математик П*єр Лаплас казав: «Те, що ми знаємо,— обмежене, а те, чого не знаємо,— безмежне. Тож пірнайте в цю безмежність і збагачуйтесь знаннями».
Задача № 1
Визначте час, необхідний для покриття сталевої деталі з площею поверхні 400 см2 шаром хрому завтовшки 36 мкм. (Учитель розв'язує задачу з коментуванням на дошці.)
Колективний Розв*язок задачи
Задача№2. Під час сріблення виробу на катоді за 30 хв утворилося срібло масою 4,55 г. Визначте силу струму при електролізі.
![]()
![]()
![]() Дано: CI Із таблиці: Розв*язання
Дано: CI Із таблиці: Розв*язання
t = 1800с k=1,12х10-6 кг/Кл m=kq
t =30хв m=4,55 х 10-3 кг m=kIt
![]() m =4,55 г I=m/ kt
m =4,55 г I=m/ kt
-
? I=
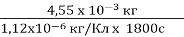 =
=
=2,25А
III. Домашнє завдання
І. Вивчити теоретичний матеріал уроку. Параграф 23
Задача 11.7. Скільки срібла осіло на катоді електролізної
установки, якщо процес електролізу тривав 10 хв при силі
струму 25 А?
Задача 11.24. За який час на катоді електролітичної ванни виділиться 40 г хрому, якщо електроліз проходить при силі струму 25 А?
Творче завдання. Підготувати повідомлення « Електроліз і його практичне застосування»


про публікацію авторської розробки
Додати розробку
